共计 385020 个字符,预计需要花费 963 分钟才能阅读完成。
第一章 白细胞分化抗原
机体免疫系统是由中枢淋巴器官、外周淋巴器官、免疫细胞和免疫分子所组成。免疫应答过程有赖于免疫系统中细胞间的相互作用,包括细胞间直接接触和通过释放细胞因子或其它介质的相互作用。免疫细胞间或细胞与介质间相互识别的物质基础是免疫细胞膜分子,包括细胞表面的多种抗原、受体和其它分子。细胞膜分子通常也称为细胞表面标记(cell surface marker)。免疫细胞膜分子的研究对于深入了解免疫应答的本质以及临床某些疾病的诊断、预防和治疗都具有十分重要的意义。
免疫细胞膜分子的种类相当繁多,主要有 T 细胞受体,B 细胞识别抗原的膜免疫球蛋白,主要组织相容性复合体抗原,白细胞分化抗原,粘附分子,结合促分裂素的分子,细胞因子受体,免疫球蛋白 Fc 段受体以及其它受体和分子。白细胞分化抗原是白细胞(还包括血小板、血管内皮细胞等)在分化成熟为不同谱系(lin-eage)和分化不同阶段以及活化过程中,出现或消失的细胞表面标记。它们大都是穿膜的蛋白或糖蛋白,含胞膜外区、穿膜区和胞浆区;有些白细胞分化抗原是以糖基磷脂酰肌醇(glyco-sylphosphatidylinositol,GPI)连接方式“锚”在细胞膜上。少数白细胞分化抗原是碳水化合物半抗原。白细胞分化抗原参与机体重要的生理和病理过程。假如:(1)免疫应答过程中免疫细胞的相互识别,免疫细胞抗原识别、活化、增殖和分化,免疫效应功能的发挥;(2)造血细胞的分化和造血过程的调控;(3)炎症发生;(4)细胞的迁移如肿瘤细胞的转移等。
第一节 白细胞分化抗原的分类
80 年代初以来,由于单克隆抗体,分子克隆、基因转染细胞系等技术在白细胞分化抗原研究中得到广泛深入的应用,有关白细胞分化抗原的研究和应用进展相当迅速。在世界卫生组织(WHO)和国际免疫学会联合会(IUIS)的组织下,自 1982 年至 1993 年已先后举行了五次有关人类白细胞分化抗原的国际协作组会议(International workshop on human leukocyte differentiation antigens), 并应用以单克隆抗体鉴定为主的聚类分析法,将识别同一分化抗原的来自不同实验室的单克隆抗体归为一个分化群,简称 CD(cluster of differentiation)。在许多场合下,抗体及其识别的相应抗原都用同一个 CD 序号,因此在参阅教科书和文献时需加注意。
一、人白细胞分化抗原的分类
迄今为至,人 CD 的序号已从 CD1 命名至 CDw130(见表 1 -2),可大致划分为 T 细胞、B 细胞、髓系细胞、NK 细胞、血小板、激活抗原、粘附分子、内皮细胞和细胞因子受体等九个组(表 1 -1)。
表 1 -1 CD 单抗分组(1993)
| 主要特异性 | CD |
| T 细胞 | CD1-CD8、CD27、CD28、CD38、CD39、CDw60、CD45、CD45RA、CD45RB、CD45RO、CD98、CD99、CD99R、CD100、CDw101 |
| B 细胞 | CD10、CD19-CD24、CD37、CD40、CD53、CD72-CD75、CDw76、CD77、CD78、CD79a、CD79b、CD80-CD83、CDw84、CD85、CD86 |
| 髓系细胞 | CDw12、CD13-CDw17、CD32-CD35、CD64、CDw65、CD66a-CD68、CD87-CD93 |
| NK 细胞 | CD56、CD57、CD94 |
| 血小板 | CD9、CD31、CD36、CD4la、CD4lb、CD42a-CD42d、CD61、CD63、CD107a、CD107b、CD26、CD30、CD69、CD70、CD71、CD95-CD97 |
| 激活抗原 | CD26、CD30、CD69、CD70、CD71、CD95-CD97 |
| 粘附分子 | CD11a-CD11c、CD15s、CD18、CD29、CD43、CD44、CD44R、CD48、CD49a-CD49f、CD50、CD51/CD61、CD54、CD55、CD58、CD59、CD62E、CD62L、CD62P、CD102-CD104、CDw108 |
| 内皮细胞 | CD105、CD106、CDw109 |
| 细胞因子受体 | CD25、CD115、CDw116、CD117、CDw119、CD120a、CD120b、CDw121a、CDw121b、CD122、CDw124、CD126、CDw127、CDw128、CDw130 |
注:(1)CD 是流水编号,但 CD110~CD114,CD118、CD123、CD125 和 CD129 暂缺;CD67 和 CD66b 是重复的。
(2)凡 CD 中带有 w 的抗原或抗体发 CDw108、CDw109 尚需继续进行全面鉴定。
(3)有些 CD 抗原又可进一步划分为不同的成员,一般用小写英文字母表示,但情况有所不同:1)如 CD1 可分为 CD1a、CD1b 和 CD1c,这三种不同分子是分别由三个不同的、高度同源的基因所编码;2)CD45 至少可分为 CD45R、CD45RA、CD45RB 和 CD45RO,它们是同一基因的不同异型(isoform);3)CD2 和 CD2R 是识别同一个分子上不同的表位;4)CD49 已进一步划分为 CD49a、CD49b、CD49c、CD49d、CD49e 和 CD49f,它们的基因定位于不同的染色体上,但具有较高的同源性。
(4)CD 九个组划分的特异性是相对的,实际上,许多 CD 抗原的组织细胞分布较为广泛。此外,有的 CD 抗原可由不同的分类角度而归入不同的组,如 IL- 2 受体 a 链 CD25 是活化 T 细胞的标记,也属于细胞因子受体;再如某些属于 T 细胞、B 细胞、髓系细胞或 NK 细胞组的 CD 抗原实际上也是粘附分子。
表 1 -2 CD 分子的主要特征
| CD | 常用单克隆抗体或代号() | 主要表达细胞 | 分子量(kDa)和结构 | 功能 |
| CDla | T6,Leu6 | Thy,DC,LHC | gp49 | TCRγδ 的配体? |
| CDlb | WM-25,4A76,NUT2 | Thy,LHC | gp45 | TCRγδ 的配体? |
| CDlc | L161,M241,7C6 | Thy,DC,Bsub | gp43 | TCRγδ 的配体? |
| CD2 | 9.6,T11,Leu5;(LFA-2,SRBC-R) | T,NKsub. | gp50 | 与 LFA-3(CD58)和 CD59 结合,T 细胞活化 |
| CD2R | T11.3,9.1 | Ta | gp50 | T 细胞活化 |
| CD3 | T3,Leu4 | T | γ、δ、ε、ζ、η5 种链分别为 p26,20,19,16,21 | T 细胞活化 |
| CD4 | T4,Leu3a | Tsub | gp55 | 与 MHCⅡ类分子结合,信号转导,HIV 受体 |
| CD5 | T1,UCHT2,T101,Leu1 | T,Bsub | gp67(小鼠 Lyt- 1 类同物) | 与 CD72 结合,T 细胞信号转导 |
| CD6 | T12,T411 | Tsub,Bsub | gp100 | ? |
| CD7 | 3A1,Leu9 | Tsub,(NK,Pt) | gp40 | ? |
| CD8 | α 链:T8,Leu2a,UCHT4 β 链:T8/2T8,5H7 | Tsub(αβ),NKsub(α/α) | gp(36/32),α/ α 或 α / β 二聚体 | 与 MHCI 类分子结合,信号转导 |
| CD9 | PHN200,FMC56 | Pre-B,M,Pt | p24(TM- 4 成员) | 血小板活化 |
| CD10 | J5;(CALLA) | Pre-B,CALlG | gp100 | 中性肽链内切酶,水解脑啡肽、趋化肽和 P 物质 |
| CD11a | MHM24,2F12;CRIS-3 | Leu | LFA-1(gp180/95)的 α 链 | 与 ICAM-1(CD54)和 ICAM-2(CD102)结合 |
| CD11b | Mol,OKM1;(Mac-1,CR3,integrin αm | G,M,NK | gp165/95 的 α 链 | C3bi 和 FB 受体,与 ICAM- 1 结合,粘附,调理吞噬 |
| CD11c | LeuM5;(CR4,integrin αx) | M,G,NK,Tsub | gp150/95 的 α 链 | C3bi 受体,调理吞噬 |
| CDw12 | M67 | M,G,(Pt) | p90~120 | ? |
| CD13 | My7, MOU28 | M,G | gp150 | 氨肽酶 |
| CD14 | Mo2,UCHM1,LeuM3 | M,(G,LHC) | gp55(GPI 连接) | LPS/LPS 结合蛋白复合体受体 |
| CD15 | MY1,LeuM1 | G,(M),RS | Lewis*3FAL,X-hapten,Lex | 参与吞噬 |
| CD15s | (Sialyl CD15) | G,M | SialylLewisx(sLex) | CD62E 和 CD62P 配体,白细胞粘附到 En 和 Pt |
| CD16a | HUNK2,Leu11,MEM-154(FcγRⅢA/FcγRⅢB) | NK,G,Mo,Mac | gp50-70(穿膜形式) | ADCC,NK 活化 |
| CD16b | ID3(FcγRⅢB) | G,M | 48(GPI 连接) | ? |
| CDw17 | GO35 | G,M,Pt | 乳糖基酰鞘氨醇 | ? |
| CD18 | MHM23;(LFA 组 β 链,integrin β2) | Leu | gp95,LFA-1,CR3、p150/95 的 β 连 | ICAM-1(CD54)、ICAM-2(CD102)、C3bi 配体,粘附,调理吞噬 |
| CD19 | B4,Leu12 | B | gp90 | 调节 B 细胞活化 |
| CD20 | B1,Leu16 | B | p37/35(非糖基化穿膜磷蛋白) | Ca2+ 通道?调节 B 细胞活化 |
| CD21 | B2,OKB-1;(CR2) | Bm,FDC | p140 | C3d/EBV 受体,B 细胞活化,结合 sCD23 |
| CD22 | HD39,Leu14,SHCL-1,HC2 BL-CAM | B | gp130/140,髓鞘(磷)脂相关蛋白类似物(MAG) | 与 CD45RO 结合,B 细胞粘附、B 细胞活化? |
| CD23 | MHM6,Leu20;(FcεRⅡ) | Bm,Ba,,Ma,Eo | gp45~50 | 参与 IgE 生成的调节,调节 B 细胞分化,IgE 介导的 ADCC,结合 CD21? |
| CD24 | BA-1 | B,G | gp41/38 | ? |
| CD25 | TAC,7G7/B6;(IL-2Rα) | Ta,Ba,Ma | gp55 | 组成高亲力受体,T 细胞生长 |
| CD26 | 5.9,Tal | Ta,B,Mac | gp120 | 二肽酰肽酶Ⅳ(DPPⅣ),HIV 另一类受体? |
| CD27 | VIT14,S152,OKT18A | Tsub | p55,NGF 受体家庭 | CD70 的配体 |
| CD28 | 9.3 | Tsub,Ba | gp44 | 与 CD80、CD86 互为配体 |
续表 2
| CD | 常用克隆抗体或代号() | 主要表达细胞 | 分子量(kDa)和结构 | 功能 |
| CD29 | 4B4,(integrinβ1,FNRβ) | 广泛分布 | gp130,GPⅡa | 与 ECM 粘合,细胞间粘附,结合 VCAM-1(CD106) |
| CD30 | Ki-1 | Ta,Ba,Rs | gp105,NGF 受体家族 | 与淋巴细胞存活和增殖有关 |
| CD31 | SG134,TM3,HEC-75;(PECAM) | Pt,M,G,B | gp140, 血小板 GPⅡa | 粘附 |
| CD32 | CIKM5,41H16(FcγRⅡ) | Mac,G,B,Eo | gp40 | 凝聚 IgG FcR,吞噬,ADCC |
| CD33 | MY9,H153,L4F3 | M,BM | gp67 | ? |
| CD34 | MY10,ICH3 | BM | gp105~120 | 生长因子受体?调控早期造血 |
| CD35 | TO5,E11,(CR1) | G,M,B,NKsub,RBC | p160~260 | 结合 C3b,调理吞噬 |
| CD36 | 5E1,ESIVC7,OKM5 | M,Pt,(B) | gp88,血小板 GPⅢb | 结合 ECM,血小板粘附 |
| CD37 | HD28,HH1 | Bm,(T,M) | gp40~52 | ? |
| CD38 | Leu17,T16,OKT10 | PC,Ta,Thy, | p45 | ? |
| CD39 | AC2,G28-10 | Bm,(M),FDC | gp70~100 | ? |
| CD40 | G28-5,EA-5 | B,FDC | p50,NGF 受体家族 | B 细胞生长和记忆细胞产生 |
| CD41 | PBM6.4,PL273;(integrinαⅡb) | Pt | GPⅡb/Ⅲa 中的 GPⅡb(gp120/25) | 血小板凝集和活化 Fb,结合 ECM 的受体 |
| CD42a | FMC25,GR-P | Pt,Meg | gp23, 血小板 GPⅨ, 形成 GPIb/Ⅸ复合物 | 血小板粘附,结合 vWF |
| CD42b | PHN89,AN51 | Pt,Meg | gp135/25, 血小板 GP1b- α 形成 GPIb/Ⅸ复合物 | 血小板粘附,结合 vWF |
| CD42c | Pt,Meg | 22,血小板 GPIb-β | ||
| CD42d | Pt,Meg | 85,血小板 GPV | ||
| CD43 | OTH71C5,G19-1;(Leukosialin) | T,G,M | gp95,Sialophorin | T 细胞活化?与 CD54 结合 |
续表 3
| CD | 常用况隆抗体或代号() | 主要表达细胞 | 分子量(kDa)和结构 | 功能 |
| CD44 | GRHL1,Hermes,F10-44-2(Pgp-1,ECM-RⅢ) | Leu | gp80~215 | 粘附 ECM,T 细胞活化,淋巴细胞归位受体 |
| CD44R | FW11,24 | CD44 限制性表位(外显子 v9 剪接的变异体) | ||
| CD45 | T29/33,BMAC1;(T200) | Leu | p170~240,白细胞共同抗原(LCA) | PTP 酶,调节信号传导调节信号传导 |
| CD45RA | G1-15,F8-11-13,Leu18;(限制性 LCA) | Tsub,B,M,(G,NK) | gp220 | 调节信号传导 |
| CD45RB | PT17/26/16;(限制性 LCA) | Leu | gp190/205/220 | 调节信号传导 |
| CD45RO | UCHL1;(限制性 LCA) | Tsub,Bsub,G,M | gp190 | 与 CD22 结合,调节信号传导 |
| CD46 | HULYM5,J48 | Leu,Pt | 膜辅助因子蛋白(MCP),gp56/66 | 调节补体活化,麻疹病毒受体 |
| CD47 | BRIC126,CIKM1 | 广泛分布 | gp47~52,N 连接葡聚糖 | ? |
| CD48 | WM68,LO-MN25 | Leu | gp41(GPI 联结),与 CD58 有 68% 同原 | CD2 的配体 |
| CD49a | SR84,IB3.1(VLAα1) | T,M | gp210,与 CD29 组成 VLA-1 | 粘附 CA 和 LM |
| CD49b | Gil4(VLA-α2,ECMR-Ⅱ,Pt-GPIa) | Leu,Pt | gp165,与 CD29 组成 VLA-2 | 粘附 CA |
| CD49c | J143(VLAα3,ECMR-1) | T,Bsub,M | gp135/25,与 CD29 组成 VLA-3 | 粘附 FN、CA 和 LM |
| CD49d | B5G10,HP2/1;(VLA-α4) | M,T,B,Thy,Pt | gp150,80,70, 与 CD29 组成 VLA-4 | 粘附 FN,结合 VCAM-1(CD106),归位受体 |
| CD49e | 2H6,3D3(VLAα5,FNRα,ECMR-Ⅳ) | T,Bsub,m | gp130/25,与 CD29 组成 VLA-5 | 粘附 FN |
| CD49f | GOH3(VLA-α6) | Pt,(T) | gp120/30,与 CD29 组成 VLA-6 | 粘附 LM |
| CD50 | 101-1D2,140-11,(ICAM-3) | Leu | gp140/108 | 粘附,CD11a-CD11b/CD18)配基 |
| CD51 | 13C2;23C6;NK1-M7(VNRα 链,integrin αv) | Pt,Leu | gp125/24,与 CD61 组成二聚体 | 粘附 VN、FN 和 vWF |
续表 4
| CD | 常用克隆抗体或代号() | 主要表达细胞 | 分子量(kDa)和结构 | 功能 |
| CD52 | YTH66.9;(Campath-1) | Leu | gp21~28 | ? |
| CD53 | HI36,MEM-53,HD77 | leu,BM | gp32~40(TM- 4 成员) | ? |
| CD54 | WEHI-CAMI,OKT27(ICAM-1) | 广泛分布 | gp90(80~114), 细胞间粘附分子 -1 | 与 LFA- 1 和 CD43 结合,鼻病毒受体,En 上恶性疟原虫受体 |
| CD55 | 143-30,BRIC110,BRIC123;(DAF) | 广泛分布 | p70,衰变加速因子(GPI 联结) | 调节补体活化 |
| CD56 | Leu19,NKH1;(N-CAM) | NK,(Tsub) | 神经细胞粘附分子(N-CAM)的三种异构体 gp120,140,180 | 粘附 |
| CD57 | Leu7,HNK-1 | NK,Tsub,Bsub | gp110 | ? |
| CD58 | G26,BRIC5;(LFA-3) | 广泛分布 | 白细胞功能抗原 -3,gp40~65(部分 GPI 联结) | 与 CD2 结合,粘附 |
| CD59 | MEM-43,YTH53.1;(TAP,Protectin) | 广泛分布 | gp18~20(GPI 联结) | 与 CD2 结合,抑制 MAC |
| CDw60 | M-T32,M-T21,M-T41;(GD3) | Tsub,Pt | 乙酰神经氨酸 - 乙酰神经氨酸半乳糖 p105 | ? |
| CD61 | Y2/51,CLB-thromb/1(VNR- β 链, integrinβ3) | Pt,Meg | p105 血小板 GPⅢa,与 CD51 组成 VNR | 结合 VN、FN 和 vWF |
| CD62E | 3B7,4DIO(E-selectin,ELAM-1) | En | gp115 | 粘附 L -selectin、CD15s |
| CD62L | Leu8,FMC46(L-selectin,LAM-1) | T,B,M,NK | gp75~80 | 粘附 E -selectin,P-selectin? |
| CD62P | G2,AK-6(P-selectin,GMP-140,PADGEM) | Pt,En | gp140,Lectin family 血小板 α 颗粒 | 结合 PMN、M 表面 |
| CD63 | RUU-SP2.28,CLB | Pt,M,Mac,(G,T,B) | gp53, 血小板致密颗粒(TM- 4 成员) | CD15s, 粘附到 En 和 Pt? |
续表 5
| CD | 常用克隆抗体或代号() | 主要表达细胞 | 分子量(kDa)和结构 | 功能 |
| CD64 | MAb32.2,MAb22;(FcγRI) | M | gp70 | 吞噬、ADCC, Mac 活化 |
| CDw65 | VIM2,HE10,CF4 | G,M | 岩藻糖基神经节苷脂 | 中性粒细胞活化 |
| CD66a | BGP | 髓样细胞 | 180~200(胆汁糖蛋白 -1) | ? |
| CD66b | MF25·1(P100, 原 CD67) | G | 95~100 | ? |
| CD66c | NCA | 髓样细胞 | 90~95 | ? |
| CD66d | CGM1 | 髓样细胞 | 30 | ? |
| CD66e | CLB-gran/10(CEA) | 髓样细胞, 上皮 | gp180~200 | 粘附 |
| CD67 | (CD66b) | G | 95~100 | ? |
| CD68 | EBM11,Ki-M7,Ki-M6 | Mac | gp110 | ? |
| CD69 | Leu23(AIM) | Ta,Ba,Mac,NK | 34,28 | 活化诱导分子 |
| CD70 | Ki-24(CD27L) | Ta,Ba,RS | 55,75,95,110,170 | CD27 的配体 |
| CD71 | OKT9;(TfR) | Mac, 增殖细胞 | p95 | 铁代谢,细胞生长 |
| CD72 | S-HCL2,J3-109,BU-40 | B | gp43,39 | 与 CD5 结合 |
| CD73 | 7G2.2.11,AD-2 | Bsub,Tsub | p69(GPI 连结) | 5` 一核苷酸外切酶 |
| CD74 | LN2,BU-43 | B,M | gp41/35/33.Ⅱ类相关恒定链(γ 链) | 与新合成 MHCⅡ类分子结合,参与抗原提呈 |
| CDw75 | LN1,HH2 | Bm,Tsub | p53,α2.6sialyltransferase | 酶活性 |
| CDw76 | HD66,CRIS-4 | Bm,Tsub | p85/67 | ? |
| CD77 | 38.13(BLA);424/4A11 | B | Globotriaosylceramide(Gb3) | ? |
| CDw78 | Leu21,AntiBa | B | p67? | ? |
| CD79a | mb-1(Igα) | B | 33,40 | mIg(BCR)复合成分 |
| cd79b | B29(Igβ) | B | 33,40 | mIg(BCR)复合 |
| CD80 | B7-1,BB1 | Ba,Mac, 胸腺 Stromal cell | 60 | 活化 B 细胞抗原,CD28、CTLA- 4 配体,刺激 T 细胞活化 |
续表 6.
| CD | 常用克隆抗体或代号() | 主要表达细胞 | 分子量(kDa)和结构 | 功能 |
| CD81 | ID6,5A6(TAPA-1) | B,T,M | 22(TM- 4 成员) | 离子通道,增殖抗体靶抗原 |
| CD82 | R2,1A4,4F9 | B | 50~53(TM-4) | 信号传递 |
| CD83 | HB15 | B,DC | 43 | ? |
| CDw84 | 2G7,152-ID5 | B | 73 | ? |
| CD85 | VWP-55,GH1/75 | B,M,PC | 120,83 | ? |
| CD86 | FUN-1,BU63 | Bac,Tac,M | 80 | CD28 配体,活化 T 细胞信号 |
| CD87 | UPA-R | 髓样细胞 | 50~65(GPI 连接) | 结合尿激酶血纤维蛋白溶酶原激活因子 |
| CD88 | S5/1,W17/1(C5aR) | 髓样细胞 | 42 | 补体 C5a 受体,趋化作用 |
| CD89 | 79E6,A3(FcαR) | 髓样细胞,Tsub,Bsub. | 55~75 | IgA Fc 段受体 |
| CDw90 | 5E10(Thy-1) | 髓样细胞, 造血祖细胞 | 25~35(GPI 连接) | T 细胞活化,神经细胞粘附 |
| CD91 | A11,C2(α2M-R) | 髓样细胞 | 517/85(α/ β 二聚体) | α2- 巨球蛋白受体,与 M,Mac 分化有关 |
| CDw92 | VIM15 | 髓样细胞 | 70 | ? |
| CD93 | VIMD2 | 髓样细胞 | 120 | ? |
| CD94 | HP3Bi(KP43) | NK | 43/43(同源二聚体) | 调节细胞粘附和溶细胞活性 |
| CD95 | 71CC,anti-Fas (APO-1/FAS) | 活化,广泛 | 42(三个富含半胱氨酸重复结构) | 抗 CD95McAb 可诱导程序性细胞死亡 |
| CD96 | G8.5,TH-111 TACTILE | 活化 | 160 | T 细胞活化? |
续表 7
| CD | 常用克隆抗体或代号() | 主要表达细胞 | 分子量(kDa)和结构 | 功能 |
| CD97 | VIM3b,VIM3C(BL-KDD/F12) | 活化 | 74,80,89 | T 细胞活化? |
| CD98 | 4F2,2F3 | Ta,Thy,NK,M,Pt | 80/40(异二聚体) | 激酶相关 |
| CD99 | D44,FMC29(E2,MIC2) | T,Leu | 32 | E 花结形成;粘附作用 |
| CD99R | HI170,IT4,(E2,MIC2) | T | 32 | ? |
| CD100 | BD16,BB18,A8 | T,Ta,NK,M | 150 | 细胞激活和增殖 |
| CDw101 | BB27,BA27 | T | 140 | 与 CD28 共表达 |
| CD102 | CBR-IC2/1,(ICAM-2) | 粘附,Leu,Pt,En | 60 | 粘附,配体 LFA-1 |
| CD103 | LF61(HML-1,integrin αE) | 粘附,Tsub | 150,25 | 粘附,T 细胞与上皮细胞相互作用 |
| CD104 | 439-9B(β4 integrin) | 粘附,上皮,Thy,En, 角朊 | 220(形成 α6β4 二聚体) | 与细胞骨架相连 |
| CD105 | 44G4,1G2(Endoglin,TGF-βRⅢ) | En,Mac | 95(S- 和 L -Endoglin 不同胞浆区都含 RGD) | TGF-βRⅢ,细胞粘附 |
| CD106 | 1G11(VCAM-1,INCAM-110) | En,M,BM | 100,110 | VLA- 4 配体,参与粘附 |
| CD107a | H5g11,(LAMP-1) | Pt | 110 | 溶酶体相关膜蛋白 |
| CD107b | H4B4(LAMP-2) | Pt | 120 | 血小板激活 |
| CDw108 | MEM-150,MEM-121 | 粘附,Tac | 80(GPI 连接) | 细胞活化 |
| CDw109 | 8A3,7D1 | En,Tac,Pt | 170/150(GPI 连接) | 细胞活化、增殖和信号传递 |
| CD115 | MR18(CSF-1R,M-CSFR) | 髓样细胞(M,Mac)定向 BM | 150(c-fms 基因产物) | M-CSF 受体,细胞生长和信号传递 |
| CDw116 | DF2714(GM-CSFRα 链) | 髓样细胞(PMN,Eo,M,Mac)BM | 75~85(与 β 链组成高亲和力受体) | GM-CSF 受体,细胞生长和分化 |
| CD117 | 17F11(SCFR,cKIT) | Mas,BM | 145 | SCF 受体,肥大细胞生长,增强其它细胞因子信号传递 |
续表 8
| CD | 常用克隆抗体或代号() | 主要表达细胞 | 分子量(kDa)和结构 | 功能 |
| CDw119 | 3B1,B8(IFN-γR) | 广泛 | 90 | IFN- γ 受体,细胞活化,MHC 抗原表达 |
| CD120a | MR-1(TNFR;55kD) | 广泛 | 55,NGF 受体家族 | TNF 受体,与 Fas 抗原共调变 |
| CDw120b | MR2-1(TNFR;75kD) | T,B,M | 75,NGF 受体家族 | TNF 受体 |
| CDw121a | hIL-1R1-M1(IL-1RⅠ型) | 广泛,T,B,En,Eb, 上皮 | 80 | IL- 1 受体 |
| CDw121b | hIL-1R2-M22(IL-1RⅡ型) | 广泛 | 68 | IL- 1 受体,T 细胞活化 |
| CD122 | 2RB(IL-2R,75kD,IL-2Rβ) | T,B,NK | 75 | IL- 2 受体,激活 T、B 和 M |
| CDw124 | hIL-4R-M57(IL-4R) | 造血细胞,Fb,上皮 | 140 | IL- 4 受体,细胞生长、分化 |
| CD126 | B-C22(IL-6R) | T,Bac | 80(与 gp130 组成高亲和力受体) | IL- 6 受体,细胞生长、分化 |
| CDw127 | H2,hIL-7R-M20(IL-7R) | 淋巴样,髓样细胞 | 75 | IL- 7 受体,细胞生长 |
| CDw128 | GB20(IL-8R) | PMN,Eo,B,M | 58~67 | IL- 8 受体,趋化和活化 PMN |
| CDw130 | AM64(IL-6R-gp130SIG) | 广泛 | 130(与 IL-6R,IL-11R,LIFR、OSMR 和 CNTFR 组成高亲和力受体) | IL- 6 受体 gp130,转导信号 |
注:Thy:胸腺细胞;DC:树突状细胞:FDC:滤泡树突状细胞;B:B 细胞;Bsub:B 亚群;Pre-B,前 B 细胞;Bm:成熟 B 细胞;Ba: 活化 B 细胞;T:T 细胞;Tsub:T 亚群;Ta:活化 T 细胞;M:Ma:活化单核细胞;Mac:巨噬细胞;Mas:肥大细胞;PC:浆细胞;G:粒细胞;PMN:多形核细胞;My:髓样细胞;NK:自然杀伤细胞;NKsub:NK 亚群;LHC:表皮郎罕氏细胞;RS:Reed-Srtenterg 细胞;NEC:神经内分泌细胞;RBC:细细胞;Pt:血小板;Eo:嗜酸性粒细胞;BM:骨髓细胞;Meg: 巨核细胞;Fb:成纤维细胞;En:内皮细胞;Leu:白细胞;gp:糖蛋白;p:蛋白质;VLA:很晚出现在抗原;CALLA:共同型急性淋巴母细胞白血病抗原;LAMP:溶酶体相关膜蛋白;MCP:膜辅蛋白;MAC:膜攻击单位;LFA:淋巴细胞功能相关抗原;CR:补体受体;3FAL:3-fucosyl-N-acetyl-lactosamine;PECAM: 血小板内皮细胞粘附分子;ECMR:细胞外基质受体;LCA:淋巴细胞共同抗原;PTPase:磷酸酪氨酸磷酸酯酶;ICAM:细胞间粘附分子;N-CAM:神经细胞粘附分子;TAP:T 细胞活化蛋白;Tyr-P:磷酸化酪氨酸;VCAM:血管细胞粘附分子;GPI:糖基磷脂酰肌醇;AIM:活化诱导分子;LIF:白血病抑制因子;OSM:抑瘤素 -M;CNTF:睫状神经营养因子;CA:胶原蛋白;LM:层粘连蛋白;FN:纤粘连蛋白;FB:血纤维蛋白原;vWF:von Willbrand 因子;TM-4:四次跨膜家族。
二、小鼠白细胞分化抗原
大多数白细胞分化抗原在生物进化过程中具有保守性,这是不同种的动物执行相同或相似生物学功能的需要。小鼠是免疫学常用的实验动物,而且对某些人白细胞分化抗原的结构和功能的了解首先是从小鼠或小鼠源性的细胞实验模型得知的,表 1 - 3 列举了部分与人 CD 抗原类同的小鼠造血细胞表面抗原,以供参考。
表 1 -3 与人 CD 抗原类同的小鼠造血细胞表面抗原
| 小鼠表面抗原 | CD 类同物 | 分 布 | 功 能 | 分子量(kDa) | 染色体定位 |
| Lyt-1 | CD5 | T,B 亚群 | 70 | 19 | |
| Lyt-2 | CD8a | CTL | CTL 粘附 | 30 | 6 |
| Lyt-3 | CD8b | CTL | CTL 粘附 | 35 | 6 |
| L3T4 | CD4 | Th/Ti | 结合 MHCⅡ类分子 | 52 | 6 |
| Ly-5 | CD45 | 白细胞,干细胞,滤泡状树突细胞,有核红细胞,胸腺细胞 | B 细胞成熟 | 200,210,200,190 | 1 |
| Ly-5 | CD45R? | 前 B,B,CTL 亚群 | 220 | 1 | |
| Ly-15 | CD11a | T,B,髓样细胞,NK,红样细胞,髓样干细胞 | CTL 粘附 | 177 | 7 |
| Ly-17 | CD32 | B,髓样, 干细胞,T?郎格罕细胞? | IgG2b/1Fc 受体 | 55~60 | 1 |
| Ly-37 | CD2 | T,B,Thy | T 细胞活化,红细胞受体 | 50~60 | 3 |
| Ly-38 | CD1 | 3 | |||
| Ly-40 | CD11b | Mδ,B,Lyt- 1 阳性 B 细胞 | C3bi 受体 | 165 | |
| Ly-43 | CD23 | B | IgE Fc 受体 | 49 | 1 |
| Ly-42 | CD25 | T,B | IL- 2 受体 α 链 | 47~53 | |
| Ly-44 | CD20 | B |
第二节 白细胞分化抗原的应用
CD 抗原及其相应的单克隆抗体在基础和临床免疫学研究中已得到广泛的应用。在基础免疫学研究中,CD 主要应用于:(1)CD 抗原的基因克隆,新 CD 抗原及新配体的发现;(2)CD 抗原结构与功能关系;(3)细胞激活途径和膜信号的传导;(4)细胞分化过程中的调控;(5)细胞亚群的功能。在临床免疫学研究中,CD 单克隆抗体可用于:(1)机体免疫功能的检测;(2)白血病、淋巴瘤免疫分型;(3)免疫毒素用于肿瘤治疗、骨髓移植以及移植排斥反应的防治;(4)体内免疫调节治疗。有关与免疫功能相关的 CD 分子归纳于表 1 -4。有关与 T 细胞表面分子、B 细胞表面分子以及 NK 细胞的表面标记参见第七章。与 CD 有关的 Ig 超家族、粘附分子、补体受体、细胞因子受体等分别在本书的有关章节中加以介绍。
表 1 -4 与免疫功能有关的 CD
| 免疫功能 | CD |
| 细胞受体 TCR CD3、CD4、CD8mIg mb-1/Igα(CD79a)、B29/Igβ/(CD79b)CR CR1(CD35)、CR2(CD21)、CD3(CD11b/CD18)、CR4(CD11c/CD18)、C5aR(CD88) FcR FcγRI(CD64)、FcγRⅡ(CD32)、FcγRⅢ(CD16)、FcεRⅡ(CD23)FcαR(CD89) 细胞因子受体 IL-2Rα(CD25)、M-CSFR(CD115)、GM-CSFR(CDw116)、SCFR(CD117)、IFN-γR(CDw119)、TNF-αR(CD120)、IL-1R(CDw121)、Il -2Rβ(CD122)、IL-4R(CDw124)、IL-6R(CD126)、IL-7R(CDw127)、IL-8R(CDw128)、gp130(CDw130) 细胞间、细胞基质相互识别 白细胞粘附分子 - 内皮细胞粘附分子:LFA-1(CD11a/CD18)-ICAM-1(CD54)、ICAM-2(CD102)Mac-1(CD11b/CD18)-ICAM-1(CD54)VLA-4(CD49d/CD29)-VACM-1(CD106)L-selectin(CD62L)-E-selectin(CD62E)、P-selectin(CD62P)CD15-E-selectin(CD62E)、P-selectin(CD62P)淋巴细胞归位受体 - 血管内皮细胞地址素 :L-selectin(CD62L)-PNAdCLA-E-selectin(CD62E)LFA-1(CD11a/CD18)-ICAM-1(CD54)、ICAM-2(CD102)VLA-4(CD49d/CD29)-VCAM-1(CD106)CD44-MAdLPAM-2(CD49d/β7)-MAd、VCAM-1(CD106) 白细胞粘附分子 - 细胞外基质:VLA-1(CD49a/CD29)-CA、LMVLA-2(CD49b/CD29)-CA、LMVLA-3(CD49c/CD29)-FN、LM、CAVLA-4(CD49d/CD29)-FNVLA-5(CD49e/CD29)-FNVLA-6(CD49f/CD29)-LMα7β1(-/CD29)-LMVNR-β1(CD51/CD29)-VN、FNMac-1(CD11b/CD18)-FBP150,95(CD11c/CD18)-FBGPⅡbⅢa(CD41/CD61)-FB、FN、vWF、TSPVNR(CD51/CD61)-VN、FB、vWF、FN、CA、TSPα6β4(CD49f/CD104)-LMVNR-β5(CD51/-)-VNCD51/ β6-FNCD49d/β7-FNGPIb-α/IX(CD42b/CD42a)-vWF免疫细胞间相互识别:CD22-CD45ROCD2-LFA-3(CD58)CD4-MHCⅡ类分子 CD5-CD72CD 8-MHCⅠ类分子 LFA-1(CD11a/CD18)-ICAM-1(CD54)、ICAM-2(CD102)CD28-B7/BB1(CD80)CD27-CD70参与白细胞激活 T 细胞:CD2(T 细胞旁路激活途径)、CD3(信号转导)、CD4、CD5、CD8、CD28、CD43、CD44、VLA-4(CD49d/CD29)、CDw90B 细胞:CD19(抑制 G→C1,抑制 Ig 分泌)、CD20(抑制细胞周期)、CD21(活化 B 细 胞)、CD22(Ca2+ 升高,促进 G→G1)、CD23(B 细胞分化)、CD40(B 细胞生 长)、CD72、CD73(G→G1)、CD80(B 细胞活化)髓样细胞:CD14(髓样细胞氧化爆发?)、CDw65(中性粒细胞活化)NK:CD16(NK 活化)、CD2、CD3 非谱系:CD69(活化诱导分子,AIM)与细胞膜表面酶有关 CD10(中性肽链内切酶)、CD13(氨肽酶)、CD26(二肽酰肽酶Ⅳ)、CD45(酪氨酸磷酸酯酶)、CD73(5` 核苷酸外切酶)、CDw75(具有酶活性) 与病毒受体有关CD21(EB 病毒 R)、CD4(HIVR)、CD54(鼻病毒 R)、CD46(麻疹病毒受体) | |
一、与 T 细胞识别、粘附、活化有关的 CD 分子
T 细胞是一类重要的免疫活性细胞,除直接介导细胞免疫功能外,对机体免疫应答的调节起关键作用。T 淋巴细胞本身的识别活化及效应功能的发挥,不仅与外来抗原、丝裂原和多种细胞因子密切相关,而且有赖于 T 细胞相互之间、T 细胞与抗原提呈细胞(APC)之间以及 T 细胞与靶细胞之间的直接接触。T 淋巴细胞识别抗原的受体是 T 细胞受体(t cell receptor,TCR)与 CD3 所组成的复合物(TCR/CD3)。在识别过程中还有赖于抗原非特异性的其它细胞表面分子的辅助,这些辅助分子(accessory molecules)主要包括 CD4、CD8,MHC Ⅰ类分子、Ⅱ类分子,LFA-1(CD11a/CD18)、CD49d、e、f/CD29(VLA-4、VLA-5、VLA-6)、CD28、CD44、CD45、ICAM-1(CD54),LFA-2(CD2)和 LFA-3(CD58)等。
有关 MHCⅠ类、Ⅱ类分子的结构和功能在第六章“MHC 及其临床应用”中讨论。VLA-4、VLA-5、LFA-6、LFA-1、ICAM-1、CD44 见第二章“粘附分子”。有关 CD45 在第八章“免疫球蛋白超家族”中阐述。
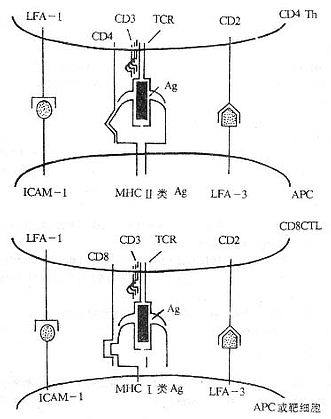
图 1 -1 参与 T 细胞对靶细胞识别的分子(模式图)
T 细胞表面的辅助分子有以下特点:
(1)存在于 T 细胞上的辅助分子可特异地与存在于 APC 或靶细胞上的某些分子(配体)相结合,如 LFA- 1 和 CD2 可分别与 ICAM- 1 和 LFA- 3 结合。
(2)辅助分子本身不具有多态性,在一个物种所有个体的所有 T 细胞的某一种辅助分子的结构基本上是相同的。
(3)辅助分子可加强 T 细胞与 APC 或靶细胞结合的程度。
(4)许多辅助分子具有转导信号的功能,如 CD2、CD4 和 CD8 等分子。
(5)有些辅助分子如 CD2、CD4、CD8、CD28、Thy- 1 等其编码的基因属于 Ig 基因超家族;有些辅助分子如 LFA-1、VLA-4、VLA- 5 和 VLA- 6 等编码的基因属于 integrin 基因超家族。
(6)T 细胞膜表面辅助分子作为膜表面重要的标记已被应用于临床的诊断和治疗。
(7)细胞因子可调节辅助分子的表达,从而改变细胞间粘附的能力,这是细胞因子免疫调节作用的一个重要方面。
(一)T 细胞受体
T 细胞受体(T cell receptor,TCR 或 Ti)是 T 淋巴细胞表面识别外来抗原与自身 MHc Ⅰ类抗原(或Ⅱ类抗原)复合物的受体,在同种异体移植中 TCR 也识别单独的非已的 MHC 抗原。目前已经证实,TCR 在细胞表面与 CD3 密切结合在一起组成 TCR/CD3 复合物,TCR 识别抗原后刺激信号是通过 CD3 分子传递的。
1.T 细胞受体的类型和结构 TCR 中的多肽链是异质性的。根据抗原结构和编码基因不同,已发现有 α、β、γ 和 δ 四种多肽链。关于 TCR 多肽链的结构大多是从分析 TCR 多肽链 cDNA 或基因组克隆(genomicclones)而来,编码 TCR 多肽链的基因属于免疫球蛋白基因超家族成员。成熟 TCR 肽链分子量在 40~60kDa 之间。根据 TCR 中异源双体的组成的不同,TCR 可分为以 TCRαβ 和 TCRγδ 两种类型。
(1)TCRαβ:CD 阳性 TCRαβT 细胞可识别非已 MHCⅡ类抗原(同种异体抗原)或自身 MHCⅡ类抗原与加工后抗原的复合物 CD8 阳性 TCr αβT 细胞则可识非已 MHCⅠ类抗原或自身 MHC Ⅰ类抗原与加工后抗原的复合物 TCRα 链分子量 40~50kDa 的酸性糖蛋白,β 链 40~50kDa 不带电或碱性糖蛋白。α 和 β 链各由一个可变区(V 区)和一个恒定区(C 区)组成,与 Ig 的 V 区和 C 区大小相似,属于免疫球蛋白超家族成员。TCRα、β 链的 V 区约含 102 到 109 个氨基酸,在 V 区部分由两个半胱氨酸形成链内二硫键,组成约含 50~60 氨基酸残基的环肽,这与 IgV 区结构和功能相似,是特异性识别外来抗原的结构域。TCRα、β 链的 C 区约含 138 到 179 个氨基酸,每个 C 区形成由链内二硫键连接的环肽。α、β 链在连接肽(connectingpeptide)形成链间二硫键。穿膜区约由 20~24 氨基酸组成,α 链穿膜区含有带正电的 1 个赖氨酸和 1 个精氨酸残基,β 链穿膜区含有 1 个带正电的赖氨酸残基, 这些带正电的氨基酸与 CD3γ、δ 和 ε 链穿膜区带负电的谷氨酸和 / 或天冬氨酸形成盐桥,稳定 TCR/CD3 复合物结构,并与 CD3 传递信息有关。α、β 链胞浆部分只有 5~12 氨基酸长的尾部(图 1 -2)。
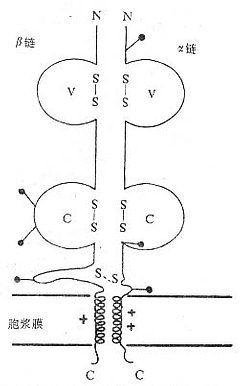
图 1 -2 TCRαβ 异源双体模
(2)TCR γδ:TCRγ 和 δ 链各包括一个 Ig 样的 V 区和 C 区、连接肽、疏水的穿膜区以及一个短的胞浆区尾部,在连接肽区可形成链间的二硫键。γ 和 δ 链的穿膜区各含有 1 个带正电的赖氨酸,此外 δ 链还有 1 个带正电的精氨酸,这些带正电的氨基酸与 CD3γ、δ 和 ε 链穿膜区带负电的天冬氨酸或谷氨酸形成盐桥。在氨基酸水平上分析,TCRγ 链与 β 链同源性较高,而 TCRδ 链与 α 链同源性较高。在人类 TCRγδ 有二硫键相连和非共价相连两种形式,而在小鼠只发现二硫键相连的 TCRγδ 形式。人 γ 链分子量为 36~55kKa,δ 链为 40~60kDa,γ、δ 链的分子量大小取决于多肽骨架的长度和糖基化的程度。
有关 TCRα、β、γ、δ 链基因的结构和重排见第三章“免疫球蛋白超家族”
2. 两种类型 TCR T 细胞的比较 TCRαβ 与 TCRγδ 不仅组成受体多肽链的结构不同,而且具有这两种类型受体 T 细胞的分布、表型、发育以及功能也有差别(表 1 -5)。
表 1 -5 TCRαβ 与 TCRγδ 细胞特性的比较
| 特性 | TCRαβ | TCRγδ | ||
| 分 布 | PBL | 60~70% | 0.5~15% | |
| 其它部分 | 小鼠树突状表皮细胞(DEC)、小鼠粘膜上皮内淋巴细胞(IEL) | |||
| 表 型 | CD4+CD8- | 60~65% | <1% | |
| CD4-CD8+ | 35% | 20~50% | ||
| CD4-CD8- | <1% | 50~80% | ||
| CD2 | 100% | 100% | ||
| CD5 | >95% | - 或 +(弱) | ||
| 发 育 | 胸腺后期 | 胸腺早期(早于 TCRαβ) | ||
| 功 能 | (1)识别 MHC 与加工处理 多肽的复合物 | (1)识别外来抗原的 MHC 限制尚有争论,识别破伤风类毒素可能受 MHCⅡ类抗原限制;小鼠 TCRγδ 对合成肽反应受 Qa 分子限制。 | ||
| (2)识别非已 MHC 及 MHCⅠ类抗原相关分子(TLa、CD1) | ||||
| (2)识别非已 MHC | ||||
| (3)产生些细胞因子(IL-2、IL-4、IL-5、GM-CSF、IFN-γ) | ||||
| (3)产生多种淋巴因子 | (4)某些 TCRγδ 细胞可杀伤靶细胞 | |||
| (5)调节 TCRαβ 的发育。 | ||||
| (4)杀伤病毒感染等靶 细胞 | ||||
| (6)上皮屏障(针对肠毒素、分枝杆菌热休克蛋白等) | ||||
注:树突状表皮细胞 dendriticepidermal cell, DEC
上皮内淋巴细胞 intraepithelial lymphocyte IEL
在正常外周血中,CD4-CD8+、CD4+CD8-、CD4+CD8+ 和 CD4-CD8- 四种表型不同的 T 细胞分别占 T 细胞总数的 25%、70%、1% 和 4% 左右,其中前三种表型 TCR 类型主要为 TCRαβ,而 CD4-CD8- T 细胞主要为 TCRγδ。以下疾病可见外周血或局部 TCRγδ 细胞数量或比率升高:(1)重症联合免疫缺陷、常见可变型免疫缺陷、Wiskott-Aldrich 综合征、Di-George 综合征、白血病患者骨髓移植等病人外周血中 TCRγδ 细胞百分率增加;(2)少数急性 T 细胞白血病、T 细胞恶性淋巴瘤患者为 TCRγδT 细胞发生恶性变;(3)慢性淋巴细胞性白血病、大颗粒淋巴细胞(LGL)白血病病人 PBMC 中 TCRγδT 细胞百分率增加;(4)肾移植患者排异反应晚期外周血中 TCRγδ 细胞增加;(5)类风湿性关节炎患者关节腔滑液中 TCRγδ 阳性细胞比率要高于外周血中 TCRγδ 细胞比例,推测 TCRγδ 可能参与局部炎症的发生;(6)经结核杆菌免疫后的局部淋巴引流液中 TCRγδT 细胞比例增加,麻风结节病灶中有很高比例的 TCRγδT 细胞,提示 TCRγδT 细胞对分枝杆菌所致的感染免疫中起重要作用;(7)HIV、EBV 感染时外周血 TCRγδT 细胞比例增加。
[超搞原]有的抗原不经过 APC 处理和递呈可直接激活 CD4 阳性 T 细胞称为超抗原(superantigen,SAg), 具有类似致分裂原的作用。SAg 对 T 细胞的激活采取一种独特的方式,即分子一端和 TCRβ 链上 V 基因产物结合,别一端和 APC 表面 MHCⅡ类分子相结合。因此 SAg 发挥作用需有两类细胞:表达 TCRβ 链的 CD4+ T 细胞和表达 MHCⅡ类抗原的辅佐细胞。外源性的 SAg 主要是葡萄菌、链球菌、支原体等微生物产生的毒素,其中以葡萄球菌肠毒素 A(Staphylococcus enterotoxin A,SEA)研究得最多,SEA 往往取用特定 TCR 基因片段 Vβ6.9 及 Vβ22,SEA 另一侧与 HLA-DR 分子 β1 结构域的 α 螺旋相结合。
SAg 激活 CD4+ T 细胞使之释放 IL-2,IFN、TNF 等细胞因子,诱导 CTL 分化为效应细胞,可杀伤对 NK、LAK 高度抵抗的白血病细胞。
(二)CD3(T3、Leu4)
CD3 分子分布于成熟 T 淋巴细胞表面,至少由 γ、δ、ε、ζ、η5 种多肽链组成,与 T 细胞抗原受体非共价连接(图 1 -3)。CD3 单克隆抗体可诱导 CD3 多肽和 TCR 共帽形成(co-capping),并诱导 T 淋巴细胞活化。TCR 识别外来抗原与自身 MHC 分子形成的复合物,CD3 对于信号的传递具有重要作用。
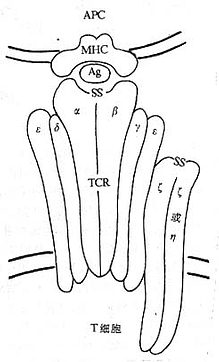
图 1 -3 TCR/CD3 结构模式图
T 细胞在胸腺发育过程中,CD3γ、δ 和 ε 基因的表达要早于 TCRα、β 链基因的表达。CD3γ、δ 和 ε 基因产物通过翻译后的修饰形成核心结构,在内织网处,此核心结构与 TCRαβ 异源双体形成复合物后转移到高尔基氏体,进行 N 连接的糖基化。ζ- ζ 同源双体与 TCRαβ/CD3γδεε 结合后组成一个完整的复合物 TCRαβ/CD3γδεεζζ(少娄分子为 TCRαβ/CD3γδεεζη)。最近发现一个分子量为 28kDa 的 ω 连或 T 细胞受体相关蛋白(t cell receptor associated protein,TRAP), 可能具有控制 TCR/CD3 复合物在内织网中装配和转移的功能,但确切的机理尚不明了。ω 链不表达于细胞膜表面。
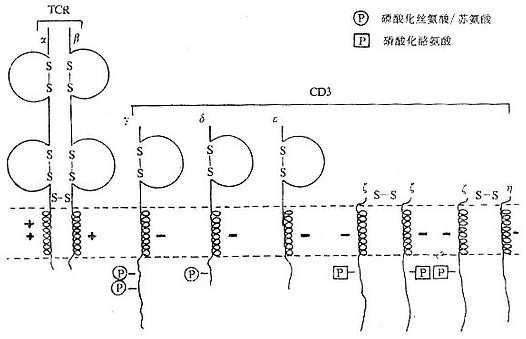
图 1 -4 TCR/CD3 复合物模式图
1.CD3γ、δ 和 ε 链 CD3γ、δ 和 ε 链基因有高度的同源性,在人类位于第 11 号染色体,小鼠 9 号染色体,这三种链的基因可能从一个祖先基因通过基因复制而来。CD3γ、δ 和 ε 链在细胞膜外都有一个 Ig 样结构域(C2),都属于免疫球蛋白超家族,但不存在多态性或可变性,因此不直接参与特异性识别抗原。γ、δ 和 ε 链的穿膜部分含有带负电谷氨酸和 / 或天冬氨酸残基,这与 TCRα、δ 链穿膜区中带正电赖氨酸、精氨酸以及 β、γ 链穿膜区中的赖氨酸相互作用有重要作用。γ、δ 和 ε 链胞浆部分含 44 到 81 氨基酸残基,提供了把信息传导到细胞内的条件。γ 链分子量为 25~28kKa,有 2 个糖基化点,氨基端 89 个氨基酸残基为亲水性,组成胞膜外区,穿膜区含 27 个氨基酸残基,胞浆内区 44 氨基酸残基,胞浆内 113 位丝氨酸残基可能是磷酸化位点。δ 链分子量为 20kDa,含有 2 个糖基化点,胞浆内 126 位丝氨酸可能是磷酸化位点。CD3δ 链抗体能非特异性地活化 T 细胞,促进 T 细胞有丝分裂。ε 链分子量为 20kDa 包括氨基端 104 亲水氨基酸的胞膜外区,穿膜区 26 个氨基酸残基,胞浆内区 81 个氨基酸残基。目前所制备的单克隆抗体中大部分是针对 CD3ε 链。
2.CD3ζ 和 η ζ(zeta)和 η(eta)链结构相似,而与 CD3γ、δ 和 ε 链无同源性。ζ 和 η 链分子量分别为 16kDa 和 21kDa,它们的胞膜外以及穿膜区和结构相似,但有胞浆区不同。胞膜外区很短,只有 9 个氨基酸残基,含有半胱氨酸,ζζ 之间或 ζη 之间形成二硫键。ζ 和 η 链穿膜部分各有一个带负电的天冬氨酸。ζ 和 η 链胞浆内区分别有 113 个和 155 个氨基酸残基,具有多个酪氨酸磷酸化的位点。最近研究证实,CD3ζ 链可能与 NK 细胞上 Fcγ 受体相连。此外,ζ 链与 FcεRⅠγ 亚单位有很高的同源性。
CD3γ、δ 和 ε 链是单链,而 ζ 则以 ζ - ζ 同源双体存在于 80~90%T 细胞中,有 10~20%T 细胞则以 ζ - η 异源双体存在。因此最常见的 TCR/CD3 复合物的组成形式是 TCRαβ/CD3γδεεζζ。
在体外,抗 CD3McAb 可促进 T 细胞表达 IL-2R,产生 IL-2、TNF-α、TNE-β、IFN- γ 和 IL- 4 等多种细胞因子,诱导非 MHC 限制的细胞毒作用,增强 T 细胞、LAK 和 NK 细胞的杀伤肿瘤作用。
1986 年美国 FDA 已批准应用小鼠抗 CD3 McAb 治疗急性肾移植排斥反应。CD3McAb 治疗心、肝移植排斥反应已完成Ⅲ期临床试验,正申请投放市场。
(三)CD4
CD4 和 CD8 分子分别与 MHCⅡ类和Ⅰ类抗原结合,不仅可增强 T 淋巴细胞与 APC 或靶细胞结合的程度,而且与刺激信号的传递有关。CD4 阳性细胞是 MHCⅡ类抗原限制的细胞群,CD8 阳性细胞是 MHCⅠ类抗原限制的细胞群。有关 CD4 和 CD8 抗原在胸腺细胞分化过程中的变化以及 CD4、CD8T 细胞亚群见第七章“淋巴细胞群及其亚群”。
1.CD4 分子的结构 为细胞膜表面单链糖蛋白,人 CD4 分子由 458 个氨基酸残基组成,包括信号肽 23 氨基酸残基,胞膜外区 374 个氨基酸残基,含 2 个糖基化点,穿膜区 21 氨基酸残基,胞浆内区含有 40 氨基酸残基。胞膜外区具有 4 个 IgV 样结构域,属免疫球蛋白超家族成员。
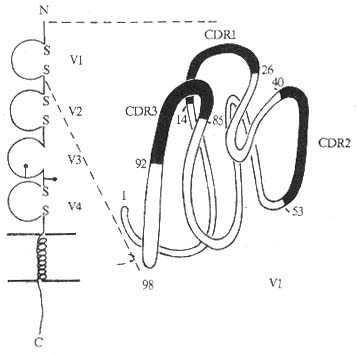
图 1 -5 CD4 分子结构模式图
第一个 V 样区与 Igκ 链的 V 区有很高同源性,有 3 个互补决定区(complementarity-determining region, CDR)。其余 3 个 V 样区功能区与 Poly IgR 的同源性最接近,其中第 2 和 4 个 V 样区中两个半胱氨酸的距离分别为 28 和 42 个氨基酸残基,第 3 个 V 样区无二硫键。CD4 跨膜区与 MHCⅡ类分子 β 链的跨膜区高度同源。编码人 CD4 基因位于第 2 号染色体,小鼠第 6 号染色体,小鼠 CD4 分子的分子量为 55kDa,由 457 个氨基酸残基组成,信号肽有 22 个氨基酸残基,N 端功能区 110 个,胞膜外还有一个长序列(long sequence)的区域,含 262 氨基酸残基,有 4 个糖基化点,穿膜区 25 氨基酸残基,胞浆内区含 38 个氨基酸残基。人和小鼠 CD4 分子约有 55% 序列相同,尤以胞浆内区为显。在胞浆部位有 3 个丝氨酸残基,可能作为 PKC 磷酸化的底物。CD4 胞浆部分功能区高度的保守性表明这一区域的功能是重要的。
2.CD4 分子的分布 分布于部分 T 淋巴细胞和胸腺细胞表面,也发现于某些 B 淋巴细胞、EBV 转化和 B 细胞、单核吞噬细胞和脑细胞。在人类,OKT4 和 Leu3McAb 可检测 CD4 抗原。小鼠 L3T4 是人 OKT4 的类同物。
3.CD4 分子的功能 在成熟的胸腺细胞、外周血和周围淋巴器官中,CD4 阳性细胞一般为辅助性 T 淋巴细胞诱导细胞 / 抑制性 T 淋巴细胞诱导细胞(helper inducer/suppressor inducer)。
(1)作为细胞与细胞之间的粘附分子:CD4 第 1、2 功能区与 MHCⅡ类分子的非多态部分结合以稳定 MHCⅡ类分子限制的 T 细胞与带有 MHCⅡ类分子与抗原复合物的 APC 细胞相互作用。抗 CD4McAb 可封闭 T 细胞的辅助活性。
(2)转导信号:CD4 分子胞浆区与蛋白酪氨酸激酶 p56lck相联,对 T 细胞信号的转导起重要作用(详见第八章)。
CD4 分子胞膜外第 1 个结构区域是 HIV 外壳蛋白 gp120 的识别部位,其中 CDR2 与 gp120 结合的亲合力最高,CDR3 可能与 HIV 感染靶细胞膜融合有关。可溶性 gp120 结合到 CD4 的反应可被下列试剂所阻断:(1)针对 CD4V1 区中 CDR2、CDR3 的 McAb;(2)CDR2、CDR3 肽段;(3)可溶性 CD4 V1 肽段;(4)抗 gp120 抗体。HIV 感染机体可引起选择性 CD4+ 细胞的数量减少和功能降低,主要通过以下不同的机理:(1)HIVgp120 与 T 细胞表面 CD4 分子结合后通过病毒芽生破坏细胞膜,在感染细胞浆内产生大量非整合的病毒 RNA 直接损伤细胞膜、干扰细胞代谢,影响 CD4 分子在细胞膜上的表达以及形成短命的合胞体;(2)阻断 CD4+ T 细胞与 Mψ 细胞表面 MHCⅡ类抗原的结合,影响 Th 细胞对抗原的识别过程;(3)产生抗体损伤 CD4 细胞,机体产生抗 gp120 或其他 HIV 成份的抗体,通过激活补体或 ADCC 效应损伤 CD4 阳性细胞;(4)特异性 CTL 也可通过识别 CD4 细胞表面的 gp120 分子而杀伤 CD4 阳性细胞。最近发现,CD26 可能是 HIV 的另一类受体。
应用基因工程生产的重组可溶性 CD4(rsCD4)治疗 ARC(AIDsrelated complexes)、艾滋病正在进行Ⅱ期临床试验;抗 CD4McAb(Leu3a)也已开始治疗 HIV 感染的 I 期临床试验。此外,应用 CD4-IgG、CD4-PE(绿脓杆菌外毒素)、CD4-RA(蓖麻毒毒 A)等杂交分子杀伤 HIV 感染的 T 细胞,作为抗爱滋病的新药也已进入临床验证。1991 年美国风湿病学年会上报道了用抗 CD4McAb 治疗类风湿性关节炎(RA),经治疗后临床症状明显改善,PBMC 中 CD4 阳性细胞的比例和 CD4 抗原密度明显下降,血清可溶性 CD4(sCD4)水平明显升高,血沉、CRP、RF、和总免疫球蛋白水平明显降低。抗 CD4 嵌合抗体(Centocor 公司)治疗类风湿性关节炎、多发性硬化症也已进入Ⅱ期临床验证。抗 CD4McAb(Ortho Biotech 公司)预防器官移植排斥反应已开始临床验证。
(四)CD8
1.CD8 分子的结构 CD8 分子是由 α、β 两条多肽链组成的穿膜糖蛋白,α 链分子量 34kDa,相当于小鼠的 Lyt-2;β 链 30kDa,相当于小鼠的 Lyt-3。每条链各包括 1 个 IgV 样结构域、连接肽、穿膜区和胞浆区。α 和 β 链在连接肽处有二硫键相连。部分 CD8 分子是由同源 α 链双体(α/α)组成,如在 CD8 阳性的 TCRγδT 细胞表面。有报道胸腺细胞上的 CD8 可能为四聚体。CD8α 和 β 链 IgV 样区约含 110 氨基酸残基,与 Igκ、λ 轻链的 V 区有 30~35% 同源性,与 V 有 20~22% 同源性,与 TCr Vα 和 Vβ 有 24% 同源性。编码 CD8α、β 链的基因属 Ig 基因超家族成员,与编码 Igκ 链基因密切连锁,定位于第 2 号染色体,表达前不需要重排。编码小鼠 Lyt- 2 和 Lyt - 3 基因定位于第 6 号染色体,各有二个等位基 Ly2a、Ly2b 和 Ly3a、Ly3b, 分别编码 Lyt-2.1、Lyt-2.2 和 Lyt-3.1 和 Lyt-3.2。
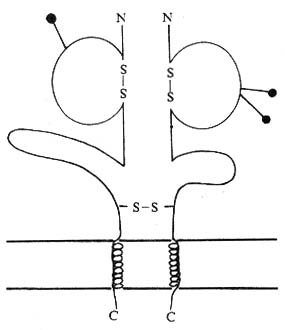
图 1 -6 CD8 分子结构模式图
2.CD8 分子的分布 分布于部分 T 淋巴细胞和胸腺细胞。在异基因骨髓移植病人中可出现 TCRγδCD8α/ α 表型的 T 细胞。NK 细胞表面的 CD8 分子为 α / α 二聚体。
最近发现,通过细胞分泌或 / 和胞膜外分子脱落的机制,在血清中存在着可溶性 CD8 分子(sCD8)。白血病、何杰金氏病、艾滋病、急性传染性单核细胞增多症、再生障碍性贫血、同种异体移植、类风湿性关节炎和全身性红斑狼疮等患者血清中 sCD8 水平增高,其升高的水平与疾病的严重程度、病情变化、治疗反应以及预后有较密切的关系。
3.CD8 分子的功能
(1)作为细胞与细胞间的附粘分子 MHCⅠ类抗原是 CD8 分子的配体。CD8 分子与 MHCⅠ类分子结合可以稳定 MHCⅠ类分子限制的 T 细胞(主要是 CTL)与带有 MHCⅠ类分子与抗原复合物的靶细胞结合。CD8 阳性细胞为抑制性 T 淋巴细胞 / 杀伤性 T 淋巴细胞(suppressor T lymphocyte/cytotoxic Tlymphocyte,Ts/Tc)。T8、Leu2 McAb 识别 CD8α 链,可封闭 Tc 的活性。
(2)转导信号,目前发现 CD8 也与蛋白酪氨酸激酶 p56lck相关。在 T 细胞增殖和分化的信号转导中起重要作用。
抗 CD8McAb 可预防骨髓移植时移植物抗宿主反应,美国 Becton-Dicknson 公司生产 Leu2 已进入Ⅱ期临床验证。
(五)CD2
1.CD2 分子的结构和分布 CD2 分子又称 T11、绵羊红细胞受体(ER)、淋巴细胞功能相关抗原 2(LFA-2)和 Leu5,是人 T 淋巴细胞表面的单链糖蛋白,分子量 50kDa,CD2 基因定位于第 1 号染色体,属免疫球蛋白基因超家族。编码 351 氨基酸残基,包括先导序列 24 氨基酸残基,2 个胞外功能区(C2)共 185 氨基酸残基,有 3 个糖基化位点,穿膜区和胞浆部分分别为 26 和 116 个氨基酸残基,胞浆区富含肺氨酸和碱性氨基酸,胞浆区与活化信号的传递可能有关。在 DNA 水平上人和小鼠 CD2 有 51% 同源性。CD2 分子分布于 95% 的 T 细胞、50~70% 胸腺细胞和大颗粒淋巴细胞(LGL/NK)。
2.CD2 分子的功能
(1)粘附功能:CD2 分子的配体是 LFA-3,后者分布于多种细胞表面。CD2 阳性 T 细胞可结合含有纯化 LFA- 3 的脂质体。CD2 分子的功能主要是通过抗 CD2McAb 对淋巴细胞功能的影响和基因转染技术来研究的。用抗 CD2McAb 可(1)抑制 lectin、同种异体抗原、可溶性抗原等诱导 T 细胞的增殖反应;(2)抑制 T 淋巴细胞 IL- 2 合成和分泌;(3)抑制 CTL 效应相杀伤功能和 NK 细胞的杀伤活性。CTL 与靶细胞之间的抗原非特异性粘附有多种途径,如 CD2 与 LFA-3结合,LFA- 1 与 ICAM- 1 结合。用抗 CD2 和抗 LFA- 1 两种抗体,或抗 LFA- 1 和抗 LFA- 3 两种抗体可完全抑制抗原非特异性粘附作用,而抗 CD2 与抗 LFA- 3 两种抗体只能部分抑制这种粘附作用。CD2 与 LFA- 3 之间的粘附功能对于 T 淋巴细胞 TCR 识别外来抗原与 APC 细胞表面 MHC 抗原复合物、肿瘤抗原、病毒感染靶细胞以及同种异体抗原均有重要的辅助作用。最近研究表明,CD48 和 CD59 也是 CD2 的配体,参与 T 细胞的粘附和细胞间的相互作用。
(2)T 细胞旁路激活途径(the alternative pathway of T cellactivation): Reinherz 成功地制备了识别了 CD2 三个不同表位的 McAbs:(1)T111与 LFA-3(CD58)的结合有关,由于绵羊红细胞 SRBC 表达 CD58 的同源物,T111可与 SRBC 结合形成 E 花环,抗 T111McAb 可抑制 E 花环形成;(2)T112与 CD58 结合无关,抗 T112McAb 可诱导 T113表位出现;(3)T113是活化 T 细胞表达的表位(已命名为 CD2R),在诱导 T113表位出现的过程中,加入蛋白质合成抑制剂 T113仍能表达,表明 T113出现并非是一种新合成的蛋白质,而是由于活化后构型变化暴露出来的表位。同时加入抗 T112和 T113McAbs 可活化 T 淋巴细胞,促进 MHCⅡ类抗原和 IL- 2 受体的表达,并在 IL- 2 受体的表达,并在 IL- 2 存在条件下,活化的 T 细胞继续增殖,称为 T 细胞旁路激活途径。T113McAb 与表达 IL- 3 的 SRBC 同 T 细胞一起孵育,也能刺激 T 细胞增殖。CD3 阴性的胸腺细胞和 NK 细胞可因 CD2 而活化,此外,CD2 可以与其它膜分子如 CD44、CD45 的功能有关。
目前关于 CD2 活化的生理学意义还不十分清楚,CD2 阳性胸腺细胞可与 LFA- 3 阳性的胸腺上皮细胞结合,在胸腺微环境的调节下,可能为早期胸腺细胞的活化提供信号,并与胸腺细胞的增殖和分化有关。
(六)CD58(LFA-3)
1.LFA- 3 分子的结构 淋巴细胞功能相关抗原 -3(lymphocyte functionassociated antigen-3,LFA-3)(CD58)是细胞表面糖蛋白,分子量 55~70kDa,属免疫球蛋白超家族成员,与 CD2 分子高度同源,胞膜外区有 2 个 Ig 超家族 C2 样区。CD2 和 CD58 基因都定位于 1 号染色体,并密切连锁,可能是从同一个基因复制而来。CD2 和 CD58 的结合是属于嗜同种的相互作用(homophilic interaction)。
2.LFA- 3 分子的分布 分布于 T 细胞、B 细胞、单核细胞、上皮细胞、内皮细胞、结缔组织、成纤维细胞、中性粒细胞和血小板表面。
3.LFA- 3 分子的功能 LFA- 3 分子的功能主要是通过应用相应的 McAb 而得知,抗 LFA- 3 抗体可(1)抑制效应相 CTL 的活性,可能与抑制 CTL 与靶细胞之间的粘附有关;(2)抑制 lectin、同种异体抗原诱导的 T 细胞增殖反应。在 EB 病毒感染的 Burkitt 氏淋巴瘤细胞株中,发现有的肿瘤细胞由于缺乏 LFA- 3 的表达而抵抗 CTL 的杀伤作用,提示 LFA- 3 缺损的肿瘤细胞可能与逃逸机体的免疫监视有关。发作性夜间血红素尿症(paroxysmalmocturnal hemoglobinuria,PNH)患者红细胞表面缺乏 LFA-3、DAF 和 FcγRⅢ。
LFA- 3 以两种形式存在于细胞膜表面:(1)穿膜形式,胞膜外区、穿膜区和胞浆区分别为 188、23 和 12 个氨基酸;(2)GPI“锚”形式,如 EBV 转化的 JYB 细胞系细胞表面 LFA- 3 分子具有穿膜和 GPI“锚”两种形式。
[GPI“锚”]糖基磷脂酰肌醇(glycosylphosphatidylinsitol,GPI)是质膜的组成成分,GPI 骨架上的乙醇胺通过酰胺键固定于蛋白质的羧基端,成为蛋白质定位于细胞膜上的锚,这种结合到 GPI 的蛋白质即称为 GPI 锚蛋白。去污剂溶解脂质双层可获得结合在 GPI 上的蛋白质,磷脂酶 C(PLC)可从细胞表面将糖一肌醇磷脂锚连的蛋白质释放出来,磷脂酰肌醇经 PLC 降解后所产生的三磷酸肌醇(IP3)和二酰基甘油(DG)是重要的第二信使。
(七)CD28
1.CD28 分子的结构 1980 年 Hara 等首先用单克隆抗体 9.3 发现了 CD28。CD28 由两条 44kDa 多肽借二硫键组成的同源二聚体,分子量为 90kDa。成熟的人 CD28 分子单肽链有 202 个氨基酸,基中胞膜外区有 134 氨基酸,属免疫球蛋白超家族成员,有一个 IgV 样区。人与小鼠 CD28 分子的同源性为 68%。CD28 与 CTLA- 4 分子有高度同源,后者主要表达于活化的 CTL 细胞表面。
2.CD28 分子的分布 在外周血淋巴细胞,CD28+ 细胞占 54~86%,其中 90%CD4+ T 细胞和 50%CD8+ T 细胞表达 CD28。CD28 在 CD28+ T 细胞中表达与功能有一定的关系,CD8+CD28+ T 细胞表现出 MHC 限制的细胞毒功能,而 CD8+CD28- 细胞可抑制抗体产生以及同种异体抗原所诱导的细胞增殖效应。此外,浆细胞瘤及部分活化 B 细胞也可表达 CD28。
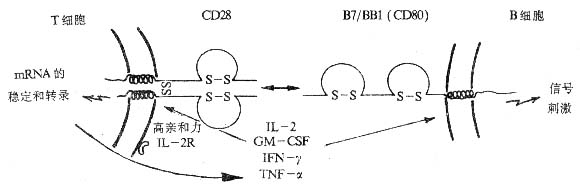
图 1 -7 CD28 与 CD80 分子相互作用示意图
3.CD28 分子的功能
(1)T 细胞活化的辅助信号:抗 CD28 可加强 PHA、ConA、抗 CD2McAb、抗 CD3McAb 等增殖、活化的效应,增加 IL-2、IL-3、TNF-α、IFN-β、GM-γ、GM-CSF 等细胞因子产生,激活 CTL 细胞。此外,抗 CD28McAb 可诱导 T 细胞 IL-13mRNA 的表达。
(2)CD28 的天然配体是 B 细胞活化抗原 B7/BB1(CD80),CD28 与 CD80 的结合是 T - B 细胞相互协作的主要方式,并刺激 B 细胞活化。
二、与 B 细胞识别、粘附、活化有关的 CD 分子
(一)BCR 复合物
B 细胞抗原受体(B cellreceptor,BCR)复合物至少由四种不同的多肽链组成,抗原结合部位是由重链和轻链构成的膜表面 Ig 的四链结构,此外,在 BCR 中还含有 Igα 和 Igβ 两种多肽链,最近在白细胞分化抗原国际专题讨论会中分别命名为 CD79a 和 CD79b。在人类 B 细胞,与 mIgM 相关的 Igα 和 Igβ 分别为 47kDa 和 37kDa 糖蛋白,属于免疫球蛋白超家族成员,编码 Igα 和 Igβ 的基因分别称为 mb- 1 和 B29。Igα 和 Igβ 胞膜外区氨基端处均有一个 Ig 样结构域。Igα 和 Igβ 均可作为蛋白酪氨酸激酶的底物,可能与 BCR 信号转导有关,因为 mIgM 和 mIgD 胞浆区只有 3 个氨基酸(KVK),不可能单独把胞膜外的刺激信号传递到细胞内。Igα 和 Igβ 胞浆部分尾部有 6 个保守的氨基酸残基,可能以磷酸化形式与胞浆中不同酶中存在的 SH2(src-homology2)结构域结合。
(二)CD19
CD19 是一种属于 Ig 超家族成员、分子量为 95kDa 的穿膜糖蛋白,分布于 B 细胞表面,其相应的生理性配体尚不清楚。CD19 与 B 细胞活化和信号的转导有关:(1)CD19 单克隆抗体可诱导胞浆内多种底物迅速发生磷酸化;(2)CD19 胞浆区可被一种丝氨酸激酶催化而发生磷酸化;(3)CD19 胞浆区与 src 激酶家族 Lyn 稳定的结合。最近提出一个 B 细胞最佳信号放大的双重抗原结合模型,这个模式认为 B 淋巴细胞 BCR/Igα、Igβ 与抗原结合后,使 CD19 与 CD21 相互接近形成复合物,外来抗原及包裹抗原的 C3dg 分别被 BCR 和 CD21 所结合,后者激活 CD19/CD21 复合物中与 CD19 紧密结合的 src 家族 Lyn,而使 CD19 分子胞浆内酪氨酸发生磷酸化,有关信号转导过程参见第八章“淋巴细胞活化过程中信号转导的分子基础”。
(三)CD21
CD21 又称 2 型补体受体(complementreceptor type 2,CR2)和 EB 病毒受体,是补体激活调节剂家族的一员。
[补体激活调节剂]补体激活调节剂(regulatorsof complement activation,RCA)家族包括 2 个血浆蛋白 H 因子和 C4bp 以及 4 个膜蛋白 CR1、CR2、DAF 和 MCP。RCA 的特点是:(1)含有 60~70 个氨基酸组成的短同源重复顺序(short consensus repeat ,SCR);(2)结合补体活化裂解片段 C3b 和 C4b;(3)基因定位于染色体 1q32 处,其基因以 MCP-CR1-CR2-DAF-C4bp 形式相连锁。
1.CD21 分子的结构 为分子量 140kDa 的单链糖蛋白,N 端在细胞外,胞膜外区 1005 个氨基酸,疏水跨膜区 28 个氨基酸,富含碱性氨基酸,胞浆区 34 个氨基酸。胞膜外区组成 15 个 SCR,每个 SCR 含有 60~70 氨基酸,有一个含 4 个 Cys 的骨架结构,C1-C4、C2-C3 间形成两个二硫键,构成一个 SCR 球状结构,SCR1- 2 与 C3dg 包裹的颗粒和 EBV 结合有关,胞膜外区有 10 个(或 12 个)N- 糖键。胞浆区有 10 个可能磷酸化为位点。
2.CD21 的分布 主要分布在成熟的 B 细胞、淋巴滤泡内树突状细胞、部分 T 细胞,此外,口咽、鼻咽以及宫颈上皮细胞表达与 CD21 相关的 145kDa 分子。
3.CD21 的功能
(1)促进 B 细胞增殖:单独 CD21 交联并不引起 B 细胞的增殖,在 T 细胞或 T 细胞源性低分子量 B 细胞生长因子(LMW-BCGF)存在下,或抗 μ 链抗体激活 B 细胞增殖时,CD21 交联具有强烈的促进作用;聚合的 C3dg、UV-EBV、CD21 单抗可加强 TPA 刺激的 B 细胞增殖;在 LMW-BCGF 存在下,CD21 单抗可刺激 B 细胞增殖;C3dg 包裹的颗粒可引起 LPS 激活的小鼠 B 细胞连续增殖;可溶性入 C3dg 诱导 Raji 细胞不信赖血清的增殖。上述结果提示外周血 B 细胞被某些刺激物刺激后,CD21 介导增殖信号促进 B 细胞进入细胞周期。最近发现 CD23 是 CD21 的一个新的配体。sCD23 在体外促进 IgE 生成,并有 BCGF 样作用,CD23 分子能与 CD21 结合,推测 CD21 就是生长因子 BCGF 的受体。
(2)CD21 介导 EBV 转化 B 细胞:EBV 与 CD21(CR2)结合后激活磷脂酶 C,水解磷脂酰肌醇,胞浆内 Ca2+和二酰基甘油水平增加,并活化钙调蛋白和 PKC。转化性 EBV(如 B95-8)感染 B 细胞后,编码反式激活蛋白(transactivator)EBNA2、LMP 激活 CD21 和 CD23 基因,导致 B 细胞持续高水平表达 CD21 和 CD23,CD23 脱落后形成 sCD23 是自分泌的 BCGF,与 CD21 结合并活化 CD21 分子的酪氨酸蛋白激酶,不断激活 PKC,从而导致 B 细胞的转化和增殖。
(3)CD21 参与免疫记忆:病原微生物或蛋白质抗原上覆盖有 C3dg 时,可与淋巴滤泡内树突状细胞表面 CD21 结合,在诱导免疫记忆过程中起重要作用。
(4)参与补体的活化:CD21 参与补体替代途径的启动以及 C3b 的固定,且在 C3bi 裂解为 C3dg 过程中为丝氨酸蛋白酶Ⅰ因子的辅因子。
(四)CD80(B7/BB1)
CD80cDNA 已克隆成功,成熟的 CD80 分子由 262 氨斟酸组成,胞膜外区 216 个氨基酸,穿膜区 27 氨基酸,胞浆区 19 氨基酸。B7 和 BB1 分子量分别为 44kDa 和 46kDa,其分子量的差异是由同一核心多肽糖基化程度不同所造成。CD80 属免疫球蛋白超家族成员,是 B 细胞活化抗原,IFN- γ 活化的单核细胞也表达 CD80。CD28 是 CD80 的配体,CD28 与 CD80 的结合可同时引起 T 细胞和 B 细胞的活化,在 T、B 细胞协作中发挥重要作用。
三、免疫球蛋白 Fc 段受体
Ig 根据其重链抗原性的差异分为 IgM、IgG、IgA、IgD 和 IgE 五类,各类 Ig 的不同功能主要与其结构有关。机体内许多细胞表面具有不同类 Ig Fc 的受体,通过 Fc 受体与 Ig Fc 的结合,参与 Ig 介导的生理功能或病理损伤过程。目前已鉴定明确属于 CD 抗原的 Fc 受体有 FcγR、FcαR、FcεR。
(一)FcγR(CD64、CD32、CD16)
1.FcγR 的结构和分布 FcγR 可分为 FcγRⅠ、FcγRⅡ和 FcγRⅢ三类,它们的结构和分布有所不同。
(1)FcγRⅠ(CD64):70kDa 穿膜糖蛋白,属 Ig 超家族成员,胞膜外区有 3 个 C2 结构,基因染色体定位于 1q23~24。识别 CD64 的代表性 McAb 有 McAb22、McAb32.2、197 和 10.1 等 FcγRⅠ是高亲合力受体,Kd 值为 10-8~10-9M,主要与人的单体 IgG1、IgG3 以及小鼠 IgG2a 和 IgG3 结合。与人 IgG4 结合的亲合力明确降低,与 IgG2 则无结合能力。FcγRⅠ主要分布于单核细胞、巨噬细胞、中性粒细胞等,但表达水平各不相同。FcγRⅠ位点数:15000~40000/ 每个单核细胞,>50000/ 巨噬细胞,<1000/ 新鲜中性粒细胞。IFN- γ 可刺激单核细胞、巨噬细胞和中性粒细胞表达 FcγRⅠ水平增加 5~10 倍,G-CSF 也有这种促进作用。
(2)FcγRⅡ(CD32):40kDa 穿膜糖蛋白,属于 Ig 超家族成员,胞膜外区有 2 个 C2 结构,基因染色体定位于 1q23~24。识别 CD32 的代表性 McAb 有 CIkM5、IV·3、KuFc79 和 41H16 等。FcγRⅡ与单体人 IgG1,IgG3、IgG4 结合为低亲合力,Kd5×10-7M。FcγRⅡ表达于除红细胞外的其它血细胞,分子数目:20000~40000/ 每个细胞。根据 DNA 序列和功能不同,FcγRⅡ可分为三种形式,不同形式 FcγRⅡ的差别主要在于胞浆区的结构不同。
(3)FcγRⅢ(CD16):50~70kDa 糖蛋白,属 Ig 超家族成员,有 2 个 C2 结构,基因染色体位于 1q23~24。识别 CD16 代表性的 McAb 有 HUNK2、Leu11、3G8、Gran1 和 B73.1 等。FcγRⅢ结合人 IgG、IgG3,为低亲和力受体。FcγRⅢ有 FcγRⅢA 和 FcγRⅢB 两种异型:①FcγRⅢA,穿膜结构,主要分布于巨噬细胞、NK 细胞和嗜酸性粒细胞,巨噬细胞表达高水平 FcγRⅢA,而单核细胞表达水平较低。FcγRⅢA 与二硫键连接的 CD3ζ 或 FcεRⅠγ 链双体相关,巨噬细胞上 FcγRⅢA 与 CD3 复合体 γ 链相关,NK/LGL 上 FcγRⅢA 则与 ζ 链相关。TGF- β 促进培养的单核细胞表达 FcγRⅢA。②FcγRⅢB,通过 GPI“锚”在中性粒细胞表面,每个人中性粒细胞表达 10 万~20 万血液中可溶性的 FcγRⅢ主要来自这种形式,中性粒细胞激活剂短时间处理后可明显降低 FcγRⅢB 的表达水平,可能与通过激活内源性蛋白酶切除 GPI 连接分子有关。
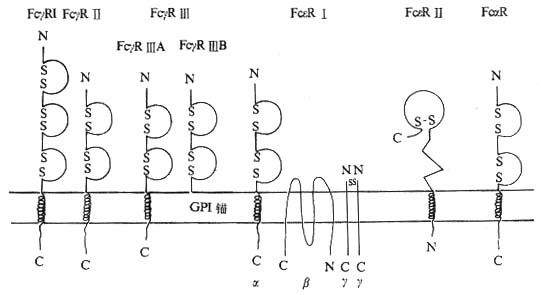
图 1 -8 FcγR、FcαR 和 FcεR 结构示意图
2.FcγR 的功能 FcγR 的功能主要是通过髓样细胞和 NK 细胞来发挥的。
(1)单核 - 巨噬细胞:FcγRⅠ、Ⅱ和Ⅲ均可介导人单核细胞 ADCC 来杀伤肿瘤等靶细胞,这种 ADCC 效应为 Mg2+依赖,并需 LFA- 1 等粘附分子参与。IFN- γ 可促进单核细胞 FcγRⅠ介导的杀伤作用。单核 - 吞噬细胞可通过 FcγRⅠ、Ⅱ、Ⅲ发挥调理吞噬和清除免疫复合物的作用。
(2)中性粒细胞:新鲜分离的中性粒细胞不能通过 FcγR 溶解靶细胞,但在 IFN- γ 刺激下可通过 FcγRⅠ和 FcγRⅡ介导杀伤作用,对于 FcγRⅠ,IFN- γ 主要是诱导其表达水平升高,而对 FcγRⅡ表达水平并未见改变,可能是通过对杀伤机理的调节。GM-CSF 也能通过 FcγRⅡ明确增加中性粒细胞的杀伤水平。GPI 连接的 FcγRⅢB 并不能介导中性粒细胞杀伤肿瘤的作用。活化中性粒细胞通过 FcγRⅠ、Ⅱ发挥调理吞噬和清除免疫复合物的作用。
(3)嗜酸性粒细胞:未刺激的嗜酸性粒细胞没有杀伤作用,GM-CSF、TNF 和 IL- 5 等是嗜酸性粒细胞发挥 ADCC 效应的有效激活剂,在杀伤寄生虫和抗肿瘤中有重要作用。GM-CSF 对嗜酸性粒细胞的激活作用主要是通过 FcγRⅡ介导的。
(4)NK 细胞:通过 FcγRⅢA 介导 ADCC 杀伤肿瘤细胞等靶细胞,IL- 2 和 IFN- γ 可明显提高 NK 细胞的杀伤活性,但并不明显改变 FcγRⅢA 的表达水平。
(二)FcαR(CD89)
FcαR(CD89)为分子量 60kDa 穿膜糖蛋白,胞膜外区 206 氨基酸,穿膜区 19 氨基酸,胞浆区为 41 氨基酸,属 Ig 超家族成员,胞膜外有 2 个 C2 结构域,为中亲和力受体,主要表达于单核细胞、巨噬细胞、中性粒细胞等,介导吞噬、ADCC 以及炎症介质的释放。中性粒细胞表面 FcαR 可结合血清型和分泌型 IgA1 和 IgA2,亲和力约为 Kd5×10-7M。热或化学物质凝集的 IgA 可刺激中性粒细胞脱颗粒。
(三)FcεR(FcεRⅠ、FcεRⅡ)
1.FcεR 的结构和分布 FcεR 可分为 FcεRⅠ和 FcεRⅡ两类,其结构、分布及介导的生物学作用有所不同。
(1)FcεRⅠ:为高亲和力受体,Kd10-9~10-10M,由 α、β、γ- γ 四条链组成。其中 α 链含 222 个氨基酸残基,分子量为 25kDa,胞膜外区属 Ig 超家族结构,2 个 C2 区,与 FcγRⅡ和 FcγRⅢ高度同源,胞膜外区与 IgECε2/Cε3 结合;穿膜区 20 左右氨基酸中含有与 FcγRⅢA 相同的 8 个氨基酸残基;胞浆区的 31 个氨基酸结构较为独特。β 链含 243 个氨基酸残基,分子量为 33kDa,有四个穿膜部分,N 端与 C 端都位于胞浆内,β 链可能把 α 链和 γ - γ 链连在一起。两条 γ 链由二硫键连接组成同源二聚体,每条链 62 个氨基酸,分子量为 8kDa,胞膜外区只有 5 个氨基酸残基,γ 链与 CD35 高度同源,γ 链与 FcεRⅡ表达的稳定性和信号的转导有关。NK 细胞表面 FcγRⅢA(CD16)可能与 CD3ζ 或 FcεRⅠγ 链相连,提示 FcεRⅠγ 链与 CD3 复合物中 ζ 的结构和功能的相似性。FcεRⅠ主要分布于嗜碱性粒细胞和肥大细胞。
(2)FcεRⅡ(CD23):低亲和力受体,分子量 45kDa,单链穿膜糖蛋白,Ⅱ型跨膜蛋白,属 C 型植物血凝素家族成员。CD23 含有 321 个氨基酸,N 端在胞膜内,1~23 位氨基酸组成胞浆尾,24~43 位氨基酸为疏水跨膜区,靠 C 端胞膜外区由 277 个氨基酸组成,有一个糖基化点,82、102、125、150 位氨基酸残基为蛋白水解酶敏感位点,凝集素同源区位于 C 端 163Cys 至 282Cys 之间,该同源区共含 6 个 Cys。88 至 116 位氨基酸之间有一个亮氨酸拉链结构,参与 CD23 分子同源二聚体的形成。CD23 分子靠胞膜外 C 端裂解的不同片段 14kDa、25kDa 和 33~37kDa 片段均称为 IgE 结合因子(IgE-binding factor IgE-BF)。FcεRⅡ可在蛋白水解酶裂解后形成可溶性 CD23 分子(sCD23)即 IgE-BF。CD23mRNA 有 FcεRⅡamRNA 和 FcεRⅡbmRNA 两种,它们所翻译的 CD23 分子仅在胞浆区有 7 个氨基酸残基的差别(图 1 -9)。FcεRⅡa 仅 B 细胞表达,并易降解为 sCD23;FcεRⅡb 表达于 B 细胞、T 细胞、嗜酸性粒细胞、血小板、单核细胞、巨噬细胞、树突状细胞、朗罕氏细胞、含有 EBV 基因组的鼻咽癌细胞、髓样细胞系如 U937 等,主要以膜分子形式存在,IgECε3 与 FcεRⅡ结合有关。IL- 4 可诱导正常 B 细胞、单核细胞、嗜酸性粒细胞转录 FcεRⅡbmRNA,促进 CD23 的合成与表达,EBV 核蛋白 EBNA2 对 CD23 表达及 sCD23 的释放也有促进作用。而 IFN-γ、TGF-β、PGE2、糖皮质激素等对 B 细胞表达 CD23 和释放 sCD23 则起抑制作用。
2.FcεR 的功能
(1)FcεRⅠ:嗜碱性粒细胞和肥大细胞具有高亲和力 FcεRⅠ,每个细胞表面约有 10 万个,当相应变应原与啫碱性粒细胞、肥大细胞表面 IgE/FcεRⅠ复合物结合后通过交联使磷酸肌醇水解,胞浆 Ca2+浓度增加,使细胞脱颗粒,合成和释放组织胺、LT、PAF 等多种介质,介导Ⅰ型速发型超敏反应。
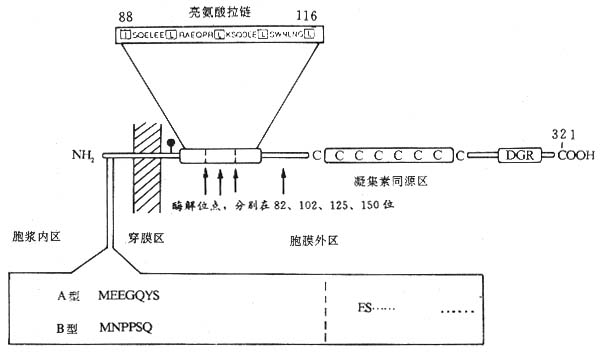
图 1 -9 CD23 分子结构模式图
(2)FcεRⅡ:FcεRⅡ为 B 细胞发化激活抗原,变态反应性疾病患者 PBMC 中 CD23 密度明显增加,血清 IgE-BP(sCD23)升高。sCD23 具有 B 细胞生长因子(bcell growth. factor, BCGF)活性,故又称 B 细胞来源的 B 细胞生长因子(B-BCGF)。sCD23 的这种生长因子作用可能是作为配体与受体 CD21(CR2)结合后介导的,CD23 分子通过可结合碳水化合物的凝集素同源区与 CD21 糖链结合。此外,sCD23 通过亮氨酸拉链结构,引起 B 细胞膜 CD21 分子交联,促进 B 细胞生长。sCD23 对膜 CD23 有正反馈作用,促进 B 细胞的分化和 IgE 的产生,并与 IL- 4 有协同作用,此外,FcεRⅡ还可介导 IgE 依赖的 ADCC 和吞噬作用。CD23 与 B 淋巴细胞的转化及恶变有关,EBV 转化 B 细胞后只有 B 细胞表达 CD23 才能建立永生化的细胞系,可能与 EBV 核蛋白的 EBNA2 有关,EBNA2 结合于 FcεRⅡa 基因起始部位 -275~-89 的一个 189bp DNA 片段结合,反式作用于 FcεRⅡa 基因启动子,并诱导 B 细胞高表达 CD23,sCD23 引起膜 CD21 分子交联,形成一种自分泌生长机制。慢性 B 淋巴细胞白血病(B-CLL)患者 B 细胞表达 CD23 增加,患者血清中 sCD23 水平明显升高。
关于 IgM 受体、IgD 受体也有报道,前者主要表达于 B 细胞,后者表达于成熟 B 细胞。这两种 Ig Fc 受体尚未归入 CD 的编号,故在本节从略。此外与多聚 IgA 和 IgM 跨膜转运至胞外分泌液中有关的多聚 Ig 受体(Poly-IgR), 通过与多聚 Ig 中的 J 链结合而介导 Ig 转运功能,PolyIgR 属免疫球蛋白超家族成员。
(金伯泉)
参考文献
1.Arnaout MA.Structure andfunction of the leukocyte adhesion molecule CD11/CD18.Blood,1991;75(5):1037
2.Autran B,et al. T cell receptorγ/δ+lymphocyte subsets during HIV infection. Clin Exp Innunol,1989;75:206
3.Barber EK,et al.Tthe CD4 andCD8 antigens are coupled to a protein tyrosine kinase(p56lck)thatphosphorylates the CD3complex.PNAS,1989;86:3277
4.Bevilacqua MP,et al.Endothelialleucocyte adhesion molceule 1,An inducible receptor for neutrophils related tocomplement regulatory proteins and lectins.Science,1989;243:1160
5.Carel JM,et al.Dual antigenrecognition by B cells,Immunol Today,1993;14(1):8
6.Eiden LE,et al.HIV interactionswith CD4:continum of conformations and consequences. ImmunolToday,1992;13(6):291
7.Figdor CG,et al.On the mode ofaction of LFA-1. Immunol Today,1990;11(8):277
8.Hirsch R,et al.Effects of invivo administration of anti-CD3 monoclonal antibody on T cell function in mice.j Immunol,1989;142(3):737
9.Hogg N.The leukocyte integrins.Immunol Today,1989;10(4):111
10.Holoshitz J,et al.Isolation ofCD4 CD8mycobacteria-reactive T lymphocyte clones from rheumatoid arthritissynovial fluid. Nature,1989;339:226
11.Kavanough AF,et al.Role ofCD18 in adhesion and transendotlial migration of T cell. JImmunol,1991;146(12):4149
12.Kevin H,et al.Murinehematopoietic cell surface antigen expression. Immunol Today,1988;9(11):344
13.Knapp W,et al.Towards a betterdefinition of human leucocyte surface molecules. Immunol Today,1989;10(8)253
14.Littman DR,et al.The isolationand sequence of the gene encoding T8, A molecule defining functional classes ofT lymphocytes. Cell,198540(1):237
15.Marx J.Biologists turn on to“off-enzymes”.Science,1991;251:744
16.Modlin RL,et al.Lymphocytesbearing antigen-specific T-cell receptors accumulate in human infection diseaselesions .Nature,1989;339:544
17.O’Brien RL,et al.Stimulationof a major subset of lymphocytes expressing T cell receptor γδby an antigenderived from mycobacterium tuberculosis. Cell,1989;57:667
18.Patel MD,et al.MultipleKinases and signal transduction.JBC,1987;262(12):5831
19.Pinto A,et al.New moleculesburst at the leukocyte surface A comprehensive review based on the 5thinternational workshop on leukocyte differentiation antigens Boston,USA,3-7November,1993.Leukemia,1994;8(3):347
20.Rivas A,et al.CD4 moleculesare associated with the antigen receptor complex on activated but not resting Tcells. j Immunol,1988;140(9):2912
21.Rudd CE.CD4 CD8 and theTCR-CD3 complex:a novel class of protein tyrosine kinase receptor. ImmunolToday,1990;11(11):400
22.Sanders ME,et al.Human naiveand memory t cells:reinterpretation of helper-inducer and suppressor-inducersubsets. Immunol Today,1988;9(7):195
23.Schlossman SF,et al.Leucocytetyping V:white cell differentiation antigens. Oxford University Press, Oxford1994 in press
24.Sukhatme VP,et al.Gene for thehuman T cell differentiation antigen Leu-2/T8 is closely linked to the lightchain locus on chronosome 2. J Exp. Med,1985;161(2):429
25.Williames AF.A year in thelife of the immunoglobulin superfamily. Immunol Today ,1987;8(10):298
26. 陈璋,沈德诚,汤美华,第五届国际人类白细胞分化抗原会议简介. 单克隆抗体通讯,1994;10(3):70
第二章 粘附分子
粘附分子(adhesionmolecules)是指由细胞产生、存在于细胞表面、介导细胞与细胞间或细胞与基质间相互接触和结合的一类分子。粘附分子大多为糖蛋白,少数为糖脂,分布于细胞表面或细胞外基质(extracellular matrix,ECM)中。粘附分子以配体一受体相对应的形式发挥作用,导致细胞与细胞间、细胞与基质间或细胞 - 基质 - 细胞之间的粘附,参与细胞的信号转导与活化、细胞的伸展和移动、细胞的生长及分化、炎症、血栓形成、肿瘤转移、创伤愈合等一系列重要生理和病理过程。
对于细胞间相互接触、粘附的现象人们早有认识。80 年代以后,由于单克隆抗体技术和分子生物学技术的发展和应用,极大地推动了对粘附分子的研究,使人们得以从分子水平上提出粘附分子的概念,并逐渐认识其作用机理。目前已基因克隆成功的粘附分子有几十种,形成一个庞大的粘附分子大家族。由于粘附分子所具有广泛、重要的生物学功能功能,目前在细胞生物学、分子生物学、免疫学、病理生理学、肿瘤学以及其它生命科学领域里已受到人们普遍的关注,1993 年第五届人白细胞分化抗原国际专题讨论会上,已将粘附分子单独列为一组新抗原。本章主要介绍粘粘附分子的种类和结构、粘附分子表达的调节、粘附分子的功能以及可溶性粘附分子等内容。
第一节 粘附分子的种类和结构
目前按粘附分子的结构特点可将其分为以下四类:(1)粘合素家族(integrin family)的粘附分子;(2)免疫球蛋白超家族(immunoglobulin superfamily,IGSF)的粘附分子;(3)凝集素家族(selectin family);(4)钙离子依赖的细胞粘附素家庭(Ca2+-dependent cell adhesion molecule family)的粘附分子或称 Cadherin。此外还有一些其它未归类的粘附分子。
一、粘合素超家族
国内将 integrin 译为粘合素、整合素等,本书暂命名为粘合素。integrin 是最初在 1986 年提出的概念,描述一个膜受体家族,此家族的粘附分子主要介导细胞与细胞外基质的粘附,使细胞得以附着而形成整体(integration),故得名。此外,粘合素家族的粘附分子还介导白细胞与血管内皮细胞的粘附。
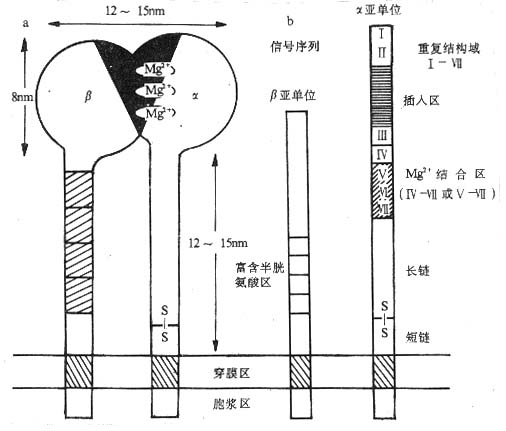
图 2 -1 integrin 分子的结构(示意图)
注:a .integrin 分子电镜下所见(模式图),黑区部分显示 integrin 分子 α、β 亚单位所 组成的球部,为配体结合域;
b.integrin 分子的结构模式图,显示出 α 亚单位的二价阳离子(Mg2+)结合区和 α、β 亚单位的重复序列。
(一)粘合素分子的基本结构
粘合素家族的粘附分子都是由 α、β 两条链由非共价键连接组成的异源双体(heterodimer),α、β 链均为Ⅰ类穿膜蛋白。α 链的分子量为 120~210kKa,β 链的分子量为 90~130kDa,个别 β 链(如 β4)分子量为 220kDa。不同的 α 链(或称 α 亚单位)或 β 链(或称 β 亚单位)氨基酸序列有不同程度的同源性,在结构上有其共同的特点。α 和 β 亚单位均由胞膜外区、胞浆区、穿膜区三部分组成。胞浆区一般较短,可能和细胞骨架相联。空膜区富含疏水氨基酸。β 亚单位的胞膜外区含有 4 个富含半胱氨酸的重复序列,靠近外侧 N 端的 40~50kDa 的氨基酸残基通过链内二硫键紧密折叠在一起;α 亚单位的胞膜外部分有 7 个同源重复序列,靠近外侧 N 端的 3 个或 4 个重复序列中含有 Asp-X-Asp-X-Asp-Gly-X-X-Asp 或类似结构,与 integrin 分子结合二价阳离子(Mg2+)有关,并与 β 亚单位共同构成粘合素分子的配体结合部位,其中 α 亚单位的二价阳离子结合区与 integrin 分子配体结合的特异性和亲和力有关。某些 integrin 分子的 α 亚单位在转录后被剪接为两段,一段为劳作膜部分,较小,约 20~30kDa;另一段为胞膜外部分,较大,两者通过二硫键连接起来(图 2 -1)。电镜下可见 integrin 分子有一个球状头部,向下伸展有两条杆状结构穿过细胞膜的磷脂双层。
(二)粘合素超家族的组成
目前已知至少有 14 种 α 亚单位和 8 种 β 亚单位,除 α7 和 αIEL 外,其它粘合素分子亚单位均已基因克隆成功。α 亚单位和 β 亚单位组合构成粘合素分子并不是随机的,多数 α 亚单位只能与一种 β 亚单位结合构成异源双体,但也有的 α 亚单位可与几种不同的 β 亚单位组合,如 αV(CD51)可分别同 β1、β3、β5、β6 和 β8 亚单位组成 integrin 分子,而大部分 β 单位则可以结合数种不同的 α 亚单位。目前按 β 亚单位的不同可将粘合素家族分为 8 个不同的组,在同一组中的粘合素分子不同成员 β 链相同,α 链不同。已知 α 链和 β 链有 20 种组合形式(表 2 -1),β1、β3、β4、α3 和 α6 等亚单位的 mRNA 分子可有不同的剪接形式,更增加了粘合素分子的多样性。
(三)粘合素分子的分布
粘合素分子的体内分布很广泛,多数粘合素分子可以表达于多种组织细胞,如 VLA 组的粘合素分子在体内广泛分布于各种细胞细胞;而多数细胞可同时表达数种不同的粘合素分子,对体外哺乳动物来源的细胞系粘合素分子表达研究发现,每一种细胞系可同时一有达 2~10 种不同的粘合素分子,但不同类型的细胞表达粘合素分子的种类是不同的。某些粘合素分子的表达则具有明显的细胞类型特性,如 gpⅡb/Ⅲa(Ⅱb/β3)主要表在宾巨核细胞和血小板;LAF-1、Mac-1、P150/95 只表达在白细胞表面;α6β4 特异性表达在上皮细胞。每一种细胞粘合素分子的表达可随其分化与生长状态的改变而变化。
(四)粘合素分子识别配体的短肽序列
粘合素分子在与配体结合时所识别的只是配体分子中由数个氨基酸组成的短肽序列。不同的粘合素分子可能识别相同的短肽序列或同一个配体中不同的短肽序列。由于同一短肽序列可以存在于几种不同的配体中,因此,每一种粘合素分子可能有几种细胞外间质成分做为配体,而每一种细胞外间质中的配体也可能被几种不同的粘合素分子所识别。
1. 识别 RGD 序列的粘合素分子 α5β1、αvβ1、αⅡbβ3、αvβ3、αvβ5、αvβ6 都可以识别配体分子中的 RGD 序列,多种细胞外间质成分(包括 FN、VN、FB、vWF)都含有 RGD 序列,它们在体内的分布极为广泛。含有 RGD 序列的人工合成肽可以抑制上述粘合素分子与配体的结合。
2. 识别非 RGD 序列的粘合素分子 α2β1、α4β1、αxβ2、αⅡbβ3、α4β7 可分别识别其配体分子中 DGEA、EILDV、GPRP、KQAGDV、EILDV 等短肽序列,其中 KQAGDV 具有与 RGD 类似的结构。上述短肽序列可以与 RGD 序列在于同一个配体分子中,如 FN 分子中同时存在 RGD 和 EILDN 序列。
表 2 -1 integrin 家族及其相应配体
| 分组 | 成员 | α/ β 亚单位分子量(kDa) | 亚单位结构 | 分布 | 配体 | 结合位点 |
| VLA 组(β1 组) | VLA-1 | 210/130(CD49a/CD29) | α1β1 | 广泛 | CA,LM | |
| VLA-2 | 165/130(CD49b/CD29) | α2β1 | 广泛 | CA,LM | DGEA | |
| VLA-3 | 135+25/130(CD49c/CD29) | α3β1 | 广泛 | FN,LM,CA | RGD? | |
| VLA-4 | 150/130(CD49d/CD29) | α4β1 | 白细胞 Mo | FN,VCAM-1 | EILDV | |
| VLA-5(FNR) | 135+25/130(CD49e/CD29 | α5β1 | 广泛 | FN | RGD | |
| VLA-6(LNR) | 120+30/130(CD49f/CD29 | α6β1 | 广泛 | LM | ||
| α7β1 | α7β1 | LM | ||||
| α8β1 | α8β1 | ? | ||||
| VNR-β1 | 150/130(CD51/CD29 | αvβ1 | VN,FN | RGD | ||
| 白细胞粘附受体组(β2 组) | LFA-1 | 180/95(CD11a/CD18) | αLβ2 | 白细胞 | ICAM-1ICAM-2ICAM-3 | |
| Mac-1 | 165/95(CD11b/CD18) | αMβ2 | 吞噬细胞大颗粒细胞 | C3bi,FBX 因子,ICAM-1 | ||
| P150,95 | 150/95(CD11c/CD18 | αXβ2 | 吞噬细胞大颗粒细胞 | FB,C3bi | GPRP | |
| 血小板糖(β3 组) | gpⅡbⅢa | 120+24/105(CD41/CD61) | αⅡbβ3 | 血小板 En,Mo,PMN | FB,FN,vWFThr, | RGDKQAGDV |
| VNR-β3 | 125+24/105(CD51/CD61) | αvβ3 | 广泛 | VN,FB,vWE,ThrFN,CA | RGD | |
| β4 组 | α6β4 | 120+30/105(CD49f/CD104) | α6β4 | 表皮细胞 | LM | |
| β5 组 | VNR-β5 | 125+25/110(CD51/-) | αvβ5 | 广泛 | VN,FN | RGD |
| β6 组 | αvβ6 | 125+25/106(CD51/-) | αvβ6 | FN | RGD | |
| β7 组 | α4β7(LPAM-1) | 150/-(CD49d/-) | α4β7αIELβ7 | FN,VCAM-1? | EILDV | |
| β8 组 | αvβ8 | 150/-(CD51/-) | αvβ8 | ? |
注:FN(fibronectin, 纤粘连蛋白)
LM(lamnin, 层粘连蛋白)
Thr(thrombospondin, 血栓海绵蛋白)
VLA(very alte appearingantigen, 很晚出现的抗原)
CA(collagen, 胶原蛋白)
VN(vitronectin, 玻璃粘连蛋白)
FB(fibronogen, 血纤维蛋白)
vWF(von Willebrand factor,von Willebrand 因子)
RGD:Arg-Gly-Asp(精 - 甘 - 天冬)
KQAGDV:Lys-Gln-Ala-Gsp-Val(赖 - 谷氨酰胺 - 丙 - 甘 - 天冬 - 缬)
DGEA:Asp-Gly-Glu-Ala(天冬 - 甘 - 谷 - 丙)
GPRP:Gly-Pro-Arg-Pro(甘 - 脯 - 精 - 脯)
EILDV:Glu-Ile-Leu-Asp-Val(谷 - 异亮 - 亮 - 天冬 - 缬)
ICAM-1:intercellular adhesion molecule-1, 细胞间粘附分子 -1
ICAM-2:intercellular adhesion molecule-2, 细胞间粘附分子 -2
ICAM-3:intercellular adhesion molecule-3, 细胞间粘附分子 -3
VCAM-1:vasccular cell adhesion molecule-1, 血管细胞粘附分子 -1
IEL:intraepithelial lymphocyte, 上皮内淋巴细胞
LPAM-1:leukocyte platelet adhesion molecule-1, 白细胞血小板粘附分子 -1
3. 识别序列尚未明确的粘合素分子 包括 α1β1、α6β1、α7β1、α8β1、αLβ2、αMβ2、α6β4、αIELβ7、αvβ8 等。
(五)纤维粘连蛋白
integrin 分子的配体包括多种细胞外基质成份,其中纤粘连蛋白(fibronectin,FN)与 β1、β3、β5、β6 和 β7 等多组 integrin 分子受体结合,对细胞的生长、分化、活化、移动等过程具有重要的调节作用。
FN 的分子量约为 550kDa,由 α、β 两条多肽链构成,两条链在羧基端以二硫键相连。α 链和 β 链的氨基酸组成和结构相似,α 链略长。FN 由成纤维细胞、血管内皮细胞、巨噬细胞等合成和分泌,通常以两种形式存在:(1)血浆 FN,以二聚体形式存在,含量可高达 300μg/ml;(2)存在于结缔组织有关的基底膜及多种细胞表面,为多聚体。两种形式的 FN 结构有所差异。不同种属的 FN 具有高度同源性,分子中均含有三类同源重复序列,每类重复序列有其特定的肽链折叠方式。①Ⅰ型重复序列(type I repeat): 由约 45 个氨基酸残基构成,分布于 FN 分子的氨基端和羧基端;②Ⅱ型重复序列(type Ⅱ repeat): 由约 60 个氨基酸组成,插入氨基端Ⅰ型重复序列之间;③Ⅲ型重复序列(type Ⅲ repeat): 由约 90 个氨基酸构成,分布于肽链的中间部分(图 2 -2)。
不同细胞来源的 FN 分子结构亦略有差异,这是由于 mRNA 水平上不同的剪接方式造成的,表现为(1)分子中两个特定位置上Ⅲ型重复序列的存在或缺如;(2)位于 FN 分子羧基端的可变片段,全长为 120 个氨基酸残基;不同细胞来源的 FN 分子多肽链中具有此片段的全部或其中某一部分(图 2 -2)。在人体内其它分子中也可发现 FN 分子Ⅰ、Ⅱ、Ⅲ型重复序列的同源序列,如凝血因子Ⅻ分子中有Ⅰ型同源重复序列,凝血酶原中有Ⅱ型同源重复序列,IL- 6 受体胞外部分含有Ⅲ型同源重复序列。
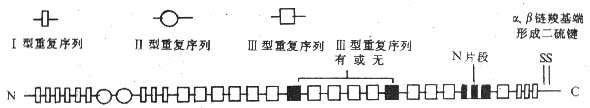
图 2 -2 纤粘连蛋白分子结构模式图
纤维粘连蛋白分子可以结合多种分子,如胶原蛋白、肝素、血纤维蛋白及细胞表面受体,其中与细胞表面受体的结合主要是通过纤粘连蛋白分子中的 RGD 序列。
二、免疫球蛋白超家族
在参与细胞间相互识别、相互作用的粘附分子中,有许多分子具有与 IgV 区或 C 区相似的折叠结构,其氨基酸组成也有一定的同源性,属于免疫球蛋白超家族(immunoglobulin superfamily, IGSF)的成员。有关免疫球蛋白超家族分子的结构特点和基因结构参见第三章。免疫球蛋白超家族粘附分子的种类、分布及其配体见表 2 -2。免疫球蛋白超家族粘附分子的配体多为免疫球蛋白超家族的粘附分子或粘合素家族的分子。
有关 CD2、CD4、CD8、CD28 和 CD58 分子的结构和功能参见第一章“人白细胞分化抗原”,MHCⅠ类抗原和Ⅱ类抗原参见第六章“主要组织相容性复合体”。本节将简要介绍 ICAM 和 VCAM- 1 分子的结构。
1.ICAM-1(intercellular adhesion molecule-1) ICAM- 1 是最早发现的免疫蛋白超家族粘附分子之一,以后又相继发殃了 ICAM- 2 和 ICAM-3,它们的免疫球蛋白结构域氨基酸序列具有同源性,且都可以结合 LFA- 1 分子。不同的 ICAM 分子在体内的分布范围有较大差异,ICAM- 1 分子分布广泛,如淋巴结和扁桃体血管内皮细胞,胸腺树突状细胞,扁桃体和肾小球上皮细胞,白细胞,巨噬细胞和成纤维细胞等,IL-1、TNF-α、IFN 和 LPS 可促进 ICAM- 1 分子的表达;ICAM- 2 则分布较局限,主要表达的血管内皮细胞;而 ICAM- 3 只表达在血细胞。ICAM- 1 分子为单链跨膜糖蛋白,核心多肽为 55kDa,由于不同种类细胞上 ICAM- 1 分子所含寡糖分子数有所差别,ICAM- 1 分子量可在 80~11kDa 范围。ICAM- 1 分子胞膜外部分具有 5 个免疫球蛋白样结构域,第 2 和第 3 结构域之间有一段连接序列,富含脯氨酸,类似免疫球蛋白的绞链区,可发生扭曲。以此连接区为界,氨基端的 D1 和 D2 结构域可结合 LFA-1 分子和鼻病毒,而羧基端侧的 D3 结构域可以结合 Mac- 1 分子(图 2 -3)。ICAM- 2 和 ICAM- 3 胞膜外部分分别有 2 个和 5 个免疫球蛋白结构域,ICAM- 2 分子 2 个结构域与 ICAM-1N 端 2 个结构域有 34% 同源性,ICAM-1D1 结构域中结合 LFA- 1 分子具有关键作用。
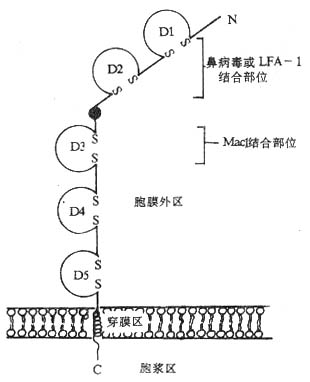
图 2 -3 ICAM- 1 分子的结构(模式图)
表 2 -2 免疫球蛋白超家族(IGSF)粘附分子的种类、分布和识别配体
| IGSF 粘附分子 | 分 布 | 分子量(kDa) | 配 体 |
| LFA-2(CD2) | T 细胞,胸腺细胞,大颗粒淋巴细胞 | 50 | LFA-3(IHSF) |
| LFA-3(CD58) | 广泛 | 40~65 | LFA-2(IHSF) |
| ICAM-1(CD54) | 广泛 | 80~114 | LFA-1(integrin) |
| ICAM-2(CD102) | 内皮细胞 | 60 | LFA-1(integrin) |
| ICAM-3(CD50) | 外周血静止白细胞 | 140/108 | LFA-1(integrin) |
| CD4 | 抑制细胞诱导亚群,辅助细胞诱导亚群 | 55 | MHC-Ⅱ(IGSF) |
| CD8 | 抑制性 T 细胞,杀伤性 T 细胞 | 32/36 | MHC-Ⅰ(IGSF) |
| MHC-Ⅰ | 广泛 | 44/12 | CD8(IGSF) |
| MHC-Ⅱ | B 细胞,活化 T 细胞,活化内皮细胞,巨噬细胞 | 32~34/29~32 | CD4(IGSF) |
| CD28 | T 细胞 | 44 | B7/BB1(IGSF) |
| B7/BB1(CD80) | 活化 B 细胞,活化单核细胞 | 60 | CD28(IGSF) |
| NCAM-1(CD56) | 神经元,胚胎细胞,NK | 120,140,180 | NCAM-1(IGSF) |
| VCAM-1(CD106) | 内皮细胞,上皮细胞,树突细胞,巨噬细胞 | 100,110 | VLA-4(integrin) |
| PECAM-1(CD31) | 白细胞,血小板,内皮细胞 | 140 | PECAM-1(IGSF) |
注:LFA:淋巴细胞功能相关抗原
VCAM:血管细胞粘附分子
NCAM:神经细胞粘附分子
ICAM:细胞间粘附分子
PECAM:血小板内皮细胞粘附分子
的氨基酸序列,并同样具有结合 LFA- 1 分子的功能。
其它部分免疫球蛋白超家族粘附分子的结构将在本书有关章节中介绍。
2.VCAM-1(vascular cell adhesion molecule-1)血管细胞粘附分子,又称诱导性细胞粘附分子(vascular cell adhesion ,INCAM), 意指在 IL-1、TNF- α 等细胞因子活化的血管内皮细胞上表达,分子量 100kDa 或 110kDa,最近命名为 CD106,VCAM- 1 的配体是分布在白细胞表面的 VLA- 4 分子。
三、selectin 家族
selectin 家族最初被称为外源凝集素细胞粘附分子家族(lectin cell adhesion moleculefamily,LEC-CAM family).selectin 是由 select 和 lectin 两词合并而来,目前国内尚无统一译法,选择凝集素一词似较为妥当。
(一)selectin 分子的基本结构
selectin 分子为Ⅰ型穿膜的糖蛋白,可分为胞膜外区、穿膜区和胞浆区。selectin 家族各成员胞膜外部分有较高的同源性,结构类似,均由三个结构域构成。(1)其外侧氨基端(约 120 个氨基酸残基)为钙离子依赖的 C 型外源凝集素结构域 (calcium dependent lectin domain), 可以结合碳水化合物基团,是 selectin 分子的配体结合部位;(2)紧邻外源凝集素结构域是表皮生长因子样结构域(epidermal growth factor-like domain), 约含 35 个氨基酸残基,EGF 样结构域虽不直接参加配体的结合,但对维持 selectin 分子的构型是必需的;(3)近胞膜部分是数个由约 60 个氨基酸残基构成的补体调节蛋白(complement regulatory protein) 重复序列或称为补体结合蛋白(complementbinding protein)重复序列,它们与补体受体(如 CR1、CR2 等)和 C4 结合蛋白(C4bp)等结构同源。各种 selectin 分子的穿膜区和胞浆区没有同源性(见图 2 -4)。selectin 分子的胞浆区与细胞内骨架相联,去除胞浆部分的 selectin 分子虽仍可结合相应配体,却失去其介导细胞间粘附的作用。
(二)selectin 家族的组成
目前已发现 selectin 家族中有三个成员:L-selectin、P-selectin 和 E -selectin,L、P 和 E 分别表示 leukocyte,platelet 和 endothelium, 是最初发现相应 selectin 分子的三种细胞,故得名。selectin 家族成员的细胞分布和相应配体见表 2 -3。
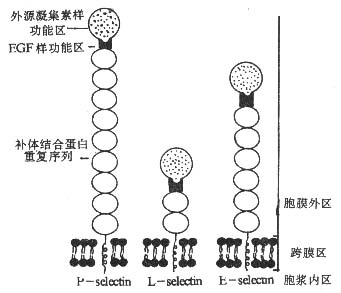
图 2 -4 selectin 分子的结构模式图
表 2 -3 selectin 家族的组成、分布及其相应配体
| selectin 家族成员 | 分布 | 分子量(kDa) | 配体 |
| L-selectin(CD62L,LECAM-1) | 白细胞 | 75~80 | PNAd |
| LAM Mel14(小鼠) | S-Lewisx | ||
| P-selectin | 血管内皮细胞,血小板 | 140 | S-Lewisx |
| (CD62P,GMP-140,PADGEM) | (凝血酶、组胺、白三烯刺激后从 α 颗粒内与质膜融合而表达在细胞表面) | CD15 | |
| E-selectin(CD62E,ELAM-1) | 血管内皮细胞(主要在毛细血管后静脉,IL-1,TNF 活化后表达) | 115 | S-Lewisx S-Lewisx CLA |
注:LECAM:leukocyteendothelial cell adhesion molecule, 白细胞内皮细胞粘附分子
PNAd:peripheral lymphonode vascular addressin, 外周淋巴结血管地址素
LAM:leukocyte adhesion molecule, 白细胞粘附分子
GMP-140:granule membrane protein-140, 颗粒膜蛋白 -140
PADGEM:plateletactivation-dependent granule external membrane, 血小板活化 依赖性颗粒外膜
ELAM-1:endothelial leukocyteadhesion molecule-1, 内皮细胞白细胞粘附分子 -1
CLA:cutaneous lymphocyte associated antigen, 皮肤淋巴细胞相关抗原
(三)selectin 分子识别的配体
与其它粘附分子不同,selectin 分子识别的配体都是一些寡糖基团。目前对于这种特殊的受体一配体结合的研究主要采用以下几种方法:(1)抗寡糖决定簇特异性单克隆抗体阻断试验;(2)外源性寡糖分子阻断试验;(3)纯化的内源性寡糖结合试验;(4)特异糖基转移酶改变相应寡糖结构后其结合能力的改变。在研究中可同时采用不同的实验方法从不同的角度分析以期获得正确的结论。迄今为止发现的 selectin 分子的配体都是具有唾液酸化的路易斯寡糖(Sialyl-Lewis)或类似结构的分子(图 2 -5)。与蛋白质分子抗原不同,直接决定细胞表面某种寡糖表达的因素是与某些特定的糖基转移酶或碳水化合物修饰酶的作用有关,这些酶的作用可能与细胞的生长与代谢状态有着密切的关联。一种寡糖基团可以存在于多种糖蛋白或糖脂分子上,并分布于多种细胞表面,因此 selectin 分子的配体在体内的分布较为广泛。如 CD15 分子可存在于 LFA-1、Mac-1、CR1 等不同的糖蛋白分子上,白细胞、血管内皮细胞、某些肿瘤细胞表面及血清中某些糖蛋白分子上都存在有 selectin 分子识别的碳水化合物基团。

图 2 -5 路易斯寡糖的结构
注:Gal:半乳糖 Fuc:岩藻糖 Glc:葡萄糖 NAc:N 乙酰基 NeuAc:唾液酸
selectin 分子对寡糖结构识别的特异性是相对的,它往往可以结合与其特异配体结构类似的寡糖,只是结合的亲和力较低。如 P -selectin 不仅可以结合 CD15 分子(lacto-N-fucopen-taose,LNFⅢ的一种异构体 LNFⅡ。
四、Cadherin 家族
Takeichi 最早发现一种介导细胞间相互聚集的粘附分子,在有 Ca2+存在时可以抵抗蛋白酶的水解作用,以后又发现两种作用和特性均与其类似的粘附分子,它们的氨基酸序列也有同源性,遂将其命名为 Cadherin(Ca2+dependent cell adhesion molecules family)家族。Cadherin 家族的粘附分了对于生长发育过程中细胞的选择性聚集具有至关重要的作用。
(一)Cadherin 分子的结构
Cadherin 分子均为单链糖蛋白,约由 723~748 个氨基酸构成,不同的 Cadherin 分子在氨基酸水平上有 43~58% 的同源性。Cadherin 分子为Ⅰ型膜蛋白,由胞膜外区、穿膜区和胞浆区三部分组成。胞膜外区有数个重复结构域,并含有由 4~5 个氨基酸残基组成的重复序列,近膜部位另有 4 个保守的半胱氨酸残基,分子外侧 N 端的 113 个氨基酸残基构成 Cadherin 分子的配体结合部位。此外胞膜外部分具有结合钙离子的作用(图 2 -6)。Cadherin 分子的胞浆区高度保守,并与细胞内骨架相连,靠近 C 端的一半对于 Cadherin 分子介导的细胞粘附可能具有重要作用,去除此部分的 Cadherin 分子虽可与配体结合却丧失介导细胞间粘附的作用。推测是由于 Cadherin 分子与细胞内骨架相连,当 Cadherin 分子胞膜外区与相应配体结合后,向胞浆内部分传递信号,导致胞浆区与细胞骨架相接,稳定胞膜外区与配体的结合,发挥细胞粘附功能。
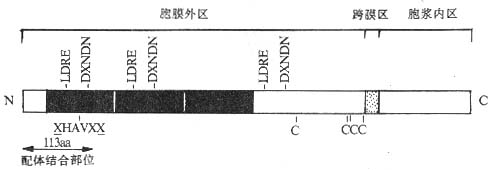
图 2 -6 Cadherin 分子的结构模式图
注:图中黑区部分显示 Cadherin 分子内重复结构域;LDRE 及 DXNDN 为重复序列。
(二)Cadherin 家族的组成和分布
目前已知 Cadherin 家族共有 3 个成员:E-Cadherin、N-Cadherin 和 P -Cadherin。E-Cadherin 也被称作 Uvomorulin、L-CAM 或 Cell-CAM120/80。不同的 Cadherin 分子在体内有其独特的组织分布,它们的表达随细胞生长、发育状态不同而改变。
表 2 -4 Cadherin 家族的组成、分布及其配体
| Cadherin 家族成员 | 分子量(kDa) | 主要分布组织 | 配体 |
| E-Cadherin | 124 | 上皮组织 | E-Cadherin |
| N-Cadherin | 127 | 神经组织、横纹肌、心肌 | N-Cadherin |
| P-Cadherin | 118 | 胎盘、间皮组织、上皮细胞 | P-Cadherin |
(三)Cadherin 分子识别的配体
Cadherin 分子以其独特的方式相互作用,其配体是与自身相同 Cadherin 分子(图 2 -7)。以这种方式相互作用的粘附分子除 Cadherin 家族的粘附分子外,还有属于免疫球蛋白超家族的 CD31(PECAM)和 CD56(NCAM)。
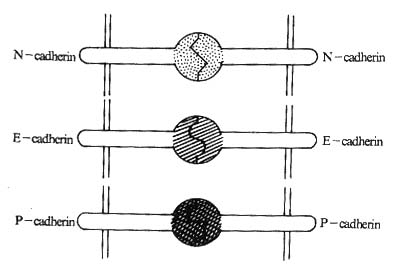
图 2 -7 Cadherin 分子相互作用的模式图
五、其它未归类的粘附分子
除了上述四类粘附分子外,还有一些粘附分子目前尚未归类,包括一组做为 selectin 分子配体的寡糖决定簇或载有这类寡糖决定簇的糖蛋白,如 CD15、S-Lewisx、S-Lewisa; 此外还有 CD44、MAd、MLA 等粘附分子。
(一)selectin 分子结合的配体
1.CD15 CD15 主要分布在粒细胞表面,是 Lewis 寡糖的异构体。在第五届白细胞分化抗原国际会议上,将唾液酸化的 CD15 命名为 CD15s。S-Lewisx和 S -Lewisa是唾液酸化的路易斯寡糖,两者互为异构体,S-Lewisx主要分布在白细胞、血管内皮细胞及某些肿瘤表面,S-Lewisa主要表达的某些肿瘤细胞。上述寡糖决定簇与多肽连接形成多种糖蛋白存在于某些细胞表面。
2.PNAd 和 CLA selectin 分子的配体还包括有另外一些细胞表面的糖蛋白,包括 PNAd 和 CLA。PNAd(peripheral lymphonode addressin)是表达在外周淋巴结高静脉内皮细胞表面的一组糖蛋白,可与特异性抗 L -selectin 分子配体的单克隆抗体 MECA-79 发生反应,分子量在 50~200kDa 之间,分子上载有唾液酸化的寡糖决定簇。CLA(cutaneous lymphocyte associated antigen)是表达在定向归位于皮肤炎症部位的记忆 T 细胞表面的一种糖蛋白,分子上存在类似 S -Lewisx结构的寡糖决定簇,可与血管内皮细胞表达的 E -selectin 分子相结合。唾液酸酶处理可以去除 PNAd、CLA 与 selectin 分子的结合活性。
(二)CD44
1.CD44 分子的结构和分布 CD44 是一种细胞表面糖蛋白,又称 Pgp-1、Ly-24、细胞外基质受体Ⅲ(ECM-RⅢ)和 Hermes。CD44 分子的基因在转录时可取用不同的外显子使在 mRNA 水平上有不同的拼接方式,翻译后糖基化的方式和程度也可以不同,导致成熟的 CD44 分子有多种变异体,按其分子量的不同可大致分为 80~90kDa、110~160kDa 和 180~215kDa 三类,每种变异体有其相应的组织分布。仅由组成性外显子编码的氨基酸序列组成的 CD44 分子称为标准 CD44 分子(CD44S),有 314 个氨基酸,其中胞膜外区 248 个氨基酸,跨膜区 21 个氨基酸,胞浆区 72 个氨基酸,核心蛋白分子量为 37.2kDa,经糖基化后为 80~90kDa,与硫酸软骨素结合后分子量可达 180~200kDa。CD44 分子胞膜外区靠近 N 端约 100 氨基酸范围内有 6 个 Cys,组成三个二硫键,形成一个球形结构,能被 Hermes-1、KM-201 单抗所识别,可能具有与透明质酸结合的功能。胞膜外有 6 个 N - 连接糖基化位点和 7 个 O 连接糖基化位点,此外还有 4 个硫酸软骨素连接位点。Hermes-3McAb 识别 CD44152~235 间的 84 氨基酸肽段,此区域含有许多亲水氨基酸,折叠后暴露于分子的外侧,Hermes-3McAb 能阻断 CD44(淋巴细胞)与粘膜 HEV 上的地址素结合。CD44 分子上的硫酸软骨素介导 CD44 与纤维连蛋白结合。CD44 还可与细胞外基质胶原蛋白Ⅰ和Ⅳ及层粘蛋白结合。
CD44 分子分布十分广泛,如 T 细胞、胸腺细胞、B 细胞、粒细胞、神经胶质细胞、成纤维细胞和上皮细胞等。
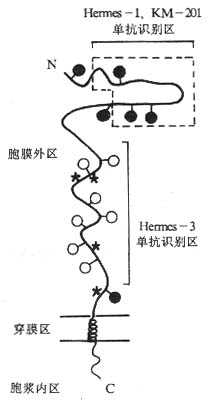
图 2 -8 CD44 分子的结构
注:●- N- 连接的糖基化位点
○- ○- 连接的糖基化位点
* 硫酸软骨素连接位点
2.CD44 分子的变异体 CD44 多种变异体主要是由于 CD44 分子基因的不同拼接方式和翻译后不同修饰所造成的。
(1)CD44 分子基因的不同拼接方式:人 CD44 基因定位于 11 号染色体短臂上,CD44 基因有 20 个高度保守的外显子,每个外显子的长度从 70bp 到 210bp 不等,被长短不一的内含子所分隔。CD44 基因的外显子按表达方式不同可分为以下两类:①10 个组成型外显子(C1~C10),转录片段存在于所有 CD44 转录产物中。仅由组成型外显子编码的氨基酸序列组成的 CD44 分子称为标准 CD44 分子(CD44S)。体内造血细胞(haemopoietic cell)主要表达糖基化的 CD44S,称为标准 CD44H。②10 个变异性拼接外显子(V 区外显子,V1~V10),总长为 1245bp。这 10 个 V 区外显子介于第 5 和第 6 个组成型外显子之间(图 2 -9),其转录产物位于 CD44S 分子第 222 个密码子的第一和第二个核苷酸之间。V 区外显子可以多种不同的方式进行拼接。参加拼接的 V 区外显子可多可少,从而产生了不同大小的转录产物。人 CD44 基因中只有 V2~V10 外显子,不含 V1 外显子。含有 V 区外显子编码的氨基酸序列的 CD44 分子称为 CD44V,目前发现的 CD44V 有 10 余种,如 CD44V(V2~V10)、CD(V8~V10)、CD44V(V4~V7)、CD44V(V6、V7)、CD44V(V6)等。
(2)CD44 分子的翻译后修饰:CD44 分子是一种高度糖基化的蛋白,其翻译后修饰包括 N - 糖基化、O- 糖基化和硫酸软骨素侧链的连接。CD44 分子中组成性外显子和 V 区处显子的编码序列均含有糖基化位点和硫酸软骨素侧链的连接位点。CD44 分子的胞膜外区 N 端部分有 5 个 N - 糖基化位点,另有一个 N - 糖基化位点位于近胞膜部位。CD44 分子胞膜外区近胞膜部位富含丝氨酸和苏氨酸,是 O - 连接糖基化位点,在此区域内还存在有丝氨酸 - 甘氨酸二聚肽结构,被认为是硫酸软骨素连接位点(图 2 -8)。含 V 区外显子编码序列的 CD44 分子经糖基化后分子量可达 110~160kDa,而 CD44 分子与硫酸软骨素分子的连接可使其分子量达 180~215kDa。

图 2 -9 CD44 分子的基因结构
3.CD44 分子的主要功能 CD44 是细胞表面的粘附分子,主要参与细胞 - 细胞,细胞 - 基质之间的粘附。
(1)CD44 分子的配体为细胞外基质,主要有透明质酸、层粘连蛋白、纤粘连蛋白和胶原蛋白等多种配体,不同的 CD44 分子识别的配体有所差别。如 85kDa 的 CD44 分子可结合透明质酸分子的硫酸软骨素侧链可与纤粘连蛋白羧基末端的肝素结合区结合。因此连接有硫酸软骨素侧链的 CD44 分子可以结合纤粘连蛋白。
(2)CD44 分子作为淋巴细胞“归巢”受体(lymphocyte homing receptor)与高内皮静脉(HEV)结合,参与淋巴细胞归位到淋巴组织。
(30)参与 T 细胞的活化,抗 CD44 抗体可促进 T 细胞对抗 CD2 和 CD3 抗体的应答,某些抗 CD44 抗体可提高 CD2/LFA- 3 依赖的 T 细胞与单核细胞的粘附作用。
(4)与细胞骨架蛋白结合,参与细胞伪足形成和迁移运动。CD44 分子胞浆区丝氨酸和苏氨酸磷酸化后,与细胞膜内侧的锚蛋白(ankyrin)结合的亲和力增加,通过锚蛋白与细胞骨架发生连接。
粘膜型地址素(Med)和外周淋巴结型地址素(PNAd)将在本章第三节中加以介绍。
第二节 粘附分子的表达的调节
如前所述,细胞粘附分子不仅具有多种生理功能,在一定条件下也与病理过程的发生密切相关。在细胞因子、炎症介质以及其它因素的作用下,细胞表面粘附分子表达的水平和构型可以发生改变,导致细胞粘附能力的变化。体内某些粘附分子的表达是组成性(constitutive)的,即通常状态下细胞表面就有一定水平的表达,如 CD11/CD18、ICAM-1、ICAM- 2 和 L -selectin 等粘附分子在相应细胞的静止状态下有一定水平的表达,在某些因素的作用下,这些粘附分子的表达也可发生上调或下调(up-regulation ordown-regulation)。另外一些粘附分子的表达可以是非组成性(non-consititutive)的,即通常状态下这些粘附分子在细胞表面表达很少或不表达,但在某些因素的作用下可诱导表达,如 E -selectin、VCAM- 1 在内皮细胞的表达即属此类。对粘附分子表达的调节有构型调节和表达数量调节两种方式,目前关于粘附分子表达调节的资料大多来自于对白细胞与内皮细胞粘附作用的研究。
一、粘附分子构型改变影响细胞的粘附作用
除了通过增加或降低粘附分子表达水平来调节细胞粘附能力外,某些因素还可以通过改变粘附分子的构型影响其与配体结合的亲和力,从而调节细胞的粘附能力,这使得对细胞粘附作用的调节更为精细和复杂。
(一)LFA- 1 分子构型改变对其粘附作用的影响
淋巴细胞在受到外来抗原,PMA,抗 CD2、CD3、CD44、CD43 或抗 MACⅡ类分子单克隆抗体的刺激作用活化后,可发生相互凝集,这种凝集作用依赖于 LFA-1/ICAM- 1 的相互作用,而这两种粘附分子在活化淋巴细胞的表达水平并没有显着增加。静止淋巴细胞即表达一定水平的 LFA- 1 和 ICAM-1,NK 细胞和某些 CTL 细胞系更是表达较高水平的 LFA-1/ICAM- 1 分子,但它们并不发生凝集作用。上述事实提示在淋巴细胞活化后,粘附分子可能通过构型变化的方式,提高 LFA-1/ICAM 相互作用的亲和力,从而提高活化淋巴细胞的粘附能力。
1.NKI-L16 和活化状态的 LFA- 1 分子 NKI-L16 是一种抗 LFA- 1 的单克隆抗体,其识别的表位在静止淋巴细胞暴露的水平很低。当 NKI-L16McAb 与淋巴细胞表面的 LFA- 1 作用后,不仅不阻断 LFA- 1 介导的粘附作用,反而可以诱导静止淋巴细胞的相互粘附而使细胞发生凝集。这种诱导粘附作用的机理部分是由 NKI-L16McAb 改变了 LFA- 1 分子的构型,诱导了 NKI-L16 识别的表位在静止淋巴细胞的表达。NKI-L16 识别表位的表达是粘附作用发生的重要条件,但并不是唯一的,因为 CTL 细胞虽表达高水平的 NKI-L16 表位却并不发生自发凝集。目前研究认为,LFA- 1 分子至少以三种形式存在:(1)静止淋巴细胞表达的 LFA- 1 分子,暴露很少的 NKI-L16 表位,与 ICAM- 1 分子结合的亲和力(affinity)低;(2)中间状态的 LFA- 1 分子,暴露出大量的 NKI-L16 表位,但与 ICAM- 1 结合的亲和力仍较低;(3)活化状态的 LFA- 1 分子,暴露出大量高亲和力的 NKI-L16 表位。不同状态的 LFA- 1 分子在淋巴细胞表面的分布方式是不同的,静止淋巴细胞的 LFA- 1 分子分布分散,而活化的外周血淋巴细胞、CTL 克隆、效应 T 淋巴细胞以及活化的 CTL 克隆细胞的 LFA- 1 分子呈集中分布,在局部形成高密度的 LFA- 1 分子区域,这可能与 NKI-L16 表位的暴露有关(图 2 -10,表 2 -5)。LFA- 1 分子在局部形成高密度状态可以提高其与配体结合时的亲合力(avidity)。
在 integrin 家族中,这种精细的构型调节作用并不仅限于 LFA- 1 分子,已发现 VLA- 4 分子同样存在着静止、部分活化和活化三种要构型,活化的 VLA- 4 分子可与 VCAM- 1 和纤粘连蛋白相结合,部分活化的 VLA- 4 分子仅结合 VCAM- 1 分子,而静止状态的 VLA- 4 分子则失去结合任何配体的能力。
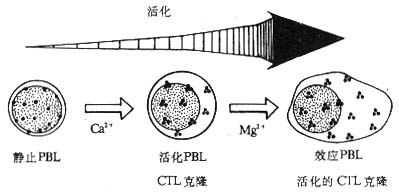
图 2 -10 淋巴细胞活化后 LFA- 1 分子分布状态的改变
注:静止外周血淋巴细胞(PBL)向活化 PBL 分化过程中需要 Ca2+存在;活化 PBL 向效应 PBL 分化以及 CTL 克隆向活化的 CTL 克隆分化过程中需要有 Cg2+存在。活化的和效应的 PBL 或 CTL 表面 LFA 分子呈集中分布。
表 2 -5 三种状态 LFA- 1 分子特性的比较
| 静止状态 LFA- 1 分子 | 中间状态 LFA- 1 分子 | 活化状态 LFA- 1 分子 | |
| LFA- 1 分布方式 | 分散 | 集中 | 集中 |
| 与 ICAM- 1 结合的亲和力 | 低 | 低 | 高 |
| 与 ICAM- 1 结合的亲和力 | 低 | 高 | 高 |
| NKI-L16 表位暴露 | 少 | 多 | 多 |
| LFA-1β 链(CD18)磷酸化 | 无 | 无 | 有 |
2.Ca2+、Mg2+与 LFA- 1 分子活化状态的关系 Ca2+和 Mg2+的存在对 LFA- 1 分子与配体的结合是必需的,在粘附试验系统中加入金属离子螯合剂(EDTA 或 EGTA)去除反应系统中的 Ca2+和 Mg2+可以完全抑制 LFA- 1 与其配体的结合。采用单克隆抗体对 LFA- 1 分子表位的表达进行检测,发现 Ca2+与 Mg2+与 LFA- 1 分子某些表位的表达有关,而这些表位的表达是 LFA- 1 分子活化构型的标志。如上述 NKI-L16 识别表位的表达需要有 Ca2+存在;另外一株单克隆抗体 24(McAb24)识别的表位在 LFA-1、Mac- 1 和 gp150、90 均有表达,但依赖 Mg2+的存在。PMA 或抗细胞表面分子的单克隆抗体作用引起的细胞凝集有一过性持续性两种,一过性的作用在半小时之内消失,而持续性的作用可维持 2 小时以上。这种现象与离子依赖种类有一定的关系,PMA、NKI-L16、抗 CD2 和 CD44 单克隆抗体可以引起持续性的 LFA- 1 分子的活化,它们的作用只依赖 Mg2+的存在;而抗 CD3、CD43 和 MHC-Ⅱ类分子的单克隆抗体所引起的凝集是一过性的,它们的作用则依赖 Ca2+与 Mg2+的同时存在。
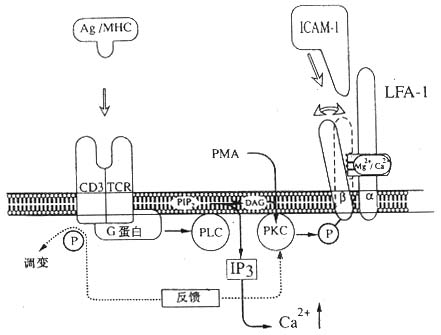
图 2 -11 LFA- 1 介导细胞粘附调节的模式图
注:抗原与 TCR/CD3 复合物结合后激活磷脂酶 c,催化 PIP2 水解为 IP3 和 DAG,引起 LFA- 1 分子 β 链的磷酸化,使 LFA- 1 分子构型发生变化,提高与配体结合的亲和力。CD3 分子的磷酸化引起 TCR/CD3 复合物的调变,导致 PKC 水平下降,使 LFA- 1 分子 β 链去磷酸化转变为非活化状态而产生去粘附作用。
3.LFA- 1 分子构型改变的机理 目前对于淋巴细胞活化后导致 LFA- 1 分子构型改变的机制还不十分明了。实验表明,PMA 作用于淋巴细胞后,通过激活蛋白激酶 C(PKC)使 LFA- 1 分子 β 链发生磷酸化,很可能与 LFA- 1 分子构型的改变有关。抗 CD2 或 CD3 单克隆抗体可以通过影响磷酸肌磷酸肌醇代谢途径导致 PKC 的激活,但两种 McAb 影响淋巴细胞粘附分子活化的过程是不同的,抗 CD2 单克隆抗体诱导持久的 LFA- 1 分子活化,而抗 CD3 单克隆抗体只能诱导短暂的、一过性的 LFA- 1 分子的活化(图 2 -11)。这种对粘附分子表达的负反馈调节机制,对于体细胞粘附作用的调节过程可能有重要的意义。体内对粘附作用的负调节意味着细胞可以与相互作用的靶细胞脱离,再作用于其它靶细胞,从而最大限度地发挥作用。前面曾提到 McAb24 识别的表位表达在活化状态的 LFA- 1 分子,McAb24 并不阻断 LFA- 1 分子和 Mac- 1 分子与配体的结合,但却可以明显抑制单核细胞向 T 细胞的抗原提呈作用、LAK 细胞对靶细胞的杀伤作用以及中性粒细胞的趋化移动,这些过程均依赖 LFA- 1 和 Mac- 1 分子与其配体的相互作用。单独 CD3 单克隆抗体只引起一过性的 LFA- 1 分子的活化,而同时加入 McAb24 则造成持续性 LFA- 1 分子的活化,提示 McAb24 可能阻止 LFA- 1 分子由活化状态转变为非活化状态。
(二)其它粘附分子构型的改变对粘附作用的影响
除 LFA- 1 分子外,在 integrin 家族中其它一些粘附分子构型的改变也可以影响细胞的粘附能力。PMA、抗 CD2 或 CD3 单抗可以诱导或增强淋巴细胞的 VLA-4(CD49d/CD29)、VLA-5(CD49e/CD29)和 VLA-6(CD49f/CD29)与其配体(层粘连蛋白或纤粘连蛋白)的粘附作用,提示上述粘附分子可能通过与 LFA- 1 相类似的机制发生构型变化,导致与配体结合的亲和力升高。Mac- 1 分子(CD11b/CD18)及血小板糖蛋白 GPⅡbⅢa(CD41/CD61)分子在细胞活化后可以暴露新的表位,是其分子构型发生改变的直接证据,但其发生机制目前还不清楚。
尽管目前尚未获得 selectin 家族粘附分子构型变化影响粘附能力的直接证据,但某些抗 L -seletin 或抗 E -selectin 分子 EGF 结构域的单抗非但不阻断 L -selectin 分子或 E -selecti 分子与相应配体的结合,反而具有促进作用,提示 selectin 家族粘附分子中同样存在着分子构型变化对粘附能力调节的可能性。
二、细胞粘附分子表达数量改变对粘附作用的调节
粘附分子表达数量的改变是粘附作用调节的另一个重要方面。粘附分子构型改变与表达数量的增减并不是截然分开的两个过程,两者可能同时存在,共同完成对粘附作用的调节。如淋巴细胞活化后不仅粘附分子构型改变导致亲和力增加,同时也伴有粘附分子数量的增加。
1. 调节细胞表面粘附分子表达数量的方式 细胞表面粘附分子表达数量的调节方式主要有诱导贮存在细胞内的粘附分子转移到细胞表面和诱导粘附分子的重新合成两种方式。转移形式的过程发生迅速,只需数秒钟,但维持时间短暂。如凝血酶和组胺作用于内皮细胞可以诱导内皮细胞内贮存在 CD62 分子迅速转移到细胞表面,然后又很快被内吞而消失;又如 CD11b/CD18、CD11c/CD18 贮存在中性粒细胞的胞浆颗粒内,在 PMA、TNF、IL- 1 刺激后迅速转移到细胞表面。重新合成过程发生较为迟缓,一般需数小时,但维持时间较长。IL-1、TNF- α 作用于血管内皮细胞则可以诱导 E -selectin、VCAM- 1 分子的重新合成与表达,诱导后 4 小时达到高峰,并可维持 24 小时以上。
2. 细胞因子、炎症介质对粘附分子表达的调节 细胞因子 IL-1、IL-3、IL-4、IL-8、PAF、GM-CSF、TNF-α、TNF- β 和 IFN- γ 以及炎症介质白三烯、组胺和凝血酶等可作用于白细胞或 / 和血管内皮细胞,调节白细胞与血管内皮细胞的粘附作用(表 2 -6)。在体内可能有多种调节因素同时存在,相互影响,并可能有更多的目前未知的因素参与细胞间粘附的调节过程。
3. 细胞的生长、发育状态对粘附分子表达的影响 除了上述细胞因子、炎症介质可以调节细胞粘附分子的表达外,细胞本身的生长、发育、分化及代谢状态也可以影响粘附分子的表达。在胚胎发育过程中,组织细胞粘附分子的表达接一定的规律发生改变,使得不同细胞得以按一定的规律组合在一起,形成不同的组织或器官。肿瘤细胞与其起源的正常组织细胞相比其表达的粘附分子可有很大差异,这可能是某些肿瘤细胞易发生浸润、转移等现象的分子基础。此外,处于不同分化和发育状态的淋巴细胞表达粘附分子也有明显改变,如与未经抗原刺激的 T 细胞(naive T cell)相比,记忆性 T 细胞(memory T cell)表达更多的 CD2、LFA-1、CD44、VLA- 4 等粘附分子,而 L -selectin 在 naive T 细胞表达水平要明显高于记忆 T 细胞。
表 2 -6 细胞因子、炎症介质对细胞粘附分子表达的调节作用
| 炎症介质或细胞因子 | 靶细胞 | 粘附分子表达水平的变化 |
| IL-1 | 血管内皮细胞 | E-selectin↑、VCAM-1↑、ICAM-1↑ |
| 某些肿瘤细胞 | ICAM-1↑ | |
| 中性粒细胞 | CD11b/CD18↑、CD11c、CD18↑ | |
| TNF-α、TMF-β | 血管内皮细胞 | E-selectin↑、VCAM-1↑、ICAM-1↑ |
| 中性粒细胞 | CD11b/CD18↑、CD11c/CD18↑ | |
| IL-3 | 嗜碱性粒细胞 | CD11b/CD18↑ |
| IL-4 | 血管内皮细胞 | VCAM-1↑ |
| IFN-γ | 血管内皮细胞 | ICAM-1↑、VCAM-1↑MHC-Ⅱ类分子↑ |
| PAF、IL-8、GM-CSF | 中性粒细胞 | L-selectin↓、CD11b/CD18↑ |
| 组胺、凝血酶 | 血管内皮细胞 | CD62↑ |
| 白三烯 | 中性粒细胞 | 粘附作用↑ |
注:↑表示上调(up-regulation)
↓表示下调(down-regulation)
第三节 粘附分子的功能
在体内,一种细胞可能同时表达多种粘附分子,一种粘附分子也可以表达于多种不同的组织细胞,而细胞间的相互粘附作用又可能由多对粘附分子受体 / 配体共同参与,单从某一对粘附分子的作用难于了解细胞粘附作用的全过程。本节着重从粘附分子参与的体内某些生理或病理过程来介绍粘附分子的功能,并简述其分子基础。
一、炎症过程中白细胞与血管内皮细胞的粘附
炎症过程的一个重要特征就是白细胞粘附、穿越血管内皮细胞,向炎症部位渗出。这一过程一个重要的分子基础是白细胞与血管内皮细胞粘附分子的相互作用,表 2 - 7 例举了参与这一过程的粘附分子。不同白细胞的渗出过程或渗出过程的不同阶段所涉及的粘附分子不尽相同。
1. 不同粘附分子在粘附过程不同阶段所起的作用 在体内由于血液处于不断流动状态,白细胞与血管内皮细胞的粘附作用是在血液流动产生的切力作用下进行的,因此白细胞与血管内皮细胞的相互粘附作用有其特殊性。体内白细胞与血管内皮细胞的粘附作用包括白细胞沿血管壁流动的最初粘附作用,以及随后的加强粘附和穿越内皮细胞的过程。为了模拟体内血液流动状态,在体外研究白细胞与血管内皮细胞的粘附作用时,采用了特殊的实验装置,使培养液中的中性粒细胞不断流动通过培养状态的单层内皮细胞。实验表明,在流体产生的切力作用下,CD11/CD18 与其配体 ICAM- 1 对于中性粒细胞与血管内皮细胞的最初粘附几乎不起作用。相比之下,L-seletin 分子与其配体 E -selectin 的结合则发挥重要的作用,抗 L -selectin 分子的单克隆抗体可明显阻断这种最初的粘附作用。在随后发生的中性粒细胞与血管内皮细胞加强粘附并穿越血管内皮细胞的过程中,L-selectin 分子与其配体的结合则几乎不起任何作用,而 CD11/CD18 与其配体的相互作用上升到关键地位。已经粘附于血管内皮细胞的中性粒细胞 L -selcetin 分子表达水平显著下降,在趋化因子(如膜结合 IL-8)的诱导下,CD11/CD18 表达水平则明显升高。事实上,L-selectin 分子表达下降可减少对已粘附中性粒细胞的牵拉作用,有利于 CD11/CD18 介导的中性粒细胞的穿越血管内皮细胞过程。
表 2 -7 参与白细胞与血管内皮细胞粘附的粘附分子
| 白细胞粘附分子(受体) | 主要表达细胞 | 内皮细胞的粘附分子(相应配体) |
| CD11a/CD18 | N.L.M | ICAM-1、ICAM-2、ICAM-3 |
| CD11b/CD18 | N.L.M | ICAM-1 |
| CD11c/CD18 | N.L.M | |
| VLA-4(CD49d/CD29) | L.M | ICAM-1 |
| l-selectin(CD62L) | N.L.M | E-selectin、P-selectin |
| CD15 | N | E-selectin、P-selectin |
注:N:中性粒细胞 L:淋巴细胞 M:单核细胞
2. 膜结合细胞因子在白细胞与血管内皮细胞粘附过程中所起的作用 调节上述白细胞粘附分子表达的细胞因子有血管内皮细胞膜表面结合的 IL-8、GM-CSF、PAF 等对中性粒细胞具有趋化作用的细胞因子,血管内皮细胞所合成的上述细胞因子主要以膜结合(membrane-bound)的形成表达于血管内皮细胞表面。中性粒细胞与血管内皮细胞的粘附过程是在血管内皮细胞膜结合细胞因子调节作用下多种粘附分子按顺序协调作用的复杂过程(图 2 -12)。
在中性粒细胞粘附、穿越血管内皮细胞的过程中,IL-8、GM-CSF 和 PAF 等细胞因子发挥着关键的调节作用,没有上述细胞因子的作用,最初粘附到血管内皮细胞的中性粒细胞可能重新回到血流中去。膜结合细胞因子的存在作用其特殊意义,它可以使细胞因子的作用局限化,促进白细胞的粘附、渗出、游离的细胞因子(IL- 8 等)作用于白细胞减少其 L -selectin 分子的表达,反而抑制白细胞的粘附、渗出。血管内皮细胞表面不同的膜结合细胞因子不同白细胞粘附作用的选择性激活可能是选择白细胞粘附、渗出过程的因素之一。
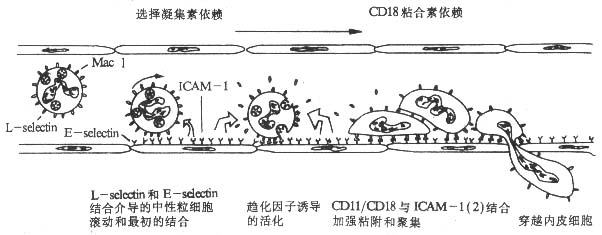
图 2 -12 中性粒细胞粘附、穿越血管内皮细胞过程的模式图
淋巴细胞的粘附、渗出过程可能采取相似的方式,只是所涉及的粘附分子及粘附激活机制有所不同。即最初是由 seectin 分子介导的淋巴细胞与血管内皮细胞的不稳定的粘附,随后血管内皮细胞的膜结合细胞因子作用于淋巴细胞激活其 integrin 分子,导致加强粘附及穿越血管内皮细胞的过程。
粘附分子在白细胞渗出过程中的重要作用在先天性白细胞粘附缺陷症(leukocyte adhesion deficiency,LAD)发病机理中得到了证实。该病的临床特征是反复发生难以治愈的感染。LAD 可分为 LAD- 1 和 LAD- 2 两型。LAD- 1 型患者白细胞 CD11/CD18 分子表达缺陷,因此不能与 FN 和 C3bi 结合,丧失非特异的调理作用;此外,虽然白细胞可以沿血管壁流动,由于不能与血管内皮细胞表面粘附分子 ICAM- 1 结合,白细胞不能渗出到炎症部位。LAD- 2 型患者白细胞 S -Lewisx(CD15s)表达缺陷,不能有效的与 E -selectin 分子结合,白细胞沿血管壁的流动能力显著低于正常人,同样也不能向炎症部位渗出。因此阻断白细胞与血管内皮细胞的粘附和白细胞的渗出有可能成为预防和治疗性疾病的一种新的手段。
3. 细胞因子在白细胞选择性渗出过程中的作用 不同炎症具有不同类型的炎细胞浸泣,如急性炎症以中性粒细胞渗出和浸润为主,慢性炎症往往以淋巴细胞浸润为主,Ⅰ型超敏反应的变态反应性炎症以嗜碱性粒细胞的选择性渗出为主,迟发型超敏反应性炎症则以单核细胞、T 细胞浸润为特征。虽然目前对白细胞选择性渗出的机理还不完全明了,但已有的证据显示粘附分子在不同类型白细胞表达的差异以及细胞因子对粘附分子表达的不同调节作用可能是重要的因素。如 IL- 4 和 IFN- γ 作用于血管内皮细胞可以选择性地诱导粘附性粒细胞表达,在中性粒细胞不表达,因此 IL- 4 和 IL- 4 和 IFN- γ 可以选择性的促进除中性粒细胞以外的白细胞的粘附作用。IL- 4 和 IFN- γ 是由活化 T 淋巴细胞产生的细胞因子,炎症局部活化 T 淋巴细胞可能通过产生 IL- 4 和 IFN- γ 等细胞因子作用于局部血管内皮细胞,促进白细胞的渗出,因此 IL- 4 和 IFN- γ 可能在免疫介导的炎症性疾病中发挥重要作用。此外,IL-8、GM-CSF 和 PAF 等膜结合细胞因子也可能是导致白细胞选择性渗出的重要因素。
二、粘附分子与淋巴细胞的归巢
淋巴细胞在中枢淋巴器官发育成熟后,经血流定居在外周淋巴器官,并在全身和器官、组织以及炎症部位发挥多种生物学功能。淋巴细胞归巢(homing)是淋巴细胞迁移的一种特殊形式,包括:(1)淋巴干细胞向中枢淋巴器官的归巢(2)淋巴细胞向外周淋巴器官的归巢;(3)淋巴细胞再循环,即外周淋巴器官的淋巴细胞通过毛细血管后静脉进入淋巴循环,以利于免疫细胞接触外来抗原,然后再回到血循环;(4)淋巴细胞向炎症部位的渗出。淋巴细胞是一个不均一的群体,可以分为不同的群或亚群。淋巴细胞归巢过程的一个显着特点是不同群或亚群的淋巴细胞在上述移行过程中具有相对的选择性,即某一特定的淋巴细胞群或亚群定向归巢到相应的组织或器官。淋巴细胞归巢过程的分子基础是淋巴细胞与各组织、器官血管内皮细胞粘附分子的相互作用。一般将淋巴细胞的粘附分子称为淋巴细胞归巢受体(lymphocyte homing receptor,LHR), 而将其对应的血管内皮细胞的粘附分子称为地址素(addressin)。多种粘附分子与淋巴细胞的归巢有关(表 2 -8),但参与不同群或亚群淋巴细胞归巢过程的粘附分子是不同的,成为淋巴细胞选择性归巢的分子基础。
(一)T 细胞前体向胸腺的归巢
对于骨髓产生的 T 细胞前体(Pro-T cell)向胸腺归位的机理尚缺乏深入的研究。目前已知 T 细胞祖细胞表达 CD44 与 L -selectin 分子,它们可能与 T 细胞祖细胞的归巢有关。此外,胸腺血管内皮细胞表达一种被称为 EA1 的分子,可能起到地址素的作用参与 T 细胞的归巢过程。最近认为 integrin 中 α6β1、α6β4 对 T 细胞前体的粘附起重要作用。
(二)淋巴细胞向外周淋巴器官的归巢
淋巴细胞向外周淋巴器官的归巢主要有淋巴细胞向外周淋巴结、派伊尔小结(Peyre’s Patch)及脾脏的选择性归巢等几种不同的途径。
1. 淋巴细胞向外周淋巴结的归巢 L-selectin 是决定淋巴细胞向外周淋巴结选择性归巢的归巢受体,其相应配体为特异性表达于外周淋巴结血管地址素(perpheral lymphonode vascular addressin,PNAd)。L-selectin 分子与 PNAd 相结合介导了淋巴细胞与外周淋巴结血管内皮细胞最初的粘附,随后参与粘附与穿越过程的粘附分子主要有 LFA-1/ICAM-1、ICAM- 2 及 CD44/MAd 分子。
2. 淋巴细胞向派伊尔小结的归巢 integrinα4β7 分子是淋巴细胞向派伊尔小结定向归巢的特异归巢受体,抗 α4β7 的抗体可特异性地阻断淋巴细胞向派伊尔小结的归巢过程,而对淋巴细胞向外周淋巴结的归巢过程无明显影响。integrin α4 亚单位可与 β1、β2、βρ 等 β 亚单位结合,分别组成 α4β1、α4β7 和 α4βρ,并表达在不同的淋巴细胞表面,可能与特定淋巴细胞群或亚群的定向归巢有关。派伊尔小结的静脉高内皮细胞专一的、高水平表达粘膜血管地址素(mucosal vascular addressin,MAd).MAd 是一种分子量为 60kDa 的糖蛋白,其对应的淋巴细胞归巢受体是 integrin α4β7,两者的相互作用构成了特定淋巴细胞群向派伊尔小结定向归巢的基础。CD44 及 LFA- 1 分子作为淋巴细胞归巢受体与其配体 MAd 和 ICAM-1、ICAM- 2 的相互作用也参与淋巴细胞向派伊尔小结的归巢过程,但它们与 α4β 不同,除参与淋巴细胞向派伊尔小结归巢外,还参加向其它外周淋巴器官的归巢。
表 2 -8 参与淋巴细胞归巢的粘附分子
| 表达于淋巴细胞的归巢受体(lymphocyte homing receptor) | 血管内皮细胞的相应地址素(addressins) | ||
| 粘附分子 | 作用 | 粘附分子 | 作用 |
| L-selecten | 淋巴细胞向外周淋巴器官的归巢 | PNDd | 外周淋巴结高静脉内皮细胞的地址素 |
| CLA | 定向归巢于皮肤的记忆 T 细胞表面的归巢受体 | E-selectin | 表达在皮肤炎症部位的血管内皮细胞 |
| LFA-1 | 参与多种淋巴细胞归巢过程 | ICAM-1、ICAM-2 | 参与多种淋巴细胞的归巢过程 |
| VLA-4 | 淋巴细胞归巢受体 | VCAM-1 | 表达于炎症部位血管内皮细胞 |
| CD44 | 参与多种淋巴细胞归巢受体 | MAd | 肠道淋巴组织及粘膜固有层血 |
| integrin | 定向归位于派伊尔小结的淋巴细胞的归巢受体 | MAd | 管内皮细胞的地址素 |
| α4β7 | |||
淋巴细胞向脾脏的归巢过程也是特定淋巴细胞群的定向归巢过程,但其归巢机理与分子基础尚不清楚。
(三)淋巴细胞向非淋巴组织的归巢
正常的非淋巴组织没有或只有少量淋巴细胞,但在炎症状态下,淋巴细胞可以大量浸润。淋巴细胞向非淋巴组织的归巢可以区分为以下两种情况:(1)正常的皮肤及消化、生殖道粘膜组织中有特定表达 γδ 型 T 细胞受体(TCRγδ)的淋巴细胞群存在,它们可能直接来自中枢淋巴器官,这些淋巴细胞的归巢过程所涉及的粘附分子还不清楚。此外,正常皮肤或粘膜等组织中经常存在有少量记忆淋巴细胞,可能是少量抗原持续刺激的结果。(2)淋巴细胞向炎症状态下的非淋巴组织的归巢。在炎症组织中浸润的淋巴细胞多为记忆性 T 细胞,这些 T 细胞表达较高水平的 CD45RO,此外,LFA-1、ICAM-1,α4-integrin、LFA-3,CD44 等粘附分子的表达也明显高于天然(naive)T 淋巴细胞。上述粘附分子相对高表达可能与记忆 T 细胞向炎症部位的选择性渗出有关。
淋巴细胞向非淋巴组织的归巢过程除了具有记忆 T 细胞的选择性外,还有组织特异性,也就是就特定的淋巴细胞群选择性的定向归巢到皮肤、粘膜或滑膜等组织。
1. 淋巴细胞向皮肤炎症部位的归巢 皮肤炎症部位的血管内皮细胞表达高水平的 E -selectin 分子,而向皮肤炎症部位定位归巢的记忆 T 细胞则表达皮肤淋巴细胞相关抗原(cutaneouslymphocyte-associated antigen,CLA),E-selectin 与 CLA 的相互作用是 CLA 阳性记忆 T 细胞向皮肤炎症部位定向归巢的分子基础。此外,VLA- 4 与 VCAM-1,LFA- 1 与 ICAM-1/ICAM- 2 的相互作用也与淋巴细胞向皮肤炎症部位的归巢过程有关(参见表 2 -8)。
2. 淋巴细胞向肠道粘膜炎症部位的归巢 目前关于这一过种的研究资料还不多。粘膜组织中的淋巴细胞表达一种称为 MLA(mucosal lymphocyte antigen)的表面抗原,由 integrin 分子 β7 链与另一条不同于 α4 链的多肽链组成,可能与淋巴细胞向肠道粘膜的归巢过程有关。
3. 淋巴细胞向滑膜炎症部位的归巢 目前已知 LFA-1/ICAN-1、VLA-4/VCAM- 1 及 CD44/MAd 都参与淋巴细胞向滑膜组织的归巢过程,但还不能解释淋巴细胞向滑膜组织归巢过程的选择性。推测可能还有未被发现的决定淋巴细胞向滑膜组织定向归巢的粘附分子。
(四)淋巴细胞归巢过程中激活粘附作用的分子
前已述及,淋巴细胞的归巢与中性粒细胞渗出的过程是相似的。同样,淋巴细胞归巢过程中最初粘附后粘附作用的激活机制也与中性粒细胞的渗出过程类似。
1. 具有趋化作用的多肽 巨噬细胞炎症蛋白 -1(macrophageinflammatory protein-1,MIP-1)可以膜结合的形式存在于淋巴结或炎症组织血管内皮细胞表面,通过作用于 CD8+ T 细胞使其与血管内皮细胞粘附作用增强,这种粘附作用的增强是由 T 细胞 VLA- 4 与血管内皮细胞 VCAM- 1 分子相互作用介导的。此外,趋化因子家族的 RANTES 对记忆 T 细胞具有选择趋化作用。不同的趋化多肽对特定淋巴细胞群粘附作用的激活可能与淋巴细胞的选择性归巢有关。
2. 粘附分子介导的粘附激活作用 抗 CD2 和抗 CD3 单克隆抗体作用于 T 淋巴细胞可使 T 细胞表面 integrin 分子构型改变而使其与配体结合的亲和力增加。此外,淋巴细胞其它表面分子在与配体结合后可能通过相同或不同的机制影响粘附分子间相互结合的亲和力。可能具有上述作用的粘附分子有 CD15、CD31 和 VLA-4。(1)抗 CD15 单克隆抗体与结合于 LFA- 1 分子的 CD15 结合后,通过 LFA- 1 分子构型的改变使其与 ICAM- 1 粘附作用增强。血管内皮细胞表达的 E -selectin 分子可能模拟抗 CD15 单克隆抗体的作用,与 CD15 结合后导致淋巴细胞 LEA- 1 与其配体 ICAM- 1 粘附作用的激活。(2)抗 CD31 的单克隆抗体作用于 CD8+ T 细胞可激活 VLA-4/VCAM- 1 介导的粘附作用,淋巴细胞 CD31 分子与其血管内皮细胞配体的作用可能导致相同结果。(3)VLA- 4 与其配体 VCAM- 1 结合对其自身的粘附具有正反馈调节作用。由于表达 CD31 的细胞多为天然 T 细胞,VLA- 4 的表达局限于部分 T 细胞,因此 CD31 和 VLA- 4 对粘附作用的激活可能与不同的淋巴细胞群的定向归巢有关。
淋巴细胞的归巢是一个多种粘附分子参与并受各种因素调节的复杂过程,对于这一过程还缺乏系统的、确切的认识。随着免疫生物学和分子免疫学研究的进展,必将推动这一重要领域的深入研究,并为某些疾病的诊断、预防和治疗提供一条崭新的途径。
三、粘附分子参与免疫细胞的识别作用
免疫细胞的相互作用及杀伤细胞识别靶细胞的过程中,除了需要对特异性抗原的识别作用外,还需要粘附分子的相互作用。某些粘附分子的抗体可以阻断免疫细胞的相互作用及杀伤细胞对靶细胞的杀伤作用(图 2 -13)。辅助性 T 细胞与抗原提呈细胞的相互作用过程中,T 细胞受体(TCR/CD3)识别抗原提呈细胞表面的特异性抗原与 MHC 分子的复合体,而 CD4/MHC-Ⅱ类分子(非多态部分)、LFA-1/ICAM-1、LFA-2/LFA-3、CD28/CD80 的相互作用则可以使两者紧密接触,提供了相互作用的重要条件,并参与 T 细胞的活化过程和细胞因子的分泌调节。杀伤性 T 细胞杀伤靶细胞(如病毒感染靶细胞)时,其 CTL 特异受体识别靶细胞抗原与 MHC-Ⅰ类分子的复合物,CD8/MHC-Ⅰ类分子(非多态部分)、LFA-1/ICAM-1、LFA-2/LFA- 3 的相互作用导致效一靶紧密接触,杀伤细胞的细胞毒介质得以有效地发挥作用。值得注意的是无论是免疫细胞的相互作用或效 - 靶细胞的相互作用,最终相互接触的细胞仍然要分开,显然细胞内存在着对粘附作用的负反馈调节机制,尽管这种调节机制目前还不完全清楚,但已知 CD3 分子的表达下调可以激活 PLC,可能导致 LFA- 1 分子的去磷酸化而使其失去活性,降低 LFA- 1 分子介导的粘附作用。
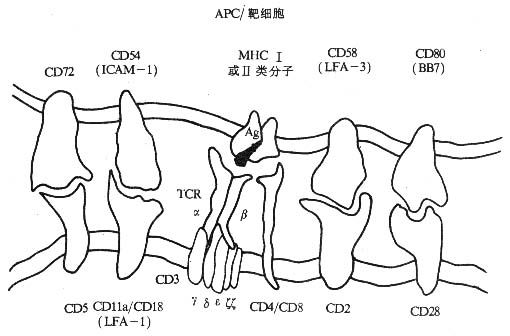
图 2 -13 粘附分子与免疫细胞的识别作用
四、粘附分子参与细胞发育、分化、附着及移动
在胚胎发育过程中,不同类型的细胞按着既定的规律形成细胞与细胞之间及细胞与细胞外基质的附着,有序地组合在一起构成不同的组织和器官。在这一过程中,粘附分子发挥着重要作用。
(一)粘附分子参与细胞间的附着
参与细胞与细胞间附着的粘附分子主要是 Cadherin 家族的粘附分子,以及属于免疫球蛋白超家族的粘附分子 NCAM 及 CD31。已经发现,Cadherin 分子是组织学上在细胞连接中起重要作用的粘着小带(zonula adherence)的重要跨膜万分。参与细胞与细胞间附着粘附分子的共同特点是以自身识别的方式相互作用,即相同的粘附分子之间的相互作用。如将转染了不同 Cadherin cDNA 的 L 细胞混合在一起后,表达相同 Cadherin 分子的 L 细胞可以重新聚集在一起。这种特殊的自身相互识别的作用方式保证了相同细胞的聚集。在胚胎发育过程中,细胞粘附分子的表达有规律的发生改变,支配不同细胞的有序组合形成组织和器官。当一群细胞失去其原来表达的 Cadherin 分子或获得表达一种新的 Cadherin 分子时,它可以离开原有的细胞群。而如果不同的细胞群的发育过程中的某一阶段表达某一种相同 Cadherin 分子,它们可以相互联系起来。如肺的间叶细胞表达 N -Cadherin 分子,而上皮细胞表达 E -Cadherin 和 P -Cadherin 分子,将肺组织胰酶消化后加入 E -Cadherin cDNA 转染的 L 细胞,则 L 细胞与上皮细胞聚集在一起。上述实验表明,Cadherin 分子在胚胎发育、分化过程中可能起着重要的作用。
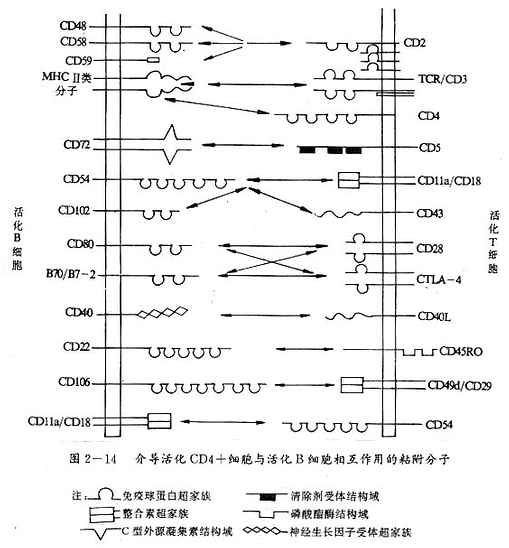
图 2 -14 介导活化 CD4+ 细胞与活化 B 细胞相互作用的粘附分子
(二)粘附分子参与细胞与基质的附着
细胞与细胞间基质的附着是细胞生存与增殖所必需的,这种附着主要由 integrinpe 家族的粘附分子来介导。除 β2 组外,integrin 分子识别的配体大都是细胞外基质的成分,包括 FN(fibronectin,纤粘连蛋白)、LM(lamnin, 层粘连蛋白)、VN(Vitronecin,玻璃粘连蛋白)、CA(collagen, 胶原蛋白)等。integrin 分子广泛表达于各种组织细胞,而其配体广泛存在于细胞外基质中。细胞与基质的附着主要有以下两种情况:(1)间叶细胞,以成纤维细胞为代表,细胞的周围均与细胞外基质附着;(2)上皮细胞,细胞的周围部分与细胞外基质附着,而细胞侧面则是细胞之间的附着,在这种情况下细胞粘附分子的分布存在着极性,细胞癌变过程往往伴随着这种极性的丧失。
(三)粘附分子参与细胞的移动
在细胞发育、分化以及创伤修复过程中都需要细胞的移动,迄今为止对这一过程的确切机制还没有明确的认识,但可以肯定的是细胞粘附分子是这一过程的重要参与者,而且这些粘附分子的表达得到精细的调控。已经发现 E -Cadherin、N-Cadherin、NCAM,CD31 及 FN 和 FN 受体都与细胞移动有关。(1)在胚胎发育过程中,视神经轴突要沿着视束生长到达中脑顶盖建立突触联系,处于生长状态的轴突在神经表皮细胞表面移动,两者均表达 N -Cadherin 分子。如将胚胎的视网膜组织种植在单层不表达 N -Cadherin 的 Neuro 2a 细胞上,神经轴突不能生长;如果将 Neuro 2a 细胞转染 N -Cadherin 分子,则可以看到神经轴突的生长;抗 N -Cadherin 分子的抗体可以抑制轴突的生长。(2)FN 及其受体的相互作用同样参与了胚胎发育中细胞的移动过程,含有 RGD 序列的多肽可以干扰胚胎发育中器官的发生。此外,FN 及其受体还参与创伤修复过程中细胞的移动,FN 可促进创面的愈合。(3)CD31 则对细胞的移动具有抑制作用。
细胞粘附分子对细胞的移动具有促进与抑制两种作用,粘附分子在细胞表面分布的极性可能与其作用的差异有关。如 CD31 和 E -Cadherin 都分布在细胞的侧面与邻近细胞接触的部位,它们对细胞的移动具有抑制作用。
五、粘附分子与肿瘤
粘附分子与肿瘤的的关系主要包括对肿瘤浸润和转移的影响,对杀伤细胞杀伤肿瘤的影响,以及辅助肿瘤的诊断。
(一)粘附分子与肿瘤的浸润与转移
恶性肿瘤一个重要生物学特征是其对邻近正常组织的浸润及远处转移。目前已知肿瘤的浸润与转移与其粘附分子表达的改变有关。一方面肿瘤细胞某些粘附分子表达的减少可以使细胞间的附着减弱,肿瘤细胞脱离与周围细胞的附着,这是肿瘤浸润及转移的第一步;另一方面,肿瘤细胞表达的某些粘附分子使已入血的肿瘤细胞得以粘附血管内皮细胞,造成血行转移。
1.E-Cadherin 与肿瘤浸润的关系 包括大肠癌、乳腺癌等在内的多种肿瘤细胞 E -Cadherin 分子表达明显减少或缺失,E-Cadherin 分子表达水平降低与肿瘤细胞恶性程度显著相关。E-Cadherin 分子在恶性程度低的乳腺癌细胞的表达水平明显高于恶性程度高的肿瘤细胞,而且其表达水平与腺小管形成成正比。体外实验更明确地证实了 E -Cadherin 分子与肿瘤浸润能力的关系。在培养状态下表达 E -Cadherin 分子的肿瘤细胞不侵入基附着的基质,但如加入抗 E -Cadherin 分子的抗体,则肿瘤细胞获得浸润能力;不表达 E -Cadherin 分子的肿瘤细胞在培养时表现浸润能力,但如将 E -Cadherin 分子的 cD-NA 转染肿瘤细胞使其表达 E -Cadherin 分子后,则肿瘤细胞丧失其浸润能力。
肿瘤细胞除粘附分子表达水平改变外,粘附分子在其表面的分布往往也有改变。E-Cadherin 分子在正常的上皮组织中只分布于细胞相邻的侧面。而在某些上皮组织起源的肿瘤细胞 E -Cadherin 分子可以表达在细胞顶部。尽管某些肿瘤细胞可以表达一定水平的 E -Cadherin 分子,但分布的异常使其难以发挥细胞间附着的作用,这也可能与肿瘤的浸润与转移有关。
2.integrin 家族与肿瘤浸润和转移的关系 integrin 家族粘附分子在肿瘤细胞的表达水平也明显改变,既可表达数量减少或缺失,也可以表达升高,分布在极性亦可能不同于正常细胞。integrin 分子在肿瘤细胞表达变化的不一致性可能与 integrin 分子的不同作用有关。同一种粘附分子可以在转移和附着两个不同的过程中发挥作用,因此 integrin 分子表达的增加或减少都可能与肿瘤细胞浸润及转移有关。
3.CD44 和其它粘附分子对肿瘤转移的影响 与 E -Cadherin 分子对肿瘤浸润与转移的抑制作用相反,肿瘤细胞表达的某些粘附分子作为血管内皮细胞表面粘附分子、细胞外基质的相应受体可使已进入血流的肿瘤细胞粘附血管内皮细胞或基质,促进肿瘤细胞的转移。对肿瘤血行转移的研究多采用小鼠尾静脉注射黑素瘤细胞造成肺转移的模型,已知黑素瘤细胞表达的 CD44 分子、层粘连蛋白受体等都可以促进黑素瘤细胞有肺部形成转移灶,用相应粘附分子的抗体或可溶性配体则可减少黑素瘤的肺部形成转移灶。此外体内慢性炎症部位往往是肿瘤转移灶的好发部位,可能与炎症产物、细胞因子作用于局部血管内皮细胞促进其粘附分子表达而有利于肿瘤细胞的粘附有关。
不同的 CD44 分子在肿瘤浸润与转移过程中的作用可能是不同的,正常组织细胞或非转移的癌细胞主要表达 CD44S,而具有转移能力的癌细胞主要表达 CD44V。
(二)粘附分子对杀伤细胞杀伤肿瘤细胞的影响
杀伤细胞与肿瘤细胞的接触由两种细胞表面粘附分子的相互作用来介导,LFA-1/ICAM- 1 的相互作用具有重要地位。多种肿瘤细胞表达 ICAM- 1 分子,肿瘤细胞 ICAM- 1 分子的表达可能与肿瘤组织内淋巴细胞的浸润有关。细胞因子如 IFN-γ、IFN-α、IL-4、TNF- α 可促进某些肿瘤细胞 ICAM- 1 分子的表达,从而增加其对杀伤细胞作用的敏感性。毛细胞白血病细胞不表达 LFA- 1 和 ICAM- 1 分子,使其对 CTL 的杀伤作用更为敏感。肿瘤患者血清中可溶性 ICAM- 1 水平往往高于正常人,可能抑制 NK 对肿瘤细胞的杀伤作用。
(三)粘附分子与肿瘤的诊断
不同 integrin 分子在不同的组织、细胞有其特定的分布方式,虽然在肿瘤组织 integrin 分子的表达不同于正常组织,但仍在一定程度上保留了这种特定的分布方式,从而可以作为肿瘤分型诊断的参考依据。由于分化程度低的恶性肿瘤细胞在组织学上难以区分其组织来源,因此对其 integrin 分子表达的检测可以作为肿瘤诊断的一个有效的辅助手段。
正常的肝细胞表达 VLA-α1 和 VLA-β1,而胆管上皮细胞表达 VLA-α2、VLA-α3、VLA-α6 和 VLA-β4。肝癌包括肝细胞癌和胆管癌两种组织类型,分化良好的肝细胞癌和胆管癌表达 integrin 分子与其来源组织基本相似,但低分化的肝细胞癌可以表达 VLA-α2、VLA-α3、VLA-α6。低分化的胆管癌细胞表达 integrin 分子的种类虽然与正常胆管相同,但表达数量明显减少。由于肝细胞癌不表达 VLA-β4,而胆管癌细胞不表达 VLA-α1,因此上述两种 integrin 分子可以作为区分两型肝癌的标志。
六、粘附分子与凝血
凝血过程中血小板聚集的分子基础是血小板表面的粘附分子。在动脉和静脉中血小板聚集的机理有所差别,所涉及到的粘附分子也不尽相同。
(一)粘附分子与动脉凝血
动脉中形成的血栓主要由血小板组成,称为白血栓。动脉中血栓的形成过程包括最初血小板与血管壁损伤部位的接触、粘附及随后的活化、伸展和聚集。血小板与血管壁损伤部位的接触由血小板表面糖蛋白复合物 GPIb-IX 与管壁上的 vWF 因子(vonWillebrand facfor)的结合介导。GPIb-IX 或 vWF 的遗传缺陷都可以导致病人凝血机能的障碍,在临床上分别被称为 Bernard-Soulier 综合征(Bernard-Soulier syndrome,BSs)和 von Willebrand 病(von Willebrand’s disease,vWd)。
GPIb 由一两条多肽链通过二硫键连接所组成,两条链分别称为 GPIba(135kDa,CD42b)和 GPIbβ(22kDa,CD42c),GPIb 与另一个糖蛋白分子 GPIX(23kDa,CD42a)按 1:1 的比例通过非共价键结合构成 GPIb-IX 复合物。GPIbα、GPIbβ 和 GPIX 的共同特点是都含有不同数目的由 24 个氨 a 基酸构成的富含亮氨酸糖蛋白的重复序列段(leucine-rech glycoprotein,LRG)。BSs 病人的血小板除缺乏 GPIbα、GPIbβ、GPIX 三种分子外,同时还缺乏另一条称为 GPV 的肽链。GPV 同样含有 LRG 序列,其功能还不清楚。GPIb-IX 复合物与 vWF 结合的部位在 GPIbα 链上,位于其 N 端的第 7 个 LRG 重复序列及近膜部分的富含碳水化合物区域之间(图 2 -15)。vWF 可由血管内皮细胞和血小板合成,单体分子量为 220kDa。血管内皮细胞可向其附着面分泌 vWF,结合于基底膜的胶原纤维。
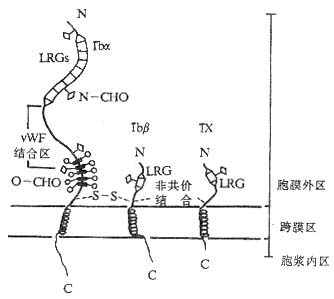
图 2 -15 GPIb-IX 复合物的结构模式图
GPIb-IX 与 vWF 结合的显著特点是切力依赖性(sheardependence),即 GPIb-IX 与 vWF 的结合只有动脉中血液快速流动状态下才会发生,在静脉血液流动缓慢或静止时 GPIb-IX 与 vWF 并不结合,目前对于这种切力依赖性结合发生的机理仍不清楚。
GPIb-IX 与 vWF 的结合导致血小板的活化,使血小板糖蛋白 GPⅡb-Ⅲa(αⅡbβ3)的构型发生改变,得以与血浆中 vWF、FB、FN 等配体结合,构成后续血小板的结合部位,触发血小板的聚集过程。另一种血小板糖蛋白 GPⅠaⅡa(α2β1)可能也参与此过程。
(二)粘附分子与静脉凝血
静脉血栓形成过程中血小板起着较为次要的作用,血栓主要含有红细胞和纤维蛋白,称为红血栓,此过程与 GPIb-IX 和 vWF 的相互作用无关。血小板与血管壁的粘附可能由 GPIaⅡa(α2β1)、GPIcⅡa(α5β1)αvβ3、GPⅡbⅢa(αⅡbβ3)等粘附分子共同介导,上述粘附分子的作用是切力非依赖性的。
七、粘附分子与细胞内信号传导
细胞间或细胞-基质间粘附分子相互作用并不仅限于细胞的粘附和附着,对参与粘附细胞的活化、分化、生长和分泌等也有显着的影响,并有赖于粘附分子将胞外粘附分子相互作用的信号向细胞内的传导。粘附分子所传导的信号可能作为一种辅助因素,协同其它刺激因素的作用,如 α3β1、α4β1、α5β1、α6β1 和 αLβ2 与配体的作用可以协同 TCR/CD3 介导的淋巴细胞增殖和细胞因子产生,提示淋巴细胞与胞外基质的作用可能影响其活化状态。此外单核细胞及中性粒细胞表面 integrin 分子与配体的作用也参与诱导细胞产生炎症因子的过程。
(一)粘附分子与细胞内酪氨酸磷酸化
酪氨酸磷酸化是细胞内信号传导的一个重要途径,而 integrin 分子与某些细胞内的酪氨酸磷酸化发生有关。血小板活化过程伴随着广泛的细胞内蛋白酪氨酸磷酸化,integrin 分子 αⅡbβ3 的表达是血小板内酪氨酸磷酸化过程发生的必要条件,αⅡbβ3 不表达或其与配体的作用被阻断均可阻碍血小板内的酪氨酸磷酸化过程。但 αⅡbβ3 单独作用并不足以引起酪氨酸磷酸化,而只是作为其它刺激活化因素的必要辅助条件。对其它细胞进行的研究结果同样提示 integrin 分子参与细胞内酪氨酸磷酸化的过程,如使 KB 细胞(一种癌细胞系)表达的 α3β1 分子发生交联后可以发现细胞内一种分子量为 115~130kDa 的分子发生酪氨酸磷酸化;NIH3T3 细胞粘附干纤粘蛋白分子或用抗 integrin 抗体刺激,可以导致细胞内一种蛋白发生酪氨磷酸化。
某些细胞(如成纤维细胞、内皮细胞)粘附于纤粘连蛋白后胞浆的 pH 值升高。胞浆中 pH 值升高是 integin 分子与配体作用后向细胞内传导信号的结果,与细胞的伸展和生长有关。
(二)粘附分子与细胞膜磷脂酰肌醇代谢
吞噬细胞表达的 integrin 分子与纤粘连蛋白或层粘连蛋白等配体作用后可以导致细胞吞噬作用的增强,近年来研究表明这一现象与 integin 分子结合配体后影响细胞膜磷脂酰肌醇代谢过程有关。
一种称之为白细胞应答整合素的 integrin 分子(leukocyte response integrin,LRI),与 integrinβ3 存在交叉反应,但不同于已知的任何一种 integrin 分子。LRI 介导的吞噬增强作用可被蛋白激酶 C 抑制剂 H7 和 Staruosporin 所阻断,也可被百日咳毒素、钙离子螯合剂 MAPTAM 及结合磷脂酰肌醇的新霉素所抑制,因此推测 LPI 与配体的作用可能引起 G - 蛋白依赖的磷脂酶 C 的活化,导致细胞内 PKC 的活化和 Ca2+浓度升高。此外还发现一种与 LPI 共沉淀的被称作整合素相关蛋白(integrin associated protein IAP)的 5kDa 分子,可能属于一种多次跨膜细胞表面分子家族。抗 IAP 的抗体可以抑制 LRI 介导的吞噬增强作用,推测 IAP 可能与 LRI 结合配体的亲和力有关或参与 LPI 的信号传导过程。
第四节 可溶性粘附分子
白细胞、血管内皮细胞或其它细胞表面的粘附分子可以被内吞进入细胞,也可以脱落下来,进入血液成为可溶性粘附分子(soluble adhesion molecules,sAM)。此外,某些粘附分子的 mRNA 存在着不同的剪接形式,其中有的 mRNA 翻译后的产物可能不表达在细胞表面,而是直接分泌进入血液,成为可溶性粘附分子的另一个重要来源。除血清外,某些可溶性粘附分子还可在脑脊液、肺胞灌洗液、尿、滑膜液及腹水中出现,反映了局部粘附分子的表达和代谢状况。在结构上,可溶性粘附分子一般缺少其对应膜结合粘附分子的穿膜和胞浆部分,其分子量也比相应膜结合粘附分子为小。由于可溶性粘附分子通常具有粘附分子的结合活性,因此可能作为机体调节细胞粘附作用的一个途径发挥作用。此外某些疾病状态下,粘附分子的表达或脱落增加,可致血清中可溶性粘附分子的水平显著升高,因此要检测可溶性粘附分子的水平可能成为监测某些疾病状态的指征。
很多粘附分子都有其对应的可溶性粘附分子存在,目前已发现的可溶性粘附分子有可溶性 E -selectin、p-selectin、L-selectin、VCAM-1、ICAM-1、CD44 和 NCAM 分子等,本节只就其中一部分要中溶性粘附分子加以介绍。
(一)可溶性 L -selectin、(sL-selectin)
血清中的 sL-selectin 分子有 62kDa 和 75~100kDa 两种,分子量的不同是由糖基化程度的差异造成的,它们分别来自淋巴细胞和中性粒细胞,较其对应的 L -selectin 分子小 3~5kDa。除血清中外,在脑脊液和尿中也发现有 sL-selectin 的存在。L-selectin 分子 mRNA 尚未发现在不同的剪接形式,因此 sL-selectin 的来源主要是细胞表面 L -selectin 分子的脱落。体外致有丝分裂原、PMA 活化的淋巴细胞或中性粒细胞受到 L -8、LPS、fMLP、GM-CSF 刺激后,都可释放 sL-selectin 分子,中性粒细胞上 L -selectin 可能是通过蛋白水解酶的作用使其脱落下来。sL-selectin 分子具有结合活性,与膜结合 L -selectin 分子相比,sL-selectin 分子与配体结合的亲和力烄低,可能 sL-selectin 分子的 EGF 样结构域构型改变有关。体外生理浓度下的 sL-selectin 分子对淋巴细胞与内皮细胞的粘附的抑制率约为 15~20%,在败血症和 HIV 感染患者血清中,sL-selectin 水平比正常人分别高 2 倍和 3 倍,反映了体内白细胞的活化。
(二)可溶性 P -selectin(sP-selectin)
sP-selectin 分子较 P -selectin 分子小 3kDa,在血中以单体形式存在,而膜结合的 P -selectin 是以寡聚体存在。巨核细胞和血管内皮细胞内 P -selectin 分子的 mRNA 存在着不同的剪接形式,其中一种缺少胞浆区 mRNA 编码的蛋白质被分泌到血液中,是血浆中 sP-selectin 的主要来源。血红蛋白尿综合征(haemolytic uremicsyndrome)和血栓性血小板减少性紫癜病人血清中 sP-selectin 水平可显著升高。
(三)可溶性 E -selectin(sE-selectin)
E-selectin 分子在体内的分布非常局限,只表达在活化血管内皮细胞。体外细胞因子活化的培养内皮细胞上清中可以检测到 sE-selectin 分子,内皮细胞在 IL-1、TNF- α 和 LT 等细胞因子活化后,2~3 小时即表达 E -selectin,24 小时内即从胞膜上量脱落下来,成为 sE-selectin,因此血清中 sE-selectin 水平反映了体内血管内皮细胞的活化状态。E-selectin 分子的 mRNA 尚未发现有不同的剪接形式,因此 sE-selectin 的来源是内皮细胞表面 E -selectin 分子的脱落。在肺间质疾病和过敏病人肺泡灌洗液中也可检出 sE-selectin 分子。sE-selectin 分子具有结合活性,在体外可以抑制膜结合 E -selectin 分子介导的白细胞与内皮细胞粘附作用。体内生理状态下 sE-selectin 分子浓度虽未达到可以抑制白细胞与内皮细胞粘附作用的程度,但不能排除体内炎症局部 sE-selectin 分子达到高浓度的可能性。感染、肿瘤、糖尿病等多种疾病患者血液中 sE-selectin 水平高于正常人,其中以脓毒败血症病人最高,可达正常人 23 倍,并与疾病的严重程度和预后相关,sE-selectini 水平持续升高的患者往往死亡率高。
(四)可溶性 ICAM-1(sICAM-1)
血浆中的 sICAM- 1 分子具有膜结合 ICAM- 1 分子胞膜外区的大部分序列,可结合 LFA- 1 分子。由于 ICAM- 1 分子在体内广泛存在,sICAM- 1 的来源也相对较广泛,包括血管内皮细胞、某些肿瘤细胞等。在体外,黑素瘤细胞培养上清中 sICAM- 1 水平明显升高,可抑制 NK 细胞的细胞毒效应,在体内 sICAM- 1 水平升高与黑素瘤病情的发展及其它肿瘤的肝脏转移相平行。在神经系统炎症性疾病患者脑脊液、类风湿关节炎的滑膜积液、卵巢癌病人的腹水、间质性肺疾患病人肺泡灌洗液中都可检测到 sICAM- 1 分子。目前尚未发现有可溶性 ICAM- 2 和 ICAM- 3 分子。
(五)可溶性 VCAM-1(sVCAM-1)
关于 sVCAM- 1 分子的报道较少,已知培养的活化内皮细胞可以释放 sVCAM- 1 分子。sVCAM- 1 分子在 80kDa 和 50kDa 两种形式,其中 80kDa 分子的 N 端与膜结合 VCAM- 1 是相同的。在脑脊液及滑膜液中也可有 sVCAM- 1 分子存在。肿瘤与炎症患者血清中 sVCAM- 1 可高于正常水平,在肾脏移植患者血清中 sVCAM- 1 与肌酸酐小平变化趋势一致,全身性红斑狼疮病人血清中 sVCAM- 1 与其病情活动程度相吻合。
表 2 -9 血浆中可溶性粘附分子水平及其与疾病的关系
| 粘附分子 | 细胞来源 | 正常人水平 | 下列疾病时升高(举例) |
| L-selectin | 白细胞 | 1.6~1.9μ/ml | 败血症、HIV 感染 |
| P-selectin | 血小板、内皮细胞 | 98~262ng/ml | 血红蛋白尿、血栓性血小板减少性紫癜 |
| E-selectin | 内皮细胞 | 9~75ng/ml | 糖尿病、败血病、疟疾、全身性红斑狼疮肾癌、膀胱癌、肾功不全、血管炎、 |
| VCAM-1 | 内皮细胞、上皮细胞、巨噬细胞、树突细胞 | 230~1400ng/ml | 肾癌、膀胱癌、肾功不全、血管炎、类风湿性关节炎、败血症、肾移植后 |
| ICAM-1 | 白细胞、内皮细胞、上皮细胞、肝细胞、平滑肌细胞 | 102~450ng/ml | 肾移植后、败血症、肾功不全、肿瘤转移、白细胞粘附缺陷综合症、溃疡性结肠炎 |
目前对于血清中可溶性粘附分子的检测多采用 ELISA 试剂盒,表 2 - 9 列举了上述 5 种可溶性粘附分子在正常人血浆中浓度的变化范围及某些疾病状态下的变化。不同来源的试剂盒由采用抗体特异性和亲和力的差别、以及标准品不同,所得出的正常值范围有较大差异,因此有必要对这种检测手段加以标准化。值得注意的采用这种方法检测得到的浓度值未必能够准确反映可溶性粘附分子的实际水平,因为可溶性粘附分子除以游离状态存在外,还可以与细胞表面游离的配体结合,用常规的 ELISA 法无法检测结合状态的可溶性粘附分子。此外,对所测得的可溶性粘附分子水平应从粘附分子产生和清除两方面进行分析,产生的增加和清除的减少都可造成可溶性粘附分子血中水平的升高,是两个不同原因所导致的相同结果。
(刘峜 金伯泉)
参考文献
1.Andrew JH,et al.Circulationadhesion molecules in disease.Immunol Today,1993;14(10):506
2.Carlos TM and HarlanJM.Membrane proteins involved in phagocyte adherence to endothelium.ImmunologicalReview,1990;114:5
3.Davis LS,et al.Fibronectinpromotes proliferation of naive and menory t cells by signaling through boththe VLA-4 and VLA-5 integrin molecules.j Immunol,1989;75:206
4.Figdor CG,et al.On the mode ofaction of LFA-1.Immunol Today,1990;11(8):277
5.Hogg N.The leukocyteintegrins,Immunol Today,1989;10(4):111
6.HynesRO.Integrins:versatility,modulation,and signaling in celladhesion.Cell,1992;69:11
7.Kavanough AF,et al.Role ofCD11/CD18 in adhesion and transendothelial migration of T cell.JImmunol,1991;146(12):4149
8.Lipsky PE,etal.Structure,function,and regulation of molecules involved in leukocyteadhesion.Springer-Verlag,1993
9.Picker LJ.Physiological andmolecular mechanisms of lymphocyte homing.Annu Rew Immunol,1992;10:561
10.Rot A.Endothelial cell bindingof NAP-1/IL-8:role in neutrophil emigration.Immunol Today,1992;13(8):291
11.Roth GJ.Platelets and blood vessels:the adhesion event.Immunol Today 1992;13(3):100
12.Smith CW,et al.Chemotactic factorsregulate lectin adhesion molecule 1-dependent neutrophil adhesion to cytokinestimulated endothelial cells in vitro.J Clin Invest 1991;87:609
13.Takeichi M.Cadherins:Amolecular family important in selective cell-cell adhesion.Annu Rew Biochem,1990;59:237
14.Volpes R,et al.Integrin asdifferential cell lineage makers of primary liver tumor.American JPathol,1993;142(5):1483
15. 金顺钱,张伟综述.CD44 的变异性表达和肿瘤转移. 国处医学分子生物学分册,1994;16(2):58
第三章 免疫球蛋白超家族
免疫球蛋白基因的研究近年来获得重大突破。日本学者利根川进(Tonegawa)因在免疫球蛋白基因结构研究有突出贡献而获得 1987 年诺贝尔医学和生理学奖。应用 X 结晶衍射分析、DNA 序列分析和园双色等技术研究表明,许多细胞膜表面分子和机体某些蛋白分子多肽折叠方式与 Lg 相似,在氨基酸组成上与免疫球蛋白可变区(V 区)或 / 和恒定区(C 区)有较高的同源性,它们可能从同一祖先基因(primordial ancestral gene)进化而来。编码这些多肽链的基因称为免疫球蛋白基因超家族(immunoglobulin gene superfamily), 这一基因超家族所编码的产物称为免疫球蛋白超家族(immunoglobulin superfamily,IGSF)。
Ig 超家族中某些成员如 FascilinNeuroglian 和 Amalgam 等分子存在于昆虫中,这表明 Ig 超家族结构域的多样化(diversification)在后生动物(Metazoon)进化早期即开始发生,通过基因的复制(duplication)和随后发生的偏离(divergence)产生了具有不同功能的多功能域结构。
第一节 免疫球蛋白超家族的组成和特点
一、Ig 超家族的组成
由于细胞表面标志、单克隆抗体以及基因工程技术的应用,发现越来越多的膜表面分子和蛋白分子属于 Ig 超家族,主要包括 T 细胞、B 细胞识别抗原受体及其信号转导分子,免疫球蛋白重链和轻链,MHC 抗原及相关分子,免疫球蛋白 Fc 段受体,某些细胞因子受体,与神经系统功能和粘附有关的分子,某些粘附分子和分化抗原等(表 3 -1)。
表 3 -1 免疫球蛋白超家族的组成(举例)
| 成 员 | 分子量(kDa) | Ig 结构域类型 | 人染色体 定 位 | 主要功能 |
| C1 C2 V | ||||
| 识别抗原和信号转导 | ||||
| Igμ 重链 | 4 – 1 | 14q32.33 | 识别抗原 | |
| Igγ 重链 | 52~58 | 3 – 1 | 14q32.33 | 识别抗原 |
| Igδ 重链 | 3 – 1 | 14q32.33 | 识别抗原 | |
| Igε 重连 | 4 – 1 | 14q32.33 | 识别抗原 | |
| Igα 重连 | 52~56 | 3 – 1 | 14q32.33 | 识别抗原 |
| Igκ 重连 | 24 | 1 – 1 | 2p12 | 识别抗原 |
| Igλ 重连 | 24 | 1 – 1 | 22q11.12 | 识别抗原 |
| Ig-α(CD79a) | 47 | (一个 Ig 结构域) | mIg 复合体成分,信号转导 | |
| Ig-β(CD79b) | 37 | (一个 Ig 结构域) | mIg 复合体成分,信号转导 | |
| TCRα 链 | 45~60 | 1 – 1 | 14q11.12 | 识别 MHC/ 多肽复合物 |
| TCRβ 链 | 40~50 | 1 – 1 | 7q32 | 识别 MHC/ 多肽复合物 |
| TCRγ 链 | 45~60 | 1 – 1 | 7p15 | 识别 MHC/ 多肽复合物 |
| TCRδ 链 | 40~60 | 1 – 1 | 14q11.2 | 识别 MHC/ 多肽复合物 |
| TCRγ 链 | 25~28 | – 1 – | 11q23 | TCR 信号传导 |
| TCRδ 链 | 20 | – 1 – | 11q23 | TCR 信号传导 |
| TCRε 链 | 20 | – 1 – | 11q23 | TCR 信号传导 |
续表 1
| 成 员 | 分子量(kDa) | Ig 结构域类型 | 人染色体 定 位 | 主要功能 |
| C1 C2 V | ||||
| MHC 抗原及相关分子 | ||||
| MHCⅠ类抗原 α 链 | 44 | 1 – – | 6p21.3 | α1、α2 结合肽片段,α3 结合 CD8 |
| MHCβ2m | 12 | 1 – – | 15q21-q22 | 稳定 MHCⅠ类分子 α 链 |
| MHCⅡ类抗原 α 链 | 32~34 | 1 – – | 6p21.3 | α1 结合肽片段,α2 结合 CD4 |
| MHCⅡ类抗原 β 链 | 29~32 | 1 – – | 6p21.3 | β1 结合肽片段,β2 结合 CD4 |
| MHCⅡ类抗原 γ 链 | 30 | (属 IGSF) | 参与Ⅱ类抗原功能 | |
| CD1 | 43~49 | 1 – – | 1q22-q23 | TCRγ/ δ 限制成分? |
| Qa/TL 重链 | 48 | 1 – – | (小鼠) | TCRγ/ δ 限制成分? |
| 免疫球蛋白 Fc 段受体 | ||||
| polyIgR | 100 | – 1 4 | 1q31-q42 | 多聚 Ig 受体(肝细胞上 polyIgR 是 HBV 受体) |
| FcγRⅠ(CD64) | 70 | – 3 – | 1q23-q24 | IgG Fc 高亲和力受体 |
| FcγRⅡ(CD32) | 40 | – 2 – | 1q23-q24 | IgG Fc 低亲和力受体 |
| FcγRⅢ(CD16) | 50~70 | – 2 – | 1q23-q24 | IgG Fc 低亲和力受体 |
| FcεRⅠα 链 | 25 | – 2 – | 1q23-q24 | IgE Fc 高亲和力受体 |
| FcαR(CD89) | 60 | – 2 – | (尚未鉴定出) | IgA Fc 受体 |
| 细胞因子受体 | ||||
| M-CSFR(C-fms) | 165 | -4 1 | 5q33.2-q33.3 | 细胞因子受体 |
| (CSF-1R)(CD115) | ||||
| SCFR(C-kit)(CD117) | 145 | -4 1 | 4q31-3 | 细胞因子受体 |
| IL-1RtI(CDw121a) | 82 | – 3 – | 2q12 | 细胞因子受体 |
| IL-1RtⅡ(CDw121b) | 68 | – 3 – | 2q12 | 细胞因子受体 |
| IL-6R(CD126) | 80 | – 1 – | 细胞因子受体 | |
| G-CSFR | 150 | – 1 – | 细胞因子受体 | |
| PDGFR | 180 | – 4 1 | 5q31-q32 | 细胞因子受体 |
| FGFR | 130 | (3 个 Ig 结构域) | 细胞因子受体 | |
| gp130(CDw130) | 130 | (属 IGSF) | 细胞因子受体 | |
| VEGFR | (7 个 Ig 属结构域) | 细胞因子受体 | ||
| 粘附分子和分化抗原 | ||||
| CD2 | 50 | – 2 – | 1p13 | LFA-3(CD58)配体 |
| CD4 | 55 | – 1 2 | 12pter-q12 | 结合 MHCⅡ类抗原 |
| CD7 | 40 | – – 1 | 17q25 | T 细胞活化 |
| CD8α 链 | 34 | – – 1 | 2p12 | 结合 MHCⅠ类抗原 |
| CD8β 链 | 30 | – – 1 | 2p12 | 结合 MHCⅠ类抗原 |
| CD19 | 95 | (2 个 Ig 样结构域) | B 细胞活化 |
续表 2
| 成 员 | 分子量(kDa) | Ig 结构域类型 | 人染色体 定 位 | 主要功能 |
| C1 C2 V | ||||
| CD22(MAG 类似物) | 130/140 | – 5 – | B 细胞粘附 | |
| CD28(同源二聚体) | 90 | – – 1 | 2q33-q34 | T 细胞活化,结合 CD80 |
| CTLA-4(CD28 类同物) | – – 1 | 2q33-q34 | 活化 CTL | |
| PECAM-1(CD31) | 140 | – 6 – | 粘附 | |
| CD33 | 67 | (2 个 Ig 结构域) | 19q13 | 髓样细胞粘附? |
| CD48(blast-1) | 41~45 | – 1 1 | 1q21-q23 | B 细胞粘附,结合 CD2 |
| ICAM-3(CD50) | 124 | – 5 – | LFA- 1 配体 | |
| ICAM-1(CD54) | 80~114 | – 5 – | 1q | LFA- 1 配体(鼻病毒受体) |
| LFA-3(CD58) | 40~65 | – 2 – | 1p13? | CD2 配体 |
| CEA(癌胚抗原)(CD66e) | 175~200 | – 2~6 1 | 19q13.1-q13.2 | 粘附作用? |
| B7/BB1(CD80) | 60 | (2 个 Ig 结构域) | B 细胞活化抗原,结合 CD28 | |
| B7-2(CD86) | 80 | (2 个 Ig 结构域) | 活化 T 细胞,结合 CD28 | |
| Thy-1(CDw90) | 17.5~18.7 | – – 1 | 11q23 | T 细胞活化和粘附 |
| CD96(TACTILE) | 160 | (3 个 Ig 结构域) | T 细胞激活 | |
| ICAM-2(CD102) | 60 | – 2 – | LFA- 1 配体 | |
| VCAM-1(CD106) (血管细胞粘附分子 -1) | 110 | – 7 – | VLA- 4 配体 | |
| MRC OX-2 | 41~47 | – 1 1 | 3 | |
| 妊娠特异性蛋白 | 54~72 | – 3 1 | 19q13.2-13.3 | 粘附作用? |
| α1BgP(血清 α1 胆汁糖蛋白) | 63 | – 5 – | (与 CEA 结构相似) | |
| BMLP(基底膜连接蛋白) | 44.5~48.5 | – – 1 | 粘附 | |
| 脊髓灰质炎病毒受体(PVR)与神经组织细胞粘附及其它功能有关 | 67 | – 2 1 | 19q | V 区与 PV 结合 |
| NCAM(CD56)(神经细胞粘附分子) | 97~220 | – 5 – | 11q23 | 神经细胞粘附 |
| NCAM-L1(神经细胞粘附分子 -L1) | 200 | – 6 – | (小鼠) | 轴索成束和延长,神经元的移行 |
| MAG | 67/72 | – 5 – | (大鼠) | 髓鞘形成中轴索和神经胶质的相互作用 |
| (大鼠髓鞘磷脂相关糖蛋白)外周髓磷脂糖蛋白(po myelin protein) | 28~30 | – – 1 | (大鼠) | 使髓鞘质紧密 |
从表 3 - 1 中可以看出,不同组 Ig 结构域的类型和数目有以下特点:
(1)识别抗原和信号转导组中,Igμ、γ、δ、ε 和 α 重链各含 1 个 V 区,3~4 个 C1 区;Igκ、λ 轻链各含 1 个 V 区和 1 个 C1 区;TCRα、β、γ 和 δ 链各含 1 个 V 区和 1 个 C1 区;CD3γ、δ 和 ε 链只含 1 个 C2 区(CD3ξ 和 η 链结构与 IGSF 无同源性)。
(2)MHC 抗原及相关分子只含 1 个 C1 区,Qa/TL 或 CD1 与 β2m 组成异源二聚体与 MHCⅠ类抗原结构相似,MHCⅠ类分子 α1、α2 结构域,MHCⅡ类分子 α1、β1 结构域具有多态性,但其结构不属于 IGSF。
(3)免疫球蛋白 Fc 受体基因均定位于 1 号染色体,除 polyIgR 外,其余 IgFc 受体的 Ig 结构域为 2~3 个 C2 区。
(4)IL-6Rα 链、gp130 和 G -CSFR 的胞膜外结构除 N 端各含有 1 个 C2 样区外,靠近胞膜侧各有一个红细胞生成素受体超家族结构域,此外,还有 2~4 个纤粘连素结构域。
(5)与神经组织细胞粘附有关的粘附分子中绝大多数含有 5 个或 6 个 C2 区。
二、Ig 超家族的特点
(一)Ig 超家族的结构特点
Ig 超家族成员均含有 1~7 个 Ig 样结构域,每个 Ig 样结构域约含 70~110 个氨基酸残基。其二级结构是两个各含 3~5 个反平行 β 折叠股所形成的 β 片层(anti-parallel β-pleated sheet)平面,每个反平行 β 折叠股由 5~10 个氨基酸残基组成,β 片层内侧的疏水性氨基酸起到稳定 Ig 折叠的作用。大多类结构域内有一个垂直连接两个 β 片层的二硫键,组成二硫键的两个半胱氨酸之间约含 55~75 个氨基酸。少数 Ig 结构域如 CD2、LFA- 3 第 1 个结构域,PDGFR 第 4 个结构域,CD4 第 3 个结构域等缺乏二硫键。肽链这种球形结构的折叠方式称为免疫球蛋白折叠(Ig fold)。
图 3 -1 人 Igλ 轻链多肽的折叠(示意图)
不同 IGSF 分子穿膜区结构差异较大,Thy- 1 缺乏胞浆部分,通过一个 GPI 锚连接在细胞膜上,而 PDGFR 胞浆区含有 543 个氨基酸残基,并具有酪氨酸激酶的结构。除 CD4 第一个结构域和 N -CAM 分子外,Ig 超家族中的一个结构域通常由一个外显子所编码。有些 Ig 超家族成员的基因连锁在一起,如 Thy-1,N-CAM,CD3γ、δ、ε 链的基因在 11q23。Ig Fc 段受体 FcγRⅠ、FcγRⅡ、FcγRⅢ和 FcεRⅠα 链基因在 1q23-q24。
根据 IGSF 结构域中 Ig 折叠方式、两个半胱氨酸之间氨基酸残基的数目以及 IgV 区或 C 区同源性的程度,IGSF 结构域可分为 V 组、C1 组和 C2 组。
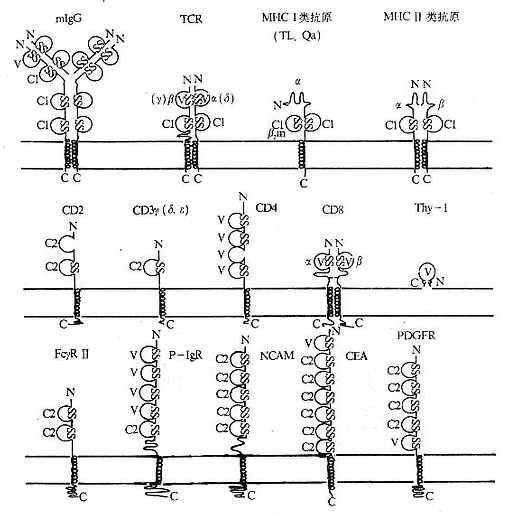
图 3 -2 免疫球蛋白超家族 V 组、C1 组和 C2 组(举例)
1.V 组 V 组结构域的两个半胱氨酸之间含有氨基酸数量较多,约 65~75 个氨基酸残基,2 个 β 片层区共有 9 个反平行 β 折叠股,比 C1、C2 组多一对 β 折叠股。许多 IGSF 分子具有 V 组结构,如 IgH 链和 L 链 V 区,TCRα、β、γ、δ 链 V 区,CD4V 区,CD8α、β 链 V 区,CD28、CTLA-4、CD7、Thy-1、pIgR 和分泌型 IgA 中分泌成分 N 端四个结构域,CEaN 端第一个结构域,M-CSFR、SCFR 和 PDGFR 靠近胞膜的结构域等。
2.C1 组 又称 C 组。C1 组结构域中二个半胱氨酸之间约含 50~60 个氨基酸残基,有 7 个 β 折叠股,如 IgH 链和 L 链 C 区(γ、δ 和 α 链的 C H1~CH 3 或 μ 和 ε 链的 C H1~CH4),TCRα、β、γ、δ 链 C 区,MHCⅠ类分子重链 α3 结构域,β2m、MHCⅡ类分子 α2 和 β2 结构域,CD1、Qa 和 TL 分子靠近胞膜结构域等。
3.C2 组 又称 H 组。C2 组结构域的氨基酸排列类似 V 组,但形成二硫键的两个半胱氨酸之间所含氨基酸残基数约为 50~60,有 7 个 β 折叠股,这种结构介于 V 组和 C1 组之间,如 CD3γ、δ 和 ε 链,CD2 和 LFA-3(CD58),pIgR 靠近胞膜结构域,FcγRⅠ、FcγRⅡ、FcγRⅢ、FcεRⅠα 链、FcαR、ICAM-1,CEA 第 2 至 7 个结构域,IL-6R、M-CSFR、G-CSFR、M-MAG、SCFR、PDGFR 第 1 至 4 个结构域,与神经系统相关的分子 N -CAM、N-CAM-L1、MAG、Po、F3、NILE、TAG1 等以及 CD22、CD48、α1-BgP 分子等。某此 IgH 链中 C H 2 和 C H 3 可有 8 个 β 折叠,在这种情况下,其中一个 β 折叠股只有 3 个氨基酸残基。
在 V、C1 和 C2 三组中,有些 Ig 超家族成员之间的同源性要大于该组中平均的类似程度,如在 V 组中 IgV、TCR-V、和 CD8V 结构域;C1 组中 IgC、TCR-C、MHC- C 结构域;C2 组中 CD2 和 LFA-3,NCAM、NCAM-L1 和 MAG,PDGFR、M-CSFR 和 SCFR,这些同源性较高的成员它们的功能往往也很相似。
(二)Ig 超家族的功能特点
Ig 超家族的功能是以识别为基础,因此又称为识别球蛋白超家族(cognoglobulin superfamily)。Ig 折叠形成一个紧密的球状结构,提供了与不同球状结构多肽或化学基团粘附的部位,使之获得不同的生物学功能。IGSF 很可能最早起源于原始的具有粘附功能的基因,通过复制和突变衍生形成了识别抗原、细胞因子受体、IgFc 段受体、细胞间粘附分子以及病毒受体等不同的结构域。IGSF 识别的基本方式有以下几种。
1.IGSF 和 IGSF 相互识别 IGSF 分子相互识别中有嗜同种的相互作用和异嗜性相互作用两种形式。(1)嗜同种的相互作用(homophilic interaction):如相同神经细胞粘附分子(NCAM)之间的相互识别,血小板内皮细胞粘附分子 -1(PECAM-1,CD31)的相互识别。(2)异嗜性相互作用(heterophilic interaction),如 CD2 与 LFA-3,CD4 与 MHC Ⅱ类分子的单态部分(α2 和 β2),CD8 与 MHCⅠ类分子的单态部分(α3),PolyIgR 与多聚 Ig,FcγRⅠ(CD64)、FcγRⅡ(CD32)、FcγRⅢ(CD16)与 Ig Fc 段,FcεRⅠ与 IgE Fc 段,FcαR(CD89)与 IgA Fc 段,CD28 与 B7/BB1(CD80)等之间的相互识别。
2.IGSF 和 integrin 相互识别 如 ICAM-1(CD54)、ICAM-2(CD102)、ICAM-3(CD50)与 LFA-1(CD11a/CD18),VCAM-1(CD106)与 VLA-4(CD49d/CD29)之间的相互作用。
3.IGSF 和其它分子的相互识别 包括 TCR 识别 MHCⅠ类或Ⅱ类分子与抗原复全物,细胞因子受体识别细胞因子等。
三、CD、粘附分子与 Ig 超家族的关系
免疫分子的命名根据不同的角度往往有不同的归类和命名,图 3 - 3 归纳了人白细胞分化抗原(CD)、粘附分子(AM)、免疫球蛋白超家族(IGSF)、细胞因子受体(CKR)、补体受体(CR)以及主要组织兼容性复合体抗原(MHC)等免疫分子命名的相互关系。
(1)A 表示 CD 命名范围中的粘附分子,如 CD49a/CD29、CD49b/CD29、CD49c/CD29、CD49d/CD29、CD49e/CD29、CD49f/CD29、CD51/CD29、CD11a/CD18、CD11b/CD18、CD11c/CD18、CD41/CD61、CD51/CD61、CD49f/CD104、CD2、CD4、CD8、CD28、CD31、CD50、CD54、CD56、CD58、CD80、CD102、CD106、CD62L、CD62P、CD62E、CD15、CD15s、CD44 等。
(2)B 表示 CD 命名范围中属 IGSF 结构的分子,如 CD79a、CD79b、CD1、CD64、CD32、CD16、CD115、CD117、CDw121a、CDw121b、CD126、CDw130、CD2、CD4、CD7、CD8、CD19、CD28、CD31、CD48、CD50、CD54、CD58、CD66e、CD80、CDw90、CD96、CD102、CD106、CD56 等。
(3)C 表示粘附分子中属 IGSF 结构的分子,无 CD 编号,如 MHCⅠ类和Ⅱ类分子。
(4)D 表示 CD 命名范围中,具有粘附功能且属于 IGSF 结构的分子,如 CD2、CD4、CD8、CD28、CD31、CD50、CD54、CD56、CD58、CD80、CD102、CD106 等。
(5)有 CD 命名的 CR 有 CR1(CD35)、CR2(CD21)、CR3(CD11b/CD18)、CR4(CD11c/CD18)和 C5aR(CD88),其中 CR3 和 CR4 属于粘附分子中整合素超家族成员。
(6)有 CD 编号的 CKR 有 CD115~CDw130;属于 IGSF 结构的 CKR 有 CD115、CD117、CDw121a、CDw121b、CD126、CDw130、G-CSFR、PDGFR 和 VEGFR 等。
图 3 -3 免疫分子命名的相互关系
第二节 免疫球蛋白基因的结构和多样性
表 3 -2 免疫球蛋白基因定位
| 编码多肽链 | 基因符号(人) | 基因定位(染色体) | |
| 人 | 小鼠 | ||
| κ 轻链 | IGK | 2p11 | 6 |
| λ 轻链 | IGL | 22q11 | 16 |
| H 重链 | IGH | 14q32.3 | 12 |
免疫球蛋白(Ig)的分子由 IGK、IGL 和 IGH 基因编码。IGK、IGL 和 IGH 基因定位于不同的染色体(表 3 -2)。编码一条 Ig 多肽链的基因是由胚系中数个分隔开的 DNA 片段(基因片段)经重排而形成。1965 年 Dreyer 和 Bennet 首先提出假说,认为 Ig 的 V 区和 C 区由分隔存在的基因所编码,在淋巴细胞发育过程中这两个基因发生易位而重排在一起。1976 年 Hozumi 和 Tonegawa 应用 DNA 重组技术证实了这一假说。
一、Ig 重链基因的结构和重排
Ig 重链基因是由 V、D、J 和 C 四种不同基因片段所组成。
(一)Ig 重链可变区(V 区)基因
重链可变区基因是由 V、D、J 三种基因片段经重排后所形成。
1. 重链 V 区基因的组成 编码重链 V 区基因长约 1000~2000kb,包括 V、D、J 三组基因片段。
(1)重链 V 基因片段:小鼠 V H基因片段数目为 250~1000 个。根据 V H基因片段核酸序列的相似性(>80% 同源性),至少可分为 11 个家族(family). 人 V 基因片段约为 100 个,至少可分为 6 个家族,每个家族含有 2~60 个成员不等。V 基因片段由 2 个编码区(codingregions)组成:第一个编码区编码大部分信号序列;第二个编码区编码信号序列羧基端侧的 4 个氨基酸残基和可变区约 98 个氨基酸残基,包括互补决定区 1 和 2(complementarity determining region 1 和 2,CDR1 和 CDR2)。
(2)重链 D 基因片段:D(diversity)是指多样性。DH基因片段仅存在于重链基因中而不存在于轻链基因。D 基因片段编码重链 V 区大部分 CDR3。小鼠 D H共有 12 个片段,位于 V H和 J H基因片段之间,大部分 D H片段较为集中,约占 60~80kb,但靠上游的 D H可能位于 V H区域内,最后一个 D H片段与 J H基因 5 ’ 端相距约 0.7kb。人类 D H片段可能有 10~20 个左右。
(3)重链的 J 基因片段:J(joining)指连接,是连接 V 和 C 基因片段。JH编码约 15~17 个氨基酸残基,包括重链 V 区 CDR3 除 D H编码外的其余部分和第 4 骨架区。小鼠 J H基因片段有 4 个,与 Cμ 相距约 6.5kb。人有 9 个 J H,其中 6 个是有功能的 J H基因片段。
V、D、J 基因片段经重组连接在一起,组成 2 个外显子,一个外显子编码信号序列的大部分,另一个外显子编码信号序列的其余部分和重链可变区。
小鼠和人在胚系中 Ig 基因的结构见图 3 - 4 和图 3 -5。
2. 重链可变区基因的移位 在重链基因重排开始时,二条染色体上都发生 D 基因片段移位到 J 基因片段而发生 D - J 基因连接。在此以后,只有其中一条染色体上的 V 基因片段与 D - J 基因片段连接。VH基因片段 5 ’ 端含有启动子(promoter),JH和 C μ基因片段之间的内含子中含有转录增强子(transcriptinalenhancer)。如果一条染色体 V H基因与 D - J 基因重排无效(non-productive),另一条染色体的 V H基因片段开始发生移位,与 D - J 基因片段连接。
某些与 Ig 基因片段重排有关的特殊序列称为识别序列(recognition sequences),位于 V 基因片段的 3 ’ 端与 J 基因片段的 5 ’ 端之间以及 D 基因片段的两侧。V 基因片段 3 ’ 端、J 基因片段 5 ’ 端以及 D 基因片段的两侧也是 DNA 重排识别信号所在区域,这些识别信号包括三部分:(1)高度保守的回文结构的七聚体(palindromic heptamer);(2)较少保守、富含 A / T 的九聚体(nonamer);(3)七聚体和九聚体之间不保守的间隔序列(spacer sequence),含有 12±1 碱基对或 23±1 碱基对。根据 12/23 碱基对间隔规则(或称 1 圈 / 2 圈定律),两个基因片段的重组仅发生在两个基因片段之间:各有一个 12 个碱基对片段和一个 23 个碱基对片段的结构(图 3 -6)。
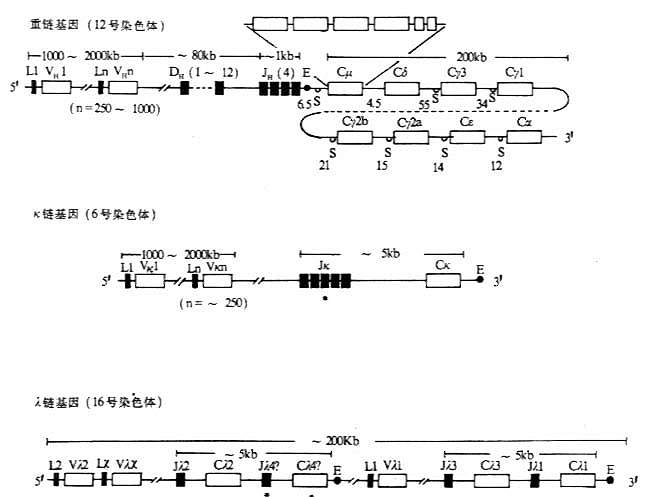
图 3 -4 小鼠 Ig 基因结构
注:(1)L:先导序列基因片段 V:可变区基因片段 D:D 基因片段
J:J 基因片段 C:恒定区基因片段 E:转录增强子
S:转换区 *:假基因
(2)内含子区域所标数字表示 DNA 长度(kb)。
(3)每个 C H基因用一个方框表示,实际上包括几个外显子,如 C μ含有 6 个外显子。
(4)λ 基因增强子位于 Cλ4 和 Cλ1 基因片段的下游。
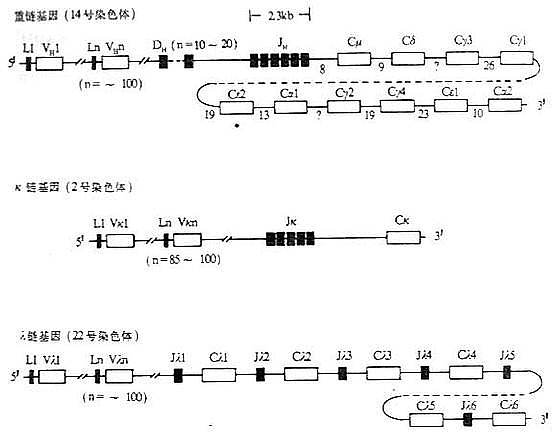
图 3 -5 人 Ig 基因结构
注:(1)L:先导序列基因片段 V:可变区基因片段 D:D 基因片段
J:J 基因片段 C:恒定区基因片 *:假基因
(2)内含子区域所标数字表示 DNA 长度(kb)
(3)每个 C H基因用一个方框表示,实际上包括几个外显子
参与 V /(D)/ J 基因重组过程的酶称为 V /(D)/ J 重组酶(recombinase), 有关于执行识别、切割和重新连接基因片段重组酶的纯化和鉴定工作还刚开始。重组酶实际上包括重组过程中多种酶的活性。最近在前 B 细胞(pre-b cell)中已经鉴定出两种刺激 Ig 基因重排的基因,称为重组激活基因 1(recombinationactivating gene 1,RAG-1)和重组激活基因 2(RAG-2),其确切的作用机理还不太清楚。重组酶作用的特点是:(1)淋巴细胞特异性的,非淋巴样细胞如成纤维细胞无重组酶活性,这可能解释了 Ig 基因的重排仅见于 B 淋巴细胞。目前一般认为 T 细胞 TCR 基因重排中的重组酶与 B 细胞中重组酶相同或相似。(2)重组酶发挥其功能仅限于 B 细胞发育早期,未成熟 B 细胞如前 B 细胞(pre-b cell)细胞系重组酶活性很高,但抗体生成细胞或骨髓瘤细胞无明显重组酶活性,因此时 B 细胞已经分泌某一特异性抗体,不再发生重排其它的 Ig 基因,因此也不会改变原先所产生抗体的特异性。转换重组酶(switch recom-binase)可能与 VDJ 重组酶(VDJ recombinase)相似,但缺乏七聚体 / 九聚体(heptamer/nonamer)识别蛋白。重组酶功能异常可导致机体不能产生 Ig 和 TCR,很可能与重症联合免疫缺陷 (severe combinedimmunodeficiency,SCID) 的发生有关。例如 SCID 小鼠 16 号染色体着丝点末端存在一个 scid 基因,为单基因常染色体遗传基因。scid 基因纯合将影响 DNA 重组酶的识别功能,在 TCR 或 BCR 基因片段重排时不能识别正确的位点,使 T 细胞、B 细胞在淋巴干细胞发育早期即夭折,导致重症联合免疫缺陷。
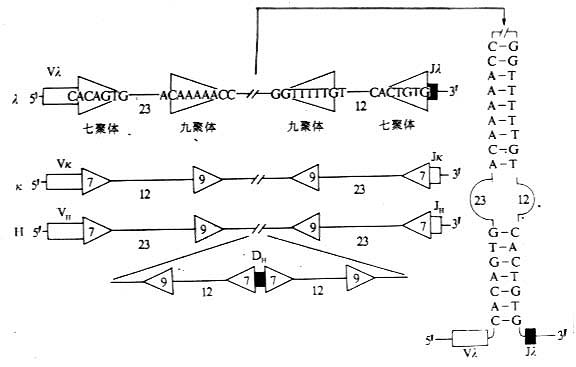
图 3 -6 参与 Ig 基因重排组酶识别的 DNA 序列
(二)Ig 重链恒定区(C 区)基因
1. 重链 C 基因片段 重链恒定区基因由多个外显子组成,位于 J 基因片段的下游,至少相隔 1.3kb。每 1 个外显子编码 1 个结构域(domain),铰链区(hinge region)是由单独的外显子所编码,但 α 重链的铰链区是由 C H 2 外显子的 5 ’ 端所编码。大多分泌的 Ig 重链羧基端片段或称尾端“tail piece”是由最后一个 C H外显子的 3 ’ 端所编码,而 δ 链的“tailpiece”是由一个单独的外显子所编码。小鼠 C H基因约占 2000kb,其外显子从 5 ’ 端到 3 ’ 排列的顺序是 Cμ-Cδ-Cγ3-Cγ1-Cγ2b-Cγ2a-Cε-Cα。人 C H基因外显子排列的顺序是 Cμ-Cδ-Cγ3-Cγ1-Cε2(pseudo 基因)Cα1-Cγ2-Cγ4-Cε1-Cα2。其中基因片段 Cγ3-Cγ1-Cε2-Cα1 和基因片段 Cγ2-Cγ4-Cε1-Cα2 可能是一个片段经过一次复制而得,为研究 C H基因的起源和进化提供有用的依据。
2. 免疫球蛋白类型转换 1964 年 Nossal 等发现 B 淋巴细胞存在着类型的转换。Ig 类型转换(class switch)或称同种型转换(isotype switch)是指一个 B 淋巴细胞克隆在分化过程中 V H基因片段保持不变,而发生 C H基因节段的重排、比较 C H基因片段重排后基因编码的产物,V 区相同而 C 区不同,即识别抗原特异性不变,而类或亚类发生改变。这种类型转换在无明显诱因下可自发产生。
局部微环境和细胞因子可影响和调节免疫球蛋白类型的转换,如在肠道派伊尔氏结的 B 细胞 V 基因片段优先转换到 Cα1 进行重排,因此主要合成和分泌 IgA。在体外向经 LPS 刺激的小鼠 B 细胞中加入 IL-4,可促进 B 细胞产生 IgG1 和 IgE,抑制 IgG2b 产生;低浓度的 IL- 4 主要诱导产生 IgG1,高浓度 IL- 4 主要诱导产生 IgE。面 IFN- γ 则诱导小鼠 B 细胞合成 IgG2a,抑制 IgE 的产生。TGF-β、IL- 5 和 IL- 6 对 IgA 的产生具有促进作用(表 3 -3)。细胞因子调节 B 细胞 Ig 类别转换的机理可能是:(1)刺激某些细胞的克隆选择性的增殖,使分泌某特定类、亚类抗体的克隆细胞增加,如 IL-5、IL- 6 促进 IgA。产生除通过同种型转换进行调节外,还可选择性促进 IgA 定向细胞分化增殖为 IgA 分泌细胞。(2)通过诱导特定位置上两个转换区的重组,诱导 B 细胞由分泌 IgM 向某一同种型 Ig 转换。如高浓度 IL- 4 促进 LPS 诱导小鼠 B 细胞产生 IgE,主要是使 Cε 转换区与重组酶的接近(accessibility), 通过同种型转换促进 IgE 的产生。
表 3 -3 细胞因子对 LPS 诱导的 Ig 类和
亚类转换的调节作用(占总 Ig%)
| 细胞因子 | IgM | IgG1 | IgG2a | IgE | IgA |
| 对照(不加外源性细胞因子) | 85 | 2 | <1 | <1 | <1 |
| IL-4 | 70 | 20 | <1 | 5 | <1 |
| IFN-γ | 80 | 2 | 10 | <1 | <1 |
| THF- β 和 IL-2 | 75 | 2 | <1 | <1 | 15 |
注:(1)纯化的小鼠 IgM+IgD+ B 细胞体外培养时,加入不同的细胞因子和 LPS,然后检 LPS,然后检测不同类或亚类免疫球蛋白的百分比。
(2)由于未检测所有类和亚类 Ig,所以每组 Ig 总百分比不到或接近 100%。
Ig 类型转换可能通过以下两种机理。
(1)缺失模型(deletion model): 又称 linear orderly deletiom ofH chain genes。以小鼠 C H基因为例,如 Cμ 和 Cδ 基因片段被缺失,那么先前重排的 VDJ 就会按照顺序与下一个 C H基因即 Cγ3 发生重排,经转录和翻译后,编码 γ3 重链;如缺失所有的 γ 链亚类基因,依次会产生 ε 链。上述模型在被刺激后小鼠 B 细胞在体外培养中产生 Ig 类别的顺序得到证实,即先产生 IgM,然后依次产生 IgG3 和 IgG1 等。但这个模型不能解释免疫动物或抗原刺激 B 细胞培养中单个 B 细胞可同时表达几种不同类或亚类的重链。
(2)RNA 的不同剪接:除 DNA 水平的 Ig 类型转换形成外,RNA 水平的不同剪接(alternative RNA splicing)也可产生不同的 Ig 类型。Cμ 和 Cδ 基因片段之间无 S 区,IgM 和 IgD 共表达的 B 细胞系 DNA 分析表明,Cμ 和 Cδ 基因片段没有发生重排,相同的 V H出现在 μ 或 δ 链的 mRNA 上,表明它们可能有一个共同的 mRNA 前体,通过不同的或差异剪接(differential splicing)分别形成 μ 链和 δ 链 mRNA。初级 RNA 转录本(primary RNa transcript)是由 VDJ 复合体连接 Cμ 和 Cδ 基因片段经转录后形成。如果在剪接过程中切除初级 RNA 转录本中的 Cδ 部分,经加工后形成 μmRNA;如去除初级 RNA 转录本中的 Cμ 部分,则加工后形成 δmRNA。这两种 mRNA 分别被翻译,使单个 B 细胞同时产生 μ 和 δ 链,同时表达 IgM 和 IgD。同样的机理可从一条长的 primary RNA 转录本中加工为 μmRNA 和 εmRNA(或其它重链 mRNA),同时表达 IgM、IgE 或其它类 Ig。
图 3 -7 Ig 类型转换缺失模型
(三)膜表面 Ig 重链基因
膜表面 Ig(mIg)重链基因的外显子结构与分泌性 Ig 重链的基因外显子结构基本相同,但在基因组的 3 ’ 端有所不同。作为识别抗原受体的 mIg,其重链羧基端有一段疏水性氨基酸插入到胞膜双层脂质中,mIg 重链的转录本要比分泌性重链转录本多 1~2 个外显子,与分泌性重链基因最后一个外显子至少相隔 1.4kb, 这 1~2 个外显子编码重链的羧基端部分,这部分氨基酸残基的数目视重链不同而有所差异,如鼠或人 mIgμ 链的这一部分约为 41 个氨基酸残基,而鼠 mIgε 链这部分却有 72 个氨基酸残基。这个区域可分为三个部分:(1)一个酸性间隔子,靠氨基端侧,与最后一个 C H结构域相连,位于细胞膜外侧;(2)跨膜部分,由 26 个不带电荷的疏水氨基酸形成一个 α 螺旋,穿过胞膜的脂质双层;(3)胞浆内羧基端部分,3~28 个氨基酸残基不等,可能与信号传递有关。
图 3 -8 RNA 的差异拼接与 IgM 和 IgD 共同表达在一个 B 细胞上
分泌形式的 μ、α 和 δ 重链最后一个结构域后有一段额外延长的由带电荷氨基酸组成的序列,称为尾片(tail pieces),约含 20 个氨基酸,在 IgM 和 IgA 分子中,单体 Ig 尾片通过二硫键相互连接或与 J 链形成二聚体或多聚体。分泌形式 μ 链的 mRNA 含有 V、D、J、Cμ1、Cμ2、Cμ3、Cμ 4 和 C μ43’ 端一个小的外显子转录区。
Ig 重链基因除 L、V、D、J 和 C 基因片段外,在内含子中还有一些与 mRNA 转录和免疫球蛋白类的转换有关的结构。
(1)插入顺序(intervening sepuence,IS):有 IS1、IS2、IS3……等。
(2)转换区序列:即 S 区(switch region)。除 Cδ 外,各个恒定区基因片段上游都有一个同源重复序列的 S 区,约占 2~10kb,分别命名为 Sμ、Sγ、Sα 和 Sε 等,与 Ig 类和亚类的转换有关。S 区含有众多串联的高度保守的 DNA 重复序列,每个重复序列可长到 52bp,其确切的功能还不清楚。如 Sμ 的结构为[(GAGCT)nGGGGT]m,n 一般为 2~5,但有时可达 17,m 可达 150。目前关于 H 链转换区的研究主要以小鼠为模型,如 4 个 Sγ 是由 49bp 长的基序的重复序列所组成。Sα 至少由长为 80pb 的 15 个重复序列,Sε 的重复序列长为 60bp。在小鼠,B 淋巴细胞经 T 细胞非依赖性活化后常发生 Sμ/Sγ3 和 Sμ/Sγ2b 的重组,因此在无 T 细胞存在条件下,LPS 活化小鼠 B 细胞成为淋巴母细胞,主要转换 Ig 的亚类为 IgG3 和 IgG2b。
(3)启动子:靠近每个 V 基因转录位点的上游,含有 TATA 盒,控制 RNA 多聚酶Ⅱ作用下的转录过程。大多数 Ig 的启动子含有许多 DNA 序列,包括一个保守的 8 个核苷酸序列,可能是核 DNA 结合蛋白(nuclear DNA-binding proteins)结合部位,在转录过程中起着重要作用。由于核 DNA 结合蛋白是由其它基因所编码,因此这种作用方式被称为反式作用(transacting).
图 3 -9 膜表面和分泌的 Igμ 基因及 μ 链羧基端结构的比较
注:(a)初级 RNA 转录本通过不同的剪接加工,分别形成分泌型 μmRNA 和膜型 μmRNA。
(b)苏氨酸(T)为 Cμ4 第 556 位氨基酸。膜表面 μ 重链的 556 氨基酸后还有 41 个氨基酸,其中富含带负电氨基酸胞膜外区 12 个氨基酸,26 个疏水性氨基酸组成的穿膜区以及胞浆区 3 个氨基酸;分泌型 μ 重链在 556 位氨基酸后有 20 个氨基酸组成的尾片,C 末端倒数第二个为半胱氨酸。
(4)增强子(E):在人和小鼠和重链和 κ 轻链中发现有增强子,其核苷酸序列为 TGGTAAG。在 H 链基因中,增强子位于 J H3’ 端侧。当 H 链 VDJ 或 κ 链 VJ 重排后,V 基因上游的启动子靠近增强子,使 V(D)JC 基因重排后开始更为有效的转录。增强子作用方式与启动子不同,呈方向非依赖方式(orientation-independent manner), 即增强子可作用于被转录基因的上游或下游。此外,增强子的作用是细胞特异性。
已重排 Ig 基因的转录起始于 TATA 盒下游约 20 核苷酸处,转录至 C 基因后,产生初级 RNA(primary RNA)转录本,在 3 ’ 端切断后进行多聚腺苷酸化(polyadenylation), 剪接掉不编码的内容含子,如 J 区与 C 区之间的不编码序列是在 RNA 水平上被剪接掉。
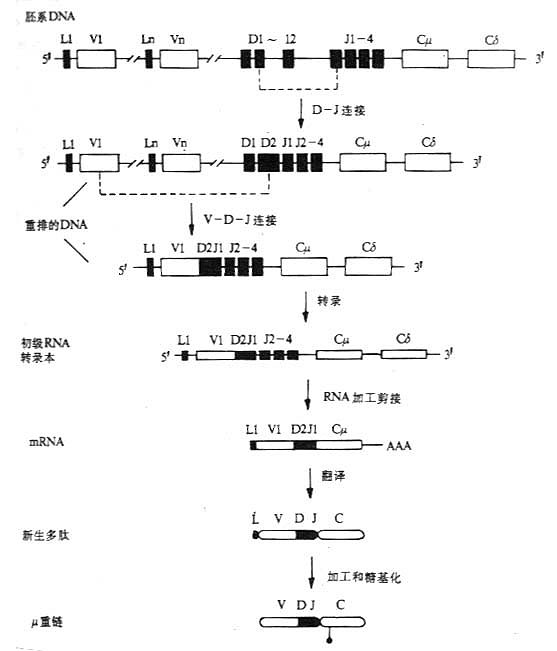
图 3 -10 小鼠 μ 链的基因重排顺序、转录和合成
(四)重链基因重排、转录和多肽链的合成。
以 μ 链基因的重排顺序、转录和 μ 链合成为例,见图 3 -10。
二、Ig 轻链基因的结构和重排
在 Ig 重链基因重排后,轻链的可变区基因片段随之发生重排,V 与 J 基因片段并列在一起。κ 轻链基因先发生重排,如果 κ 基因重排无效,随即发生 λ 基因的重排。
(一)κ 链基因的结构和重排
在小鼠,Vκ 基因片段约有 250 个,间隔距离平均为 10~12kb;Jκ 有 5 个,其中 4 个有功能:Cκ 只有 1 个。在人类,Vκ 基因片段约有 85~100 个,编码 V 区氨基端的 1~95 位氨基酸,包括 CDR1、CDR2 和部分 CDR3。根据 DNA 相似性程度,Vκ 可分为 16 个组。在胚系 DNA 水平上,Vκ 基因片段分散约占 2000kb 之长,占人 2 号染色体长度的百分之一左右。Jκ 基因片段有 5 个,编码第 96~108 氨基酸。Jκ 与最后一个 Vκ 基因片段的 3′端相距为 23kb,但与 Cκ 外显子靠得较近。Cκ 也只有 1 个,编码 C 区(109~214 氨基酸),所有 κ 轻链具有同一结构的 C 区。人和鼠 Cκ 距最后一个 Jκ 基因片段约 2.5kb。Vκ 与 Cκ 之间以随机的方式发生重组连接。人 κ 轻链 V 基因的排列多样性约为 100Vκ×5Jκ=500。
(二)λ 链基因的结构和重排
小鼠 Igλ 轻链基因结构见表 3 -4。在大多数近交系小鼠中,有 4 个 J λ和 4 个 C λ,根据其在胚系 DNA 上的分布位置可分为两组(cluster):Jλ2Cλ2Jλ4Cλ4(C2-C4 组)和 J λ3Cλ3Jλ1Cλ1(C3-C1 组),每组基因片段长约为 5kb。
表 3 -4 λ 链基因结构和编码的氨基酸
| 分类 | 名称 | 在基因片段中的位置 | 编码氨基酸在轻链中的位置 | 编码氨基酸数 |
| 先导序列基因片段 | ||||
| L1 | 基因组 5′端 | 第 -19~- 5 先导肽段 | 15 | |
| 外显子 | L2 | 紧接 V 基因 5′端 | 第 -4~- 1 先导肽段 | 4 |
| V 基因片段 | L2 的 3′端 | V 区 1~96 或 98 | 96 或 98 | |
| J 基因片段 | V 基因片段 3′端 | V 区 97 或 99~112 | 14 或 16 | |
| C 基因片段 | J 基因片段 3′端 | C 区 113~214 | 102 | |
| 内含子 | IS1 | 在 L1 与 L2 之间 | 93 bp | (不编码) |
| IS2 | J 与 C 之间 | 1205 bp | (不编码) | |
λ 基因组中共含有 V λ1、Vλ 2 和 V λx3 个 V λ基因片段,Vλ 2 与“C2-C4 组”(Jλ2Cλ2Jλ4Cλ4)的 5′端相距 73kb;Vλ 1 与“C3-C1 组”(Jλ3Cλ3Jλ1Cλ1)相距 19kb;VλX与 V λ23′端相距 19kb;Vλ重因片段与 J λ、Cλ基因片段的连接并不完全随机,Vλ 1 与 J λ 3 或 J1 重排,组成 V λ1Jλ3Cλ 3 基因或 V λ1Jλ1Cλ 1 基因,而 V λ 2 似乎只与 J λ 2 重排组成 V λ2Jλ2Cλ 2 基因,偶尔可见 V λ 2 与 J λ 3 或 J λ 1 重排,分别组成 V λ2Jλ3Cλ 3 基因和 V λ2Jλ1Cλ 1 基因。Jλ4、Cλ 4 不具备功能。目前尚未发现 V λ 1 与 J λ 2 重排。VλX只发现与 J λ 2 重排。
在人类,λ 基因位于第 22 号染色体,Vλ约有 100 个,不同亚型含 C λ数量在 6~9 个之间,每个 C λ与各自的 J λ基因片段相邻。λ 轻链的转录过程是某一个 V λ基因片段与某一个 J λ片段连接成 V λ/Jλ外显子,然后与邻近 C λ基因片段重组转录为初级 mRNA,再通过 mRNA 的剪接、翻译及修饰,成为成熟的 λ 轻链。
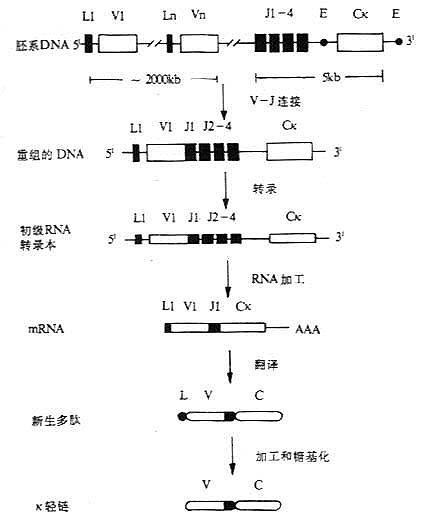
图 3 -11 小鼠 κ 轻链基因重排顺序、转录和合成
三、免疫球蛋白基因表达的调节
(一)核因子对 Ig 基因转录的调节作用
Ig 基因转录活性是由两个顺式作用组件(cis-acting elements)即启动子(promoter,P)和增强子(enhancer,E)来调节。而启动子和增强子的功能又由反式作用的核因子(trans-acting nuclear factor)所控制。这些核因子也称为 DNA 结合蛋白(DNA-binding proteins,DBP),结合到启动子或增强子内特异的核苷酸序列,从而抑制或刺激启动子和增强子的活性。许多种类细胞受到某些刺激后可诱导或活化特定的 DBP。
1.ATGCAAAT 序列及其核因子 Ig 重链启动子含有 8 个保守的核苷酸序列 ATGCAAAT,这个序列也存在于 κ 轻链的启动子、重链增强子以及许多非 Ig 的启动子中。B 细胞 Ig 基因的转录依赖于启动子中这一完整的 ATGCAAAT 序列的存在。哺乳动物细胞中至少存在三种特异性结合 ATGCAAAT 的蛋白质,即 Oct1、Oct2(OTF2A)和 OTF2B。Oct1 又称 OTF1(octamer transcription factor 1), 广泛存在于哺乳动物的细胞中;OTF2A 和 OTF2B 为淋巴细胞特异性,活化 Ig 基因的转录。
2.GGGACTTTCC 序列和 NF-κB 小鼠 κ 链增强子含有 GGGACTTTCC10bp 的序列,是一种称之为 NF-κB(nuclearfactor of kappa B)DNA 结合蛋白结合的靶序列。
(1)NF-κB 结合靶序列的分布:NF-κB 结合的 DNA 序列也存在于许多其它淋巴细胞、非淋巴细胞、病毒基因增强子和启动子以及 HIV- 1 的长未端重复序列中,如某些 MHCⅠ类基因,IL-2Rα 链,TCRβ 链,IL-2、IL-3、IL-6、IFN-α、IFN-β、IFN 调节因子、GM-CSF、SV40 基因等。在不转录 κ 基因的前 B 细胞(pre-b cell)系中无 NF-κB 活性,这些细胞用 LPS 处理后可诱导出有功能的 NF-κB,随之也刺激 κ 链基因的转录。
(2)NF-κB 结构及作用特点:NF-κB 是一个异源四聚体复合物,包含两个与 DNA 结合的 50kDa 多肽和两个不与 DNA 直接结合的 65kDa 多肽链 NF-κB 解离常数在 10-12~10-13 M 之间,这种高亲和力是它发挥功能所必需的。在大多数细胞系中由于抑制因子 IκB 与 p65 的偶联作用,使整个 NF-κB 分子以无活性的形式存在于细胞质内。IκB 由于磷酸化(如 PKC 作用)或其它的修饰作用丧失功能,从 NF-κB/IκB 复合物上解离下来,洲离的 NF-κB 随即进入细胞核,结合靶基因的特定序列,从而激活这一基因的转录反应。如抗原结合到 B 细胞 mIg 后刺激 B 细胞内 PKC 活化。LPS 也可活化 PKC。NF-κB 在有效合成 κ 链的骨髓瘤细胞中是无活性或是缺乏的,提示 NF-κB 和 κ 链基因的增强子在 B 细胞分化早期对于起始 κ 基因转录是需要的,但对于分化后期维持转录过程中并不是必需的。
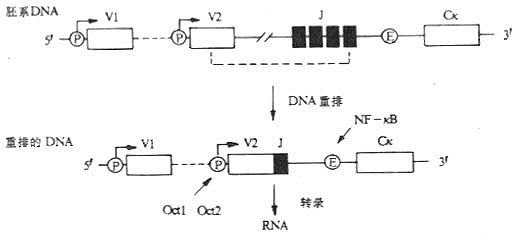
图 3 -12 免疫球蛋白基因转录的调节
注:VDJ 重排使启动子(P)靠近位于 Jκ 和 Cκ 之间的增强子,增加了已重排 V2 基因的转录水平,DNA 结合蛋白 NF-κB 结合到增强子内靶序列,Oct1、Oct2 可结合到启动子上。
(二)等位基因排斥现象
免疫球蛋白基因表达中一个重要的发现是等位基因排斥现象(allelic exclusion)。编码人 Ig 重链基因位于第 14 对染色体上,在 B 细胞发育过程中,这一对同源染色体中仅有一条染色体 Ig 基因得到表达。例如一个人 B 细胞内来自母本的染色体上的 Ig 重链基因得到表达,则来自父本的第 14 号染色体的 Ig 重链基因受到抑制而不表达。这可能是通过已发生有效重排的染色体产生反馈抑制(feedbackinhibition)信号抑制另一条同源染色体上的 Ig 重链基因发生重排。一条染色体上 Ig 重链基因的有效重排,一方面抑制了另一条同源染色体重链基因的重排,另一方面可发出信号使第 2 号染色体上 Igκ 轻链基因发生重排,如果一对同源染色体上的 κ 轻链基因重排均无效,才发生 22 号染色体 λ 轻链基因重排,这种现象称为轻链同种型排斥现象(light chain isotype exclusion)。
四、免疫球蛋白的多样性
机体对外界环境中众多抗原刺激可产生相应的特异性抗体,有人推算抗体的多样性在 107以上,这种抗体多样性主要是由遗传控制的。引起免疫球蛋白多样性的原因主要有以下几个方面。
1. 胚系中众多的 V、D、J 基因片段 胚系(germ line)中未重排的(unrearranged) DNA 有众多的 V 基因片段以及一定数量的 D、J 基因片段。以小鼠为例。VH、DH和 J H基因片段分别为 1000、12 和 4,单独重链重组的多样性可达 4.8×104左右;Vκ 和 Jκ 分别约为 250 和 4,κ 轻链 V - J 重排的多样性为 1.0×103。经重链与 κ 轻链随机配对后推算的多样性为(4.8×104)×(1.0×103)=4.8×107。
表 3 -5 小鼠 Ig 胚系基因片段和重链、κ 轻链配对的多样性
| 多肽链 | 基因片段数 | 可变区基因 | 经重排和随机配对后 | |
| V J | 重组方式 | 推算的多样性数目 | ||
| 重 链 | 1000 12 4 | V-D-J | 4.8×104 | |
| 4.8×107 | ||||
| κ 轻链 | 250 | V-J | 1.0×103 |
注:多样性数目不包括 VDJ 连接多样性、N 区插入和体细胞突变所增加的多样性数目。
2.VDJ 连接的多样性 轻链基因重排过程中,VJ连接点以及重链基因重排过程中 D - J 以及 V -D- J 连接点有一定的变异范围。例如轻链 V L因片段 3′端 5 个核苷酸 CCTCC 和 J L基因片段 5′端 4 个核苷酸 GTGG 连接时,9 个核苷酸中只有 6 个核苷酸编码轻链第 95、96 位氨基酸,可产生 8 种不同的连接方式(图 3 -13)。
3. 体细胞突变(somatic mutation) 体细胞在发育过程中可发生基因的突变。以长期体外培养的 B 细胞前体为例,每个细胞每个碱基对的突变率为 1~3×10-5,这种类型突变主要发生在 V 基因。体细胞突变扩展了原有胚系众多基因片段的多样性。
4.N 区的插入(insert of N region) 在 Ig 重链基因片段重排过程中,有时可通过无模板指导的机理(non-temple directed mechanism)在重组后 D 基因片段的两侧即 V H-DH或 D H-JH连接处插入称之为 N 区的几个核苷酸。N 区不是由胚系基因所编码。在 N 区插入前,先通过外切酶切除 V H-DH或 D H-JH连接处的儿个碱基对,然后通过末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase,TdT)连接上 N 区。由于额外插入了 N 区,可发生移码突变(frameshift mutation), 使插入部位以及下游密码子发生改变,从而编码不同的氨基酸,增加了抗体的多样性。
图 3 -13 轻链基因 V - J 连接多样性举例
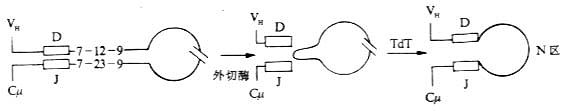
图 3 -14 N 区插入 D - J 连的接处(示意图)
5. 轻链重链相互随机配对 如表 3 - 5 所示,小鼠重链与 κ 轻链随机配对后推算的多样性可达 4.8×107,如果再加上重链与 λ 轻链的随机配对其多样性就更多了。
第三节 T 细胞受体基因
编码 T 细胞受体(T cell receptor,TCR)α、β、γ 和 δ 链的基因定位于不同的染色体(表 3 -6)。人和小鼠 δ 基因都位于 α 基因的复合体中,均位于 14 号染色体;人 TCRβ 和 γ 链基因分别位于第 7 对染色体的长臂和短臂,小鼠 β 和 γ 链基因则分别位于第 6 和 13 号染色体。
表 3 -6 TCR 多肽链基因定位
| TCR 基因 | 染色体定位 | |
| 人 | 小鼠 | |
| α 链 | 14q11.12 | 14 |
| β 链 | 7q32 | 6 |
| γ 链 | 7p15 | 13 |
| δ 链 | 14q11.2 | 14 |
一、TCR 基因的结构
TCR 基因的结构和重排与 Ig 基因有许多相似之处。在胚系中,编码 TCR 多肽链的 DNA 是由几个分隔开的 DNA 片段组成,在胸腺细胞中重排后,形成编码一条完整多肽的基因。TCR 多肽链可变区基因是由 2~4 个基因片段通过重排连接在一起。V 基因片段编码信号序列和可变区氨基端 95~100 个氨基酸残基;J 基因片段编码可变区羧基端 13~23 个氨基酸残基。TCRβ、δ 链 V 区基因除 V、J 基因片段外,还有 1~2 个 D 基因片段,编码 V 与 J 之间数个氨基酸残基。TCR 不同多肽链可变区基因的重排可有 V -J、V-D- J 或 V -D-D- J 等几种方式。TCR 多肽链 C 基因片段通常由 3~4 个外显子所组成,位于 J 基因片段的下游。与 IgC 基因片段不同,TCrC 基因片段是由数个外显子编码一个结构域,如 β 链的连接肽(connectingpeptide)是由 3 个分隔的外显子所编码。
(一)TCRα 链基因
TCRα 链基因与 TCRβ 链和 Ig 基因结构有很大差别。小鼠 α 链 V 基因约 100 个,至少可分为 12 个家族。人 Vα 大约在 100 个左右,长约数百个 kb。TCRα 基因没有 Dα 基因片段。人和小鼠 α 链基因都含有 J 基因片段(Jα),小鼠约有 60 个,相互间隔至少 500bp。VαJα 连接具有多样性。TCRα 链基因只有 1 个 Cα 基因片段,含有 4 个外显子。在 TCRα 链基因座中有 TCRδ 链基因。TCRα 链基因重组信号中长的间隔序列(23bp)3′端靠近 Vα,短的间隔序列(12bp)的 5′端靠近 Jα,这种重组信号的排列方式类似 Ig 轻链 V 区的基因,允许 Vα 基因直接与 Jα 基因重排,而不需要 V D基因片段。
(二)TCRβ 链基因
小鼠胚系中未重排的 β 链基因结构已经搞清,长约数百 kb。Vβ 基因数目约 30 个,大多数 Vβ 基因片段位于 Cβ1 的上游,至少有 1 个 Vβ(Vβ14)在 Cβ2 基因 3′下游 10kb 处,与转录的方向相反。人 Vβ 基因片段约有 100 个。小鼠和人都有 2 个 Dβ 基因片段,12~14bp 长,分别位于 Jβ1 和 Jβ2 基因片段组上游约 500~600bp 处。小鼠和人都有 2 组(cluster)Jβ 基因片段,称为 Jβ1 和 Jβ2,与相应的 Cβ1 和 Cβ2 基因片段间隔 2~3kb。小鼠 Jβ1 和 Jβ2 各含 7 个 Jβ 基因片段,其中 6 个有功能,Jβ 基因片段相互间隔 36~421bp。人 Jβ1 和 Jβ2 各含 7 个有功能的 Jβ 基因片段。人和鼠 TCRβ 基因都有 2 个基本相同的 Cβ 基因片段,各含 4 个外显子。Cβ1 和 Cβ2 高度同源,2 个 Cβ 基因片段的编码产物中只有 4 个氨基酸残基(小鼠)或 5 个氨基酸(人)不同。
TCRα 和 β 链 V 基因编码区域包括了相当于 Ig 的 CDR1 和 CDR2,主要是识别 MHC 分子和抗原的复合物。CDR3 主要是由于 V -D- J 或 V -D-D- J 连接的多样性(junctionaldiversity)和广泛分布的 N 核苷酸插入(Nnucleotide insertion)所造成,其有高度的多样性,可识别众多种类的抗原。
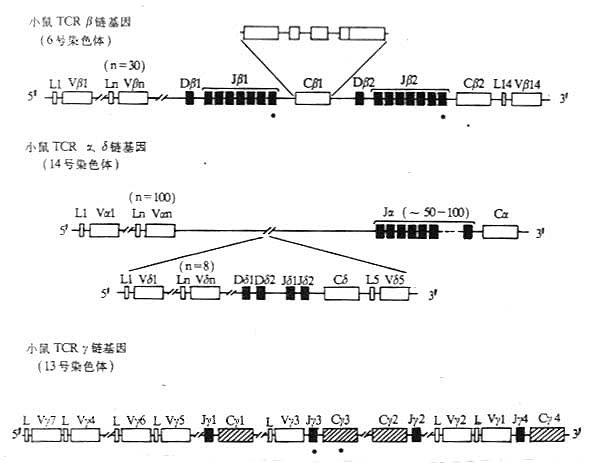
图 3 -15 小鼠 TCR 基因的结构
(三)TCRγ 链基因
Vγ 基因片段数较少,在 Balb/ c 小鼠 Vγ 基因片段有 7 个,分为 5 个家族,其中 4 个家族各只含 1 个 Vγ,另一家族有 3 个 Vγ。人 Vγ 有 14 个,其中 8 个是有功能的。人和小鼠 TCRγ 链基因均不含 D 基因片段。在小鼠,有 4 个 Jγ 基因片段,基中 Jγ1、Jγ3 和 Jγ4 分别位于 3 个 Cγ 基因片段的上游,Jγ3 为假基因。在人类共有 5 个 Jγ 基因片段,可分为 Jγ1 和 Jγ2 两组,其中 Jγ1 的 3 个片段位于 Cγ1 上游,Jγ2 的 2 个片段位于 Cγ2 基因片段的上游。不鼠有 4 个 Cγ 基因片段,其中 Cγ3 是假基因。人有 2 个 Cγ 基因片段,相距约 10kb,其中 1 个 Cγ 有 3 个外显子,另一个 Cγ 含有 4 个或 5 个外显子。编码 γ 链连接肽部分的两个 Cγ 基因外显子组成存在着差异,有一个 Cγ 基因片段不编码半胱氨酸,因此造成了 TCRγ 链在分子量、N- 连接糖基化的形式以及是否与 TCRδ 链之间形成二硫键有所不同。
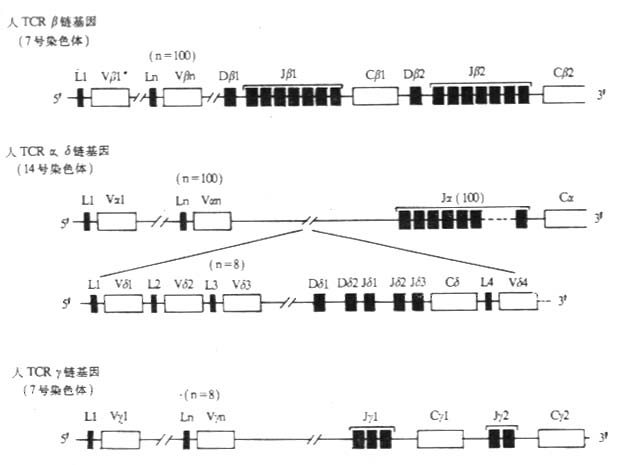
图 3 -16 人 TCR 基因的结构
(四)TCRδ 链基因
人和小鼠 TCr δ 链基因结构十分相似,均位于 α 链基因座内。在 Balb/ c 小鼠,Vδ 基因片段数约为 8 个。在小鼠 δ 链基因中有 2 个 Dδ、2 个 Jδ 和 1 个 Cδ 基因。在胸腺细胞分化过程中,δ 链先于 α 链表达。Vα 与 Jα 重排可导致 δ 基因复合物中 D、J 和 C 基因片段的缺失。在人 δ 链基因中有 8 个 Vδ 基因片段,2 个 Dδ、3 个 Jδ 和 1 个 Cδ。某些 Vδ 基因片段是与 TCRα 链 Vα 基因共用的。
TCRδ 链基因连接信号的排列方式是:每个 Vδ 基因片段的 3′端紧靠着“七聚体 - 长间隔序列 - 九聚体”(7-23-9)结构;Dδ 基因片段 5′端是“九聚体 - 短间隔序列 - 七聚体(9-12-7)结构,3′端是“7-23-9”结构;2 个 Jδ 基因片段的 5′端是“9-12-7”结构。这种 TCRδ 链基因重组信号排列的方式使得 V、D、J 链接可有以下几种不同方式:(1)V-D- J 连接,在小鼠胚胎 TCRγδ 胸腺细胞最常见到 Vδ-Dδ2-Jδ 的连接,人胚胎胸腺细胞最常见到 Vδ-Dδ3-Jδ;(2)V- J 的直接连接;(3)大多数成年小鼠 TCRγδ 胸腺细胞以 Vδ-Dδ1-Dδ2-Jδ 连接,人妊娠后期胎儿 TCRγδ 胸腺细胞也存在着 Vδ-Dδ1-Dδ2-Jδ 的排列方式。Vδ 基因位于 Vα 基因之中,同一个 V 基因片段可用作 Vδ 或 Vα,如果 V 基因片段是用作 Vδ,多发生 V -D(-D)- J 重排。
小鼠 TCRγδ T 细胞 γ 和 δ 链配对的,Vδ1 几乎总是和 Vγ5 或 Vγ6 配对。小鼠 TCRγδ 阳性树突状表皮细胞(DEC)几乎都是 Vγ5 与 Vδ1 配对。在人 Vδ2 几乎总是与 Vγ9 配对。
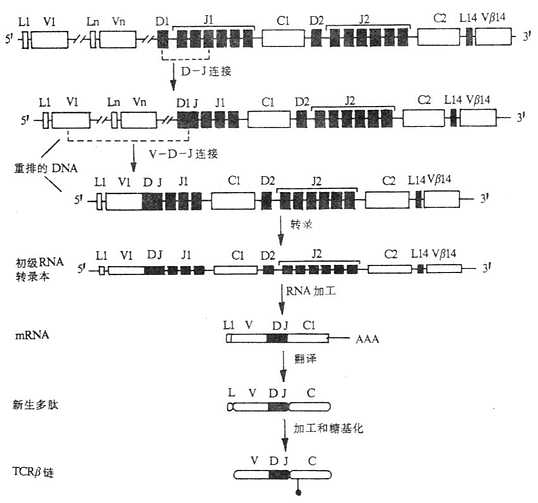
图 3 -17 小鼠 TCRβ 基因重排顺序、转录和合成
二、TCR 基因的重排
T 细胞在胸腺中发育成熟过程中,TCR 基因按照一定的顺序发生重排。TCR 基因的重排顺序和表达与免疫球蛋白基因的重排和表达十分相似。在基因组中的识别序列包括了一个保守的七聚体和九聚体,七聚体与九聚体之间含有一个不保守的 12 碱基对或 23 碱基对间隔序列(spacer sequence)。
TCRβ 链基因座的重排要先于 α 链。首先是一个 Dβ 片段与一个 Jβ 片段连接,然后 D - J 与一个 Vβ 片段相连,完成了 VDJ 基因的重组。TCRβ 链初级的 RNA 转录本在重组的 VDJ 和 C 基因之间含有内含子。VDJ 与 Cβ1 或 Cβ2 的重排是随机的,目前尚未发现 Cβ 类似 Ig 重链类别转换那样从一个 Cβ 基因转换到另一个 Cβ 基因上。在小鼠 Cβ2 基因的 3′端推测有一个增强子。
TCRβ 链基因的功能性重排和表达,诱导了 TCRα 基因的重排。α 链基因的重排与 β 链相似,由于 α 链基因不存在 D 片段,故 α 链基因只有 V - J 的连接。小鼠 Vα 转录起始点的 5′端有一个启动子,Cα 基因的 3′端也有一个增强子。此外,靠近 α 链增强子处有“静息顺序”(silencersequences),这些顺序可抑制非 T 细胞或者是 TCRγδT 细胞中 α 链的转录。由于 α 链只有一个 Cα 基因,因此一旦初始的转录本形成后,经过 RNA 加工只能产生一种完整的 α 链 mRNA。
如同 Ig 基因的重排和表达,TCRα 和 β 链基因的重排和表达也有等位基因排斥现象(al-lelicexclusion), 如果在一条染色体上 TCR 基因的重排是有效的,那末就可以抑制另一条染色体相应等位基因座的重排。当一条染色体上 α 链或 β 链基因座的重排、转录或翻译无效时,则另一条染色体上相应 α 或 β 链相应的等位基因座开始发生重排。如果两条染色体上 TCRα 或 β 链基因重排都无效,则未成熟的 T 细胞死亡。
三、T 细胞库的多样性
推测 T 细胞库(T cell repertoire)中多样性在 1010以上,其多样性的原因与 Ig 相似,主要有以下几方面。
1. 胚系中有众多的 V、D 和 J 基因片段 尽管 TCRα 和 β 基因中 V 基因片段数比 Ig 基因少,但 J 基因片段明显比 Ig 基因为多,如小鼠中约 50~100 个 Jα 和至少 12 个 Jβ 基因片段,而 IgH 和 κ 链基因座中 J 基因片段各只有 4 个。
2. 连接处连接的多样性 与 IgVDJ 连接的多样性相似。
3.N 区的插入 N 区插入在 Ig 基因重排中只发生在重链基因,而 TCRα 和 β 链基因均可发生 N 区的插入。此外,在 TCRα 和 β 链基因中都发现一种称之为“易变性”(flexibility)的现象,如有一个以上 Vα 基因 3′端可以连接到 Jα 片段。
4.TCRα 与 β 链的随机配对 人 TCRαβ 库多样性可推算为:α 链(Vα(100)×Jα(100))×β 链(Vβ(100)×Dβ(2)×Jβ(14))=2.8×107,这种多样性尚未包括 N 区插入所扩展的多样性。
(金伯泉)
参考文献
1.Cunningham B A,et al.Neuralcell adhesion molecule:structure,immunoglobulin-like domain,cell surfacemodulation,and alternative RNA splicing.Science,1987;236:799
2.Flanagan JG,et al.Arrangementof human immunoglobulin heavy chain constant region genes implies evolutionaryduplication of a segment containing γ,ε and α genes. Nature,1982;300:709
3.Hood L,et al.T cell antigenreceptor and the immunoglobulin supergene family. Cell.1985;40:225
4.Hunkapiller T,et al.The growingimmunoglobulin gene superfamily.Nature,1986;323: 15
5.Nossal GJV.Triumphs and trialsof immunology in the 1980s.Immunol Today,1988;9: 286
6.Romagnanni S.Regulation andderegulation of human IgE synthesis.Immunol Today,1990;11(9):316
7.Sims JE,et al.cDNA expressioncloning of the IL-1 receptor,a member of the im-munoglobulinsuperfamily,Science,1989;241:585
8.Shimizu A,et al.Organization ofthe constant region gene family of the mouse im-munoglobulin hearychain.Cell,1982;28:499
9.Tucker PW.Transcriptional regulationof Igm and IgD. Immunol Today,1985;6:181
10.White JM,et al.Viral receptorof the immunoglobulin superfamily.Cell,1989;58:725
11.Williams AF.A year in the lifeof immunoglobulin superfamily.Immunol Today, 1987;8:298
12. 徐人尔综述,赵寿元审校.NF-κB 与基因调控. 国外医学分子生物学分册.1993;15(6):2511
第四章 细胞因子及其受体
细胞因子(cytokine)是指主要由免疫细胞分泌的、能调节细胞功能的小分子多肽。在免疫应答过程中,细胞因子对于细胞间相互作用、细胞的生长和分化有重要调节作用。80 年代以来,由于基因工程、细胞工程研究的飞速发展,不仅克隆了早先发现的生物活性肽的 cDNA,而且发现了许多新的细胞因子,并对各种细胞因子产生来源、分了子结构和基因、相应的受体、生物学功能以及与临床的关系等进行了大量的研究,成为当今基础免疫学和临床免疫学研究中一个活跃的领域。
第一节 细胞因子的概念和作用特点
一、细胞因子的命名
细胞因子是多种细胞所分泌的能调节细胞生长分化、调节免疫功能、参与炎症发生和创伤愈合等小分子多肽的统称。免疫球蛋白、补体不包括在细胞因子之列。
(一)根据产生细胞因子的细胞种类不同分类
1. 淋巴因子(lymphokine) 于 60 年代开始命名,主要由淋巴细胞产生,包括 T 淋巴细胞、B 淋巴细胞和 NK 细胞等。重要的淋巴因子有 IL-2、IL-3、IL-4、IL-5、IL-6、IL-9、IL-10、IL-12、IL-13、IL-14、IFN-γ、TNF-β、GM-CSF 和神经白细胞素等。
2. 单核因子(monokine)主要由单核细胞或巨噬细胞产生,如 IL-1、IL-6、IL-8、TNF-α、G-CSF 和 M -CSF 等。
3. 非淋巴细胞、非单核 - 巨噬细胞产生的细胞因子 主要由骨髓和胸腺中的基质细胞、血管内皮细胞、成纤维细胞等细胞产生,如 EPO、IL-7、IL-11、SCF、内皮细胞源性 IL- 8 和 IFN- β 等。
(二)根据细胞因子主要的功能不同分类
1. 白细胞介素(interleukin,IL) 1979 年开始命名。由淋巴细胞、单核细胞或其它非单个核细胞产生的细胞因子,在细胞间相互作用、免疫调节、造血以及炎症过程中起重要调节作用,凡命名的白细胞介素的 cDNA 基因克隆和表达均已成功,目前已报道 IL-1~IL-15。
2. 集落刺激因子(colonystimulating factor,CSF) 根据不同细胞因子刺激造血干细胞或分化不同阶段的造血细胞在半固体培养基中形成不同的细胞集落,分别命名为 G(粒细胞)-CSF、M(巨噬细胞)-CSF、GM(粒细胞、巨噬细胞)-CSF、Multi(多重)-CSF(IL-3)、SCF、EPO 等。不同 CSF 不仅可刺激不同发育阶段的造血干细胞和祖细胞增殖的分化,还可促进成熟细胞的功能。
3. 干扰素(interferon,IFN) 1957 年发现的细胞因子,最初发现某一种病毒感染的细胞能产生一种物质可干扰另一种病毒的感染和复制,因此而得名。根据干扰素产生的来源和结构不同,可分为 IFN-α、INN- β 和 IFN-γ,他们分别由白细胞、成纤维细胞和活化 T 细胞所产生。各种不同的 IFN 生物学活性基本相同,具有抗病毒、抗肿瘤和免疫调节等作用。
4. 肿瘤环死因子(tumor necrosisfactor,TNF) 最初发现这种物质能造成肿瘤组织坏死而得名。根据其产生来源和结构不同,可分为 TNF- α 和 TNF- β 两类,前者由单核 - 巨噬细胞产生,后者由活化 T 细胞产生,又名淋巴毒素(lymphotoxin,LT)。两类 TNF 基本的生物学活性相似,除具有杀伤肿瘤细胞外,还有免疫调节、参与发热和炎症的发生。大剂量 TNF- α 可引起恶液质,因而 TNF- α 又称恶液质素(cachectin)。
5. 转化生长因子 - β 家族(transforminggrowth factor-β family,TGF-β family) 由多种细胞产生,主要包括 TGF-β1、TGF-β2、TGF-β3、TGFβ1β2 以及骨形成蛋白(BMP)等。
6. 趋化因子家族(chemokinefamily) 包括两个亚族:(1)C-X-C/ α 亚族,主要趋化中性粒细胞,主要的成员有 IL-8、黑素瘤细胞生长刺激活性(GRO/MGSA)、血小板因子 -4(PF-4)、血小板碱性蛋白、蛋白水解来源的产物 CTAP-Ⅲ和 β -thromboglobulin、炎症蛋白 10(IP-10)、ENA-78;(2)C-C/ β 亚族,主要趋化单核细胞,这个亚族的成员包括巨噬细胞炎症蛋白 1α(MIP-1α)、MIP-1β、RANTES、单核细胞趋化蛋白 -1(MCP-1/MCAF)、MCP-2、MCP- 3 和 I -309。
7. 其它细胞因子 如表皮生长因子(EGF)、血小板衍生的生长因子(PDGF)、成纤维细胞生长因子(FGF)、肝细胞生长因子(HGF)、胰岛素样生长因子 -I(IGF-1)、IGF-Ⅱ、白血病抑制因子(LIF)、神经生长因子(NGF)、抑瘤素 M(OSM)、血小板衍生的内皮细胞生长因子(PDECGF)、转化生长因子 -α(TGF-α)、血管内皮细胞生长因子(VEGF)等。
二、细胞因子的作用特点
众多的细胞因子有以下共同的作用特点。
(1)绝大多数细胞因子为分子量小于 25kDa 的糖蛋白,分子量低者如 IL- 8 仅 8kDa。多数细胞因子以单体形式存在,少数细胞因子如 IL-5、IL-12、M-CSF 和 TGF- β 等以双体形式发挥生物学作用。大多数编码细胞因子的基因为单拷贝基因(IFN- α 除外),并由 4~5 个外显子和 3~4 个内含子组成。
(2)主要与调节机体的免疫应答、造血功能和炎症反应有关。
(3)通常以旁分泌(paracrine)或自分泌(autocrine)形式作用于附近细胞或细胞因子产生细胞本身。在生理状态下,绝大多数细胞因子只有产生的局部起作用。
(4)高效能作用,一般在 pM(10-12M)水平即有明显的生物学作用。
(5)存在于细胞表面的相应高亲和性受体数量不多,在 10~10000/ 每个细胞。近年来,细胞因子受体的研究进展相当迅速,根据细胞因子受体基因 DNA 序列以及受体胞膜外区氨基酸序列、同源性和结构,可分为四个类型:免疫球蛋白超家族、造血因子受体超家族、神经生长因子受体超家族和趋化因子受体。
(6)多种细胞产生,一种 IL 可由许多种不同的细胞在不同条件下产生,如 IL- 1 除单核细胞、巨噬细胞或巨噬细胞系产生外,B 细胞、NK 细胞、成纤维细胞、内皮细胞、表皮细胞等在某些条件下均可合成和分泌 IL-1。
(7)多重的调节作用(multiple regulatory action), 细胞因子不同的调节作用与其本身浓度、作用靶细胞的类型以及同时存在的其它细胞因子种类有关。有时动物种属不一,相同的细胞因子的生物学作用可有较大的差异,如人 IL- 5 主要作用于嗜酸性粒细胞,而鼠 IL- 5 还可作用于 B 细胞。
(8)重叠的免疫调节作用(overlapping regulatory action), 如 IL-2、IL-4、IL- 9 和 IL-12 都能维持和促进 T 淋巴细胞的增殖。
(9)以网络形式发挥作用,细胞因子的网络作用主要是通过以下三种方式:(1)一种细胞因子诱导或抑制另一种细胞因子的产生,如 IL- 1 和 TGF- β 分别促进或抑制 T 细胞 IL- 2 的产生;(2)调节同一种细胞因子受体的表达,如高剂量 IL- 2 可诱导 NK 细胞表达高亲和力 IL- 2 受体;(3)诱导或抑制其它细胞因子受体的表达,如 TGF- β 可降低 T 细胞 IL- 2 受体的数量,而 IL- 6 和 IFN- γ 可促进 T 细胞 IL- 2 受体的表达。
(10)与激素、神经肽、神经递质共同组成了细胞间信号分子系统。
第二节 细胞因子的结构和生物学特征
由于基因工程技术的迅速发展,许多细胞因子的 cDNA 克隆获得成功,并获得了高活性基因表达产物,这给细胞因子的细胞生物学和分子生物学的研究提供了必要的前提。目前已有 IL-2、EPO、G-CSF、GM-CSF、IFN- γ 和 IFN- α 等细胞因子投放市场,有更多的细胞因子正在进行不同期的临床验证。细胞因子在正式投入市场成为商品前,必须经过临床前筛选实验、临床Ⅰ期、Ⅱ期、Ⅲ期试用等几个阶段的验证。
一、白细胞介素(IL)
在 1979 年第二届国际淋巴因子专题讨论会上,将来自单核 - 巨噬细胞、T 淋巴细胞所分泌的某些非特异性发挥免疫调节和在炎症反应中起作用的因子称为白细胞介素(interleukin,IL)。目前已知许多 IL 是来自单核 - 巨噬细胞和淋巴细胞以外的其它细胞。已正式命名的白细胞介素有 IL-1~IL-15。
(一)IL-1
IL- 1 是一种单核因子。1972 年 Gery 等发现人白细胞培养的上清中含有一种可溶性物质,这种物质可促进小鼠胸腺细胞对植物血凝素(PHA)的有丝分裂反应。起初命名为淋巴细胞激活因子(lymphocyte-activatingfactor,LAF)或内源性热原质(endogenous pyrogen)、破骨细胞激活因子(osteoclast activating factor)、黑素瘤细胞生长抑制因子(melanomagrowth inhibitory factor)等,1979 年国际统一命名为 IL-1。
1.IL- 1 的产生 IL- 1 可由多种细胞合成和分泌。
(1)单核细胞、巨噬细胞(如腹腔粘连细胞 peritoneal cell,PC)、树突状细胞等在摄取抗原抗体复合物后或在抗原提呈过程中可产生 IL-1。在大多数刺激剂刺激外周血单个核细胞(PBMC)条件下,IL-1βmRNA 水平要高于 IL-1αmRNa 20~25 倍。
(2)小鼠巨噬细胞细胞系 P388D1、J774、PU5-1.8、WEHI- 3 以及人前单核细胞株 U937 等在脂多糖(LPS)刺激后都能分泌大量的 IL-1。
(3)表皮细胞、NK 细胞、B 细胞、成纤维细胞、内皮细胞、脑胶质星状细胞、肾小球系膜细胞(mesangial cell)、滑膜衬里细胞(synovial lining cell)、平滑肌细胞、上皮细胞、胎盘细胞、白血病细胞、PMN 等在某些条件下亦可产生 IL-1。
许多因素可以直接影响单核 - 巨噬细胞 IL- 1 的分泌:①细胞因子如巨噬细胞激活因子(MAF)、集落刺激因子(CSF)、IFN-α、IFN- γ 对 IL- 1 产生具有增强作用。②LPS、PPD、BCG 和李斯特菌,葡萄球菌、链球菌外毒素,活病毒等也是 IL- 1 产生的刺激剂。在外周血中 20pg/ml 内毒素刺激单核细胞即可产生 IL-1,因此在一般培养条件下,由于微量内毒素的污染可刺激单核细胞分泌 IL-1。10ng/mlLPS 可使单核细胞合成 IL- 1 增加 100 倍。③蛋白激酶 C(PKC)的激活剂乙酸肉豆蔻佛波醇(phorbol myristateacetate,PMA)以及钙离子载体(calcium ionophore)如 A23187 均具有强烈的刺激作用。④皮质类固醇和前列腺素则对 IL- 1 的产生有抑制作用。
2.IL- 1 的分子结构和基因 完整的人 IL-1α 和 IL-1β 基因组分别为 10.5kb 和 7.8kb。人和小鼠 IL- 1 基因定位于 2 号染色体,均含 7 个外显子。IL- 1 前体 (ProIL-1) 为 31kDa,通过蛋白水解酶裂解形成成熟的 IL- 1 分子。IL- 1 在不同种属中有较高同源性。在氨基酸水平上,IL-1α 和 IL-1β 在不同种属同源性分别为 60%~70% 和 75%~78%;但在同一种属中 IL-1α 与 IL-1β 同源性只有 25%。人 IL-1α(PI5.0)和 IL-1β(P17.0)分别由 159 和 153 个氨基酸残基组成,分子量约 17.5kDa,同源性为 28%。IL- 1 对糜蛋白酶敏感。不同细胞所产生 IL- 1 的等电点可有所差异。
3.IL- 1 的受体 T 细胞、成纤维细胞表面 IL- 1 受体为 80kDa,而 B 细胞则为 68kDa。编码这两种 IL- 1 受体是不同基因产物。P80IL-1R 称为 IL-1RtI(CDw121a),P68IL-IR 称为 IL-1RtⅡ(CDw121b)。
表 4 -1 IL-1 Rt Ⅰ和 IL-1RtⅡ的比较
| IL-1 RtⅠ | IL-1RtⅡ | |
| 结构 | ||
| 同源性 | Ig 超家族(3 个 C2 区) | Ig 超家族(3 个 C2 区) |
| 分子量(kDa) | 80 | 68 |
| 氨基酸数目 | 549 | 384 |
| 胞膜外 | 319 | 329 |
| 穿膜 | 20 | 26 |
| 胞浆内 | 213 | 29 |
| 主要分布细胞 | 广泛,T 细胞、成纤维细胞等 | EBV 转化 B 细胞、Raji、PMN、骨髓细胞等 |
| 与配体结合 | ||
| 结合能力 | IL-1α>IL-1β | IL-1β>IL-1α |
| 丝氨酸 / 苏氨酸 | +(信号转导) | (功能尚不清) |
| 残基磷酸化 | ||
| 配体受体结合后变化 | 易内化 | 易降解 |
(1)IL-1RtⅠ:IL-1RtⅠ cDNA 克隆在人和鼠均已获得成功。IL-1RtⅠ为穿膜蛋白,胞膜外区有 3 个结构域属免疫球蛋白超家族,穿膜区有 20 个氨基酸残基,胞浆区含有丝氨酸和苏氨酸残基,当 IL- 1 与 IL-1RtⅠ结合后丝氨酸和苏氨酸很快被磷酸化。通过基因转染 Hela 细胞实验证明,IL-1RtⅠN 端 2 个结构域与配体结合有关。针对 N 端 17 个氨基酸片段的 McAb 能阻断 IL-1RtⅠ与 IL- 1 结合。IL- 1 与 IL-RtⅠ结合后即发生内化(internalization)。成纤维细胞、平滑肌细胞主要表达 IL-1RtⅠ。一般来说,IL-1RtⅠ可与 IL-1α 和 IL-1β 相结合,但 IL-1α 与Ⅰ型受体结合能力较高,而 IL-1β 与Ⅱ型受体结合较高。IL- 1 与不同种属不同细胞结合后的生物学效应有所差别,如人和鼠 IL-1α 结合到人内皮细胞上的亲和力相同,但产生的生物学效应不完全相同。抗 IL-1RtⅠMcAb 在体内和体外均可抑制 IL- 1 在生物学效应。
(2)IL-1RtⅡ:主要分布于 EBV 转化的 B 细胞、Raji 细胞、巨噬细胞、胎盘、Th2 克隆、活化 T 细胞、PMN 和骨髓细胞等。胞膜外区有 3 个结构域属免疫球蛋白超家族,与 IL-1RtⅠ之间有 28% 氨基酸同源性,穿膜区有更高的同源性,但胞浆区要比Ⅰ型受体短,可能在介导信号传递上有差别。IL- 1 与 IL-1RtⅡ结合后易发生降解而不象 IL-1RtⅠ那样发生内化。IL-1RtⅡ经蛋白水解酶水解后可形成可溶性的 IL- 1 结合蛋白(soluble IL-1 binding protein,sIL-1BP),46kDa,与 IL-1β 有较高亲和力,在自然情况下 sIL-1BP 是 IL-1β 的抑制剂。可溶性 IL-1R(solubleIL-1 receptor,sIL-1R)可有效防止小鼠心脏移植排斥反应,减轻 Lewis 大鼠的实验性关节炎和过敏性大脑炎。
在 T 细胞中,CD4 阳性细胞亚群 IL- 1 受体表达要高于 CD8 阳性 T 细胞亚群。以小鼠胸腺瘤细胞系 EL- 4 为模型,发现 IL-1α 和 IL-1β 可结合到相同的高亲和力受体。现已发现联合免疫缺陷病人的 T 细胞表达 IL-1R 缺陷,对抗原刺激不发生增殖反应,也不产生 IL-2,病人易患机会致病菌感染。
4.IL- 1 受体拮抗物 在某些白血病患者血清和尿中以及单核细胞培养上清中发现一种多肽性质的 IL- 1 特异性抑制因子,称为 IL- 1 受体拮抗物(interleukin 1 receptorantagonist,IL-1ra), 又称 IL- 1 受体拮抗蛋白(IL-1 receptor antagonist protein, IRAP)。
(1)IL-1ra 的产生:IL-1ra 体外可由 LPS 刺激的单核细胞,PMA、PHA、CSF 刺激的单核细胞系产生。
(2)IL-1ra 分子的结构和基因:IL-ra 基因克隆 1990 年获得成功,编码人 IL-1α、IL-1β 和 IL-1ra 基因都定位于 2 号染色体。IL-1racDNA 编码的多肽为 17kDa,糖基化后分子量为 25kDa,但糖基对 IL-1ra 活性并非必需。未成熟的 IL-1ra 分子为 177 个氨基酸残基的肽链,N 端 25 个氨基酸多为疏水性氨基酸,构成典型的信号肽顺序。成熟分子由 152 个氨基酸残基组成。在 65、68、116 及 122 位上有 4 个保守的半胱氨酸残基,Cys65-116,Cys68-122 间形成链内二硫键。从 cDNA 推算的氨基酸序列 IL-1ra 与 IL-1α 和 IL-1β 分别有 19% 和 26% 的同源性,人和小鼠的 IL-1ra 有 77% 同源性。
(3)IL-1ra 的生物学作用:IL-1ra 能特异性地抑制 T 细胞表面 IL-1R 与 IL- 1 结合,但不抑制 TNF 或 IL- 2 与相应受体的结合。IL-1ra 不与 IL- 1 直接结合,而是一种 IL- 1 与 IL-1R 相互结合的竞争性抑制物。rIL-1ra 与Ⅰ型和Ⅱ型 IL-1R 都能结合,但与 IL-1RtⅠ结合的亲和力要高于与 IL-1RtⅡ结合的亲和力。rIL-1ra、rIL-1α、rIL-1β 与 IL-1RtⅠ结合的亲和力比较相近,但 rIL-1ra、rIL-1α 与 IL-1RtⅡ结合的亲和力要低于 rIL-1β 与 IL-1RtⅡ结合的亲和力。IL-1ra 能抑制 IL- 1 刺激滑膜细胞 PGE2 的产生和软骨细胞胶原酶合成,抑制胸腺细胞的增殖以及中性粒细胞、嗜酸性粒细胞与内皮细胞的粘附。在体内可抑制 IL- 1 引起的发热。IL-1ra 可结合 T 细胞和成纤维细胞表面 IL-1RtⅠ, 也能抑制 IL- 1 与 PMN、B 细胞、髓样单核细胞白血病细胞 IL-1RtⅡ的结合。IL-1ra 可抑制 PBMC、骨髓细胞衍生的髓样淋巴细胞白血病细胞自发增殖和自发产生 IL-1、IL- 6 和 GM-CSF。在体内,IL-1ra 可阻止 LPS 引起的家兔死亡,减轻免疫复合物所诱导的炎症,抑制小鼠骨髓移植后 GVHR 的发生,提高存活率,此外,还可防治动物实验性溃疡性结肠炎。
(4)IL-1ra 与临床:正常人血清 IL-1ra 水平在 200pg/ml 以下,感染、炎症以及内毒素血症病人血清中 IL-1ra 水平可升高到 8ng/ml。应用 IL-1ra 治疗败血症已进入Ⅲ期临床验证,死亡率明显下降。此外 IL-1ra 治疗类风湿性关节炎也已开始在临床验证。IL-1ra 在体内的副作用很小,但应用剂量较大,阻断 IL-1 50% 生物学效应时所用 IL-1ra 的用量是 IL- 1 用量的 10~500 倍。
5.IL- 1 的生物学作用 IL- 1 具有广泛的免疫调节作用,并有致热和介导炎症的作用,它的生物学功能是通过与相应高亲和力受体结合而介导的,IL- 1 生理条件下的浓度仅在 10-12~10-14 M 之间。IL- 1 作用无明显的种属特异性,人 IL- 1 可作用于小鼠源性的细胞。主要表达 IL-1RtⅡ的细胞似乎比表达 IL-1RtⅠ细胞相对有种属特异性。
(1)促进胸腺细胞、T 细胞的活化、增殖和分化:T 细胞经抗原、有丝分裂原或抗 TCR/CD3 刺激后表达 IL- 1 受体,在 IL- 1 作用下 T 细胞被活化,由 G 期进入 G 1期。活化后的 T 细胞分泌 IL-2、IFN-γ、GM-CSF、IL- 4 等细胞因子,并表达 IL- 2 受体进而 T 发生增殖和分化。IL- 1 还可增加 T 细胞表面 MHCⅡ类抗原的表达。IL- 1 能诱导杀伤性 T 淋巴细胞(CTL)的分化,在混合淋巴细胞培养(MLC)中,IL- 1 诱导 CTL 的产生可能是通过促进 T 细胞分泌 IL- 2 和 IFN-γ。IL- 6 可协同 IL- 1 活化 T 细胞和刺激 IL- 2 的产生。
(2)促进 B 细胞功能:协同 IL- 4 等细胞因子刺激 B 细胞的增殖和分化,促进免疫球蛋白的合成和分泌,这种作用可能是通过 IL- 1 诱导 PBMC 产生 IL- 6 而介导的。
(3)刺激骨髓多能干细胞的增殖:现已证实 IL- 1 与 Stanley(1986)报道的血细胞生成素 -1(hemopoietin-1)是同一种分子。IL- 1 刺激造血细胞和成纤维细胞产生 CSF,增加造血细胞 CSF 受体的数量,并协同 IL-3、IL-6、G-CSF、M-CSF、GM-CSF、SCF 等因子刺激造血功能,对粒单系祖细胞和巨核系祖细胞均有刺激作用。此外,IL- 1 可刺激干细胞产生 SCF,IL- 1 本身可作用早期干细胞,激活干细胞从 Go 期进入增殖周期。IL- 1 能预防化疗造成的骨髓抑制已进入临床Ⅱ期验证。
(4)增强 NK 细胞的杀伤活性:通过提高 NK 细胞对 IL- 2 等细胞因子的敏感性增强其杀伤活性,IL- 1 与 IL- 2 或 IFN 有协同刺激 NK 细胞活性的作用。
(5)促进多种免疫分子的基因表达:如 IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、TNF-α、TNF-β、INF-β、G-CSF、GM-CSF、GM-CSF,IL-2Rα 链(Tac),补体 C2、Bf,粘附分子以及 c -fos、c-myc 和 c -jun 等原癌基因的表达。C-fos 和 C -jun 组成活化蛋白 -1(AP-1),活化 IL- 2 基因的启动子,诱导 B 细胞 κ 链核因子(NF-κB)活化免疫球蛋白 κ 链基因,诱导 NF-IL- 6 转录因子活化 IL- 6 启动子。
(6)刺激单核细胞和巨噬细胞产生 IL- 6 和 TNF,并通过单核细胞和巨噬细胞产生 IL- 8 介导对中性粒细胞的趋化作用。此外,IL- 1 诱导内皮细胞活化,刺激中性粒细胞释放炎症蛋白和炎症介质,直接参与炎症发生过程。
IL- 1 与 TNF 生物学性质,尤其在非免疫性作用方面较为相似(见表 4 -8)。抗 TNF- α 中和抗体可预防内毒素引起的休克,同时降低了 IL- 1 和 IL- 6 水平,表明在某些条件下,IL- 1 水平受到 TNF 的调控。
6.IL- 1 与临床
(1)发热:IL- 1 是一种内源性热原质(endogenous pyrogen), IL- 1 引起发热作用与内毒素不同,IL- 1 对热敏感,反复注射不产生耐受。IL- 1 引起发热的机理之一可能是 IL- 1 促进单核 - 巨噬细胞释放 PGE2,刺激下丘脑体温调节中枢,引起发热。阿斯匹林、消炎痛等抑制 PGE2 的合成,可作为解热剂。PGE2 对 IL- 1 产生有负反馈作用。老龄人或癌症患者 PBMC 中单核细胞产生 IL- 1 能力低于正常人,可能与感染后不易出现明显发热等临床症状有关。
(2)促进肝细胞合成急性期蛋白(acute phase protein):如 C - 反应蛋白、血清淀粉样 A 蛋白(serum amyloid a protein,SAA)和 α 酸性糖蛋白(α-acid glycoprotein,αAGP)以及某些补体的组分,有利于机体抵抗病原微生物等,是机体非特异性防御因素之一。低剂量 IL- 1 可提高动物对脑型和恶性疟疾的抵抗力。
(3)对间质细胞和其它细胞的作用:类风湿关节炎关节囊内巨噬细胞受到刺激和活化后可分泌 IL-1,刺激滑膜细胞、软骨细胞、成纤维细胞分泌大量 PGE2、胶原酶和中性蛋白酶等,从而使关节中的胶原组织降解,骨质吸收,局部血管通透性增加,直接参与关节的病理损伤。多种关节炎的关节液中可测出高水平 IL-1。IL- 1 还可刺激脑组织神经胶质细胞增生,形成瘢痕,与癫痫发作可能有关。此外,IL- 1 刺激肾小球系膜细胞增生,导致肾实质纤维化和慢性肾功衷竭。
(4)抗肿瘤作用:由于 IL- 1 能协同 IL-2、IFN- γ 诱导 CTL 和 NK 细胞的杀伤活性,促进杀伤细胞 IL- 2 受体的表达以及成纤维细胞分泌 IL-6,因此具有抗肿瘤作用。临床已试用 IL- 1 治疗肿瘤。
(5)抗放射作用(radioprotective):小鼠注射 IL-1100ng 在 950R 照射条件下可提高白细胞水平,延长存活时间,能预防放疗造成的骨髓抑制。临床上已试用 IL- 1 治疗骨髓移植。最近在动物实验中发现 IL- 1 能降低血糖水平,有可能成为治疗糖尿病的新药。
(二)IL-2
1976 年 Morgan 等发现小鼠脾细胞培养上清中含有一种刺激胸腺细胞生长的因子,由于这种因子能促进和维持 T 细胞长期培养,称为 T 细胞生长因子(tcell growth factor,TCGF),1979 年统一命名为白细胞介素 2(interleukin 2,IL-2)。
1.IL- 2 的产生 IL- 2 主要由 T 细胞或 T 细胞系产生。
(1)CD4 阳性或 CD8 阳性 T 细胞:有丝分裂原刺激 CD4 阳性或 CD8 阳性 T 细胞亚群均可产生 IL-2;同种异体抗原主要刺激 CD4 阳性 T 细胞分泌 IL-2。PBMC、脾脏、淋巴结和扁桃腺中的 T 细胞受到刺激后都能产生 IL-2。在小鼠 Th 细胞中,只有 Th1 亚群可产生 IL-2。
(2)T 细胞肿瘤细胞系或白血病细胞系:人和动物某些 T 细胞白血病细胞系或肿瘤细胞在有丝分裂原、钙离子载体(如 A23187)或 PMA 刺激下可产生高水平的 IL-2。如长臂猿 T 细胞系 MLA144 可自发产生 IL-2,小鼠胸腺瘤细胞系 EL- 4 和人 Jurkat 细胞静止状态不合成和分泌 IL-2,刺激后可分泌高水平的 IL-2。
(3)T 淋巴细胞杂交瘤:T 淋巴细胞杂交瘤 123,FS6-14.13,HT-24A 等在 ConA 刺激下产生 IL-2。
(4)应用基因工程技术制备:1983 年 Taniguchi 等从 ConA 刺激的 Jurkat 白血病 T 细胞中克隆成功 IL-2cDNA,并在大肠杆菌中得到高水平的表达。目前应用基因工程技术所制备和纯化的 IL- 2 已用于临床治疗某些肿瘤和其它疾病。
2.IL- 2 的分子结构和基因 人 IL- 2 含有 133 氨基酸残基,分子量为 15.5kDa。天然 IL- 2 在 N 端含有糖基,但糖基对 IL- 2 的生物学活性无明显影响,等电点在 6.6~8.2。IL- 2 分子含有 3 个半胱氨酸,分别位于第 58、105 和 125 位氨基酸,其中 58 位与 105 位半胱氨酸之间所形成的链内二硫键对于保持 IL- 2 生物学活性起重要作用。在 IL- 2 基因产物的提纯和复性过程中,如二硫键配错或分子间形成二硫键都会降低 IL- 2 的活性。现已有应用点突变,将第 125 号位半胱氨酸突变为亮氨酸或丝氨基,使只能形成一种二硫键,保证了在 IL- 2 复性过程的活性。还有报道用蛋白工程技术生产新型 rIL-2,将 IL- 2 分子第 125 位半胱氨酸改为丙氨酸,改构后 IL- 2 比活性比天然 IL- 2 明显增加。人 IL- 2 基因定位于第 4 号染色体,长约 5kb,由 4 个外显子和 3 个内含子组成。人和小鼠 IL- 2 基因 DNA 序列有 63% 同源性。
3.IL- 2 的受体 IL-2R 是由 α、β 和 γ 三条链组成。
(1)IL-2Rα 链:Uchiyama(1981)首次制备了抗活化 T 细胞抗原 Tac 的 McAb,与 IL- 2 相互竞争结合到 Tac 阳性细胞。Tac 的分子量为 55kDa。1984 年 Leonard 将 Tac 分子的 cDNA 克隆成功。Tac 分子为糖蛋白,由 272 个氨基残基组成,包括 21 个氨基酸残基信号肽,成熟分子含 251 个氨基酸,含有多个半胱氨酸,2 个 N - 糖基化位点,穿膜区和胞浆区分别含 19 和 13 个氨基酸残基。人 Tac 的基因定位于第 10 号染色体,包括 8 个外显子和 7 个内含子,长约 25kb。Tac(p55)即为 IL- 2 受体 α 链(或亚单位),又称 CD25,是活化 T 淋巴细胞的标志。在骨髓移植中如除去 Tac 阳性供体细胞可以降低移植物抗宿主反应(GVHR),现已进入Ⅱ期临床验证。也可用抗 IL-2r McAb 选择性地封闭、消除活化的效应细胞,从而治疗同种异体移植物排斥反应及某些自身免疫性疾病。
(2)IL-2Rβ 链:分子量 70kDa,故又称 p70,在人白细胞分化抗原中编号为 CD122。人 IL-2Rβ 链基因定位于 22 号染色体。成熟 IL-2Rβ 链有 525 个氨基酸,5 个 N 糖基化位点,包括胞膜外区、穿膜区和胞浆区。胞膜外区由 214 个氨基酸组成,有 8 个 Cys,其结构上有 1 个红细胞生成素(EPO)受体超家族特征性的结构域,还有 1 个Ⅲ型纤维粘连蛋白结构域。跨膜区 25 个氨基酸。胞浆区有 286 个氨基酸,与 EPO 受体胞浆区有一定的同源性。IL-2Rβ 链本身无酪氨酸激酶区,但胞浆区中有两个结构域:一个是靠近膜端的丝氨酸富含区,在 IL- 2 诱导的增殖信号传递中起重要作用;另一个是与酪氨酸激酶相联的酸性区域。缺乏酸性区域的 IL-2Rβ 链突变体能传导增殖信号,并诱导转录 c -myc, 不能介导诱导转录因子 Fos 的作用;缺乏丝氨酸富含区的 IL-2Rβ 链突变体不能诱导细胞增殖及 c -myc 的转录。因此,酪氨酸激酶途径似乎与 c -fos 基因的诱导有关,而非激酶依赖的途径与 c -myc 基因的诱导有关。IL-2Rβ 链主要分布于 T 细胞、大颗粒淋巴细胞(LGL)、B 细胞、pre- T 细胞。
(3)IL-2Rγ:糖蛋白,含 347 个氨基酸,分子量 64kDa。胞膜结构特征属于红细胞生成素家族成员,胞浆区含 86 个氨基酸,从 288~321 位氨基酸序列似乎同源于 src 同源区 2(SH2),此区能与一些磷酸化蛋白中磷酸化酪氨酸残基相连,参与信号的转导。IL-2Rγ 链表达于多种淋巴样细胞表面,如 Molt-β、Molt-4、Jurkat、MT-1、MT- 2 以及 EB 病毒感染的 Raji 细胞。
(4)IL-2R 的组成与亲和力的关系:单独 IL-2Rγ 链不能结合 IL-2,但对于中亲和力 IL-2R(βγ 链)、高亲和力 IL-2R(αβγ 链)的组成、IL- 2 的内化以及信号转导是必需的。X- 性联重症联合免疫缺陷症病人的 IL-2Rγ 基因发生突变而丧失 IL-2R 功能。
表 4 -2 三种亲和力 IL-2R 的组成
| 组成 | 亲和力(Kd) | 细胞分布举例 |
| α 链(p55,CD25) | 低,10-8M | B 淋巴细胞 |
| β 链(p70,CD122)+ γ 链 | 中,10-9M | YT(NK 细胞株),MLA144 |
| α 链 + β 链 + γ 链 | 高,10-11M | PHA 刺激母细胞,HUT102B2 |
(5)可溶性 IL-2R:可溶性 IL-2R(solubleIL-2 receptor,sIL-2R)是膜结合形式 IL-2Rα 链的脱落物,分子量 45kDa。在人类 T 细胞白血病Ⅰ型病毒(HTLV-I)感染的 HUT102B2 细胞培养上清中含有大量 sIL-2R。PBMC 经丝裂原、CD3McAb 和同种异体抗原刺激后可释放 sIL-2R。正常人血清和尿液中亦可检出少量 sIL-2R。sIL-2R 可能与膜表面 IL-2R(mIL-2R)竞争结合 IL-2,从而成为一种免疫抑制物质。sIL-2R 增高可见于某些恶性肿瘤、自身免疫病、病毒感染性疾病以及移植排斥等(见本章第三节)。
4.IL- 2 的生物学作用 IL- 2 的作用具有沿种系谱向上有约束性,向下无约束性的特点,如人的 IL- 2 能促进小鼠 T 细胞的增殖,而小鼠的 IL- 2 不能维持人 T 细胞的生长。IL- 2 体内的半衰期只有 6.9 分钟。有报道用 PEG 对 IL- 2 加以修饰,对生物学活性无影响,半衰期可延长 7 倍左右。目前关于 IL- 2 的生物学作用大都是体外实验的结果。具有中和活性的抗 IL- 2 抗体可抑制 IL- 2 的生物学活性。
(1)Th、Tc 和 Ts 细胞都是 IL-2 的反应细胞:IL- 2 对静止 T 细胞作用较弱。胸腺细胞和 T 细胞经抗原、有丝分裂原或同种异体抗原刺激活化后有在 IL- 2 存在的条件下进入 S 期,维持细胞的增殖。IL- 2 可刺激 T 细胞转铁蛋白受体(TfR,CD71)、胰岛素受体、MHCⅡ类抗原的表达,并产生多种淋巴因子如 IFN-γ、IL-4、IL-5、IL-6、TNF- β 及 CSF 等。
(2)诱导 CTL、NK 和 LAK 等多种杀伤细胞的分化和效应功能,并诱导杀伤细胞产生 IFN-γ、TNF- α 等细胞因子。IL- 2 可增强 CTL 细胞穿孔素(perforin)基因的表达。
(3)直接作用于 B 细胞,促进其增殖、分化和 Ig 分泌。已发现活化的 B 细胞也可具有 IL-2R,IL- 2 对 B 细胞的调节作用除通过刺激 T 细胞分泌 B 细胞增殖和分化因子外,还可能有直接的调节作用。
(4)活化巨噬细胞。
5.IL- 2 的临床应用 目前重组 IL- 2 已用于临床治疗肿瘤以及感染性疾病等。
(1)抗肿瘤:IL- 2 在体外可诱导 PBMC 或肿瘤浸润淋巴细胞(TIL)成为淋巴因子激活的杀伤细胞(LAK)。LAK/IL- 2 对肾细胞癌、黑素瘤、非何杰金氏淋巴瘤、结肠直肠癌有较明显疗效,对肝癌、卵巢癌、头颈部鳞癌、膀胱癌、肺癌等有不同程度的疗效。近年来已开始采用 IL- 2 基因治疗对黑素瘤、肾细胞癌以及神经母细胞瘤等肿瘤等进行临床验证。
(2)治疗感染性疾病:动物实验结果表明,IL- 2 对某些因细胞免疫功能低下而受病毒感染,需增强细胞免疫功能的病人有一定疗效。IL- 2 本身无直接抗病毒活性,它是通过增强 CTL、NK 活性以及诱导 IFN- γ 产生而介导抗病毒感染的。目前用 IL- 2 治疗活动性肝炎已显示出可喜的苗头,对于单纯疱疹病毒感染、AIDS 病(已进入Ⅱ期临床验证)、结节性麻风、结核杆菌感染等也有一定疗效。如 rIL- 2 明显延长结核杆菌 H37RV 株感染小鼠和豚鼠的半数死亡时间,降低死亡率,减少感染动物脾、肺组织内的结核杆菌数。
(3)免疫佐剂作用(adjuvanticity): 应用 IL- 2 作为佐剂与免疫原性弱的亚单位疫苗联合应用,可提高机体保护性免疫应答的水平。此外,最近发现 IL- 2 具有降低血压作用,IL- 2 治疗高血压已进入Ⅰ期临床验证。
(4)采用 IL- 2 白喉毒素融合蛋白治疗类风湿性关节炎进入Ⅰ/Ⅱ期临床验证,约有 74% 患者病情得到改善,IL- 2 融合毒素主要作用于 CD4 阳性淋巴细胞,有较好的选择性。
rIL- 2 体内大剂量使用毒性作用较大,可引起毛细血管渗漏综合征(capillary leak syndrome,CLS)。此外,IL- 2 半衰期短,有时还可在体内诱导产生一定抗体。
美国 Immunex 应用抗 IL-2Rα 链 McAb 预防骨髓移植后 GVHR 进入Ⅱ期临床试验。
(三)IL-3
见本节集落刺激因子。
(四)IL-4
1982 年 Howard 发现 T 细胞培养上清中有一种促进 B 细胞增殖的因子,起初命名为 B 细胞生长因子 -1(b cell growth factor-1,BCGF-1)。有的实验室称为 B 细胞刺激因子 -1(b cell stimulatingfactor-1,BSF-1)、T 细胞生长因子 -2(T cell growth factor-2,TCGF-2)。1986 年基因克隆成功,国际统一命名为白细胞介素 4(interleukin 4,IL-4)。
1.IL- 4 的产生 在人类 IL- 4 主要由活化 T 细胞产生。在小鼠由 Th2 亚群产生。此外,肥大细胞、IL- 2 刺激小鼠 T 细胞系 2.19、ConA 刺激人 Th 克隆 2F1、小鼠胸腺瘤 EL- 4 细胞以及 B 细胞系 CH12 均能分泌 IL-4。
2.IL- 4 的分子结构和基因 小鼠 IL- 4 基因长约 6kb,成熟 IL- 4 分子由 120 氨基酸残基组成,裸肽分子量为 14kDa,有 3 个糖基化点,经糖基化后 IL- 4 分子量为 30kDa。人 IL- 4 基因定位于第 5 号染色体,由 4 个外显子和 3 个内含子组成,约 10kb,是现知淋巴因子基因中较大的一个。成熟人 IL- 4 分子由 129 氨基酸残基组成,15kDa,有 2 个糖基化点,含有 6 个半胱氨酸,参与分子内二硫键的组成。人与鼠 IL-4DNA 水平上有 70% 同源性,IL- 4 前体蛋白从 N 端到 91 位氨基酸以及 C 端到 128 位氨基酸人小鼠之间在氨基酸水平上有 70% 同源性,前体蛋白 91 至 128 位氨基酸之间很少有同源性,这可能与 IL- 4 种属作用特异性有关,如人、鼠 IL- 4 生物学作用上没有交叉反应。
3.IL- 4 的受体人 IL- 4 受体(IL-4R)由 800 氨基酸残基组成,分子量为 140kDa,胞膜外区 207 氨基酸,跨膜区 24 氨基酸,胞浆区 569 氨基酸,与小鼠 IL-4R 有 53% 同源性,属于红细胞生成素受体超家族成员,最近命名为 CDw124。在小鼠,T 细胞、B 细胞、胸腺细胞、骨髓细胞、巨噬细胞和肥大细胞表面都有 IL-4R,每个细胞受体数目在 100~2000 左右,其亲和力 Kd 在 10-10~10-11M,1~5×10-12 M 浓度的 IL- 4 可使 B 细胞增殖(3H-TdR 掺入率)达到最大值的 50%。LPS 对 B 细胞 IL-4R 表达有正调节作用,受体数量可增加 5~10 倍。IL- 4 与相应受体结合后细胞内传递信号的途径尚不清楚,IL-4R 胞浆区富含苏氨酸和丝氨酸,PTK 和 PKC 可能参与受体介导的信号传递,IP3 和 Ca2+浓度升高。在小鼠发现有不同剪接形式 mRNA 所翻译的分泌型(可溶性)IL-4R(sIL-4R)。sIL-4R 与膜型 IL-4R(mIL-4R)同配体 IL- 4 结合时具有相同的亲和力。sIL-4R 可能是 IL- 4 保护性载体,或调节 IL- 4 的生物学活性。
4.IL- 4 的生物学活性 IL- 4 对于 B 细胞、T 细胞、肥大细胞、巨噬细胞和造细胞都有免疫调节作用。
(1)B 细胞:促进 SAC 或抗 IgM 预先刺激 B 细胞的增殖,这一生物学功能已被用来作为检测 IL- 4 的生物学活性。IL- 4 促进 B 细胞 MHCⅡ类抗原、FcεRⅡ/CD23 和 CD40 的表达,并增强 B 细胞提呈抗原能力,使免疫系统对小量抗原刺激发生免疫应答。增加 FcεRⅡ/CD23(Ige Fc 段低亲和力受体)的表达,并释放可溶性 CD23(sCD23)/IgE 结合因子(IgE-BF),与 mIgE 阳性细胞结合并诱导其分化,可能与促进 B 细胞 IgE 的产生有关。IL- 4 提高 LPS 刺激小鼠 B 细胞 IgG1、IgE 产生水平分别为 8~10 倍和 10~100 倍,但对 IgG3 分泌降低 6~10 倍,IgG2a、IgG2b 和 IgM 有不同程度下降,对 IgA 产生无明显影响。IL- 4 增强 IgG1 和 IgE 水平的机理可能是:①使选择性刺激定向产生 IgG1 或 IgE 的 B 细胞的增殖和分化;②增加特异的重链稳定区(CH)Ig 类的转换区 Sμ-Sγ1 结合,促进 IgG1 合成和分泌。IFN- γ 对 IL- 4 上述生物学功能有明显抑制作用。而 IL- 4 则可抑制 IFN-γmRNA 的转录和抑制 IFN- γ 诱导 B 细胞产生 IgG2a。寄生虫感染时血清 IgG1 和 IgE 水平升高。此外,IL- 4 还可促进休止期 B 细胞的早期活化,从 G o期进入 G 1期,细胞体积增大,并表达 CD25。
(2)T 细胞:IL- 4 是 T 细胞自身分泌的生长因子,如 HT- 2 细胞系是一种 IL- 2 依赖细胞系,IL- 4 可单独维持 TH- 2 的增殖,抗 IL- 2 和抗 IL-4McAb(11B11)可分别抑制 IL- 2 和 IL- 4 刺激 IL- 2 细胞的增殖作用,但相互之间无交叉抑制作用。纯化后的 T 细胞(CD4 阳性或 CD8 阳性亚群)对 IL- 4 的增殖反应还需要 IL-1(或 PMA)的协同作用;而 IL- 2 单独可维持活化 T 细胞的增殖。表明 IL- 4 生长信号的传递过程与 IL- 2 有所不同。高剂量 IL- 4 能诱导 CD4-CD8+ 或 CD4+CD8- 或 CD4-CD8- 胸腺细胞的增殖。IL- 4 增强 PHA 刺激 T 细胞释放 GM-CSF 和 G -CSF。在小鼠实验系统中,多数情况下 IL- 4 对 CTL 和 LAK 细胞的分化有正调节作用;而对人的杀伤细胞则有时表现为负调节作用,如在人 MLC 中 IL- 4 选择性地促进 Th 增殖,同时伴有 CTL、NK 和 LAK 功能的降低。此外 IL- 4 还能抑制 IL- 2 所诱导的 NK 白血病细胞 LAK 活性。最近发现,用 IL- 4 与 T 细胞或 B 细胞温育,可降低高亲和力 IL-2R 位点数,但不影响低亲和力 IL-2R 的数量。IL- 4 还可刺激 CD3 阴性 NK 细胞克隆和生长。
(3)刺激肥大细胞增殖,并与 IL- 3 有协同作用,尤其对于粘膜和结缔组织型肥大细胞体外生长是必需的。
(4)促进巨噬细胞提呈抗原和杀伤肿瘤细胞的功能,可能与调节 MHCⅡ类抗原和 FcR 表达有关。IL- 4 与 GM-CSF、IL- 3 和 LPS 有协同作用。IL- 4 可诱导外周血单核细胞分泌 G -CSF 和 M -CSF,增强中性粒细胞介导的吞噬、杀伤活性和 ADCC 作用。IL- 4 是小鼠巨噬细胞趋化因子,并促进 IL-1ra 产生,但抑制单核细胞 IL-1、TNF 和 IL- 6 的产生。
(5)协同 CSF 刺激造血细胞的增殖,与 G -CSF 协同增强粒细胞集落形成,协同红细胞生成素(EPO)增强 BFU- E 的形成。
IL- 4 作为肿瘤免疫调节剂已进入Ⅱ期临床试验。此外,还开始进行治疗免疫缺陷症的临床试验。由于体内、体外均证实 IL- 4 可以抑制 IL-1、IL- 6 和 TNF 分泌,并促进 IL-1ra 产生,因此应用 IL- 4 可能为治疗败血症休克提供一种新的方法。
(五)IL-5
1980 年 Takatsu 等发现在 T 细胞条件培养液中,含有一种因子能替代 T 细胞在体外协同胸腺依赖抗原的抗体应答,称为 T 细胞替代因子(t cell replacing factor,TRF)。由于这种因子对 B 细胞和啫酸性粒细胞增殖、分化有重要调节作用,又名 B 细胞生长因了了 -Ⅱ(b cellgrowth factor-Ⅱ,BCGF-Ⅱ),IgA 增强因子(IgA-enhancingfactor,IgA-EF),嗜酸性粒细胞集落刺激因子(eosinophilcolony-stimulating factor,Eo-CSF)和嗜酸性粒细胞分化因子(eosinophildifferentiation factor,EDF)。1986 年统一命名为白细胞介素 -5(interleukin 5,IL-5)。
1.IL- 5 的产生 在人类 IL- 5 主要由活化 T 细胞产生,在小鼠则由 Th2 亚群细胞产生。
2.IL- 5 的分子结构和基因 1986 年 Kinashi 获得 IL-5cDNA 克隆。小鼠 IL- 5 由 133 氨基酸残基组成,含 21 氨基酸的信号肽,成熟 IL- 5 分子含有 112 氨基酸残基,裸肽分子量 12~15kDa,有 3 个糖基化位点,糖基化后分子量为 18kDa,糖基化对于 IL- 5 活性表达以及与相应受体的结合起重要作用。小鼠 IL- 5 通常以二硫键连接的二聚体形式存在,分子量为 45kDa。人的 IL- 5 由 134 氨基酸残基组成,含 22 氨基酸残基信号肽,2 个糖基化点,人和小鼠 IL- 5 基因分别定位于第 5 号和第 11 号染色体,与 IL-3、IL-4、GM-CSF 等造血因子的基因密切连锁。人和鼠 IL- 5 在氨基酸水平上有 70% 的同源性,生物学作用有交叉反应。
3.IL- 5 受体 小鼠 IL- 5 由 α 和 β 两条链组成。α 链,p60,含 415 个氨基酸,糖蛋白,先导序列 17 个氨基酸,胞膜外区 322 氨基酸残基,空膜区 22 个,胞浆区仅 54 个氨基酸残基。α 链单独结合 IL- 5 为低亲和力,参与信号的转导;β 链,p130,单独不结合 IL-5,与 α 链共同组成高亲和力受体。小鼠 IL-5Rβ 与 IL-3R 的 β 链(AIC2B 基因产物)相同,人 IL-5Rβ 链是与 IL-3Rβ 链、GM-CSFRβ 是共同的。由于 mRNA 剪接的不同,已发现有二种可溶性小鼠 IL-5Rα 链,其中一种可抑制 IL- 5 与膜结合 IL-5R 的结合。人和鼠 IL-5Rα 链有 79% 的同源性。
4.IL- 5 的生物学活性 与其它 IL 相比,IL- 5 生物学活性作用谱相对较窄。
(1)小鼠 IL- 5 促进抗原刺激的 B 细胞分化为抗体合成细胞,主要作用于进入细胞增殖后期的 B 细胞,并增加活化 B 细胞 IL-2R 的表达,IL- 5 的这种刺激作用与人 IL- 6 功能相似,人 IL- 5 只作用于 B 细胞刺激后很窄的时相内。
(2)促进 IgA 合成,其机理可能是:①作为 IgA 特异性启动因子,使 mIgM 阳性 B 细胞分化为 mIgA 阳性 B 细胞;②作用于 IgA 型 B 细胞,促进其增殖和分化,成为分泌 IgA 的浆细胞。IL- 4 有协同 IL- 5 促进 IgA 合成的作用。IL- 5 对 IgM 的分泌也有促进作用。
(3)协同 ConA 或 IL- 2 诱导胸腺中杀伤性 T 细胞前体(CTPp)分化为 CTL。
(4)趋化人嗜酸性粒细胞,延长成熟嗜酸性粒细胞的存活时间,刺激人和小鼠嗜酸性粒细胞的功能,诱导嗜酸性粒细胞的分化。
(六)IL-6
1980 年发现成纤维细胞经 Poly I- C 刺激后能产生一种抑制病毒复制的细胞因子,称为 β2 干扰素(IFN-β2)。以后的研究结果未能证实这种因子的直接抗病毒作用,但具有其它多方面的生物学功能,根据实验系统和功能的不同,不被命名为杂交瘤 / 浆细胞瘤生长因子(hybri-doma/plasmacytoma growthfactor,HPGF),B 细胞分化因子(B cell differentiationfactor,BCDF),B 细胞刺激因子 -2(b cellstimulatory factor 2,BSF-2),26kDa, 溶细胞性 T 细胞分化因子(cytolytic T cell differentiation factor,CDF)和肝细胞刺激因子(hepatocyte stimu-lating factor,HSF)等。1986 年统一命名白细胞介素 6(interleukin 6,IL-6)。
1.IL- 6 的产生 淋巴样和某些非淋巴样细胞均可产生 IL-6。
(1)T 细胞:T 细胞产生 IL- 6 依赖于巨噬细胞或 PMA。抗原提呈细胞刺激相应的 T 细胞克隆,以及 HTLV- I 感染的 T 细胞系等均可分泌 IL-6。
(2)B 细胞:如 SAC 刺激而活化的 B 细胞。
(3)单核细胞:LPS 刺激单核细胞产生 IL-6,某些单核细胞系如 P388D1 也可分泌 IL-6。
(4)成纤维细胞:可自发产生 IL-6,其它因子或刺激物如 IL-1、TNF、PDGF、IFN-β、PolyI-C、A23187、PMA 等可促进 IL- 6 的产生。
(5)肾小球系膜细胞、角朊细胞、内皮细胞等在一定培养条件下均可产生 IL-6。此外,肿瘤细胞或细胞系如 MG63 成骨肉瘤,T24 膀胱癌、A549 肺癌、7860 肾癌、SK-MG- 4 神经胶质母细胞瘤、U373 星状细胞瘤、心脏粘液瘤细胞和骨髓瘤细胞等也能分泌 IL-6。最近发现垂体前叶中的滤泡—星状细胞(folliculostellate)可产生 IL-6,可能与败血症时 LPS 刺激导致 GH、ACTH 等激素水平升高有关。
IL-1、TNF、IFN-β、PDGF、LPS、Poly Ⅰ-C、A23187 和 PMA 等对 IL- 6 的产生具有正调节作用。
2.IL- 6 的分子结构和基因 1985 年 Kishimoto 等从人 T 细胞中首先获得 IL-6cDNA 克隆成功,人 IL- 6 基因与小鼠有 65% 同源性。人 IL- 6 基因位于第 7 号染色体,长约 5kb, 有 5 个外显子和 4 个内含子。
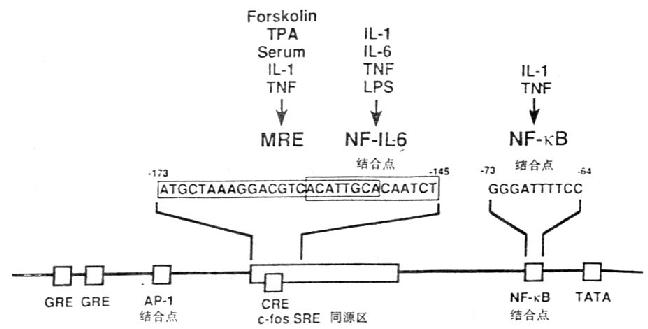
图 4 -1 IL- 6 基因的功能调节区
在 IL- 6 基因功能调节区基因中存在着儿种转录控制元件(transcriptional control element),如糖皮质激素反应元件(glucocorticoidresponsive elements,GRE)、AP- 1 结合位点、c-fos 血清反应元件同源物(c-fos serum responsiveelement homology,c-fos SRE homology),cAMP 反应元件(cycli AMp responsive element,CRE)和 NF-κB 结合位点。IL-1、TNF 等细胞因子可使 IL- 6 启动子很快发生一过性的活化。IL- 1 反应的元件在 IL- 6 启动基中 -180/-123;IL- 6 核因子(NF-IL-6)识别一段特殊的 14bp,ACATTGCACAATCT。多反应元件(multi-responseelement,MRE)位于 c -fos SRE 同源区内,这个区域对 IL-1、TNF、forskolin 和 PMA 诱导 IL- 6 产生有关;与 IL-1、TNF 刺激 IL- 6 产生有关的 NF-κB 位于 TATA 盒的上游。
人 IL- 6 分子由 212 个氨基酸残基组成,包括 28 个氨基酸残基的信号序列,成熟 IL- 6 为 184 氨基酸残基,分子量 26kDa。IL- 6 分子由 4 个 α 螺旋和 C 端(175~181 位氨基酸)受体结合点所组成,其中 179 位精氨酸残基对于与受体的结合非常重要。分子中糖基对生物学活性功能并非必需,N 端 23 个氨基酸残基虽不直接与 IL- 6 生物学活性有关,但对整个 IL- 6 分子组成起稳定作用。人 IL- 6 氨基酸序列与小鼠 IL- 6 有 42% 同源性,人的 IL- 6 对小鼠某些细胞有刺激作用。IL- 6 与 G -CSF 和 IFN- β 有较高同源性,对骨髓造血细胞和髓样白血病细胞的某些作用也有相似之处。
3.IL- 6 的受体 目前已知,IL-6R 至少由称之为 IL- 6 结合受体蛋白(IL-6binding receptor protein)和称为信号转导蛋白(signal-transducingprotein)的 gp130 所组成,习惯上前者称之 IL-6R。
(1)IL-6R(CD126):人 IL-6R 由 468 个氨基酸组成,切除 N 端 19 个氨基酸残基后的成熟分子有 449 氨基酸,胞膜外区、穿膜区和胞浆区分别为 339、28 和 82 个氨基酸,分子量为 80kDa,6 个 N 糖基化位点。胞膜外由一个 Ig 样区(C2,约 100 氨基酸)、2 个Ⅲ型纤维结合蛋白结构(各含 100 氨基酸)及 1 个细胞因子受体的同源区所组成,后者含 4 个保守的 Cys 和一个 WSXWS 结构。单独 IL-6R 与 IL- 6 结合为低亲和力。IL-6R 分布于淋巴样细胞和非淋巴样细胞,如活化 B 细胞、EBV 转化 B 细胞、急性淋巴母细胞白血病细胞、骨髓瘤细胞、静止 T 细胞、肝细胞、单核细胞、急性髓样白血病(AML)细胞、嗜铬细胞瘤细胞等。
(2)gp130(CDw130):分子量为 130kDa 的糖蛋白,共有 14 个潜在 N - 糖基化位点,胞膜外区、穿膜区和胞浆区分别有 597、22 和 277 个氨基酸。胞膜外区有 1 个 IgC2 区,6 个Ⅲ型纤维结合蛋白的结构,其中第二个和第三个结构区之间有 4 个保守的 Cys 和 WSXWS 结构的区域,形成 1 个细胞因子受体家族结构特征的结构域。gp130 不能直接与配基 IL- 6 结合,在生理情况下,IL- 6 与 IL- 6 受体结合后使 IL-6R 的构象发生变化并迅速与两个 gp130 分子结合,形成高亲和力的结合位点,并通过 gp130 亚单位传递信号。人和小鼠 gp130 在氨基酸水平上有 77% 的同源性。转染 gp130cDNA 小鼠 pro- B 细胞在 IL-6/sIL-6R 复合物刺激下可传递增殖信号。小鼠体内注射 IL- 6 可增加 gp130mRNA 的表达。目前已证实,gp130 除组成 IL- 6 高亲和力受体外,也是白血病抑制因子(LIF)、抑瘤素 M(OSM)、睫状神经营养因子(CNTF)和 IL-11 等受体所共用的亚单位。
(3)信号转导:gp130 与 IL-6/IL-6R 复合物结合后,刺激 gp130 胞内部分发生酪氨酸磷酸化,目前关于参与此过程的酪氨酸蛋白激酶的作用还不清楚。酷氨酸激酶被激活后继而引起丝氨酸 / 苏氨酸激酶如丝裂原活化的蛋白激酶(mitogen activated proteinkinase,MAPK)的激活,使 NF-IL- 6 中丝氨酸和苏氨酸磷酸化而被激活,从而促进相应基因的活化。
(4)sIL-6R:存在于正常人尿、骨髓瘤细胞系 U266 培养上清,PHA 活化人 PBMC 以及 HTLV- I 阳性细胞也能分泌 sIL-6R,分子量为 50kDa。用反转录 PCR 从正常人细胞和骨髓瘤细胞中均分离出编码 sIL-6r mRNA, 序列分析表明与膜结合受体相应区域序列一致。sIL- 6 也可从膜结合的 sIL-6R(mIL-6)脱落而来。sIL-6R 与 IL-12p40 亚基具有高度同源性,而 IL- 6 与 IL-12 的 p35 亚基序列高度同源。因此可以推测类似于 IL-6/sIL-6R 复合物的 IL-12 分子可能也通过类似于 pg130 分子作用于细胞。与其它可溶性细胞因子受体不同,sIL-6R 结合 IL- 6 后可与细胞膜表面 gp130 结合,增强 IL- 6 的刺激活性。而可溶性 gp130(sgp130)可抑制 sIL-6R/IL- 6 复合物的活性。sIL-6R 水平的升高与某些自身免疫性疾病有关。
4.IL- 6 的生物学活性
(1)刺激细胞生长:IL- 6 可促进多种细胞的增殖,如 B 淋巴细胞杂交瘤、浆细胞瘤、EBV 转化的 B 细胞、T 细胞、PMA 和 IL- 4 刺激的胸腺细胞、造血干细胞、角朊细胞和肾小球系膜细胞。
(2)促进细胞分化:如 B 细胞分化和 Ig 的分泌,CTL 分化,协同 IL- 2 增强 CTL 中穿孔素基因的表达,并增加 T 细胞 IL- 2 产生和 IL-2R 表达,诱导异巨噬细胞、神经细胞和 NK 细胞分化。协同 IL- 3 促进干细胞分化和巨核细胞的成熟。明显促进小鼠骨髓移植后免疫功能的重建。
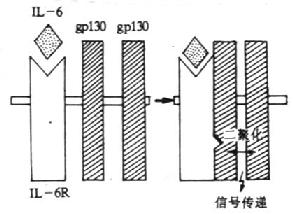
图 4 -2 IL- 6 受体信号传递的模式图
(3)加速肝细胞急性期蛋白(acute phase protein)的合成。
(4)抑制 M1 髓样白血病细胞系的生长,促进其成熟和分化;抑制黑素瘤、乳腺癌细胞生长。
5.IL- 6 与临床 IL- 6 与临床上多种疾病的发生有一定的关系。
(1)IL- 6 与自身免疫性疾病
①心脏粘液廇:患者往往表现为高丙球蛋白血症,有多种血身抗体以及急性期蛋白升高。培养的粘液瘤细胞含有 IL- 6 和 IL-6mRNA,患者血清中 IL- 6 明显升高,骨髓中可见有 IL- 6 依赖的多克隆浆细胞增殖。手术后上述症状和体症可见逐渐消退。
②Castleman 氏病:患者表现为高丙球蛋白血症,急性期蛋白和血小板升高,增生的淋巴结生发中心中 B 淋巴样细胞产生 IL-6,其中某些患者可发展成为多发性骨髓瘤。
③类风湿性关节炎:表现为多克隆性浆细胞增多症,自身抗体、C 反应蛋白(CRP)和血小板升高。急性期血清以及关节的滑液中能测到 IL-6,滑液中 IL- 6 与 IgG 以及血清中 IL- 6 与 C 反应蛋白之间有明显的相关性。患者的 T 细胞、B 细胞、滑膜细胞以及软骨细胞均可产生 IL-6。
④艾滋病:与艾滋病患者多克隆 B 细胞活化有关,HIV 感染诱导单核细胞产生 IL- 6 可能引起血清中 IL- 6 水平的升高。此外,IL- 6 可能是 Koposi 氏肉瘤的主要生长因子之一,反义 IL- 6 基因在体内可抑制 Koposi 氏肉瘤细胞的生长。
(2)IL- 6 与肿瘤
①浆细胞瘤形成:慢性炎症诱导 IL- 6 生物合成增加与浆细胞瘤的发生有关。如用石腊或降植烷腹腔刺激小鼠,诱导炎症,可诱导出较高比例的浆细胞瘤。在患者也可见到类似情况,如早先发生的类风湿性关节炎可能与浆细胞瘤形成有关。在体外,IL- 6 可促进浆细胞瘤和骨髓瘤细胞的生长,某些浆细胞瘤细胞生长依赖于 IL- 6 的存在。
②可能通过自分泌机理与非 Hodgkin 氏淋巴瘤、慢性淋巴细胞白血病和急性髓样白血病的发病有关。血清中 IL- 6 水平与多发性骨髓瘤如浆细胞白血病病情严重程度有关。多发性骨髓瘤患者不仅骨髓细胞表面 IL-6R 表达增加,而且血浆中 sIL-6R 水平明显升高。
(3)IL- 6 与膜增生性肾小球肾炎(mesangial proliferativeglomerulonephritis,MPG):MPG 患者尿中可测出 IL-6,而且其水平与疾病的发展有关。体外培养的患者肾小球膜细胞可产生 IL-6,提示 MPG 发生与 IL- 6 的自分泌有关。
IL- 6 转基因小鼠可出现某些与临床上相似的变化,如血清中高浓度的 IL- 6 和 IgG1,浆细胞增多症,MPG 的发生以及骨髓中巨核细胞的成熟。
(4)烧伤和术后伴有血清 IL- 6 水平增加。
(5)病毒性脑膜炎和脊髓膜炎小鼠的胶质细胞可分泌大量 IL-6,IL- 6 又可促进脑胶质细胞分泌其它神经营养因子和神经生长因子。
(6)IL- 6 作用于下丘脑 - 垂体 - 肾上腺轴,刺激 ACTH 和皮质激素的释放以及星状细胞合成内啡肽。
IL- 1 和 TNF- α 对 IL- 6 引起的病理损伤可能有协同作用。
应用 IL- 6 治疗放疗、化疗所致血小板减少症、癌症以及作为疫苗佐剂已进入临床试验。
(七)IL-7
1982 年 Whitlock 建立了骨髓长期培养系统(LTBMC),使得人们有可能对 B 细胞前体的增殖和分化进行深入的研究。由于 B 细胞前体的生长对于基质细胞有严格的依赖性,推测骨髓基质细胞可能分泌一种 B 细胞前体细胞的生长刺激因子。1988 年 Namen 等应用 LTBMC 获得一株 SV40 病毒转染的骨髓基质细胞株(bone marrow stromal cell line)IXN/A6,能分泌一种前 B 细胞刺激因子,起初命名为淋巴细胞生长素(lymphopoietin-1,LP-1),或小鼠前 B 细胞生长因子(murine pre-B cell growth factor),1988 年统一命名为 IL-7。
1.IL- 7 的产生 由骨髓基质细胞和胸腺基质细胞产生,以 IL-7 cDNA 为探针,在小鼠胸腺、脾、肾、肝等细胞中均测得有 IL-7mRNA 存在,但大小不一。
2.IL- 7 的分子结构和基因 天然 IL- 7 分子量约为 25kDa,在 69 和 90 位氨基酸残基有 N 糖基化点,分子内有 6 个半胱氨酸,可能参与链内二硫键的形成,对 IL- 7 的生物学活性起重要作用。1988 年 Namen 等用 IXN/A6 细胞株建立 cDNA 文库,筛选出 IL- 7 的 cDNA,经克隆后 COS- 7 细胞中表达出有活性 IL-7。小鼠 IL- 7 前体有 154 氨基酸残基,25 氨基酸残基的信号肽,成熟的 IL- 7 由 129 氨基酸残基组成,推算裸肽分子量为 14.9kDa,小于天然 IL-7,但活性类似。1989 年 Goodwin 以小鼠 IL-7cDNA 为探针,从人肝癌细胞系 cDNA 文中,获得与小鼠 IL-7 cDNA 高度同源的人 IL-7cDNA 克隆,并在 COS 细胞中得到表达。人 IL- 7 基因定位于第 8 号染色体。rHuIL- 7 分子有 177 个氨基酸,包括 25 个氨基酸先导序列,成熟 IL- 7 分子有 152 个氨基酸,裸肽分子量 17.4kDa,与小鼠 IL- 7 有 60% 同源性。IL- 7 对 pH 改变(pH2.1~8)、SDS、热等理化因素均有一定的抵抗。
3.IL- 7 受体 IL- 7 依赖的小鼠 IXN/2b 基质细胞表面存在高亲和力(Kd~1×10-10M)和低亲和力(Kd~4×10-8M)两种类型受体。每个细胞约有 2000~2500 个受体,其中 15~20% 为高亲和力型。在 Pre-B、胸腺细胞、部分 T 细胞株上和某些巨噬细胞肿瘤细胞株上有 IL-7R,成熟 B 细胞上无 IL-7R 表达。不成熟 B 细胞前体所表达的 IL-7R 与酪氨酸激酶信号转导途径密切相关,酪氨酸磷酸化是 IL-7R 介导的跨膜信号产生和传递过程中必不可少的步骤。现已发现一种由于 mRNA 的不同剪接所产生的可溶性 IL-7R,可有效地结合 IL-7,可能是 IL- 7 是一种抑制物。最近研究表明,IL-7R 属于红细胞生成素受本超家族成员,并有 1 个Ⅲ型纤维粘连蛋白结构域。
4.IL- 7 的生物学活性 人 IL- 7 可作用于小鼠的前 B 细胞,小鼠 IL- 7 对人前 B 细胞则无刺激作用。目前所知 IL- 7 的主要生物学活性有以下几方面。
(1)B 细胞:刺激 Pre~B 细胞(B220+)的生长,TGF- β 对此有抑制作用,但不被抗 IL-4、抗 IL-6McAb 以及抗 IL-2R、IL-3R 和 IL-5R 的 McAbs 所抑制。对骨髓中淋巴干细胞的分化可能也有刺激作用。纯化 IL- 7 在 10-13 M 即可刺激 IXN/2b 细胞增殖。
(2)胸腺细胞:促进胸腺中 CD4-CD8- 和 CD4+CD8+ 细胞亚群的增殖。
(3)T 细胞:促进混合淋巴细胞培养(MLC)或 PMA 刺激 T 细胞的增殖,协同 ConA 刺激 T 细胞产生 IL- 2 以及 IL-2R 和 ICAM- 1 的表达。IL- 7 诱导 T 细胞增殖可通过 IL- 2 依赖和不依赖两种途径。
(4)诱导人 PBMC 产生 LAK 活性,加入 IL- 2 抗血清对 LAK 活性无显著变化,表明 IL- 7 这种诱导 LAK 活性作用不依赖 IL-2,IL- 7 诱导 LAK 的前体细胞主要来血 PBMC 中的 NK。IL- 4 对这种诱导作用有抑制效应,抗 IL- 4 抗血清可使 IL- 7 诱导 LAK 活性提高 4~10 倍。
(八)IL-8
见本节趋化因子。
(九)IL-9
1988 年 Uyttenhove 等报道了一种来自小鼠 T 细胞的细胞因子,能支持某些 Th 细胞克隆的生长,分子量在 30~40kDa,又称 T 细胞生长因子 -Ⅲ(t cellgrowth factor Ⅲ,TCGF-Ⅲ)或 P40。人 IL- 9 最初是从 HTLV-Ⅰ感染的 T 细胞系培养上清中发现的,能刺激人巨核细胞白血病细胞株 Mo7e 的增殖。1990 年命名为 IL-9。
1 .IL- 9 的产生 IL- 9 由活化 T 细胞(主要是 CD4+ T 细胞)产生,PHA 或抗 CD3McAb、Ca2+载体可诱导 T 细胞分泌 IL-9,PMA 有协同作用。PMA 和 Ca2+载体刺激人 PBMC 可转录大量 IL-9mRNA。此外,HTLV- I 转化的 T 细胞株 C5MJ2 细胞、肥大细胞也可产生 IL-9。目前还没有检测到静止 T 细胞或活化 B 细胞中有 IL-9mRNA 的表达。
2.IL- 9 的分子结构和基因 人和小鼠 IL- 9 基因结构相似,在 DNA 水平上有 67% 同源性。人 IL- 9 基因由 5 个外显子和 4 个内含子组成,基因长约 4kb,与 IL-3、IL-4、IL-5、M-CSF、GM-CSF、c-fms、PDGFR 基因位于第 5 号染色体中,在小鼠位于 13 号染色体。IL- 9 基因 5′非翻译区(UTR)含有 TATA 盒以及活化蛋白(activator protein,AP)1、2 和 3,NF-κB,specificity protein-1(SP-1)位点和糖皮质激素反应元件(GRE)等识别位点。小鼠 IL- 9 分子的前体由 144 个氨基酸残基组成,含 18 个氨基酸残基的信号肽。人成熟 IL- 9 由 126 个氨基酸残基组成,分子量为 14.2kDa。人和小鼠 IL- 9 在氨基酸水平的 56% 同源性。均含有 10 个保守的半胱氨酸,在生理情况下可能形成复杂的二硫键。IL- 9 为碱性蛋白,有多个 N 糖基化点。
3.IL- 9 受体 IL-9R 结构上属于红细胞生成素受体超家族(ERS),与配体结合为高亲和力。小鼠 IL-9R 含 468 个氨基酸,人 IL-9R 为 553 个氨基酸,两者有 53% 同源性。在小鼠已发现有缺乏空膜区和胞浆区的可溶性 IL- 9 受体(sIL-9R)。
4.IL- 9 的生物学功能 与其他的细胞因子不同,小鼠 IL- 9 可作用于人的细胞,而人的 IL- 9 却对小鼠细胞无刺激活性。
(1)维持 T 细胞生长,为一种自分泌生长因子,因此又称为 T 细胞生长因子 -Ⅲ(TCGF-Ⅲ)。由于抗 CD3McAb 能诱导 IL- 9 产生,故推测 IL- 9 对 T 细胞抗原刺激后启动的免疫应答有重要调节作用。
(2)IL- 9 对于 IL- 4 诱导 PBL 中正常 B 细胞 IgG、IgE 和 IgM 的产生有促进作用。
(3)小鼠 IL- 9 协同 IL- 3 或 IL- 4 刺激骨髓来源肥大细胞的增殖,并诱导其产生 IL-6。
(4)刺激巨核母细胞白血病细胞的生长。此外,人和鼠 IL- 9 均可与 EPO 协同,支持体外骨髓细胞红细胞系的爆发形成单位(erythroid burst forming units,BFU-E)的产生。IL- 9 单独能支持 BFU- E 的短期存活。
IL- 9 可能与 Hodgkin 氏病的发生有关。原代或传代培养的 Hodgkin 氏瘤和 Reed-Sternberg 细胞表达 IL- 9 和 IL-9R。
(十)IL-10
1989 年美国 DNAX 研究所 Fiorentino 等发现小鼠 Th2 细胞株 D10.G4.1 产生一种新的细胞因子,能抑制 Th1 细胞株细胞因子 mRNA 的转录,称为细胞因子合成抑制因子(cytokine synthesis inhibitory factor,CSIF), 同年命名为白细胞介素 10(interlenkin 10,IL-10)。
1.IL-10 的产生 抗原或丝裂原刺激小鼠 Th2 细胞株 D10.G4.1 以及 CDC25、CDC35、D9、MB2- 1 等细胞可分泌 IL-10。在小鼠,活化胸腺细胞、巨噬细胞、角朊细胞、Ly1+(CD5+)和正常 B 细胞也可产生 IL-10;在人类,某些 CD4+ T 细胞克隆、来自 AIDS 病人 B 细胞系、EBV 感染的淋巴母细胞、Burkitt 氏淋巴瘤、活化单核细胞、外周血 T 细胞(包括 CD8+ 细胞,CD4+CD45RA+naive T 细胞、CD4+CD45RO+ 记忆 T 细胞)均可产生 IL-10。
2.IL-10 的分子结构和基因 小鼠和人 IL-10 基因都定位于第 1 号染色体,其基因组包括 5 个外显子和 4 个内含子,并可能有 NF-κB 和 AP- 1 的结合位置。人和小鼠 IL-10 在 DNA 和氨基酸水平上分别有 81% 和 73% 的同源性。DNA 序列分析表明,IL-10 与 EB 病毒基因组中开放读框区 I(BCRF-I)有 70% 左右的同源性。有人把 BCRF- I 的基因产物称为病毒 IL-10(vIL-10),提示 EBV 可能摄取了哺乳动物 IL-10 的基因,以求自身的生存。如 EBV 感染过程中通过产生 vIL-10 抑制宿主细胞 IFN- γ 产生,保持 EBV 在宿主细胞内生存和繁殖。Moore 等已克隆成功 IL-10cDNA,并在 COS7 细胞中得到表达。人和小鼠 IL-10 均含 178 个氨基酸残基,内有 18 氨基酸信号肽系列,裸肽分子量 18.7kDa,PI8.1。成熟 IL-10 分子为 160 氨基酸残基,小鼠和人 IL-10 分子中分别含 5 个和 4 个半胱氨酸残基,由于不同糖基化可使分子量有所差别,在 35~40kDa 之间,酸性条件下不稳定,在溶液中呈非共价连接的同源双体。人 IL-10 可作用于小鼠源性细胞,而小鼠 IL-10 对人的细胞则无作用。
3.IL-10 的生物学功能
(1)抑制小鼠 Th1 细胞的增殖以及 IL-2、IL-3、IFN-γ、TNF 以及 GM-CSF 等细胞因子合成。其作用机理可能是 IL-10 作用于 APC 细胞,降低其 MHCⅡ类抗原的表达,或诱导 APC 细胞产生另一种细胞因子,改变细胞内信号的传递途径,从而选择性抑制某些细胞因子 mRNA 转录。IL-10 可抑制人 TH0、TH-1、TH- 2 样 T 细胞克隆的增殖。
(2)促进肥大细胞和胸腺细胞增殖,IL-10 也是淋巴结、脾脏细胞生长的复合因子(cofac-tor)。
(3)协同 IL- 2 诱导 ConA 活化脾细胞中 CTL 前体细胞(CTLp)分化为成熟的 CTL。
(4)提高 B 细胞的存活率,促进 B 细胞的增殖、MHCⅡ类抗原表达以及 Ig 的分泌,并与 Th2 所产生的 IL-4、IL- 5 有协同作用。
(5)抑制 NK 细胞因子的产生。
IL-10 的拮抗剂可能具有抗 EB 病毒的作用;而 IL-10 通过促进单核细胞表达 IL-1ra 而可能成为抗炎症的治疗手段,动物实验表明,IL-10 可有效地避免 LPS 诱导小鼠休克而造成的死亡。
(十一)IL-11
IL-11 最初由 Paul 等在灵长类动物骨髓基质细胞株 Pu-34 培养上清发现的。这种生长因子可刺激 IL- 6 依赖的小鼠浆细胞瘤细胞系 T1165.85.2.1 的生长,即使在有中和活性抗 IL-6McAb 的存在,仍有这种刺激作用,以后证实这种因子与脂肪形成抑制因子(adipogenesisinhibitory factor,AGIF)是同一物质。1990 年命名为白细胞介素 11(interleukin 11,IL-11)。
1.IL-11 的产生 主要由间充质来源的粘附细胞(mesenchymal-derived adherent cell)产生,如骨髓基质细胞、基质成纤维细胞、人胚肺成纤维细胞和滋养层细胞。IL- 1 刺激 Pu-34 细胞后 IL-11 明显升高。
2.IL-11 的分子结构和基因 杨育中等首先发现并克隆人 IL-11 基因,至今小鼠 IL-11 基因尚未克隆成功。人 IL-11 基因定位于 19 号染色体,含有 5 个外显子和 4 个内含子。在 5′UTR 含有与 RNA 多聚酶Ⅱ结合的 TATA 盒;3′UTR 含有多个 ATTTA 重复序列,可能与降低 mRNA 的稳定性有关;此外,还有一些序列可能与干扰素诱导元件(或因子)(interferon-inducible elements 或 interferon-induciblefactors)如 SP-1(specificityprotein 1 或 promotor-specific factor)和 AP-1(activator protein 1)相结合。成熟的人 IL-11 分子含 178 个氨基酸残基,分子量 23kDa,不含半胱氨酸残基,亦无潜在的糖基化位点。
3.IL-11 受体 迄今为至特异性结合 IL-11 的人 IL-11 受体 α 链尚未基因克隆成功。PU34 细胞每个细胞有 138 个 IL-11 结合位点,亲和力 Kd 为 1.2×10-10M。目前已经证实,gp130 是 IL-11 受体的信号转导亚单位,gp130 是 IL-11R 以及 IL-6R、LIFR、OSMR、CNTFR 所共有的。IL-11 可诱导靶细胞的酷氨酸磷酸化,gp130 中和活性抗体可抑制 IL-11 诱导的酷氨酸磷酸化。有关 gp130 的基因的分子的结构参见本节 IL- 6 受体和本章第三节。1994 年 Hilton 等从成年小鼠肝 cDNA 文库中克隆成功小鼠 IL-11Rα 链 cDNA,与 IL-6Rα 链有 24% 同源,属于造血因子受体家族。
4.IL-11 的生物学活性 IL-11 的功能与 IL-1、IL-6、G-CSF 和 SCF 的功能相近。
(1)促进 B 细胞抗体的生成,这一作用依赖于 CD4T 细胞的存在。体内实验证明,IL-11 可使小鼠脾脏抗原特异性 PFC 水平和血清中特异性抗体升高。
(2)促进某些 IL- 6 依赖细胞株如 TF- 1 的生长,IL-11 与 IL- 6 可诱导靶细胞产生相似的蛋白酪氨酸磷酸化以及原癌基因 jun- B 的表达。
(3)与 IL-3、IL- 4 协同作用于骨髓造血干细胞,缩短干细胞 Go 期。
(4)与 IL- 3 等协同促进骨髓巨核细胞体外集落形成、生长和成熟,并增加细胞体积,增加外周血血小板的数量。
(5)IL-11 对小鼠骨髓和胎儿肝脏来源的不同分化阶段红系祖细胞具有刺激作用,在早期阶段需要与 IL- 3 或 SCF 协同,而在分化晚期,IL-11 单独可促进 CFU- E 的成熟。
(6)诱导肝细胞急性期蛋白合成。
(7)抑制脂蛋白脂酶(lipoprotein lipase,LPL)活性和脂肪细胞的分化,因此,又称为脂肪形成抑制因子(AGIF)。
小鼠体内应用 IL-11 可诱导抗体产生细胞的产生,血小板升高,增加骨髓来源 CFU-GM、BFU-E、CFU-GEMM 祖细胞细胞周期的速率。在骨髓抑制的小鼠中,IL-11 可促进外周血中血小板、红细胞和粒细胞的数量。在骨髓移植小鼠中,IL-11 可明显促进外周血中性粒细胞和血小板水平的恢复。
(十二)IL-12
1982 年 Wagner 等发现在丝裂原刺激小鼠淋巴细胞的条件培养液中存在一种不同于 IL- 2 的细胞因子,这种细胞因子在体外能与 IL- 2 协同促进鼠 CTL 应答。1986 年在人混合淋巴细胞培养(MLC)或 PHA 活化的 PBMC 培养上清中也发现了与此类似的因子,称为 CTL 成熟因子(cytotoxic lymphocyte maturationfactor,CLMF; 或 Tc maturation factor TcMF)。1991 年 Gubler 等将 CLMfcDNA 克隆并表达成功,表明是一种新的细胞因子,遂将 CLMF 命名为白细胞介素 12(interleukin 12,IL-12)。
1.IL-12 的产生 主要由 B 淋巴细胞产生。
(1)MLC 或丝裂原活化的 PBMC 培养上清。
(2)PMA 与钙离子载体 A23187 联合刺激 EBV 转化的 B 淋巴样母细胞 RPMI8866 可产生较高水平的 IL-12。
2.IL-12 的分子结构和基因 IL-12 是由二硫键联接的异源双体,两个亚单位的分子量分别为 35kDa 和 40kDa,等电点在 pH4.5~5.5。从高产 IL-12 的人 B 淋巴样母细胞亚克隆 NC37.98 基因文库中克隆了 IL-12cDNA,转染 COS 细胞获得高表达。人 IL-12P35 亚单位有 197 个氨基酸残基,含 7 个半胱氨酸和 3 个 N 糖基化位点,P40 亚单位 306 个氨基酸残基,有 10 个半胱氨酸,4 个 N - 糖基化位点。小鼠 IL-12P35 有 193 个氨基酸残基,与人 IL-12P35 有 66% 同源性,P40 有 313 个氨基酸残基与人 P40 有 70% 同源性。在生理情况下,亚单位中的半胱氨酸残基之间可能形成复杂的分子间二硫键结构。两个亚单位是由不同的基因所编码,基因转染试验结果表明,只有将编码两个亚单位 cDNA 同时转染才能获得有生物学活性的 IL-12。P35 与 IL- 6 和 G -CSF 有同源性,P40 与 IL- 6 受体、睫状神经营养因子(CNTF)受体、G-CSF 受体有同源性,具有细胞因子受体家族的特征。提示 IL-12 分子可能是一种细胞因子 / 可溶性细胞因子受体复合物。在 RPMI8866 细胞系中纯化到的自然杀伤细胞刺激因子(natural killer cell stimulating factor,NKSF)的结构和功能与 IL-12 相同。
3.IL-12 受体 IL-12R 亚单位的基因最近克隆成功,推算有 662 个氨基酸,裸肽分子量 70kDa,糖基化后约为 100kDa。IL-12R 亚单位为Ⅰ型穿膜蛋白,胞膜外区含 516 个氨基酸残基,与 gp130、G-CSFR、LIFR 高度同源。单体 IL-12R 不结合 IL-12,双体或寡聚体 IL-12R 亚单位与 IL-12(p40 亚单位为与受体结合部位)结合为低亲和力,Kd 为 2~6nM,PBMC 表面有 IL-12 高亲和力受体,Kd 约 100pM,目前与 IL-12R 亚单位组成高亲和力的另一个亚单位尚未确定。IL-12P35 亚单位、P40 亚单位和 IL-12R 亚单位分别与 IL-6、IL-6R 和 gp130 有很高的同源性,而且相互结合的模式也十分相似,即 IL-12P35 同 P40 形成异源双体后可同双体或寡聚体的 IL-12R 亚单位结合,而 IL- 6 同 IL-6R 受体结合后可同 gp130 二聚体结合。IL-12 受体分布于 PHA 活化的 CD4+、CD8+ T 细胞亚群以及 IL- 2 活化的 CD56+NK 细胞,1000~9000IL-12 结合点 / 细胞。
4.IL-12 的生物学功能 人 IL-12 作用有种属特异性,人 IL-12 对小鼠细胞作用甚微。
(1)与 IL- 2 协同诱导 CTL 的分化,促进同种异体 CTL 反应。
(2)刺激 PHA 活化 CD3+ T 细胞(包括 CD4+ 和 CD8+)增殖。IL-12 诱导 T 细胞最大增殖水平低于 IL- 2 的增殖刺激作用,但刺激 50% 最大增殖所需细胞因子浓度远低于 IL-2。IL-12 这种增殖作用所经途径与 IL-2、IL- 4 和 IL- 7 的刺激作用不同,因为针对 IL-2、IL-2R、IL- 4 和 IL- 7 的单克隆抗体不能阻断 IL-12 的增殖作用;IL-12 单克隆抗体对 IL-2、IL- 4 和 IL- 7 诱导增殖亦无阻断作用。IL-12 对静止 PBMC 不具有增殖作用,这一性质与 IL- 4 相似。但 IL-12 与亚适剂量 IL- 2 可协同诱导静止 PBMC 增殖。其机理可能是:①IL-12 促进 IL- 2 诱导 T 细胞 IL-2r P55 的表达,提高 PBMC 对 IL- 2 的反应性;②IL- 2 促进 PBMC 某些亚群 IL-12R 表达;③在 IL- 2 存在的条件下,IL-12 可提高 IFN-γmRNA 转录水平,增加其稳定性,促进分泌 IFN-γ,如小鼠 IL-12 可诱导 Th1 细胞产生 IFN-γ。此外,IL-12 通过诱导产生的 IFN- γ 激活巨噬细胞,诱导其 TNF- α 的分泌。IL-12 可诱导 Th1 亚群的形成,此作用可能通过两种途径:①IL-12 直接作用于 Th1 亚群;②IL-12 刺激 T 细胞、NK 细胞产生 IFN- γ 诱导 Th1 亚群形成。
(3)协同 IL- 2 诱导 CD56+NK 细胞增殖以及 LAK 细胞产生,促进 ADCC 功能,NKSF 释放,诱导 CD56、CD2、CD11a、IL-2R、TNFR(CD120b)、LFA- 1 和 ICAM- 1 等分子的表达。
(4)促进 B 细胞 Ig 产生和 Ig 类型转换,由 IgM 转为 IgG,抑制 IL- 4 诱导 B 细胞 IgE 合成。这种抑制作用是 T 细胞依赖的,其作用机理与 IFN-γ、TGF- β 和 IL- 8 抑制 IgE 产生的机理可能有所不同。
IL-12 发挥生物学效应所需的细胞因子浓度很低(≤pM),与亚适剂量 IL- 2 联合应用可降低 IL- 2 用量,同时提高 CTL、NK、LAK 的杀伤活性,因此 IL-12 可能成为一种新的抗肿瘤生物制剂。
(十三)IL-13
1993 年 Minty 等报道了白细胞介素 12(interleukin 13,IL-13)cDNA 克隆获得成功。IL-13 主要由活化 T 细胞产生,抗 CD28 抗体可诱导 IL-13mRNA 表达;在小鼠 IL-13 由 Th2 亚群产生。
1.IL-13 的分子结构和基因 人 IL-13 基因定位于 5 号染色体,由 4 个外显子和 3 个内含子组成。人和小鼠 IL-13 在基因水平上有 66% 同源性。人 IL-13 分子有 132 个氨基酸,切除 18 个氨基酸的信号肽后,成熟 IL-13 分子为 114 个氨基酸,非糖基化 IL-13 分子量为 12.4kDa,糖基化后为 17kDa,与小鼠 IL-13 有 58% 同源性。IL-13 基因与 IL- 4 基因连锁,在氨基酸水平上有 20%~25% 同源性。
2.IL-13 的生物学活性
(1)趋化单核细胞,延长单核细胞在体外存活时间,抑制 LPS 诱导单核细胞、巨噬细胞 IL-1、IL-6、IL- 8 和 TNF- α 等炎症因子产生。
(2)协同抗 IgM 活化 B 细胞的增殖,诱导和上调 B 细胞 MHCⅡ类抗原、CD23 和 CD72 的表达,诱导 B 细胞产生 IgM、IgG 和 IgE。
(3)诱导大颗粒淋巴细胞(LGL)产生 IFN-γ,并可与 IL- 2 协同刺激 LGL 产生 IFN-γ,因而在诱导 LAK 活性以及 Th1 型细胞免疫中可能有重要作用。
(十四)IL-14
白细胞介素 14(interleukin 14,IL-14)又称高分子量 B 细胞生长因子(high molecular-weight B cell growthfactor,HMW-BCGF)。成熟 IL-14 有 468 个氨基酸,单体形式,主要由 T 细胞产生,可诱导活化 B 细胞的增殖,但对静止 B 细胞无刺激作用,抑制有丝分裂原刺激的 B 细胞 Ig 的分泌。
(十五)IL-15
Grabstein 等首先在猴肾表皮细胞系 CV-1/EBVA 上清中发现一种能维持 CTLL 增殖的因子,随后基因克隆获得成功并命名为白细胞介素 15(interleukin 15,IL-15)。以猴 IL-15 cDNA 为探针克隆人 IL-15 cDNA 获得成功,人和猴 IL-15 基因编码区序列有 97% 同源。人体多种组织和细胞表达 IL-15mRNA,如心、肺、肝、肾,尤以胎盘和骨骼肌以及 PBMC 最为丰富,但活化的外周血 T 细胞却检测不到 IL-15mRNA。IL-15 前体分子由 162 氨基酸组成,先导序列较长为 48 个氨基酸残基,成熟分子 114 个氨基酸残基,分子量 14~15kDa。IL-15 具有类似 IL- 2 的结构和功能,刺激 CTLL 细胞和 PHA 活化 T 细胞(CD4+CD8+ 亚群)的增殖,诱导 CTL 和 LAK 细胞的产生。IL-15 的刺激作用需要有靶细胞的 IL- 2 受体 β 和 γ 链的参与,但不需要 IL- 2 受体的 α 链。
表 4 -3 白细胞介素(IL)种类和主要生物学活性
| IL | 主要产生细胞 | 氨基酸数目 | 分子量(kDa) | 主要生物学活性 |
| IL-1 | 单核细胞 | IL-1α159 | 17.5 | (1)促进胸腺细胞、T 细胞活化、增殖和分化 |
| 巨噬细胞 | IL-1β153 | 17.5 | (2)增强 CTL 和 NK 杀伤活性 | |
| (3)协同 IL- 4 刺激 B 细胞增殖、分化和 Ig 产生 | ||||
| (4)协同 CSF 促进造血功能 | ||||
| (5)刺激干细胞产生 SCF | ||||
| IL-2 | 活化 T 细胞 | 133 | 15.5 | (1)促进活化 T 细胞增殖、分化和细胞因子产生 |
| (2)增强 CTL、NK 和 LAK 杀伤活性 | ||||
| (3)促进 B 细胞增殖、分化和抗体分泌 | ||||
| (4)活化巨噬细胞 | ||||
| IL-3 | 活化 T 细胞 | 133 | 15 | (1)促进多能干细胞、定向祖细胞、髓样、红样、巨核、前单、单核、中性、嗜酸、肥大细胞增殖和分化 |
| (2)促进 T 细胞增殖 | ||||
| (3)增强外周血 PMN、Mo、Eo 的数量,促进 Eo 的 ADCC | ||||
| IL-4 | 活化 T 细胞(Th2) | 129 | 20 | (1)促进活化 B 细胞增殖、Ig 产生和类别转换为 IgE 和 IgG1 |
| (2)T 细胞生长因子 | ||||
| (3)促进肥大细胞增殖 | ||||
| (4)增强巨噬细胞功能 | ||||
| (5)协同 CSF 刺激造血细胞 | ||||
| IL-5 | 活化 T 细胞 | 115×2 | 45 | (1)诱导 B 细胞分化为抗体分泌细胞、IgA 合成 |
| (Th2) | (2)协同 IL- 2 促进 CTL 分化 | |||
| (3)促进人 Eo 激活、增殖和分化 | ||||
| IL-6 | 单核细胞巨噬细胞 | 184 | 26 | (1)刺激 T 细胞、B 细胞、杂交瘤细胞和干细胞增殖 |
| 成纤维细胞 | (2)促进 B 细胞 Ig 产生 | |||
| (3)促进 CTL、NK 干细胞和巨核细胞分化 | ||||
| IL-7 | 骨髓和胸腺 | 152 | 25 | (1)刺激 B 细胞前体、前 B 细胞的增殖 |
| 中基质细胞 | (2)促进前 T 细胞、胸腺细胞和 T 细胞增殖 | |||
| (3)诱导 LAK 活性 | ||||
| IL-8 | 单核细胞 | 69,72,77, | 8-10 | 趋化中性、嗜碱性粒细胞和 T 细胞 |
| 内皮细胞 | 79 | |||
| IL-9 | 活化 T 细胞 | 14.2 | (1)T 细胞生长因子 | |
| 126 | (2)协同 IL- 3 刺激肥大细胞 | |||
| IL-10 | 活化 T 细胞 | 2×160 | 35~40 | (1)抑制 Th1 细胞分泌细胞因子 |
| (Th2) | (2)促进胸腺细胞和肥大细胞增殖 | |||
| (3)协同 IL- 2 促进 CTL 分化 | ||||
| IL-11 | 基质纤维样 | 178 | 23 | (1)促进 B 细胞抗体分泌 |
| 细胞 | (2)促进浆细胞瘤生长 | |||
| (3)协同 IL- 3 等刺激骨髓干细胞和巨核细胞生长 | ||||
| IL-12 | B 细胞 | 197/306 | 35/40 | (1)协同 IL- 2 促进 CTL、NK、LAK 分化 |
| (2)促进 PHA 活化 T 细胞增殖 | ||||
| (3)促进 B 细胞 Ig 产生和类型转换 | ||||
| IL-13 | 活化 T 细胞 | 132 | 17 | (1)刺激 B 细胞增殖和 CD23 表达 |
| (2)抑制单核 - 巨噬细胞炎症性细胞因子产生 | ||||
| IL-14 | 活化 T 细胞 | 468 | – | (1)刺激活化 B 细胞增殖 |
| (2)抑制丝裂原诱导的 B 细胞 Ig 的分泌 |
二、集落刺激因子(CSF)
骨髓造血干细胞体外半固体培养技术的建立和重组集落刺激因子(colony-stimulating factor,CSF)的问世给集落刺激因子的研究提供了前提。根据细胞因子刺激不同造血细胞系或不同分化阶段的细胞在半固体培养基中形成不同细胞集落,分别命名为粒细胞 CSF(G-CSF)、巨噬细胞 CSF(M-CSF)、粒细胞和巨噬细胞 CSF(GM-CSF)、多重集落刺激因子(multi-CSF, 又称 IL-3)、干细胞因子(SCF)、红细胞生成素(EPO)。有人将 IL- 5 称为嗜酸性粒细胞集落刺激因子(Eo-CSF)。此外,IL-1、IL- 6 和 IL-11 在骨髓多能干细胞早期的分化中也有重要的作用。
(一)IL-3
1981 年 Ihle 等发现 ConA 刺激小鼠脾细胞的培养上清中含有一种因子,能提高裸鼠脾脏淋巴细胞成熟淋巴细胞标志 20-α- 羟固醇脱氢酸(20-α-hydroxysterioddehydrogenase,20αSDH)的阳性率,命名为白细胞介素 3(interleukin-3,IL-3)。由于 IL- 3 可刺激多能干细胞和多种祖细胞的增殖与分化,又称为多重集落刺激因子(multi-colony stimulating factor,multi-CSF)。
1.IL- 3 的产生 主要由活化 T 细胞或 T 细胞克隆产生。小鼠髓样单核细系(myelomonocytic cell line) WEHI-3B 细胞系可自发产生一定水平的 IL-3。此外,胸腺上皮细胞、活化小鼠肥大细胞等也可表达 IL-3。
2.IL- 3 的分子结构和基因 1984 年美国和澳大利亚分别从 ConA 刺激小鼠 T 细胞和 WEHI-3B 细胞中提取高活性部分 mRNA,逆转录成 cDNA,进行克隆化和 DNA 序列分析。编码小鼠 IL- 3 和 GM-CSF 的基因都定位于第 11 号染色体。IL- 3 的基因组由 5 个外显子和 4 个内含子组成。cDNA 编码 166 氨基酸残基,N 端 26 氨基酸残基为信号肽,此外 N 端另有数个氨基酸残基可能被血清蛋白酶所切除。成熟小鼠 IL- 3 由 131 氨基酸残基组成,含有糖基,分子量为 25~28kDa。
1986 年美籍华人杨育中从长臂猿 T 白血病细胞株 MLA144 中提取 IL-3mRNA,成功地获得长臂猿 IL-3cDNA(gIL-3cDNA), 后又用 gIL-3cDNA 作为探针筛选人 IL- 3 基因组 DNA,并克隆成功。人 IL- 3 基因结构与小鼠相似,由 5 个显子和 4 个内含子组成,人与鼠 IL-3DNA 约有 45% 同源性,氨基酸有 29% 同源性,但人鼠间 IL- 3 生物学作用无交叉反应。人和长臂猿 IL- 3 有高度同源性,成熟的 IL- 3 分子都由 133 个氨基酸残基组成,仅 11 个氨基酸残基不同,在第 16 位和 84 位上 2 个半胱氨酸残基在分子内形成二硫键,此外还有 2 个 N 糖基化点。在体外糖基不影响 IL- 3 的生物学活性。hIL- 3 启动子上游调控区含有多个转录调控子同源位点,其中 AP-1(TGAGTCA)位于 -301 处,CREB(TTACGTCT)位于 -147 处,NFAT-1(GATGAATAAT)位于 -156 处,CK-1(GAAGGTTCCA)位于 -126 处,CK-2(TCAGATAA)位于 -115 处。hIL- 3 转录调控主要受上游两个顺式调控区的调控。第一个位于 -121 到 -161 之间,它对于 hIL- 3 转录激活最为重要,其间除含有 CREB、NFAT- 1 外,新发现了对 hIL- 3 表达起决定作用的转录调控蛋白结合位点,该位点被命名为 NF-IL-3-A(ATGAATAA)。第二个调控区位于 -301 处的 AP- 1 位点,AP- 1 位点能强有力地增强 hIL- 3 基因的转录。此外,最近还发现了 hIL- 3 转录抑制调控区,位于 -250 和 -271 之间,称为 NIP 位点。目前认为位于其上游 -301 处 AP- 1 对 hIL- 3 的转录增强作用是通过消除 NIP 对 hIL- 3 基因转录的抑制来实现的。
人 IL- 3 以及 IL-4、IL-5、IL-13、GM-CSF、M-CSF、M-CSF 受体(c-fms 编码产物)、PDGFR(血小板衍生的生长因子受体)、β2- 肾上腺素能受体(β2AR)、内皮细胞生长因子(ECGF)和 CD14 的基因都定位于第 5 号染色体。这种在一定区域内连锁的现象可能与协同调节造血过程有关,并可能与骨髓发育异常综合征(myelodysplastic syndrome,MDS)、原发性急性非淋巴细胞白血病(acutenonlymphocytic leukemia,ANLL)、顽固性巨幼红细胞贫血等疾病的发病有关。
3.IL- 3 受体 分子量为 140kDa,属于红细胞生成素受体超家族成员,而且具有 2 个该家族的结构域,IL-3R 胞浆区是酪氨酸激酶的底物。有关 IL-3Rβ 链参见本节 GM-CSF 受体和本章第三节。
4.IL- 3 的生物学活性 IL- 3 与其它集落刺激因子的生物学作用见表 4 -4。除具有多重集落刺激作用外,最近发现 IL- 3 可刺激皮肤上皮细胞、CD4-CD8-TCRαβ 细胞、肥大细胞、嗜碱性粒细胞的增殖,阻止肥大细胞发生程序性细胞死亡。
(二)GM-CSF
1977 年 Burgess 等从小鼠肺条件培养液中发现一种能刺激粒细胞和巨噬细胞形成集落的因子,命名为粒细胞 - 巨噬细胞集落刺激因子(granulocyte-macrophage colonystimulating factor,GM-CSF)。1984 年和 1985 年小鼠和人 GM-CSF 的 cDNA 分别克隆成功。
1.GM-CSF 的产生 T 细胞、B 细胞、巨噬细胞、肥大细胞、内皮细胞、成纤维细胞等均可产生 GM-CSF。其中 T 细胞和巨噬细胞一般在免疫应答或炎症介质刺激过程中直接产生;而内皮细胞、成纤维细胞可能通过 IL- 1 和 TNF 的诱导而产生。
表 4 -4 CSF 的生物学功能及临床应用
| CSF | 分子量(kDa)鼠 人 | 主要产生细 胞 | 主要集落刺激作用 | 促进吞噬细胞功能 | 临床治疗疾病 | 使用情况 | 基因定位 | 外显子 / 内含子 | 人与鼠同源性(%) | 人与鼠活性交叉 | 糖基化 |
| G-CSF(CSF-β) | 25 30 | Mo,En,Fb | 髓样、中性粒细胞集落增殖、分化成熟 | PMN 的吞噬和杀伤功能,ADCC | 增加化疗作用,艾滋病,白血病,再生障碍性贫血、癌症,骨髓移植 | FDA 已批准 | 17q11~q13 | 5/4 | 73 | + | 0- |
| M-CSF(CSF-1) | 70 45(同源二聚体) | Mo、En、Fb | 前单核、单核 | Mφ 吞噬和细胞毒功能,ADCC,促进 IL-1、TNF- α 的产生 | Ⅰ期临床试验 | 5q23~q31 | 80 | + | N- | ||
| GM-CSF(CSF-α,CSF-2) | 23 22 | Tact、Fb、En、Mo | 多能干细胞、髓样干细胞、单核、嗜酸、中性粒细胞增殖 | 增加 Mφ、Mo、PMN、Eo 的数量,提高吞噬功能 | 二次化疗所致中性粒细胞减少症,异体和自体骨髓移植,再生障碍性贫血,烫伤骨髓功能衰竭,血小板减小 | FDA 已批准 | 5q23~q31 | 4/3 | 54 | – | N- |
| IL-3(multi-CSF) | 25 18 | Tact | 多能干细胞、多种定向祖细胞、前髓、髓样、红样、巨核、前单、单核、中性、嗜酸、肥大细胞 | 体内注射 IL- 3 增加外周血中 PMN、Mo、Eo 的数量,促进 Eo ADCC | Ⅰ、Ⅱ期临床试验 | 5q23~q31 | 5/4 | 29 | _ | N- | |
| EPO | 30 30-34 | 肾基质细胞 | 红细胞系 | 促进 BFU-E、CFU- E 以及红系的增殖和分化 | 贫血 | FDA 已批准 | 7q11~q22 | 5/4 | 80 | + | N-/0- |
| SCF | 31×2(同源二聚体) | 肝细胞 | 干细胞、造血祖细胞、髓系、红系、巨核细胞系 | 干细胞增殖和分化,与 IL-3、G-CSF、GM-CSF 和 EPO 有协同作用 | 癌症 | Ⅰ期临床试验 | 80 |
Mo: 单核细胞;Mφ:巨噬细胞;Eo:嗜酸性粒细胞;En:内皮细胞;Fb:成纤维细胞;Tact: 活化 T 细胞
表 4 -5 产生 GM-CSF 的细胞和刺激物
| 细胞种类 | 刺激物 |
| 生理性 GM-CSF 主要来源 | |
| T 淋巴细胞 | 抗原、外源凝集素、CD28McAb、IL-1、HTLV |
| B 淋巴细胞 | LPS、TPA |
| 巨噬细胞 | LPS、FCS、吞噬作用、粘附作用 |
| 成纤维细胞 | TNF、IL-1、TPA |
| 内皮细胞 | TNF、IL-1、TPA、修饰的 LDL |
| 间皮细胞 | EGF+TNF |
| 成骨细胞 | PTH、LPS |
| 病理性 GM-CSF 主要来源 | |
| AML | TNF、粘附、IL-1 |
| 类风湿性关节炎滑膜 | |
| 实体瘤 |
注:PTH:甲状旁腺激素
2.GM-CSF 的分子结构和基因 人和鼠 GM-CSF 基因 DNA 序列有高度同源性,基因组约 2.5kb 长,包括 4 个外显子和 3 个内含子。小鼠 GM-CSF 基因位于 11 号染色体。在人则位于第 5 号染色体长臂,在 IL- 3 基因下游 9kb 处,此外,人的 IL-4、IL-5、M-CSF、M-CSF 受体(C-fms)和早期生长应答基因 -1(early growth response gene-1,EGR-1)也位于第 5 号染色体的长臂(表 4 -6)。
表 4 -6 人第 5 号染色体上某些生长因子、受体和 CD 抗原的基因
| 细胞因子 | IL-3、IL-4、IL-5、IL-13 |
| M-CSF、GM-CSF、ECGF | |
| 受 体 | M-CSFR(C-fms) |
| PDGFR、β2AR | |
| CD 抗原 | CD14、CD49a、CD49b |
| 其 它 | EGR-1 |
人和小鼠 GM-CSF 基因以及其它某些淋巴因子基因上游区 TATA 盒上游 330bp 有较高的同源性,包括一个富含 GC 的区域和一个 10 个核苷酸同一的序列(decanucleotideconsensus sequence),这一序列也见于人或小鼠 IL- 2 和 IL- 3 基因的 promoter 中。此外,CK-1(cytokine consensus-1)或称保守的淋巴因子元件 1(conserved lymphokine element 1,CLE-1)在小鼠或人 G -CSF、GM-CSF、IL- 2 和 IL- 3 的基因组中均可见到;而 CK- 2 仅见于人或小鼠 GM-CSF 和 IL- 3 的基因组中。
人和小鼠 GM-CSF 分别由 144 和 141 氨基酸残基组成,均包含 17 氨基酸的先导序列。成熟的人和小鼠 GM-CSF 分子分别由 127 和 124 个氨基酸残基组成,在氨基酸水平上有 54% 同源性,但生物学作用具有种属特异性。GM-CSF 含有高度保守结构的 2 个链内二硫键,其中 51 个与 93 位之间形成的二硫键对该因子的生物学活性有重要作用。人 GM-CSF 分子中第 21~31 和 78~94 氨基酸残基对刺激造血功能极为重要,而糖基无论在体内或体外对 GM-CSF 的生物效应似乎无影响。
用 GM-CSF 转基因小鼠造血细胞为研究模型,发现这类小鼠有高水平的 GM-CSF,同时伴有许多细胞组织的损伤。自分泌 GM-CSF 的造血细胞同时转录 IL-1α、TNF 和 FGF(成纤维细胞生长因子)mRNA。
13.GM-CSF 的生物学活性 GM-CSF 有多种生物学活性(表 4 - 4 和 4 -7)。
表 4 -7 GM-CSF 的生物学活性
| 体外实验 | |
| 刺激细胞增殖 | 骨髓细胞,粒细胞,巨噬细胞祖细胞,红样,巨核细胞祖细胞,AML,白血病细胞系,BFU-E,内皮细胞,单核 - 巨噬细胞,淋巴细胞,骨髓来源树突状细胞祖细胞,成骨肉瘤细胞,腺癌细胞 |
| 促进功能 | |
| 中性粒细胞 | 存活和蛋白合成,移动抑制,氧化代谢,脱颗粒,细胞因子分泌,再循环,IgA 介导吞噬作用,ADCC 吞噬和杀死病原体,表面受体调变,花生四烯酸释放,白三烯和 PAF 合成 |
| 嗜酸性粒细胞 | 存活,细胞毒,白三烯合成 |
| 嗜碱性粒细胞 | 组胺释放 |
| 巨噬细胞 | 细胞因子合成(如 IL-1、TNF-α),杀灭寄生虫,表面受体、抗原表达,杀灭肿瘤,粘附,氧化代谢 |
| 朗罕氏细胞 | 成熟,存活力和功能 |
| 体内 | |
| 促进造血,嗜酸细胞增多 | |
| 降低血清胆固醇 | |
| 髓样细胞增殖综合征 | |
| 失明和肌肉炎细胞浸润(转基因动物) |
有报导 GM-CSF 和 IL- 3 的融合蛋白可明显增强造血功能,如融合蛋白 PIXY321 与同时表达 GM-CSFR 和 IL-3R 细胞株结合,亲和力增加 5~10 倍,促进细胞增殖作用是 GM-CSF 加 IL- 3 作用的 10 倍,刺激 BFU-E、CFU-E、CFU-GM、CFU-GEMM 造血细胞集落作用比单独使用 IL-3、GM-CSF 或两者联合应用要高 10~20 倍。
4.GM-CSF 受体 人和小鼠 GM-CSFR 均由 α、β 两条链组成,单独 α 链与配体的结合为低亲合力,β 链单独不结合配体,但与 α 链共同组成高亲和力受体,在信号转导中起主要作用。GM-CSFR。α、β 两条链胞膜外结构均属于造血因子受体超家族(或称红细胞生成素受体超家族)成员。已证实 GM-CSFRβ 链为 IL-3、IL- 5 受体所共用,但在人和小鼠 β 链的共同情况有所差异。
(1)小鼠 GM-CSFR:α 链又称 STH 分子,由包括信号肽在内的 396 个氨基酸组成,成熟分子约 70kDa,与 IL- 3 结合为低亲和力,Kd 值 4×10-8M。小鼠 GM-CSFr β 链有 AIC2A 和 AIC2B 两种分子,其中 AIC2A 为 GM-CSFR 所特有,AIC2B 则为 GM-CSFR、IL-3R、IL-5R 所共有。β 链与 GM-CSFRα 链组成高亲和力受体,Kd 为 3×10-10M。AIC2A 由包括信号肽在内 878 个氨基酸组成,成熟分子 120kDa,糖蛋白,胞浆部分 413 个氨基酸,不含激酶结构,但可被酪氨酸激酶磷酸化,在信号转导过程中发挥重要作用。
(2)人 GM-CSFR:α 链为低亲和力受体。人 β 链又称 KH97 分子,与小鼠 GM-CSFr β 链 AIC2B 有 56% 同源性,人 GM-CSFR β 链 cDNA 编码 897 个氨基酸,成熟分子 120kDa,有 16 个氨基酸的先导序列,胞膜外区 422 个氨基酸,穿膜区 26 个氨基酸,胞浆区 433 个氨基酸,β 链为 IL-3、IL-5、GM-CSF 受体所共用,其信号转导与酪氨酸磷酸化有关,有关信号转导机理参见本章第三节。
(3)GM-CSFR 的分布:GM-CSFR 主要分布于髓系细胞,但分布的方式有所不同。在中性粒细胞表面仅有 GM-CSFR 的 α 和 β 链,而无 IL-5R 和 IL-3R 的 α 链,因而 IL-3、IL- 5 对 GM-CSF 与中性粒细胞表面 GM-CSFR 结合不发生竞争,由于 α 链数目少于或等于 β 链的数目,所以中性粒细胞表面仅有高亲和力 GM-CSFR,而无低亲和力受体。IL-3、GM-CSF 两种细胞因子均可作用于单核细胞,而且可以相互竞争结合。单核细胞可同时表达 IL-3、GM-CSF 的高亲和力受体,也表达这两种低亲和力受体,提示在单核细胞表面这两种细胞因子受体 α 链表达的数目多于 β 链。在嗜酸性粒细胞表面同时表达 IL-3、IL- 5 和 GM-CSF 三种受体,而且 IL-3、IL- 5 和 GM-CSF 三种配体均可相互竞争抑制。嗜碱性粒细胞亦具有这三种受体,但结合相应配体的能力依次是 GM-CSF>IL-3>IL-5。
(三)G-CSF
1.G-CSF 的产生 内毒素、TNF- α 和 IFN- γ 可活化单核细胞和巨噬细胞产生粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)。此外,成纤维细胞、内皮细胞、星状细胞和骨髓基质细胞等在 LPS、IL- 1 或 TNF- α 刺激活化后也可分泌 G -CSF。某些白血病细胞以及 CHu- 2 人口腔癌细胞、5637 人膀胱癌细胞、MIAPa Ca- 2 胰腺癌细胞可组成性地表达 G -CSF。
2.G-CSF 的分子结构和基因 1986 年 G -CSF cDNA 克隆成功,G-CSF 基因全长 2.5kb,包括 5 个外显子和 4 个内含子,人 G -CSF 基因位于 17 号染色体,与小鼠 G -CSF 基因约有 73% 同源性,与 IL- 6 无论在基因水平以及氨基酸水平上都有很高同源性,包括外显子、内含子组成,Cys 数目,两对二硫键位置以及分子的三级结构等。小鼠 G -CSF 分子共含有 208 个氨基酸,30 个氨基酸先导序列,成熟蛋白为 178 个氨基酸。人类有两种不同的 G -CSf cDNA,分别编码含 207 和 204 氨基酸的前体蛋白,均有 30 个氨基酸的先导序列,成熟蛋白分子分别为 177 和 174 个氨基酸,前者除了在成熟分子 N 端 35 位处插入了 3 个氨基酸外,其余的序列与 174 氨基酸分子相同。人 G -CSF 分子量为 19.6kDa,PI6.1,O- 糖基化,对酸碱(pH2~10)、热以及变性剂等相对较稳定。G-CSF 有 5 个半胱氨酸,Cys 36 与 Cys42,Cys74 与 Cys64 之间形成两对二硫健,Cys17 为不配对半胱氨酸,二硫键对于维持 G -CSF 生物学功能是必须的因素。人和小鼠 G -CSF 在氨基酸水平有 73% 同源性,并具有相互交叉的生物学活性。
3.G-CSF 受体 1990 年 G -CSF 受体 cDNA 克隆成功,基因组 16.5kb 长,有 17 个外显子。G-CSFR 为高亲和力受体,表达在造血祖细胞和中性粒细胞、胎盘细胞、内皮细胞和髓样白血病细胞株如 HL-60 细胞等,每个中性粒细胞有 300~1000 个 G -CSFR,Kd 为 100pM。小鼠 G -CSFR 是高度糖基化的,含 812 个氨基酸。膜型 G -CSFR 包括胞膜外区、穿膜区和胞浆区。胞膜外区含有 3 个区域:(1)N 端 1 个 Ig 样区;(2)1 个红细胞生成素受体超家族结构域,这是识别 G -CSF 配体的部位;(3)三个串连的Ⅲ型纤维粘连素(fibronectin)结构区。人 G -CSF R 含 813 氨基酸,与小鼠 G -CSFR 有 62% 同源性。此外,人 G -CSFR 还有一种 759 氨基酸的异型(isoform),这种异型 G -CSFR 除 C 端序列不同外,其它部分与前者相同。G-CSFR 还可以可溶性形式(sG-CSFR)存在于体液中。
4.G-CSF 的生物学作用 G-CSF 主要作用于中性粒细胞系(lineage)造血细胞的增殖、分化和活化。在体外 G -CSF 刺激骨髓造血祖细胞中中性粒细胞集落的形成,延长成熟中性粒细胞的存活时间,活化中性粒细胞,促进其 ADCC,超氧阴离子的产生和碱性磷酸酶的合成。最近研究表明,单独 G -CSF 或与 SCF 协同可促进多能造血干细胞的增殖、干细胞母细胞集落形成以及体内 CFU- S 的形成。G-CSF 还具有对人粒细胞、单核细胞、成纤维细胞、平滑肌细胞以及成肌纤维细胞的趋化作用。肿瘤患者注射 G -CSF 后可提高血循环中中性粒细胞的水平,这种作用可能与缩短某些骨髓细胞进入 S 期的时间以及增加生成粒细胞的祖细胞数量有关。
(四)M-CSF
巨噬细胞集落刺激因子(macrophagecolony stimulating factor,M-CSF)又称 CSF-1,最初发现其存在于血清、尿或其它体液中,能刺激骨髓造血祖细胞巨噬细胞集落的形成。
1.M-CSF 的产生 多种细胞均可产生 M -CSF,包括:成纤维细胞、子宫内膜中分泌型上皮细胞、骨髓基质细胞、脑星状细胞、成骨细胞;LPS 等激活的巨噬细胞、B 细胞、T 细胞和内皮细胞等;此外,多种肿瘤细胞如原粒细胞性白血病、淋巴母细胞性白血病、肺腺癌细胞、乳腺癌和卵巢癌等。
2.M-CSF 分子的结构和基因 人和小鼠天然 M -CSF 为糖蛋白,由二硫键连接的同源双体,分子量 40~90kDa。人 M -CSF 前体长度 554~256 个氨基酸不等,均有 32 个氨基酸的信号肽和 23 个氨基酸的穿膜部分。膜结合型 M -CSF 表达在单层培养的成纤维细胞,可刺激表达 M -CSF 受体的巨噬细胞的粘附和增殖。成熟 M -CSF 分子靠近 N 端 150 氨基酸在与 M -CSF 受体结合中起关键作用,人和小鼠 M -CSF 分子这个区域结构高度保守,其同源性达 80%。
3.M-CSF 受体 M-CSFR 由 c -fms 原癌基因所编码。人和小鼠 M -CSF 和 M -CSF 受体基因分别定位于第 5 和第 11 对染色体,与 GM-CSF、IL-3、IL-4、IL-5、IL-13 和酸性 FGF 基因密切连锁。M-CSF 受体为高亲和力,表达于循环的单核细胞和组织巨噬细胞以及胎盘滋养层细胞。人 M -CSFR 为穿膜糖蛋白,胞膜外区 512 个氨基酸,组成 5 个免疫球蛋白样区,穿膜区 25 个氨基酸,胞浆区 435 个氨基酸,并具有蛋白酪氨酸激酶区。通常 M -CSFR 是以同源二聚体形式存在。
4.M-CSF 的生物学作用 M-CSF 主要的生物学作用是促进单核 - 吞噬细胞包括破骨细胞在内的存活、增殖和活化。妊娠妇女尿中 M -CSF 水平明显增加,可能与胎盘的形成有关。M-CSF 是炎症反应中的介质,并可提高巨噬细胞杀伤肿瘤细胞和微生物的能力。人 M -CSF 可作用于小鼠,而小鼠的 M -CSF 生物学作用则具有种属的特异性。
![]()
图 4 -3 细胞因子与造血细胞分化
合理应用重组人 M -CSF 有助于提高机体免疫应答水平,现已用于治疗某些肿瘤,提高化疗后总白细胞和粒细胞水平,还可治疗小儿慢性中性粒细胞减少症。
M-CSF 可能与某些癌症、全身性红斑狼疮和骨质疏松症等疾病发生有关。白血病、淋巴细胞恶性增生、骨髓及外骨髓增殖性疾病、卵巢癌、子宫内膜癌、全身性红斑狼疮以及免疫性血小板减少性紫瘢病人血清或血浆中 M -CSF 的水平可升高。
(五)SCF
干细胞因子(stem cellfactor,SCF)又称肥大细胞生长因子(mast cell growth factor,MGF),最初是从 Buffalo 大鼠肝细胞系中 cDNA 克隆成功,在小鼠 MGF 基因位于第 10 号染色体 SL 基因,是 C -kit 的配体(C-kit ligand,KL),因此也称之造血生长因子 KL。
1.SCF 的产生 主要由肝细胞产生。
2.SCF 的分子结构 人和小鼠 SCF 分别由 248 和 220 个氨基酸组成,约有 80% 同源性。SCF 可以可溶性和膜结合两种形式存在,可能与 SCf mRNA 剪接或蛋白酶切割位点不同有关。在体内 SCF 以非共价相连同源二聚体形式存在,单体分子量约 31kDa,单体中含有 4 个半胱氨酸残基,形成分子内二硫键。糖基对 SCF 生物学活性并非必需。
3.SCF 受体 SCF 受体即是 C -kit,成熟 SCF 受体分子由 953 个氨基酸组成,其中胞膜外区 497 个氨基酸,属免疫球蛋白超家族成员,组成 5 个 Ig 样的结构域,与 M -CSFR、PDGFR 有较高的同源性;穿膜区由 23 个疏水性氨酸组成;胞浆区 433 个氨基酸,含有酪氨酸激酶和自身磷酸化的结构域。SCFR 表达于多种干细胞、集落形成细胞和肥大细胞等。
4.SCF 的生物学作用
(1)促进 IL- 3 依赖的早期造血前体细胞的增殖和分化,可以 IL-3、G-CSF、GM-CSF 和 EPO 等细胞因子协同促进髓样、淋巴样和红细胞样细胞的产生。
(2)促进肥大细胞增殖。
(3)促进黑素母细胞(melanoblasts)的增殖。
SCF 在骨髓移植、造血功能障碍以及干细胞基因治疗中有潜在的应用价值。目前 SCF 已进入临床Ⅰ期试验,主要治疗乳腺癌和淋巴瘤病人。
(六)EPO
红细胞生成素(erythropoietin,EPO)是一种刺激红细胞产生的糖蛋白。
1.EPO 的产生
(1)肾脏是 EPO 产生的主要来源,产生 EPO 细胞为肾小管基底膜外侧的肾小管周围间质细胞(peritubular interstitial cell),由于这些细胞释放第Ⅷ因子,因此这种 EPO 产生细胞可能是一种肾小管周围毛细血管的内皮细胞。组织氧利用率下降所引起组织缺氧是诱导 EPO 产生的主要刺激因素。
(2)肝脏中枯否氏细胞
(3)骨髓中巨噬细胞
2.EPO 的分子结构和基因 人和小鼠 EPO 基因分别定位于第 7 和第 5 号染色体。人 EPO 基因组为单拷贝,5.4kb 长,有 5 个外显子和 4 个内含子。EPO 基因上游有 TATA 盒,5′UTR 处有 AP-1、SP-1、NF-IL-6、GRE 和 NF-κB 的结合序列。EPo cDNA 编码 193 个氨基酸,包括 27 个氨基酸先导序列,成熟 EPO 分子由 166 个氨基酸组成,分子量为 18kDa,在 CHO 细胞中表达 rEPO 为 30kDa,糖占 39%,在人尿中的 EPO 为 34kDa 糖蛋白。
3.EPO 受体 1989 年从 MEL 细胞 745 表达文库中 EPORcDNA 克隆成功。人 EPOR 基因位于 19 号染色体,裸肽分子量为 55kDa,糖基化后为 66kDa,由 508 个氨基酸残基组成,包括 24 氨基酸残基的先导序列,成熟 EPOR 为 484 个氨基酸残基,其中,胞膜外区 226,穿膜区 22,胞浆区 236 个氨基酸残基,胞膜外结构属红细胞生成素 / 细胞因子受体超家族。还可能存在着 66kDa 与其它膜分子的复合物。EPOR 有高亲和力和低亲和力两种,至今对 EPOR 组成的确切结构和信号转导还不清楚。目前至少已发现 3 种在自然状态下由于膜受体裂解脱落的可溶性 EPO 受体(sEPOR)。
4.EPO 的生物学作用 EPO 特异地作用于红细胞样前体,对其它细胞系几乎没有作用。EPO 刺激骨髓中红细胞样前体细胞产生红细胞样集落形成单位(colony-formingunit-erthroid,CFU-E)和红细胞样爆发形成单位(burst-formingunit-erythroid,BFU-E)。CFU- E 为迅速分裂的红细胞样前体细胞,对低浓度 EPO 即有反应;BFU- E 则为更不成熟的红细胞样前体细胞,对 EPO 反应后,其分裂速度较慢。
EPO 水平过高见于:(1)原发性红细胞增多症;(2)继发性红细胞增多症,如高原居住者,慢性阻塞性肺疾患,紫绀性心脏病,高亲和力血红蛋白病,吸烟,局限性肾脏缺氧,恶性或良性肾脏肿瘤,肝细胞瘤,肝癌,肾上腺肿瘤等。EPO 水平过低主要见于肾功衰竭或晚期肾病引起的贫血,慢性感染、类风湿性关节炎、AIDS、肿瘤引起的贫血,其他原因引起的贫血等。患上述疾病机体可能产生 IL-1、TNF-α,这些细胞因子是 EPO 活性的抑制剂。再生障碍性贫血、缺铁性贫血、地中海性贫血、巨幼细胞性贫血等病人 EPO 水平反而升高,表明上述贫血症原因并非由 EPO 缺乏所引起。
EPO 主要用于肾功衰竭引起的贫血,还可用于类风湿性关节炎、多分性骨髓瘤、非 Hodg-kin 氏淋巴瘤、AIDS、化疗等原因引起的贫血。1989 年美国 FDA 批准 Amgen 公司首先将 rEPO 投放市场。
(七)CSF 的临床应用
如前所述,多种 CSF 已广泛应用于临床治疗多种疾病,体内应用 CSF 可提高循环血液中的血细胞,纠正贫血,减少感染等并发症,可明显改善症状,降低病死率。其主要适应症是下列原因引起的血液细胞减少(参见表 4 -15 和表 4 -16)。
(1)肿瘤化疗引起的血液细胞减少;
(2)肿瘤放疗引起的血液细胞减少;
(3)骨髓移植后重建造血功能;
(4)再生障碍性贫血以及慢性肾衰、肿瘤及血引起的贫血;
(5)艾滋病、骨髓发育异常综合征(MDS)患者血细胞减少;
(6)烧伤等。
三、肿瘤坏死因子
1975 年 Carswell 等发现接种 BCG 的小鼠注射 LPS 后,血清中含有一种能杀伤某些肿瘤细胞或使体内肿瘤组织发生血坏死的因子,称为肿瘤坏死因子(tumor necrosis factor,TNF)。1985 年 Shalaby 把巨噬细胞产生的 TNF 命名为 TNF-α,把 T 淋巴细胞产生的淋巴毒素(lymphotoxin,LT)命名为 TNF-β。TNF- α 又称恶质素。
1.TNF 的产生
(1)TNF- α 是一种单核因子,主要由单核细胞和巨噬细胞产生,LPS 是较强的刺激剂。IFN-γ、M-CSF、GM-CSF 对单核细胞 / 巨噬细胞产生 TNF- α 有刺激作用,而 PGE 则有抑制作用。前单核细胞系 U937、前髓细胞系 HL-60 在 PMA 刺激下可产生较高水平的 TNF-α。T 淋巴细胞、T 细胞杂交瘤、T 淋巴样细胞系以 NK 细胞等在 PMA 刺激下也可分泌 TNF-α。SAC、PMA、抗 IgM 可刺激正常 B 细胞产生 TNF-α。此外,中性粒细胞、LAK、星状细胞、内皮细胞、平滑肌细胞亦可产生 TNF-α。
(2)TNF- β 是一种淋巴因子,抗原和丝裂原均可刺激 T 淋巴细胞分泌 TNF-β。PMA 刺激 RPMI1788B 淋巴母细胞可分泌高水平 TNF-β。
2.TNF 的分子结构和基因
(1)人的 TNF- α 基因长约 2.76kb,小鼠为 2.78kb,结构非常相似,均由 4 个外显子和 3 个内含子组成,与 MHC 基因群密切连锁,分别定位于第 6 对和第 17 对染色体上。1984 年从 HL-60、U937 等细胞中克隆成功 rHuTNF-α cDNA,并在大肠杆菌中获得高表达。人 TNF- α 前体由 233 个氨基酸残基组成,含 76 个氨基酸残基的信号肽,切除信号肽后成熟型 TNF- α 为 157 氨基酸残基,非糖基化,第 69 位和 101 位两个半胱氨酸形成分子内二硫键。rHu TNF- α 分子量为 17kDa。小鼠 TNF- α 前体为 235 氨基酸残基,信号肽 79 氨基酸残基,成熟的小鼠 TNF-α(rMuTNF-α)分子量为 17kDa,由 156 个氨基酸残基组成,第 69 位和 100 位两个半胱氨酸形成分子内二硫键,有一个糖基化点,但糖基化不影响其生物学功能。rHu TNF- α 与 rMu TNF- α 有 79% 氨基酸组成同源性,TNF- α 的生物学作用似无明显的种属特异性。最近有人报道通过基因工程技术表达了 N 端少 2 个氨基酸(Val、Arg)的 155 氨基酸人 TNF-α,具有更好的生物学活性和抗肿瘤效应。此外,还有用基因工程方法,将 TNF- α 分子氨基端 7 个氨基酸残基缺失,再将 8Pro、9Ser 和 10Asp 改为 8Arg、9Lys 和 10Arg,或者再同时将 157Leu 改为 157Phe,改构后的 TNF- α 比天比天然 TNF 体外杀伤 L929 细胞的活性增加 1000 倍左右,在体内肿瘤出血坏死效应也明显增加。TNF- α 和 β 发挥生物学效应的天然形式是同源的三聚体。
(2)人 和小鼠 TNF- β 基因分别定位于第 6 和第 17 号染色体。HuTNF- β 分子由 205 个氨基酸残基组成,含 34 氨基酸残基的信号肽,成熟型 Hu TNF- β 分子为 171 个氨基酸残基,分子量 25kDa。rHuTNF- β 分子由 202 氨基酸残基组成,包括 33 个氨基酸残基的信号肽,成熟分子 169 个氨基酸残基,与 Hu TNF- β 有 79% 的同源性。Hu TNF- β 与 Hu TNF-αDNA 同源序列达 56%,氨基酸水平上同源性为 36%。
3.TNF 的受体
(1)TNF- R 的分型:TNF- R 可分为两型:Ⅰ型 TNF-R,55kDa,CD120a,439 氨基酸残基,此型受体可能在溶细胞活性上起主要作用;Ⅱ型 TNF-R,75kDa CD120b,426 氨基酸残基,此型受体可能与信号传递和 T 细胞增殖有关。两型 TNF- R 均包括胞膜外区、穿膜区和胞浆区三个部分,胞膜外区有 28% 的同源,但在有包浆区无同源性,可能与介导不同的信号转导途径有关。TNF- R 属于神经生长因子受体(NGFR)超家族。TNF- α 和 TNF- β 的受体可能是同一的。TNF- R 存在于多种正常及肿瘤细胞表面,一般每个细胞受体数目有 103~104,如 ME-180 肿瘤细胞系 TNF-αR 约 2000/ 个细胞,Kd 为 2 *10-10M。不同细胞表面 TNF-αR 的数目和亲和力似乎与细胞对 TNF- α 的敏感性并不平行。TNF- α 与相应受体结合后信号传递的机理尚不清楚,可能与活化蛋白激酶 C(PKC),催化受体蛋白磷酸化有关。
(2)可溶性 TNFR:TNF 结合蛋白(TNF-BP)是 TNFR 的可溶性形式,有 sTNf RⅠ(TNF-BPI)和 sTNFRⅡ(TNF-BPⅡ)两种。一般认为 sTNFR 具有局限 TNF 活性,或稳定 TNF 的作用,在细胞因子网络中有重要的调节作用。Seckiner 1988 年发现发热患者尿中有 TNF 抑制物,分子量为 33kDa。Olsson 1989 年在慢性肾功不全患者血和尿中也发现有 TNF-BP。TNF-BP 可与 TNF 特异结合,抑制 TNF 活性,如抑制其细胞毒活性和诱导 IL- 1 产生,可促进皮下接种 Meth A 肉毒的生长,可见于正常妊娠尿中。炎症、内毒素血症、脑膜炎双球菌感染、SLE、HIV 感染、肾功不全时以及肿瘤时可升高。可溶性 TNFR 可有效地减轻佐剂性关节炎的病理改变以及败血症休克。
4.TNF 的生物学活性 TNF- α 与 TNF- β 的生物学作用极为相似,这可能与分子结构的相似性和受体的同一性有关。但有某些生物学作用方面也有不同之处。
(1)杀伤或抑制肿瘤细胞:TNF 在体内、体外均能杀死某些肿瘤细胞(cytolytic action),或抑制增殖作用(cytostatic action)。肿瘤细胞株对 TNF- α 敏感性有很大的差异,TNF- α 对极少数肿瘤细胞甚至有刺激作用。用放线菌素 D、丝裂霉素 C、放线菌酮等处理肿瘤细胞(如小鼠成纤维细胞株 L929)可明显增强 TNF- α 杀伤肿瘤细胞活性。体内肿瘤对 TNF- α 的反应也有很大的差异,与其体外细胞株对 TNF- α 的敏感性并不平行。同一细胞系可能有敏感株和抵抗株如 L929- S 和 L929-R。此外,靶细胞内源性 TNF 的表达可能会使细胞抵抗外源性 TNF 的细胞毒作用,因此,通过诱导或抑制内源性 TNF 的表达可改变细胞对外源性 TNF 的敏感性。巨噬细胞膜结合型 TNF 可能参与对靶细胞的杀伤作用。
TNF 杀伤肿瘤的机理还不十分清楚,与补体或穿孔素(perforin)杀伤细胞相比,TNF 杀伤细胞没有穿孔现象,而且杀伤过程相对比较缓慢。TNF 杀伤肿瘤组织细胞可能与以下机理有关。
①直接杀伤或抑制作用:TNF 与相应受体结合后向细胞内移,被靶细胞溶酶体摄取导致溶酶体稳定性降低,各种酶外泄,引起细胞溶解。也有认为 TNFN 激活磷脂酶 A2,释放超氧化物而引起 DNA 断裂,磷脂酶 A2 抑制剂可降低 TNF 的抗病效应。TNF 可或改变靶细胞糖代谢,使细胞内 pH 降低,导致细胞死亡。
②通过 TNF 对机体免疫功能的调节作用,促进 T 细胞及其它杀伤细胞对肿瘤细胞的杀伤。
③TNF 作用于血管内皮细胞,损伤内皮细胞或导致血管功能紊乱,使血管损伤和血栓形成,造成肿瘤组织的局部血流阻断而发生出血、缺氧坏死。
(2)提高中性粒细胞的吞噬能力,增加过氧化物阴离子产生,增强 ADCC 功能,刺激细胞脱颗粒和分泌髓过氧化物酶。TNF 预先与内皮细胞培养可使其增加 MHCⅠ类抗原、ICAM- 1 的表达,IL-1、GM-CSF 和 IL- 8 的分泌,并促进中性粒细胞粘附到内皮细胞上,从而刺激机体局部炎症反应,TNF- α 的这种诱导作用要比 TNF- β 为强。TNF 刺激单核细胞和巨噬细胞分泌 IL-1,并调节 NHCⅡ类抗原的表达。
(3)抗感染:如抑制疟原虫生长,抑制病毒复制(如腺病毒Ⅱ型、疱疹病毒Ⅱ型),抑制病毒蛋白合成、病毒颗粒的产生和感染性,并可杀伤病毒感染细胞。TNF 抗病毒机理不十分清楚。
(4)TNF 是一种内源性热原质,引起发热,并诱导肝细胞急性期蛋白的合成。TNF 引起发热可能是通过直接刺激下丘脑体温调节中枢和刺激巨噬细胞释放 IL- 1 而引起,还可通过 IL-1、TNF- α 刺激其它细胞产生 IL-6。
(5)促进髓样白血病细胞向巨噬细胞分化,如促进髓样白血病细胞 ML-1、单核细胞白血病细胞 U937、早幼粒白血病细胞 HL60 的分化,机理不清楚。TGF- β 可抑制 TNF- α 多种生物学活性,但不抑制 TNF- α 对髓样白血病细胞分化的诱导作用,甚至还有协同效应。
(6)促进细胞增殖和分化:TNF 促进 T 细胞 NHCⅠ类抗原表达,增强 IL- 2 依赖的胸腺细胞、T 细胞增殖能力,促进 IL-2、CSF 和 IFN- γ 等淋巴因子产生,增强有丝分裂原或外来抗原刺激 B 细胞的增殖和 Ig 分泌。TNF- α 对某些肿瘤细胞具有生长因子样作用,并协同 EGF、PDGF 和胰岛素的促增殖作用,促进 EGF 受体表达。TNF 也可促进 c -myc 和 c -fos 等与细胞增殖密切相关原癌基因的表达,引起细胞周期由 Go 期向 G1 期转变。最近报道 INF-β(LT)是 EB 病毒转化淋巴母细胞的自分泌生长因子,抗 LT 抗体、sTNf R 以及 TNF- α 能抑制 EB 病毒转化淋巴细胞的增殖。
IL-1、IFN- γ 和 GM-CSF 对 TNF 的生物学作用有明显的增强作用,可能与增加细胞 TNF 受体的表达有关。已报道一种抗 TNF- α 单克隆抗体,可模拟 TNF- α 的某些生物学作用,这种现象在其它因子中还尚未见到。
5.TNF 与临床
应用 TNF 在治疗肿瘤等方面开始临床Ⅱ期试验,也可与 IL- 2 联人事治疗肿瘤,目前认为全身用药的疗效不及局部用药,后者如病灶内注射,局部浓度高且副作用也较轻。近年来已采用 TNF 基因治疗开始对黑素瘤等肿瘤进行临床验证。值得重视的 TNF 又与临床某些疾病的发生有关。
TNF 与 IL- 1 和 IL- 6 的生物学性质有许多相似之处(表 4 -8)。
表 4 -8 IL-1、IL- 6 和 TNF 的生物学性质比较
| 生物学性质 | IL-1 | TNF | IL-6 |
| 内源性热原质引起发热 | + | + | + |
| 肝急性期蛋白 | + | + | + |
| T 细胞活化 | + | + | + |
| B 细胞活化 | + | + | + |
| B 细胞免疫球蛋白合成 | + | – | + |
| 成纤维细胞增殖 | + | + | – |
| 干细胞活化 | + | – | + |
| 非特异性抗感染 | + | + | + |
| 抗放射 | + | + | – |
| 滑膜细胞活化 | + | + | – |
| 内皮细胞活化 | + | + | – |
| 休克综合征 | + | + | – |
| 诱导 IL-1、TNF、IL- 6 和 IL-8 | + | + | – |
(1)感染性休克:目前认为革兰氏阴性杆菌或脑膜炎球菌引起的弥漫性血管内凝血、中毒性休克是由于细菌内毒素刺激机体产生过量 TNF-α,引起发热,心脏、肾上腺严重损害,呼吸循环衰竭,甚至引起死亡,其 TNF 水平与病死率正相关。其发病机理可能是 TNF 刺激内皮细胞,导致炎症、组织损伤和凝血。TNF 也是急性肝坏死的重要因素。病毒性暴发型肝衰竭外周血细胞诱生 TNF,IL- 1 活性升高,且与病情程度相关。目前有关 TNF 介导内毒素性休克的机理还不很清楚。有认为 TNF 能促进前凝血酶原活性物质生成,抑制内皮细胞凝血酶调节毒素休克。TNF 抗体(抗血清或单克隆抗体)在小鼠、家兔和狒狒体内均有效地阻止致死性内毒素体克的发生。应用抗 TNf McAb 治疗脓毒症和化脓性休克已进入Ⅲ期临床试验,抗 TNF 嵌合抗体治疗细菌性感染也已开始Ⅰ期临床试验。
(2)恶液质:TNF- α 又称恶液素(cachectin),可诱发机体发生恶液质。
(3)TNF 与病毒复制的关系:TNF 还具有类似 IFN 抗病毒作用,阻止病毒早期蛋白质的合成,从而抑制病毒的复制,并与 TNF- α 和 TNF- γ 协同抗病毒作用。另一方面,TNF 诱导 HIV-Ⅰ基因在 T 细胞中表达。TNF 和 HIV 感染的 CD4+ 细胞中活化或诱导 NF-κB,NF-κB 结合于 HIV 的长末端重复序列(LTR)的增强子部位,活化 HIV 基因,可能与艾滋病发病有关。艾滋病患者单核细胞 TNF- α 产生增加,血清中 TNF- α 水平升高。
四、干扰素(IFN)
1957 年 Isaacs 和 Lindenmann 首先发现了病毒干扰现象,即病毒感染的细胞能产生一种因子,作用于其他细胞干扰病毒的复制,因而命名为干扰素。目前已知干扰素并不能直接杀伤病毒,而是诱导宿主细胞产生数种酶,干扰病毒的基因转录或病毒蛋白组分的翻译。根据产生干扰素细胞来源不同、理化性质和生物学活性的差异,可分为 α - 干扰素(interferon α,IFN-α)、β- 干扰素(interferon β,IFN-β)和 γ - 干扰素(interferon γ,IFN-γ)。
(一)IFN- α 和 IFN-β
IFN- α 和 IFN- β 有许多相似之处,如:(1)两种 IFN 基因来自同一个祖先基因(common ancester gene);(2)由相同的细胞在相同的刺激物诱导下产生;(3)结合相同的受体,并发挥相似的生物学效应。
1.IFN-α/ β 的产生 IFN-α/ β 以往称为Ⅰ型 IFN,主要由白细胞、成纤维细胞等在细菌、DNA 或 RNA 病毒、多聚肌苷酸多聚胞苷酸(Poly I-C)、多核苷酸等刺激物诱导下产生。IFN-α/ β 在 pH2 或 pH11 以及热(56℃)条件下仍稳定,而 IFN- γ 则很易丧失活性。
2.IFN-α/ β 的分子结构和基因 IFN- α 和 IFN- β 基因均位于人 9 号染色体和小鼠 4 号染色体,并连锁在一起。IFN- α 基因至少有 20 个,成串排列在一个区域,无内含子,同一种属 IFN- α 不同基因产物其氨基酸同原性≥80%。人和小鼠 IFN- β 基因只有一个,无内含子,与 IFN- α 基因连锁在一起。IFN- β 与 IFN- α 氨基酸组成有 26~30% 同源性。IFN- α 由 2 个亚族(subfamily)组成,分别称为 IFN-α1 和 IFN-α2,其中 IFN-α1 至少由 20 个有功能的基因组成,彼此间有 90% 左右的同源性;IFN-α2 亚族有 5~6 个基因成员,目前只发现 1 个有功能的基因,其余是假基因。
IFN- α 分子不同亚型由 166/165 个的氨基酸组成,无糖基,分子量约 19kDa 左右,不同种属之间同源性 70% 左右。IFN- α 分子含有 4 个 Cys1-99,Cys29-139 之间形成两个分子内二硫键。IFN- α 的生物学作用有一定的种属特异性。
人 IFN- β 分子含 166 个氨基酸,有糖基,分子量为 23kDa,含有 3 个半胱氨酸,分别在 17、31 和 141 位氨基酸。31 与 141 位半胱氨酸之间形成的分子内二硫键对于 IFN- β 生物学活性非常很重,141Cys 被 Tyr 替代后则完全丧失抗病毒作用,而 Cys17 被 Ser 替代后不仅不影响生物学活性,反而是使 IFN- β 分子稳定性更好。糖基对生物学活性无影响。小鼠 IFN- β 分子只有一个 Cys17,分子内无二硫键。IFN- β 的生物学作用有较强的种属特异性。
3.IFN-α/ β 体受 一般认为,IFN- α 和 IFN- β 结合相同的受体,IFT-α/βR 基因定位于 21 号染色体,受体的亲和力 Kd 在 10-9~10-10M 之间,受体胞膜外结构属细胞因子受体中干扰素受体家族。IFN-α/ β 受体分布相当广泛,包括单核细胞、巨噬细胞、多形核白细胞、B 细胞、T 细胞、血小板、上皮细胞、内皮细胞和肿瘤细胞等。
4.IFN-α/ β 的生物学作用
(1)抗病毒作用:IFN-α/ β 具有广谱的抗病毒作用,其作用机理是:①通过抑制某些病毒的吸附(如 VSV)、脱衣壳和最初的病毒核酸转录(如 SV-40、HSV-1、流感病毒和 VSV)、病毒蛋白合成(如 SVS、SV-40)以及成熟病毒的释放(如逆转录病毒、HSV-1)等不同环节;②通过 NK、巨噬细胞和 CTL 杀伤病毒感染靶细胞。
(2)抑制某些细胞的生长(cytostatic),如抑制成纤维细胞、上皮细胞、内皮细胞和造血细胞的增殖,其机理可能通过使细胞停留在 Go/G1 期,降低 DNA 合成,下调 c -myc、c-fos 等细胞原癌基因转录水平,下调某些生长因子受体表达,如 EGf R、胰岛素 -I R 和 M -CSFR 等。
(3)免疫调节作用:促进大多数细胞 MHCⅠ类抗原的表达,活化 NK 细胞和 CTL。
(4)抑制和杀伤肿瘤细胞:IFN-α/ β 杀伤肿瘤细胞主要是通过促进机体免疫功能,提高巨噬细胞、NK 和 CTL 的杀伤水平。
不同的 INF- α 亚型的诱生、抗病毒和免疫调节活性可有所不同,例如①同一病毒在不同细胞中诱生 IFN- α 亚型种类有很大差别,如仙台病毒在人白细胞中以诱生 IFN-α1 为主,其次为 IFN-α2,少量 IFN-α14;而在类淋巴母细胞中却以诱生 IFN-α2 为主,IFN-α1 为次,无 IFN-α14;在单核细胞中则主要诱导 IFN-α8。②INF- α 的不同亚型对于不同靶细胞表现出不同的抗病毒活性,如 Hu IFN-α1 在 MDBK 细胞上的抗病毒活性比 Wish 细胞高 20~30 倍,而 HuIFN-α2a 在这两种细胞中抗病毒活性无明显差别。③不同 IFN- α 亚型对不同病毒的抗病毒作用有很大差异,如 HuIFN-α1 抑制肾综合征出血热病毒的繁殖能力比 IFN-α2a 高 15 倍。④不同 IFN- α 亚型对 MHC 抗原表达、NK 活性以及细胞因子产生的调节作用也有较大的差异,如 Hu IFN-α1 可促进单核细胞 MHCⅡ类抗原的表达,而 Hu IFN-α2 则无这种诱导作用。
(二)IFN-γ
1965 年 Wheelock 等首先在 PHA 刺激的白细胞培养上清中发现具有 IFN 样抗病毒物质,但在 pH2 条件下即失去抗病毒的活性。1973 年 Youngert 和 Salvin 发现来自淋巴细胞培养上清中存在一种 IFN,但抗原性不同于以往发现的 IFN,遂命名为Ⅱ型 IFN,1980 年统一命名为 IFN-γ。1981 年 Goeddle 等将 IFN- γ 基因克隆成功。
1.IFN- γ 的产生 主要由活化 T 细胞产生,在小鼠,由 Th1 亚群产生。当抗原、PHA 或 ConA 刺激后 T 细胞分泌 IFN-γ,通常与 IL- 2 的产生相一致。目前认为巨噬细胞活化因子(MAF)的主要活性存在于 IFN- γ 中。此外,活化 NK 细胞也可产生 IFN-γ。
2.IFN 的分子结构和基因 人和小鼠 IFN- γ 基因分别定位于 12 号和 10 号染色体,在 DNA 水平上 IFN- γ 基因与 IFN-α/ β 基因无同源性。人和小鼠 IFN- γ 在 DNA 水平上有 65% 左右同源性,在氨基酸水平的同源性只有 40% 左右。小鼠成熟 IFN- γ 分子由 133 个氨基酸残基组成。人 IFN- γ 成熟分子由 143 个氨基酸组成,糖蛋白,以同源双体形式存在,分子量为 40kDa,其生物学作用有严格的种属特异性。
3.IFN- γ 受体 人 IFN-γR 基因定位于第 6 号染色体,小鼠在第 10 号染色体。IFN- γ 受体分布广泛,受体阳性细胞每个细胞约表达 100~1000 个受体,亲和力 kD10-9~5*10-11M。裸肽分子量 50kDa,糖基化后 90kDa,其 N 末端与 IFNα/ β 受体有一定的同源性,具有种属特异性。目前认为人 IFN-γR 可能存在着第二条链。
IFN-γR 为穿膜糖蛋白,胞膜外区、穿膜外区、穿膜区和胞浆区分别有 228、21 和 223 个氨基酸残基,从胞膜外区结构特征来看,属于细胞因子受体干扰素受体家族,最近命名为 CDw119。
IFN- γ 配体诱导 IFN-γR 二聚体化在信号转导中可能起重要作用,并与受人本的磷酸化有关。IFN- γ 与受体结合后可活化多种 IFN- γ 调节的基因。目前已知,IFN- γ 刺激后至少有 20 种蛋白被表达,其中 12 种是 IFN 刺激后所特有的。这种表达是由于活化特异的 DNA 结合蛋白使其从胞浆移位到胞核,如干扰素刺激的基因因子 2(interferon-stimulated gene fac-tor 2,ISGF2)和 γ - 干扰素激活因子(gamma-interferon activation factor,GAF 或 STAT91)结合到 IFN 基因启动子中两个称之为 γ 干扰素活化点(gamma-interferon activation site,GAS)和干扰素刺激的反应元件(interferon-stimulated response element,ISRE)的位置上。IFN- γ 可促进 HLA-B、HLA-DR、IP-10、P1 激酶和 2 -5A 合成酶的全成,其中 P1 激酶可抑制病毒蛋白的翻译,而 2 -5A 合成酶则可裂解病毒 RNA。
4.IFN- γ 的生物学活性 IFN- γ 生物学作用有较严格的种属特异性,人 IFN- γ 只作用于人或灵长类动物的细胞。
(1)诱导单核细胞、巨噬细胞、树突状细胞、皮肤成纤维细胞、血管内皮细胞、星状细胞等 MHCⅡ类抗原的表达,使其参与抗原提呈和特异性免疫的识别过程。此外,IFN- γ 可上调内皮细胞 ICAM-1(CD54)表达,促进巨噬细胞 FcγR 表达,协同诱导 TNF 并促进巨噬细胞杀伤病原微生物。
(2)促进 LPS 体外刺激小鼠 B 细胞分泌和 IgG2a,降低 IgG1、IgG2b、IgG3 和 IgE 的产生;抑制由 IL- 4 诱导小鼠 B 细胞增殖,IgG1 和 IgE 产生以及 FcεRⅡ表达;促进 SAC 诱导的人 B 细胞的增殖。
(3)协同 IL- 2 诱导 LAK 活性,促进 T 细胞 IL-2R 表达。
(4)诱导急性期蛋白合成,诱导髓样细胞分化。
(三)IFN 的临床应用
IFN 是第一个应用于临床的基因工程产品,目前 IFN-α、IFN-β、IFN- γ 都有基因工程产物,40 多个国家使用干扰素制剂,治疗 30 多种疾病,但主要用于临床肿瘤、病毒性感染等治疗(表 4 -9)。
(1)治疗病毒性感染:IFN 对慢性活动性乙型肝炎、慢性活动性丙型肝炎、单纯疱疹病毒性角膜炎、带状疱疹、慢性宫颈炎、新生儿巨细胞病毒性脑炎以及鼻病毒和冠状毒引起的普通感冒有一定疗效。
(2)抗肿瘤:IFN 对多种肿瘤近期有良好疗效,如毛细胞白血病(hairy cell leukemia)、慢性髓样白血病、淋巴瘤、Kaposi 氏肉瘤、黑素瘤、皮肤瘤、肾肉瘤、神经胶质瘤和骨髓瘤等。IFN 抗肿瘤的机理是:①抑制肿瘤细胞增殖;②诱导 NK、CTL 等杀伤细胞,并协同 IL- 2 增强 LAK 活性;③诱导肿瘤细胞表达 NHCⅠ类抗原,增加对杀伤细胞的敏感性。
表 4 -9 干扰素治疗肿瘤、病毒性感染及其他疾病的疗效(1992)
| 疾 病 | 病 原 | 疗 效 |
| 肿瘤 | ||
| 毛细胞白血病 | 60%~90% 缓解 | |
| 慢性白血病 | 50% 部分缓解 | |
| 淋巴瘤 | 37% 部分或完全缓解 | |
| Kaposi 氏肉瘤 | 26% 部分缓解 | |
| 急性白血病 | 24% 部分缓解 | |
| 多发性骨髓瘤 | 20% 部分或完全缓解 | |
| 神经胶质瘤 | 17% 部分或完全缓解 | |
| 肾细胞癌 | 16% 部分或完全缓解,较差 | |
| 恶性黑素细胞癌 | 10% 以上部分或完全缓解,局部应用疗效较好 | |
| 卵巢癌 | 10% 以上部分缓解(IFN- α 腹腔注射) | |
| 乳腺癌 | 10% 以上部分缓解,较差 | |
| 恶性胰腺肿瘤 | 部分改善 | |
| 星期直肠癌 | 部分改善 | |
| 食道癌 | 部分改善 | |
| 非小细胞性肺癌 | 部分改善 | |
| 小细胞性肺癌 | 部分改善 | |
| 病毒性感染 | ||
| 慢性活动性乙型肝炎 | VBV | 约 40% 患者 HBe 阴转,与激素联用可以提高疗效 |
| 丙型肝炎 | HCV | 约 25%~50% 患者 ALT 下降或 正常 |
| 艾滋病 | HIV | 抑制艾滋病患者 HIV 的复制,延长 HIV 带毒无症状者发病的潜伏期,缩小 Koposi 氏肉瘤,增加血清 β2m 水平,与 AZT 联合应用可以改善症状 |
| 唇和生殖器官复发性疱疹 | HSV-1,HSV-2 | 缩短病和程,减轻疼痛 |
| 带状疱疹 | VZV | 缩短病程,阻止扩散,减轻疼痛 |
| 肿瘤患者水痘 | VZV | 降低致命性的内脏合并症 |
| 病毒性角膜炎 | HSV-1,腺病毒 | 缩短病程,减少复发,痊愈率 >90% |
| 红眼病 | 肠道病毒 70 | 缩短病程 |
| 慢性宫颈炎(包括宫颈湿疣) | HPV,HSV,HCMV | 局部应用 60% 显效,95% 有效 |
续表 1
| 疾 病 | 病 原 | 疗 效 |
| 肛门-生殖器扁平湿疣 | HPV | 治愈率 40~50% |
| 青年喉乳头状瘤 | HVP-11 | 肿瘤消失或缩小,但易复发 |
| 寻常疣 | HVP | 改善 |
| 巨细胞病毒 | HCMV | 尿毒症消失,降低发病率 |
| 普通感冒 | HRV | 缩短病程,痱毒减少 |
| 外阴前庭炎 | 50% 与 HPV 有关 | 改善临床症状 |
| 呼吸道合胞病毒感染 | RSV | 志愿者试验表明,攻击前后均给药,可以明显减轻症状,但仅在病毒攻击后给药则无效 |
| 尖锐湿疣 | HPV | 疗效较好 |
| 其它疾病 | ||
| Behect 氏病(征)(生殖器溃疡、口疮及眼色素层炎) | 不明 | γ 干扰素治疗后,口、生殖器溃疡、结节性红斑、血栓性静脉炎、复发性关节炎等均可减轻症状或完合消除,但眼色素层炎、视神经乳头炎无改善,停药后易复发 |
| 类风湿性关节炎 | 不明 | γ 干扰素治疗后疼痛明显减轻,40~50% 缓解 |
| 慢性肉芽肿 | HFN- γ 治疗有一定疗效 | |
| 多发性硬化症 | 不明 | 延长缓解期 |
| 精神分裂症 | 不明 | 部分改善 |
注:HBV hepatitisB virus, 乙型肝炎病毒
HCV hepatitis C virus 丙型肝炎病毒
HIV human immunodeficiency virus, 人类免疫缺陷病毒
HSV herpes simplex virus, 单纯疱疹病毒
VZV varicella-zoster virus, 水痘 - 带状疱疹病毒
HPV human papilloma virus, 人乳头状瘤病毒
HCMV human cytomegalouirus, 人巨细胞病毒
HRV human rhinovirus, 人鼻病毒
RSV respiratory syncytial virus, 呼吸道合胞体病毒
IFN 治疗一般无严重毒副反应,少数病例可有发热、疲劳不适、食欲不佳、白细胞减少以及血压波动等,停药后很快消失,IFN-a1b 的副作用要明显低于 IFN-a2a 和 a2b。重组 IFN- a 在治疗过程中有时可产生抗体,如发现抗体产生,应改用其他亚型的 IFN-a。据报道,使用 INF-a2a 约有 20.9% 患者产生抗体,而使用 IFN-a2b 仅有 6.9% 使用者产生
五、转化生长因子 -β(TGF-β)
转化生长因子 -β(transforming growth factor-β,TGF-β)是属于一组新近发现的调节细胞生长和分化的 TGF- β 超家族。这一家族除 TGF- β 外,还有活化素(activins)、抑制素(inhibins)、缪勒氏管抑制质(Mullerian inhibitor substance,MIS)和骨形成蛋白(bonemorpho-genetic proteins,BMPs)。TGF- β 的命名是根据这种细胞因子能使正常的成纤维细胞的表型发生转化,即在表皮生长因子(EGF)同时存在的条件下,改变成纤维细胞巾壁生长特性而获得在琼脂中生长的能力,并失去生长中密度信赖的抑制作用。TGF- β 与早先报道的从非洲绿猴肾上皮细胞 BSC- 1 所分泌的生长抑制因子是同一物。
1.TGF- β 的产生
(1)机体多种细胞均可分泌非活性状态的 TGF-β。在体外,非活性状态的 TGF- β 又称为 latency associated peptide(LAP),通过酸外一时可被活化。在体内,酸性环境可存在于骨折附近和正在愈合的伤口。蛋白本科的裂解作用可使 TGF- β 复合体变为活化 TGF-β。一般在细胞分化活跃的组织常含有较高水平的 TGF-β,如成骨细胞、肾脏、骨髓和胎肝的造血细胞。TGF-β1 在人血小板和哺乳动物骨中含量最高;TGF-β2 在猪血小板和哺乳动物骨中含量最高;TGF-β3 以间充质起源的细胞产生为主。
(2)活化后 T 细胞或 B 细胞产生 TGF- β 水平比静止细胞明显为高。
(3)几科所有肿瘤细胞内可检测到 TGF-βmRNA。神经胶质细胞瘤在体内可分泌较高水平的 TGF-β。
2.TGF- β 的分子结构和基因1985 年 TGF- β 的基因克隆成功,并在大肠杆菌内得到表达。在哺乳动物至少发现有 TGF-β1、TGF-β2、TGF-β3、TGF-β1β2 四个亚型。在鸟类和两栖类动物还分别存在着 TGF-β4 和 TGF-β5,对后两者的生物学作用所知甚少。
TGF- β 是由两个结构相同或相近的、分子量的 12.5kDa 亚单位借二硫键连接的双体。人 TGF-βcDNA 序列研究表明,单体的 TGF-β112 氨基酸残基是由含 400 氨基酸残基的前体份子(per-pro-TGF-β)从羧基端裂解而来。pre-pro-TGF-βN 端含有一个信号肽,在分泌前被裂解掉,成为非活性状态的多肽链前体(pro-TGF-β),通过改变离子强度、酸化或蛋白酶水解切除掉,成为非活性状态的多肽链前体(pro-TGF-β),通过改变离子强度、酸化或蛋白酶水解切除 N 端部分氨基酸残基,所剩余的羧基端部分形成有活性的 TGF-β。TGF-β1 与 TGF-β2 有 71% 氨基酸同源性,TGF-β1 与 TGF-β3 有 77% 同源性,TGF-β2 与 TGF-β3 有 80% 同源性。TGF- β 与 TGF- β 超家族其化成员有 30~40% 同源性。
人 TGF-β1、TGF-β2 和 TGF-β3 的基因分别定位于染色体 19q3、1q41 和 14q24,均含有 7 个外显子,核苷酸序列有高度同源性,所编码的前体分子 C 端者有 9 个保守的 Cys,提示 TGF-β1、TGF-β2 和 TGF-β3 基因可能来自一个共同的祖先基因。人和小鼠 TGF-β1 的同源性高达 99%,表明在不同种属中 TGF- β 都具有重要的生物学功能。对其人 TGF-β1 基因调控区进行了研究,发现该基因 5` 端序列包含 5 个明显的调控区:一个类增强子(enhancer-like)活性区,二个负调控区和二个启动子区。
3.TGF- β 受体 许多细胞表面都有 TGF- β 受体。大鼠成纤维细胞系 NRK-49F 和 BALB/c 3T3 细胞表面 TGF- β 受体亲和力 Kd 值为 5.6~14*10-11M,每个细胞 TGF- β 结合点约 1.6~1.9*104。在淋巴细胞表面,TGF-βRKd 值 1~5.1*10-12M。T 细胞、B 细胞每个细胞 TGF-βR 数约 250,活化后受体数量可增加 5~6 倍,但 Kd 值无明显变化。造血细胞表面 TGF-βR 对 TGF-β1 亲和力要比 TGF-β2 明显为高,这可能解释了造血细胞对 TGF-β1 反应要比 TGF-β2 更为敏感。TGF-β1、β2 和 β3 结合细胞表面相同的受体。
最近发现 TGF-βR 存在着Ⅰ、Ⅱ、Ⅲ型三种形式,分子量分别为 53kDa、70~85kDa 和 250~350kDa,。Ⅰ、Ⅱ型 TGF-βR 均为糖蛋白,它们和 TGF-β1 的亲和力要比和 TGF-β2 的亲和力大 10~80 倍;Ⅲ型受体是一种蛋白聚糖(proteoglycan),它与 TGF-β1、TGF-β2、TGF-β3 的亲和力近似,是为 TGF- β 主要的受体,可能在 TGF- β 发挥生物学功能中起着主要作用。TGF-βRⅢ又名 Endoglin,CD105,TGF-β1 和 TGF-β3 为其主要配体。
Ⅱ型 TGF-βR 胞浆区具有丝氨酸 / 苏氨酸激酶区。这种结构也见于活化受体Ⅱ(ActRⅡ)和 ActRⅡB。Ⅲ型 TGF- β 受体本身缺乏蛋白激酶活性,对于其如何参与信号的传递还不清楚。当 TGF- β 诱导增殖时 G 蛋白可能参与诱导过程,此外,TGF- β 促进 Ca2+ 内流和胞内 IP3 水平的升高,激活 PKC。
4.TGF- β 的生物学作用 起初对 TGF- β 的生物学功能研究主要在炎症、组织修复和胚胎发育等方面,近年来发现 TGF- β 对细胞的生长、分化和免疫功能都有重要的调节作用。TGF-β1、β2 和 β3 功能相似,一般来说,TGF- β 对间充质起源的细胞超刺激作用,而对上皮或神经外胚层来源的细胞起抑制作用。
(1)抑制免疫活性细胞的增殖:①抑制 IL-3、GM-CSF、M-CSF 所诱导小鼠造血前体细胞和 LTBMC 的集落形成,并降低巨核细胞对 IL-3T 和 CSF 的反应性。②抑制 ConA 诱导或 ConA 与 IL-2、IL- 6 联合诱导的胸腺细胞增殖。③抑制丝裂原、同种异体抗原刺激的 T 细胞增殖或 IL- 2 依赖的 T 细胞生长。④抑制 SAC 刺激后 IL- 2 依赖的 B 细胞增殖。
(2)对细胞表型的调节:①抑制 IL- 2 诱导的 T 细胞 IL-2R、TfR 和 TLiSA1 活化抗原的表达,对 CD3 表达未见有影响。②抑制 IFN- γ 诱导黑素瘤细胞 MHCⅡ类抗原表达。
(3)抑制淋巴细胞的分化:①抑制 IL- 2 和 BCDF 依赖的 B 细胞分泌 IgM,促进 B 细胞分泌 Ig 类型转换为 IgA 和 IgE。②抑制混合淋巴细胞培养(MLC)中 CTL、NK 和 LAK 功能,这种抑制作用可被 TNF-α(小鼠 MIC)或 IL-2(人 MLC)所逆转。③抑制 PBMC 中 NK 活性以及 NK 细胞对 TNF- α 的的以应性。④抑制 ConA 和 IL-2、IL- 6 协同诱导小鼠胸腺 MHC 非限制杀伤性细胞的活性。
(4)抑制细胞因子产生:如抑制 PBMC 中 IFN- γ 和 TNF- α 的产生。
(5)其它调节作用:①促进成纤维细胞、成骨细胞和雪旺氏细胞的生长。TGF-β1、TGF-β2 促进人成纤维细胞 IL- 6 的产生,其机理可能是通过对 IL- 6 基因转录的调节。②抑制上皮细胞、破骨细胞、内皮细胞生长和脂肪、心肌、骨骼肌的形成。TGF- β 可拮抗 EGF 的某些生物学功能。③促进细胞外基质(ECM)如胶原蛋白、纤粘连蛋白的表达和抑制 ECM 的降解,对细胞的形态发生、增殖和分化过程起着重要作用,有利于胚胎发育和细胞修复。动物体内实验表明,局部注射 TGF- β 可以促进伤口愈合和典型肉芽组织形成。④单核细胞和成纤维细胞的趋化剂,但不引起胶颗粒和氧化物的产生。⑤抑制淋巴细胞与内皮细胞的粘附。⑥促进嗜碱性粒细胞释放组织胺。
(6)TGF-β1 与原癌基因表达:TGF-β1 能诱导 c -sis 的表达,但抑制 c -myc 的表达,这种诱导或抑制作用与作用细胞种类及 TGF- β 的不同功能有关。如 TGF- β 诱导成纤维细胞中 c -sis 基因表达,与促进其在软琼脂中生长有关;而对上皮角朊细胞生长的抑制则与抑制 c -myc 基因表达有关。TGF-β1、TGF-β2 和 TGF-β3 在大多数生物学作用方面非常相似,但在有些作用方面可有很大差异,如 TGF-β2 对血管内皮细胞和造血祖细胞的生长抑制作用仅为 TGF-β1 和 TGF-β3 的 1%。
TGF- β 在治疗伤口愈合,促进软骨和骨修复以及通过免疫抑制治疗自身免疫性疾病和移植排斥等方面有潜在的应用前景。
[α2- 巨球蛋白的细胞因子载体效应]α2- 巨球蛋白(α2M)是由 4 个相同多肽亚单位靠链同二硫键和非共价键结合形成具有交叉结构的四聚体。每个亚单位内由半胱氨酸的巯基与邻近的谷氨酰胺残基的羧基形成硫酸键。这种硫酯键易受蛋白水解酶裂解从而使 α2M 构型变化增加其电泳迁移率,称为快型 α2M(Fα2M)硫酯键裂解可与含有巯基的细胞因子结合成复合物,出现细胞因子载体效应。
(1)IL-1β:IL-1β 与 α2M 结合的最佳条件为 pH9.0~9.3,这种结合是可逆的,与 α2M 结合的 IL-1β 呈“隐蔽”状态,如果 IL-1β 从复合物中释放出来,仍恢复自然的 IL-1β 活性。
(2)IL-6:α2M 与 IL- 6 结合可保护 IL-6,不易被胰蛋白酶、糜蛋白酶以及组织蛋白酶 G 的作用,从而处长血浆中 IL- 6 的半衰期。呈结合状态的 IL- 6 并不改变基生物学活性。
(3)THF-β:α2M 可降低血浆中 THF- β 的生物学活性,其机理除抑制 THF- β 与其相应受体结合外,α2M 与 THF- β 复合物可能被具有 α2M 受体的吞噬细胞所清除。
(4)其它:α2M 还可作为巨噬细胞活化因子(MAF)、血小板衍生的生长因子(PDGF)、碱性成纤维细胞生长因子(bFGF)的载体,对它们的生物学活性产生不同的影响。
胎牛血清中含有较高水平的 α 2M,因此体外培养测定条件培养液中某引起细胞因子时应加注意。
表 4 -10 α2 M 对所结合细胞因子活性的影响
| 所结合的细胞因子 | 细胞因子活性变化 | 影 响 机 理 |
| IL-1β | 部分降低 | 使 IL-1β 活性部位呈隐蔽状态 |
| IL-6 | 不 变 | 抑制多种酶裂解 IL-6,从而延长 IL- 6 在血浆中的半衰期 |
| TGF-β | 降 低 | 抑制 TGF- β 与相应受体结合,加速 TGF- β 的清除 |
| MAF | 不 变 | 保护作用 |
| PDGF | 降 低 | 加快 PDGF 的清除 |
| bFGF | 失 活 | 促进 b -FGF 的酶解,加速从血循环中排出 |
六、趋化因子
由组织细胞和微生物产生的趋化剂(chemoattractants)对白细胞的趋化作用(chemotaxis)是炎症发生过程中重要的起始步骤,也是机体防御和清除入侵病原体等异物先天性免疫功能的一个重要方面。1986 年以前,“经典”的(classical)白细胞趋化物质主要有补体片段 C5a、白三烯 B4(leukotrinin B4,LTB4)、血小板激活因子(platelet-activating factor,PAF)和 fMLP(N-formylmethionyl-leucyl-phenyl-alanine,N- 甲酰甲硫氨酰 - 亮氨酰 - 苯丙氨酸),这些趋化物质的受体同属于 G 蛋白偶联受体(Gprotein-coupled receptor)。
(一)趋化因子的种类
1. 趋化因子的命名 1986 年以来,陆续发一现了一类主要由免疫细胞产生的、具有趋化白细胞作用的细胞因子(chemoattractant cytokines 或 chemotacticcytokines)。在 1992 年第 3 届国际趋化因子研讨会上,绝大多数学者建议把 chemoattractant(chemotactic)cytokine 简称为 chemokines, 本书暂译名为趋化因子。趋化因子又称可诱导的小分子蛋白(small-inducible protein,SIP)、间分泌(intercrine)、细胞因子 PE- 4 超家族(PF-4superfamily of common an-cestralcytokines)或 PF- 4 样细胞因子(PF-4 likecytokine)等。
2. 趋化因子亚族及其成员 通过基因克隆和 cDNA、氨基酸序列分析,人的趋化因子超家族目前至少发现有 19 个成员,它们具有以下共同的特点。(1)来自同一个祖先基因(com-mon ancestral gene)。(2)成熟分子为分子量 8~10kDa 的小分子多肽。(3)可诱导性(inducible)。(4)不同成员在氨基酸水平上有 21%~90% 的同源性,其中不同亚族成员间同源性,其中不同亚族成员间同源性为 21%~31%,同一亚族不同成员间同源性为 25%~90%。所有趋化因子均含有 4 个 Cys 的保守基序(motif),组成特征性的两个二硫键。第一个 Cys 前的 N 端肽段较短,约 4~12 氨基酸,第 4 个 Cys 后 C 端肽段较长,为 18~24 氨基酸。(5)其相应的受体属于 G 蛋白偶联受体,这类受体有 7 个跨膜区(seven predicated transmembranedomains,STR),在胞浆内与三个亚单位所组成的 G - 蛋白(heterotrimeric G protein)相偶联。
根据多肽键一级结构中第 1、2 两上 Cys 排列的方式,可将趋化因子超家族分为两个亚族(subfamily):(1)C-X- C 亚族(或 α 亚族),除 NAP- 4 以外,这个亚族其余成员分子中 N 端两个 Cys 之间被另一个氨基酸残基所分隔;(2)C- C 亚族(或 β 亚族),第 1、2 两个 Cys 是相连的。两个亚族所包括的成员见表 4 -11。
表 4 -11 两个趋化因子亚族所包括的成员
| C-X- C 亚族(α 亚族) |
| IL-8/NAP-1(interleukin-8/neutrophil-activating protein 1, 白细胞介素 8 / 中性粒细胞激活蛋白 1) |
| NAP2/CTAPⅢ/βTG(neutrophile-activating protein 2/connective tissue-activating peptide Ⅲ/β-thromboglobulin,中性粒细胞激活蛋白 2 / 结缔组织激活肽Ⅲ/β- 凝血球蛋白) |
| NAP-4(neutrophil-activating protein 4, 中性粒细胞激活蛋白 4) |
| GROα/NGSA(growth related gene α/melanoma growth-stimulating activity, 生长相关基因 α / 黑素瘤生长刺激活性) |
| GROβ(growth related gene β, 生长相关基因 β) |
| GROγ(growth related gene α/melanoma growth-stimulating activity, 生长相关基因 α / 黑素瘤生长刺激活性) |
| PF-4(platelet factor-4, 血小板因子 -4) |
| ENA-78(a 78-residue epithelial cell-derived neutrophil-activator,78 氨基酸上皮细胞来源的中性粒细胞活化剂) |
| γIP-10(interferonγ-inducible protein-10,γ 干扰素诱生蛋白 -10) |
| Mig(monokine inducible by γ-interferon,γ 干扰素诱生的单核因子) |
| GCP-2(granulocyte chemoattractant protein-1/monocyte chemotactic and activating factor, 单核细胞趋化蛋白 -1/ 单核细胞趋化和激活因子) |
续表 1
| NCP-2/HC14(monocyte chemoatractant protein-2, 单核细胞趋化蛋白 -2) |
| MCP-3/NC28(monocyte chemoattractant protein-3, 单核细胞趋化蛋白 -3) |
| MIP-1α/LD78(macrophage inflammatory protein-1α, 巨噬细胞炎症蛋白 -1α) |
| MIP-1β/Act-2(macrophage inflammatory protein-1β, 巨噬细胞炎症蛋白 -1β) |
| RANTES(reduced upon activation,normal Texpressed and secreted, 正常 T 细胞表达和分泌,活化时表达下降的因子) |
| 1309(活化人 T 细胞 - 种基因产物,cDNA 克隆并表达成功) |
注:(1)NAP-2/CTAPⅢ/βTG 是由血小板碱性蛋白(platelet basicprotein,PBP)N 端加工后形成。
(2)LD78 和 Act- 2 分别是人的 MIP-1α 和 NIP-1β,与小鼠源性 MIP-1α 和 NIP-1β 有很高同源性。
(3)GROα、GROβ 和 GROγ 指基因产物。
3. 趋化因子作用特点 趋化因子 C -X- C 和 C - C 亚族的生物学活性有明显的差别。C-X- C 亚族中,除 γIP-10、Nig 和 PF- 4 外,其余成员均具有趋化和激活中性粒细胞的活性。编码这个亚族成员的基因定位于第 4 号染色体长臂,氨基酸水平上的同源性在 25%~90%。γIP-10 主要趋化单核细胞和 T 细胞。C- C 亚族主要趋化和激活单核细胞和某些 T 细胞亚群,基因定位于第 17 号染色体长臂,而且各成员的基因密切连锁,氨基酸水平上同源性在 25%~70%。两个亚族之间同源性为 21%~31%。
趋化因子除趋化和激活中性粒细胞、单核细胞或某些 T 细胞亚群外,有些成员还可趋化嗜酸性粒细胞,或趋化嗜碱性粒细胞并刺激其释放组织胺。某些趋化因子还具有刺激造血细胞、成纤维细胞、角化细胞或黑素瘤细胞的生长。趋化因子除了以游离形式发挥作用外,还可结合到细胞外基质 (ECM) 或内皮细胞表面,从而趋化白细胞到相应的组成或血管内皮处,聚集并激活中性粒细胞或单核细胞。下面仅就 C -X- C 亚族中的 IL- 8 和 GRO 以及 C - C 亚族中 MCP-1/MCAF、MIP-1α、MIP-1β 和 RANTES 作一介绍。
(二)IL-8
1986 年 Kownatzki 等首先证实了单核细胞可产生一种中性粒细胞趋化因子。嗣后,不同实验室根据这种因子不同的生物学活性有不同的命名,如中性粒细胞激活蛋白 -1(neu-trophil-activating protein-1,NAP-1),单核细胞来源的中性粒细胞趋化因子(monocyte-derived neutrophil chemotactic factor,MDNCF),单核细胞来源的中性粒细胞激活肽(monocyte-derived neutrophil-activating peptide,MDNAP), 中性粒细胞激活因子(neu-trophil-ac-tivating factor,NAF), 中收粒细胞激活肽(neutrophil-activating peptide,NAP),T 淋巴细胞趋化因子(t lymphocyte chemotactic factor,TCF)和内皮细胞来源的中性粒细胞激活肽(endothelial-derived neutrophil-activating peptide,EDNAP)。1988 年基因克隆成功,属于 C -X- C 亚族(α 亚族)成员,目前文献中多采用名称是 IL-8(interleukin-8)/NAP-1。
1.IL- 8 的产生
(1)IL-1、TNF、LPS 和 PMA 均能诱导单核细胞、巨噬细胞、内皮细胞、成纤维细胞和表皮细胞等合成分泌 IL-8。
(2)PHA 等丝裂原活的 T 细胞也可产生 IL-8。
(3)人类多种肿瘤细胞均可高表达 IL-8。其中甲状腺癌、鳞状细胞癌、黑素瘤等可组成性产生 IL-8,而星状细胞瘤、肝癌、肾细胞癌等则需要 IL-1β 或 TNF- α 等刺激下才合成和分泌 IL-8。
2.IL- 8 的分子结构 IL- 8 分子量 8.3kDa,不成熟的 IL- 8 为 99 个氨基酸,单核细胞产生的成熟 IL- 8 分子主要形式为 72 个氨基酸,而内皮细胞产生的成熟 IL- 8 分子主要为 77 个氨基酸。在 α 亚族中,α 与 GROα、GROβ、GROγ、ENA-78 和 NAP- 2 相对有较高源性。IL- 8 分子含 4 个 Cys,无 N 糖基化位上噗,IP8.0~8.5,耐热、耐碱,但对巯基化合物敏感。1988 年 Matsushima 首次获得 IL-8cDNA 克隆,并在大肠杆菌和中国仓鼠卵母细胞中表达成功。人 IL- 8 基因定位于第 4 号染色体,基因组有 7 个外显子和 3 个内含子。5` 端上游有典型的“CAT”和“TATA”盒以及 AP- 1 结合序列和糖皮质反应元件(GRE)等结构。IL- 8 基因与 CXC 亚族中 PF-4、GROα、γIP-10 基因相连锁成熟的 IL- 8 分子的 N 端,是由蛋白酶水解的不同所致。在体外,凝血酶或血纤维蛋白溶酶可将 77 氨基酸形式裂解为 72 氨基酸形式的 IL-8,后者较前者的生物学活性要高 2~10 倍。
3.IL- 8 受体 IL- 8 受体有两型:IL-8R A 型(或 IL-8RⅠ)和 IL-8r B 型(或 IL-8RⅡ),两型受体在氨基酸水平上有 77% 同源性,最近命名为 CDw128。IL-8rA 特异性结合 IL-8,为高亲和力,受体主要分布于中性粒细胞(每个细胞 20000 受体,Dd 为 8 *10-10M)、单核细胞、T 细胞和黑素瘤细胞。IL-8B 除 IL- 8 结合外,还可结合 GROβ、GROγ 和 NAP-2,与 IL-8、GROα、GROβ 和 GROγ 结合为高亲和力。与 IL-8r B 结合的这 5 种配体分子近 N 端均具有一个 Glu-Leu-Arg(ELR)序列,可能是与 IL-8r B 结合的一个重要结构。此型受体主要分布于中性粒细胞和髓样细胞前体细胞系,如 HL60 细胞系。IL-8R 属于 G 蛋白偶联受体,与 fMLP 受体和 C5a 受体有 29%~34% 同源性。IL- 8 与相应受体结合后可使细胞内 Ca2+浓度短暂升高,百日咳杆菌毒素(IAP)可抑制 IL- 8 的这种刺激作用,表明 IAP 敏感的 G 蛋白与 IL- 8 受体的信号转导有关。此外,细胞膜磷酸肌醇脂代谢和 PKC 也与 IL-8R 的信号转导有关。最近证实人红细胞膜表面 Duffy 抗原(gpD)可结合包括 IL- 8 在内的多种趋化因子,这种受体还分布在肾脏和大脑,可能具有清除循环中 IL- 8 等趋化因子的功能,在炎症发生过程中具有重要的调节作用。
4.IL- 8 的生物学活性
(1)趋化和激活中性粒细胞:IL- 8 的这种效应无明显种属特性。动物腹腔或静脉注射 IL- 8 可引起外周血中性粒细胞数量的增加。IL- 8 可使中性粒细胞外形改变,促进其脱颗粒,激活中性粒细胞并使其产生呼吸爆发(respiratoryburst)、释放超氧化物(O2-、H2O2)和溶酶体酶。局部注射 IL- 8 可趋化中性粒细胞,并刺激中性粒细胞产生白三烯 B4(LTB4)而使皮下血浆渗出,IL- 8 还能诱导中性粒细胞上调 Macl 抗原(CD11b/CD18)的表达,促进中性粒细胞粘附到内皮细胞和内皮细胞下的基质蛋白。
(2)趋化嗜碱性粒细胞,并刺激其释放组织胺,可能与速发型超敏反应的发生有关。此外,还可刺激 GM-CSF 或 IL- 5 预先处理的嗜酸性粒细胞的脱颗粒作用。
(3)趋化 T 淋巴细胞:可趋化部分静止的 CD4+ 或 CD8+ T 细胞,这种趋化作用需要单核细胞的同时存在。局部注射 IL- 8 可使局部和引流区淋巴结 T 细胞明显增多。IL- 8 还可明显趋化 IL- 2 活化和 NK 细胞。
(4)IL- 8 是角化细胞的复合促有丝分裂原(co-mitogen),也是黑素瘤细胞的自分泌生长因子。
5.IL- 8 与临床 目前关于 IL- 8 与疾病的关系的研究仅仅开始。已发现牛皮癣皮屑中和类风湿性关节炎关节滑液中含有 IL-8,IL- 8 可诱导中性粒细胞产生软骨降解酶,引起关节组织损伤,皮质激素能抑制非特异性炎症可能与抑制 IL- 8 的产生有关。此外,某些与中性粒细胞积聚有关的炎症和呼吸系统疾病局部或血清中 IL- 8 水平往往升高,如胃炎、炎症性结肠炎、肺纤维化或成人呼吸窘迫综合征、支气管肺泡灌洗液、慢性支气管炎、支气管扩张、败血症休克、急性脑膜炎球菌感染、酒精性肝炎等。IL- 8 水平升高往往与局部浸润的单核细胞和中性粒细胞数量相平行。
IL- 8 与 IL-1、TNF-α、G-CSF、GM-CSF 或 IFN 等联合应用有可能治疗中性粒细胞减少症以及 HIV 所致的免疫缺陷症等。肿瘤局部注射 IL- 8 可趋化中性粒细胞、T 细胞和 NK 细胞,在治疗肿瘤中可能有应用前景。
(三)GRO
GRO(growth related gene, 生长相关基因)可分为 GROα、GROβ 和 GROγ 三种,此处指基因产物,属于 C -X- C 亚族。GROα 又称为黑素瘤生长刺激活性(melanoma growth-stimulating activity,MGSA), 常以 GROα/MGSA 表示。GROα 与 GROβ 和 GROγ 分别有 90% 和 86% 的同源性。GROα、GROβ 和 GROγ 与 ENA-78 和 NAP- 2 也有较高的同源性。此外,在 DNA 和氨基酸水平上人 GRO 与细胞因子诱导的大鼠中性粒细胞趋化剂(CINC)、小鼠巨噬细胞炎症蛋白 -2(murinemacrophage inflammatory protein 2,MIP-2)也有较高的同源性。
GPOα 前体长 107 氨基酸,切除 N 端 34 氨基酸先导序列后形成 73 氨基酸的成熟分子。单核细胞、成纤维细胞、黑素瘤细胞、上皮细胞和脐带静脉内皮细胞等经血清、PDGF 或 IL-1、TNF 等炎症介质刺激下均可表达 GPOα,在某些肿瘤细胞 GPOα 的表达是组成性的(con-stitutive)。GPOα 趋化人中性粒细胞的能力约为 IL- 8 的 10 倍,但在激活中性粒细胞并刺激其脱颗粒的作用则弱于 IL-8。体内试验表明,GPOα 与急性炎症的发生密切相关,使炎症局部有大量中性粒细胞浸润。GPOα 对单核细胞则无趋化作用。GPOα 对人 Hs294T 黑素瘤细胞的生长有一定的刺激活性,对滑膜来源的成纤维细胞Ⅰ型和Ⅲ型胶原蛋白的表达有下调作用。GPOα 与 IL-8RB 有高亲和力的结合,还可与人红细胞膜 Duffy 抗原(gpD)结合。
(四)MCP-1/MCAF
单核细胞趋化蛋白 -1(monocyte chemotactic protein 1,MCP-1)又称单核细胞趋化和激活因子(monoctye chemotactic and activating factor,MCAF),属于 C - C 亚族(β 亚族)成员。MCP-1/MCAF 起初是从人髓样单核细胞系 THP-1、神经胶质瘤细胞系以及 LPS 或 PHA 刺激的人 PBMC 培养上清中发现。目前已知,单核细胞、巨噬细胞、成纤维细胞、内皮细胞、B 细胞、平滑肌细胞等在 PHA、LPS、Poly I-C、IL-1、IFN-γ、PDGF、EGF 或某些病毒刺激下均可被诱导分泌 MCP-1。某些肿瘤细胞系则可组成性产 MCP-1。
人 MCP-1/MCAF 基因定位于第 17 对染色体。人 MCP- 1 前体长 99 个氨基酸,切除 23 个氨基酸先导序列后形成 76 氨基酸的成熟分子,为碱性蛋白。非糖基化的 MCP- 1 分子量 8.7kDa,经不同糖基化后 MCP- 1 分子量有 13kDa 两种。MCP- 1 分子中 11 与 36Cys 和 12 与 52Cys 之间所形成两个链内二硫键以及 Try28 和 Arg30,对于 MCP- 1 的生物学活性是必需的。在氨基酸水平上,MCP- 1 与另外两种单核细胞趋化蛋白 MCP-2(HC14)和 MCP-3(NC28)分别有 62% 和 72% 同源性,与 C -X- C 亚族中 IL- 8 有 24% 同源性。
体内和体外实验均证实了 MCP- 1 对单核细胞具有趋化活性,激活单核细胞和巨噬细胞,使其胞浆内 Ca2+ 浓度升高,超氧阴离子的产生和释放,并释放溶菌酶,上调单核细胞和巨噬细胞粘附分子如 integrin 家族 β2 组和 α4 分子的表达和细胞因子 IL-1、IL- 6 的产生,活化的巨噬细胞可抑制肿瘤细胞的生长。MCP 是嗜碱性粒细胞的趋化剂和激活剂,尤其是刺激嗜碱性粒细胞脱颗粒和组胺释放的作用较为强烈。MCP- 1 与 MCP-1R 发生特异性的结合,此受体主要分布于单核细胞、髓样前体细胞系和嗜碱性粒细胞,属于 IL-8R 家族。分布于人红细胞表面的 Duffy 抗原也可结合 MCP-1。
风湿性关节炎病人的滑液和血清中 MCP- 1 水平明显升高,滑液组织巨噬细胞组成性地产生 MCP-1,提示 MCP- 1 与风湿性关节炎的病理损伤有关。高胆固醇血症时,动脉内侧平滑肌细胞产生高水平 MCP-1,单核细胞粘附于血管壁并浸润动脉壁。肾脏炎症时,IL- 1 诱导肾小球细胞产生 MCP-1。高血脂症时,LDL 与肾小球细胞结合,刺激其产生 MCP-1,趋化单核细胞在局部浸润。
(五)MIP-1α 和 MIP-1β
巨噬细胞炎症蛋白 1(macrophage inflammatory protein 1,MIP-1)最初从 LPS 刺激小鼠巨噬细胞上清中发现。根据 MIP- 1 分子结构的差异,可分为小鼠 MIP-1α 和 MIP-1β,人的 MIP-1α 又称 LD78,人的 MIP-1β 又称 Act-2。在同一种属中,MIP-1α 和 MIP-1β 间约有 70% 同源性。不同种属 MIP- 1 之间也有较高的同源性,如人和小鼠 MIP-1β 有间约有 70% 同源性。不同和中属 MIP- 1 之间也有较高的同源性,如人和小鼠 MIP-1β 有 77% 同源性,并且人和小鼠 MIP-1α 和 MIP-1β 均有种属交叉反应性。成熟的人和小鼠 MIP-1β 分子均为 69 个氨基酸,MIP 属于 C - C 亚族(β 亚族)的成员。
表 4 -12 MIP-1α 和 MIP-1β 生和的学活性比较
| 生物学活性 | MIP-1α | MIP-1β(a) |
| 趋化单核细胞 | + | + |
| 趋化嗜酸性粒细胞并刺激其脱颗粒 | + | |
| 趋化嗜碱性粒细胞 | + | – |
| 刺激肥大细胞、嗜碱性粒细胞释放组织胺 | + | |
| 趋化 T 细胞 | CD4+、CTL | “naive”T |
| 趋化 B 细胞 | + | |
| 急性炎症性肉芽肿介质 | + | |
| 保进 CD8+ T 细胞与内皮细胞的粘附(b) | ± | + |
注:(a)MIP-1β 对某些生物学功能的调节作用尚未见有报道。
(b)T 细胞需 MIP- 1 预处理;内皮细胞需经 MIP- 1 等因子的刺激,使之表达 VCAM- 1 分子。
活化后的 T 细胞、B 细胞、单核细胞和肥大细胞均表达 MIP-1α 和 MIP-1β。MIP-1α 和 MIP-1β 均可趋化单核细胞,但对其它细胞的调节作用则有所差别(表 4 -14)。
MIP-1α 与 MIP-1α/RANTES 受体结合,MIP-1α/RANTES 受体正如命名所示,除与 MIP-1α 配体结合外,还可与 RANTES 结合,此型受体主要分布于单核细胞、T 细胞、髓样细胞前体细胞系、B 细胞以及嗜酸性粒细胞和嗜碱性粒细胞等。
(六)RANTES
RANTES 是 reduced upon activation,nornal T cell expressed andsecreted 的略写词,国内尚未见翻译的专业术语,从产生条件角度一为试译,似为此种趋化因子在正常 T 细胞表达和分泌,活化时其产生水平则降低。RANTES 最初认为是只是 T 细胞产生的,以后发现,RANTES 与凝血酶刺激人血小板所释放的嗜酸性粒细胞趋化物质是同一种分子。除 T 细胞(CD4+ 和 CD8+)和血小板外,肾小和官上皮细胞、肾小球膜细胞、肾脏、肝脏等也可表达 RANTES。人 RANTES 的前体是高度碱性的蛋白,91 个氨基酸,切除 23 个氨基酸先导序列后成熟分子含 68 氨基酸,与 MIP-1α 和 MIP-1β 有较高同源性。作小鼠 RANTES 在氨基酸水平上同源性有 90% 以上。RANTES 属于 C - C 亚族(β 亚族)成员。
RANTES 对多种白细胞具有趋化或 / 和刺激作用:(1)趋化单核细胞;(2)趋化未刺激的 CD4+CD45RO+ 记忆 T 细胞以及活化后的 CD4+ 和 CD8+ T 细胞;(3)趋化嗜酸性粒细胞并刺激其脱颗粒和呼吸爆发;(4)是嗜碱性粒细胞较强的趋化剂,但刺激其组织胺等介质释放的作用较弱;(5)RANTES 预外理 T 细胞可增加其与 IL-1α 刺激内皮细胞的粘附能力。
百日咳杆菌外毒素可抑制 RANTES 的生和的学活性,提示其受体跨膜信号的转导与 IL-8R 相似。RANTES 与 MIP-1α/RANTES 受体相结合,些型受体主要分布于单核细胞、T 细胞、髓样细胞前体细胞系、B 细胞、嗜酸性粒细胞和嗜碱性粒细胞等,如人单核细胞性白血病细胞系 THP- 1 上与 MIP-1α/RANTES 结合位点每个细胞约 700 个,Kd 值 700pM。
七、其它细胞因子
(一)LIF
60 年代末人们就发现一种能诱导 M1 白血病细胞系分化为正常细胞的因子,后称之为白血病抑制因子(leukemia inhibitory factor,LIF)。小鼠和 LIF cDNA 分别于 1987 年和 1988 年克隆成功。
1.LIF 的产生 已在活化的 T 细胞、单核细胞、神经胶质细胞、肝成纤维细胞、骨髓基质细胞、胚胎干细胞、胸腺上皮细胞等多种细胞中发现有 LIF 的表达。
2.LIF 的分子结构和基因 人和小鼠 LIF 基因分别定位于第 22 号和第 11 号染色体,基因长度分别人 6.0kb 和 6.3kb,均含有 3 个外显子和 2 个内含子,基因编码区域具有高度的保守序列,其同源性在 78~94%。ILF 为 180 个氨基酸,核心蛋白分子量为 20kDa,有 7 个糖基化位点,6 个 Cys,分子内部二硫键对于维持 LIF 分子的结构和生物学活性可能起重要作用。由于糖基化程度的不同,LIF 分子量和电荷有所差别,分子量 38~64kDa,IP8.6~9.2。LIF 体外生物学功能似乎与糖基化程度无关,但糖基化是否影响 LIF 在体内稳定性和功能尚待确定。人和小鼠 LIF 在氨基酸水平上有 78% 同源性,人 LIF 对鼠源性细胞有相似的活性,而小鼠 LIF 对人的细胞则作用很弱。在氨基酸水平上,LIF 与抑瘤素 -M(oncostatin M,OSM)和睫状神经营养因子(CNTF)有一事实上的同源性,而且在蛋白质分子二级结构上也有相似之处。
3.LIF 的受体 ILF 受体 α 链为低亲和力受体,其结构属于红细胞生成素受体家族成员,含有 2 个该家族特征性结构域。gp130 是 LIF 受体的另一个亚单位,与 LIF 受体 α 链共同组成高亲和力受体。LIF 受体分布较广泛,如脂肪细胞、成骨细胞、神经细胞、胚胎癌细胞、胚胎干细胞、M1 白血病细胞以及活化的巨噬细胞等。
4.LIF 的生物学活性
(1)调节细胞的增殖、分化和表型:LIF 抑制小鼠胚胎干细胞(embryonic stem cell,ES)的分化。对于造血系统中的肿瘤细胞,LIF 常显示出抑制效应,同时诱导这些肿瘤细胞的分化,例如 LIF 可抑制小鼠白血病 M1 细胞的增殖,诱导其转变为巨噬细胞表型,如表达 Fc 受体,并获得吞噬能力等。对单核细胞的分化也超诱导作用。LIF 与 GM-CSF、G-CSF 或 IL- 6 协同抑制 HL-60 和 U937 细胞的生长,并诱导其分化。LIF 增强 IL- 3 对巨核细胞前体的造血干细胞的致有丝分裂作用,提高体内巨核细胞和血小板的数量。LIF 还可促进成肌细胞的增殖。在一定条件下,LIF 可促进新生大鼠背根神经节中的神经元表型从肾上腺素能型转变为胆碱能型,因此 LIF 又称为胆硷能神经元分化因子(cholinergic neuronaldifferentia-tion factor,CNF)。此外,LIF 还可促进移植神经嵴分化的胚胎性神经元的存活。
(2)抑制脂蛋白脂酶活性,降低 3T3-L1 脂肪细胞对游离脂肪酸的摄取。
(3)促进骨的重吸收,这种作用可能是通过 LIF 刺激成骨细胞合成前列腺素所介导的。
(4)诱导肝脏急性期蛋白的产生。
(二)OSM
1.OSM 的产生 1986 年 Zarling 等首次从 PMA 活化 U937 细胞培养上清中分离纯化到一种因子,这种因子有明显抑制 A375 人黑素瘤细胞生长而命名为抑瘤素 -M(oncostatin M,OSM)。以后从 PHA 活化的 T 细胞、单核细胞或 HTLV-Ⅱ感染的人 T 细胞培养上清中也发现 OSM。
2.OSM 的分子结构和基因 人 OSM 基因定位于 22 号染色体,基因组由 3 个外显子和 2 个内含子组成,与 LIF 基因结构相似。OSM 前体有 252 个氨基酸,切除 25 个氨基酸的先导序列后称之原 OSM,含 227 个氨基酸,在类胰蛋酶作用位点(RSRR)切除原 OSm C 端 31 个氨基酸后,形成 196 个氨基酸成熟分子,含有 N - 和 O - 糖基化位点,为 28kDa 糖蛋白。OSM 分子中有 5 个 Cys,Cys31-Cys152 和 Cys74-Cys192 形成两个分子内二硫键,其中 Cys74-Cys192 二硫键对于维持 OSM 生物学活性非常重要。OSM 对热和酸稳定。OSM 与 LIF、G-CSF、IL- 6 及 CNTF 分子之间有一定的同源性和相似的二级结构。
3.OSM 的受体 gp130 是 OSM 受体的一个亚单位,是识别 OSM 的低亲和力受体,在组成 OSM 高亲和力受体中,除 gp130 亚单位外,还有 LIFR 的参与。此外,另一个特异性的组成高亲和力受体的亚单位(OSMR)还有待证实。OSM 受体广泛分布于多种肿瘤细胞、内皮细胞和上皮细胞。
4.OSM 的生物学活性
(1)调节细胞的生长和分化:这方面的活性与 LIF 相似。OSM 可抑制多种肿瘤细胞的生长,如低剂量 OSM 即可抑制大多数肺癌及乳腺癌细胞的生长。诱导某些肿瘤细胞的分化,如诱导小鼠髓样白血病细胞系 M1 分化为巨噬细胞样细胞,协同 GM-CSF 促进人 U937 细胞的分化。抑制骨髓干细胞的分化。促进 Kaposi 氏肉瘤的生长并分泌 IL-6。诱导多种成纤维细胞和人红白血病细胞株 TF- 1 的增殖。
(2)诱导肝癌 HepG2 细胞等产生急性期蛋白,增加 LDL 受体,增加肝脏对胆固醇的摄取。
细胞因子种类繁多,作用复杂,新的细胞因子不断涌现。除前述的细胞因子外,还有核糖核酸酶超家族中血管生成素,表皮生长因子家族中表皮生长因子、转化生长因子 -α、肝素结合 EGF 样生长因子,成纤维细胞生长因子家族的碱性成纤维细胞生长因了和酸性成纤维细胞胞生长因子,胰岛素样生长因子家族中胰钪素样生长因子,血小板衍生的生长因子家族中血小板衍生的生长因子和血管内皮细胞生长因子,以及肝细胞生长因子、神经生长因子和多效素等,现归纳为“部分细胞因子 - 览表”供参考。
表 4 -13 部分细胞因子 - 览表
| 细胞因子 | 细胞因子 | 分子组成 | 来 源 | 受 体 | 功 能 |
| 家族归类 | |||||
| 血管生成素(angiogenin,ANG) | 核糖核酸酶超家族 | 单链 13aa(14.2kDa) | HT-29 人腺癌细胞、WI-38 成纤维细胞、外周血淋巴细胞、正常克隆上皮细胞、A549 人肺癌细胞 | 肌动蛋白 | (1)与 TGF-β、aFGF、bFGF 有协同作用(2)结合 ECM,支持内皮或成纤维细胞的粘附和移动,有新生血管作用(3)引起细胞表面肌动蛋白的聚合和释放 |
| 表皮生长因子(epidermal growth factor,EGF) (又名尿抑胃素,urogastrone) | 表皮生长因子家族 | 1. 膜结合形式发挥近分泌作用(juxta-crine)2. 可溶性形式 53aa(6kDa) | 1. 存在于众多体液和汗腺 2. 在血小板中有 EGF 样活性 | EGFR170kDa 有 PTK 结构 | (1)促进间质及上皮细胞增殖和分化(2)促进成纤维细胞和内皮细胞增殖(3)在体内介导上皮生长,促进血管形成,抑制胃酸分泌(4)加速伤口愈合 |
| 转化生长因子 -α(transforming growth factor,-α,TGF-α) | 表皮生长因子家族 | 1. 膜结合形式 2. 可溶性形式 50aa(6kDa) | 垂体、脑、皮肤角化细胞、巨噬细胞 | EGFR | (1)正常和异常细胞的分化(2)促进成纤维细胞和上皮的生长(3)体内的血管生成因子和角化细胞游走刺激物 |
| 肝素结合 EGF 样生长因子(heparin-binding EGF-like growth factor,HB-EGF) | 表皮生长因子家族 | 1. 膜结合形式 2. 可溶性形式 86aa | 肺、骨骼肌、脑、心脏、创伤部位 | EGFR | 促进成纤维细胞和平滑肌细胞的增殖 |
续表 1
| 细胞因子 | 细胞因子 | 分子组成 | 来 源 | 受 体 | 功 能 |
| 家族归类 | |||||
| 成纤维细胞生长因子(fibroblast growth factor,FGF) | 成纤维细胞生长因子于家族 | 碱性 FGF 155,157,163aa(18~kDa)酸性 FGF 155aa(16~18kDa) | 碱性 FGF;神经组织、垂体、肾上腺皮质、黄体和胎盘酸性 FGF:脑、视网膜、骨基璺和骨肉瘤 | FGFR1 FGFR2 FGFR3 FGFR4 | (1)刺激所有中胚层来源的细胞,以及许多神经外胚层、外胚层和内胚层来源的细胞的增殖(2)体内对内皮细胞有趋化和促有丝分裂作用,促进血管形成(3)碱性 FGF 介导神经元的分化、存活和再生,刺激神经胶质细胞的移行(4)参与由细胞过度增殖和血管过度形成所引起的多种病理损害 |
| 肝细胞生长因子(hepatocyte growth factor,HGF) | (与其它细胞因子无相似性) | 又链 α44aa β234aa 674aa (82kDa) | 枯否氏细胞 / 巨噬细胞、内皮细胞、胚胎肺成纤维细胞、Ito 或肝脂肪贮存细胞、血管平滑肌 | c-mot 原癌基因产物 | (1)促进各种上皮及中胚层和外胚层来源的细胞的增殖(2)对上皮和内皮细胞有促游走作用(3)参与最初的形态发生(4)抑制人燕麦细胞癌、HcpG2 肝细胞癌、B6/F1 黑素细胞和 KB 鳞状细胞癌的生长 |
| 胰岛素样生长因子(insulin-like growth factor,IGF) | 胰岛素样生长因子家族 | IGF-Ⅰ单单链,70aa IGF-Ⅱ单链,67aa | 肝脏等多种组织 | IGF-ⅠR IGF-ⅡR | (1)参与神经组织的生长和维持(2)IGF-Ⅱ是胎儿生长发育和成人胸腺组织中主要的 IGF |
| 神经生长因子(never growth factor,NGF) | (与其它细胞因子无相似性) | 同源双体单链,120aa(26kDa) | (鼠)下颌下管上皮、神经元、雪旺氏细胞成纤维细胞、平滑肌细胞、甲状腺滤泡旁细胞 | p140TRK(TRK 原癌基因产物);p75LNGFR | (1)维持感觉、交感神经元的存活(2)趋化中性粒细胞和提高其存活和吞噬水平,诱导单核细胞分化 |
| 血小板衍生的生长因子(platclet-derived factor,PDGF) | 血小板衍生的生长因子家族 | 同源或异源双体 A:125 或 110aaB:160 或 109aa | 动脉内皮细胞、激活的单核 / 巨噬细胞、新生鼠动脉平滑肌细胞、刺激的成纤维细胞、细胞滋养层及多种肿 | PDGF-Rα PDGF-Rβ | (1)促进皮肤成纤维细胞、神经胶质细胞、平滑肌细胞、上皮及内皮细胞的增殖(2)趋化成纤维细胞、平滑肌细胞、中性粒细胞和单个核细胞 |
续表 2
| 细胞因子 | 细胞因子 | 分子组成 | 来 源 | 受 体 | 功 能 |
| 家族归类 | |||||
| 瘤细胞 | (3)抑制 NK 细胞的活性(4)刺激中性粒细胞、单核细胞释放颗粒及中性粒细胞的吞噬作用(5)刺激胶原蛋白的合成(6)调节血栓海绵蛋白的表达和分泌(7)刺激胶原酶的活性和分泌(8)调节神经再生、神经胶质细胞增殖和分化 | ||||
| 血管内皮细胞生长因子(vascular endothelial growth factor,VEGF) | 血小板衍生的生长因子家族 | 同源双体 121aa 165aa 188aa 206aa (34~42kDa) | 大多数肿瘤细胞、伤口中角化细胞和巨噬细胞 | Flt KDR | (1)体内重要的和因管生成因子之一,促进内皮细胞的有丝分裂和对蛋白质及其它分子通透性的升高,刺激单核细胞移行穿过内皮细胞层(2)在实体瘤和伤口愈合中发挥促有丝分裂和提高通透性 |
| 多效素(pleiotrophin,PTN) | (与其它细胞因子无相似性) | 136aa (18kDa) | 成骨细胞、软骨细胞、成纤维细胞、星形胶质细胞、少突胶质细胞、雪旺氏细胞、神经元、垂体后叶细胞、睪丸间质细胞、基质层角化细胞、肿瘤细胞 | PTNR | (1)刺激轴突的生出和神经元的分化(2)与肿瘤的发生有关 |
八、细胞因子的临床应用
目前,细胞因子已广泛应用于临床多种疾病的治疗,其中以干扰素、各种集落刺激因子最为常用。部分细胞因子已获美国 FDA 批准投放市场,有的细胞因子已进行不同阶段的临床试验或正在申请获准准投放市场。有关细胞因子临床应用的情况参见表 4 -14 和表 4 -15。
表 4 -14 美国 FDA 批准投放市场的重组细胞因子
| 细胞因子 | 商品名 | 公 司 名 | 适 应 症 | FDA 批准日期 |
| IFN-α2a | Roferon-A | Hoffmann-La Roche | 毛细胞性白血病 | 1986.6 |
| 艾滋病相关的 Kaposi 氏肉瘤 | 1988.11 | |||
| INF-α2b | IntronA | Schering-Plough | 毛细胞性白血病 | 1986.6 |
| 生殖器疣 | 1988.6 | |||
| 艾滋病相关的 Kaposi 氏肉瘤 | 1988.11 | |||
| 非甲非乙肝炎(丙型肝炎) | 1991.2 | |||
| IFNαn3 | Alferon A | Interferon Sciences | 生殖器疣 | 1989.10 |
| IFN-γ1b | Actimmune | Genentech | 慢性肉芽肿 | 1989.10 |
| α-EPO | Eopgen | Amgen | 慢性肾功衰竭合并贫血, | 1989.6 |
| AZT | ||||
| 治疗 HIV 感染的贫血 | ||||
| PROCRIT | Ortho Biotech | 同上 | 1990.12 | |
| G-CSF | Neupogen | Amgen | 化疗后中性粒细胞减少症 | 1991.2 |
| filgrastim | ||||
| GM-CSF | Prokine | Hoechst-Roussel | 自身骨髓移植 | 1991.3 |
| Sargramostim | ||||
| Leukine | Immunex | 自身骨髓移植 | 1991.3 | |
| Sargramostim |
表 4 -15 美国尚未投入市场的重组细胞因子开发状况(1991 年)
| 细胞因子 | 商品名 | 公司名 | 适应症 | 开发现状 |
| IL-1α | Immunex | 预防化疗和放疗所致的骨髓 | Ⅰ/Ⅱ期临床 | |
| 抑制,肿瘤 | ||||
| IL-1β | Immunex | 预防化疗和放疗所致的骨髓 | Ⅰ/Ⅱ期临床 | |
| Syntex | 抑制,肿瘤 | |||
| Immunex | 伤口愈合 | Ⅱ期临床 | ||
| IL-2 | Amgen | 肿瘤 | Ⅲ期临床 | |
| Hoffmann-La Roche | 与 IFN- α 联合用于肿瘤治疗 | 期临床 | ||
| Proleukine | Cetus | 肾细胞癌 | 已申请 | |
| aldesleukin | 肿瘤 | Ⅰ/Ⅲ期临床 | ||
| Cetus | 与 AZT 联合治疗 Kaposi 氏肉瘤 | Ⅰ期临床 | ||
| PEG-IL-2 | 与 AZT 联合治疗 AIDS | Ⅰ期临床 | ||
| IL-3 | Hoechst-Roussel | 骨髓功能衰竭、血小板减少 | Ⅰ/Ⅱ期临床 | |
| 自身骨髓移植、化疗佐剂 |
续表 1
| 细胞因子 | 商品名 | 公司名 | 适应症 | 开发现状 |
| Immunex | 外周干细胞移植 | Ⅰ期临床 | ||
| IL-4 | Schering-Plough | 免疫缺陷病、肿瘤、疫苗佐剂 | Ⅰ/Ⅱ期临床 | |
| Sterling Drug | 肿瘤 | Ⅱ期临床 | ||
| G-CSF | Neupogen | Amgen | 艾滋病、白血病、再生障碍性贫血 | 已申请 |
| filgrastim | 贫血 | |||
| M-CSF | Macrolin | Cetus | 肿瘤、真菌病 | Ⅰ期临床 |
| Genetics Institute | 肿瘤、白血病、骨髓移植 | Ⅰ期临床 | ||
| GM-CSF | Leukine | Immunex | 同种骨髓移植,化疗佐剂 | Ⅲ期临床 |
| Sargramostim | ||||
| 艾滋病 | Ⅱ期临床 | |||
| Prokine | Hoechst-Roussel | 再次化疗所致中性粒细胞减少 | Ⅲ期临床 | |
| sargramostin | ||||
| Amgen | 化疗佐剂 | Ⅰ/Ⅱ期临床 | ||
| Leucomax | Sazdoz | 血细胞减少 | 已申请 | |
| Schering-Plough | 血细胞减少 | 已申请 | ||
| Genetics Institute | 血细胞减少 | 正申请 | ||
| αEPO | PROCRIT | Ortho Biotech | 肿瘤或肿瘤化疗所致贫血 | Ⅲ期临床 |
| 防止手术失血所致贫血 | ||||
| Genetics Institute | 自体输血佐剂 | |||
| βEPO | Marcogen | 肾病继发贫血 | 已申请 | |
| Sterile | ||||
| Chugai-Upjohn | 自体输血,取代输血 | Ⅱ/Ⅲ期临床 | ||
| SCF | Amgen | 乳腺癌和淋巴瘤 | Ⅰ期临床 | |
| IFN-α2a | Roferon A | Hoffmann-La Roche | 与 5 - 氟尿嘧啶联合治疗直肠癌,乙型肝炎、非甲非乙肝炎、慢性髓性白血病、胃癌,与 AZT 联合治疗 HIV 阳性、ARC 和艾滋病 | Ⅱ期临床 |
| IL-α2b | Intron A | Schering-Ploough | 浅表膀胱癌、基底细胞癌、慢性乙肝炎、丁型肝炎、丙型肝炎 | 已申请 |
| ` | 丙型肝炎 | |||
| 急性乙型肝炎、慢性髓样 | Ⅲ期临床 | |||
| 白血病 | ||||
| 与 AZT 联合治疗 HIV 感染 | Ⅰ期临床 | |||
| IFN-αn3 | Alferon LDO | Interferon Sciences | ARC、爱滋病 | Ⅰ/Ⅱ期临床 |
| IFN-β | R-Prone | Serono Sciences | 肿瘤 | Ⅰ期临床 |
| Belaseron | Berlex Lab. | 多发性硬化症 | Ⅲ期临床 | |
| 肿瘤 | Ⅰ/Ⅱ期临床 | |||
| IFN-γIL | Actimmune | Genentech | 小细胞肺癌、特应性皮炎 | Ⅲ期临床 |
| 肾细胞癌、外伤感染 | Ⅱ期临床 | |||
| 哮喘和过敏 | Ⅰ期临床 | |||
| Immuneron | Biogen | 类风湿性关节炎 | Ⅰ/Ⅲ期临床 | |
| 生殖器疣 | Ⅱ期临床 | |||
| TNF | Amgen | 肿瘤、传染病 | Ⅱ期临床 | |
| Biogen | 肿瘤 | Ⅱ期临床 | ||
| Knoll pharma. | 肿瘤 | Ⅱ期临床 | ||
| ceuticals | ||||
| Genentech | 肿瘤 | Ⅱ期临床 | ||
| IL-1ra | Antril | Synergen | AML、CML、炎性肠炎、 | Ⅰ/Ⅲ期临床 |
| anakinra | 类风湿关节炎、脓毒症、 | |||
| 化脓性休克 | ||||
| FGF | Chiron Ophthalmics | 角膜与晶体手术 | Ⅲ期临床 | |
| Ethicon | 伤口愈合、皮肤溃疡 | Ⅱ期临床 | ||
| Chiron | 伤口愈合、皮肤溃疡 | Ⅱ期临床 | ||
| California | 慢性软组织溃疡 | Ⅱ期临床 | ||
| Biotechnolgy | ||||
| bFGF | Synergen | 静脉郁积、糖尿病的腿足溃疡 | ||
| 胰岛素样生长因 | Genentech | 营养支持 | Ⅱ期临床 | |
| 子 -1(IGF-1) | Ⅱ型糖尿病 | Ⅰ期临床 | ||
| Chiron | Ⅱ型糖尿病 | Ⅱ期临床 | ||
| PDGF | Amgen | CIBA-GEIGY | Ⅱ型糖尿病 | Ⅱ期临床 |
| Amgen | 慢性皮肤溃疡 | Ⅰ/Ⅱ期临床 | ||
| Chiron | 皮肤溃疡 | Ⅱ期临床 | ||
| Ethicon | 皮肤溃疡 | Ⅱ期临床 | ||
| Zymo Genetics | 糖尿病溃疡 | Ⅰ期临床 |
第三节 细胞因子受体
细胞因子是由多种细胞产生的,具有广泛调节细胞功能作用的多肽分子,细胞因子不仅作用于免疫系统和造血系统,还广泛作用于神经、内分泌系统,对细胞间相互作用、细胞的增殖分化和效应功能有重要的调节作用。细胞因子发挥广泛多样的生物学功能是通过与靶细胞膜表面的受体相结合并将信号传递到细胞内部。因此,了解细胞因子受体的结构和功能对于深入研究细胞因子的生物学功能是必不可少的。随着对细胞因子受体的深入研究,发现了细胞因子受体不同亚单位中有共享链现象,这对阐明众多细胞因子生物学活性的相似性和差异性从受体水平上提供了依据。绝大多数细胞因子受体存在着可溶性形式,掌握可溶性细胞因子受体产生的规律及其生理和病理意义,必将扩展人们对细胞因子网络作用的认识。检测细胞因子及其受体的水平已成为基础和临床免疫学研究中的一个重要的方面。
一、细胞因子受体的结构和分类
根据细胞因子受体 cDNA 序列以及受体胞膜外区氨基酸序列的同源性和结构征,可将细胞因子受体主要分为四种类型:免疫球蛋白超家族(IGSF)、造血细胞因子受体超家族、神经生长因子受体超家族和趋化因子受体。此外,还有些细胞因子受体的结构尚未完全搞清,如 IL-10R、IL-12R 等;有的细胞因子受体结构虽已搞清,但尚未归类,如 IL-2Rα 链(CD25)。
(一)免疫球蛋白超家族
该家族成员胞膜外部分均具有一个或数个免疫球蛋白(Ig)样结构域,有关 Ig 超家族的结构特点参见第三章。目前已知,属于 IGSF 成员的细胞因子受体的 IL-1Rt I(CD121a)、IL-1RtⅡ(CD121b)、IL-6Rα 链(CD126)、gp130(CDw130)、G-CSFR、M-CSFR(CD115)、SCFR(CD117)和 PDGFR,并可分为几种不同的结构类型,不同 IGSF 结构类型的受体其信号转导途径也有差别。
(1)M-CSFR、SCFR 和 PDGFR:胞膜外区均含有 5 个 Ig 样结构域,其中靠近胞膜区为 1 个 V 样结构,其余 4 个为 C2 样结构。受体通常以二聚体形式与相应的同源二聚体配体结合。受体胞浆区本身含有蛋白酷氨酸激酶(protein tyrosine kinase,PTK)结构。
(2)IL-1Rt I 和 IL-1RtⅡ:胞膜外区均含有 3 个 C2 样结构,受体胞浆区丝氨酸 / 苏氨酸磷酸化可能与受体介导的信号转导有关。
(3)IL-6Rα 链、gp130 以及 G -CSFR:胞膜外区 N 端 均含 1 个 C2 样区,在靠近胞膜侧各有 1 个红细胞生成素受体超家族结构域,此外在胞有胞膜外区还含有 2~4 个纤粘连素结构域。gp130 胞浆区酷氨酸磷酸化与信号转导有关。这种结构类型的受体其相应配体 IL-6、OSM、LIF 和 G -CSF 在氨基酸序列和分子结构上也有很大的相似性。
(二)造血细胞因子受体超家族
造血细胞因子受体超家族(haemopoieticcytokine receptor superfamily)又称细胞因子受体家族(cytokinereceptor family),可分为红细胞生成素受人本超家族(erythropoietinreceptor superfamily,ERS)和干扰素受体家族(interferon receptorfamily。
1.ERSERS 所有成员胞膜外区与红细胞生成素(erythropoietin,EPO)受体胞膜外区体在氨基酸序列上有较高的同源性,分子结构上也有较大的相似性,故得名。
(1)ERS 的成员:属于 ERS 的成员有 EPOR、血小板生成素 R、IL-2β 链(CD122)、IL-2Rγ 链、IL-3Rα 链(CD123)、IL-3Rβ、IIL-4R(CDw124)、IL-5Rα 链、IL-5βα 链、IL-5Rβ 链、IL-6Rα 链(CD126)、gp130(CDw123)、IL-7R、IL-9R、IL-11R、IL-1240kDa 亚单位、G-CSFR、GM-CSFRα 链、GM=CSFRβ 链、LIFR、CNTFR 等,此外,某些激素如生长激素受体(GRGR)和促乳素受体(PRLR)亦属于 ERS。
(2)ERS 的结构特征:红细胞生成素受体超家族成员在胞膜外与配体结合部位有一个约含 210 氨基酸残基的牲性同源区域,主要特点①同源区靠近 N 端有 4 个高并能保守的半胱氨酸残基 Cysl、Cys2、Cys3、Cys4 和 1 个保守的钯氨酸,Cys1 与 Cys2 之间、Cys3 与 Cys4 之间形成两个二硫键。②同源区靠近细胞膜处,约在细胞膜外 18~22 氨基酸基处有一个色氨酸一丝氨酸 -X- 色氨酸 - 丝氨酸基序,所谓 Trp-Ser-Xaa-Trp-Ser 即 WSXWS 基序,其生物学功能尚不明了。IL-3α 链、IL-3Rβ 链、GM-CSFRβ 链、LIFR 办有两个 ERS 结构域,其中 GM-CSFRβ 链第一个 ERS 结构中有一个类似 WSXWS 基序,即为脯氨酸一丝氨酸 - 赖氨酸 - 色氨酸 - 丝氨酸(PSKWS)基序。1994 年 Hilton 等合成 WSXWS 基序相应的寡核苷酸为探针,从成鼠肝 cDNA 文库中克隆小鼠 IL-11 受体 α 链 cDNA 获得成功。IL-6Rα 链和 gp130 以及 G -CSFrN 端有一个 IGSF 结构。IL-7R 靠近 N 端侧的部位只有 Cys1 和 Cys3,与其它成员相比,缺乏 Cys2 和 Cys4 以及色氨酸残基。IL-1240kDa 亚单位有 ERS 的同源结构,但为非膜结合的,而且与 IL-12 另一 35kDa 亚单位通过二硫键开成异源双体。GM-CSFr N 端在 ERS 中可以看作由 2 个Ⅲ型纤维粘连素组成,每个Ⅲ型纤维粘连素结构域由 7 股反平行 β 折叠股形成一个桶状结构,两个桶状结构之间的槽是配体膜外保守区域有明显的进化同源性,这种同源性的程度与 IGSF 成员间相似。EPo R 似科与其它家族成员有更高的同源性,在进化上可能处于主导的地位。ERS 的胞浆区长度不一,从 54 个氨基酸残基到 568 个氨基酸残基,除 IL-2Rβ 链与 EPOR 之间胞浆区有一定同源性外,其它成员在胞浆区未见明显的同源性。ERS 成员胞浆区本身均不具备 PTK 结构,其信号传递的途径和机理也有所不同。IL-2Rβ 链胞浆区的本双重性区与胞浆中酪氨酸激酶相关联,富含丝氨酸区与非激酶信赖途径有关。IL-2Rγ 链胞浆区具有 SH2 结构,参与信号传递。细胞浆中的 PTK 和 PKC 可能参与 IL-4R 介导的信号传递。gp130 胞浆区丝氨酸富含区以及酷氨酸磷酸化与 gp130 介导的信号转导有关。此外,酪氨酸磷酸化与 IL-7R、GM-CSFRβ 链、IL-3Rβ 链、IL-5Rβ 链介导的信号转导有关。
注:根据 ERS 胞膜外结构特点,可分为以下四种类型:
(a)1 个 ERS 结构域的穿膜受体,包括 IL-2Rβ、IL-2Rγ、IL-4R、IL-5R、IL-7R、IL-9R、GM-CSFR、EPOR;
(b)2 个 ERS 结构域的穿膜受体,包括 LIFR、KH97、AIC2A、AIC2B;
(c)N 端有 1 个 IGSF 结构域和 1 个 ERS 结构域的穿膜受体,包括 IL-6R、IL-11R(?)、G-CSFR 和 gp130;
(d)N 端 1 个 IGSF 结构域和 1 个 ERS 结构域 GPI 连接的受体,如 CNTFR。
2. 干扰素受体家族属于这一家族的成员有 IFN-α/βR、IFN-γR 和组织因子(TF)(为凝固白酶因子Ⅶ的细胞膜受体),其结构与红细胞生成素受体家族相似,但 N 端只含有两个保守性的 Cys,两个 Cys 之间有 7 个氨基酸。近膜处也有两个保守的 Cys,两个 Cys 之间间隔有 20~22 个氨基酸。IFN-α/βR 由两个上述的结构域所组成。
(三)神经生长因子受体超家族
1.NGFR 超家族的成员属于该家族成员除神经生长因子受体(nerve growth factor receptor,NGFR)外,不有 TNF-RⅠ(CD120a)、TNF-RⅡ(CD120b)、CD40、CD27、T 细胞 cDNA-41BB 编码产物、大鼠 T 细胞抗原 OX40 和人髓样细胞表面活化抗原 Fas(CD95)。各成员的主要功能参见表 4 -16。
表 4 -16NGFR 超家族成员的功能
| 成 员 | 结构域数目 | 主 要 功 能 |
| NGFR | 4 | 介导神经细胞生长 |
| TNF-RⅠ(CD120a) | 4 | 介导溶解靶细胞活性 |
| TNF-RⅡ(CD120b) | 4 | 信号传递和 T 细胞增殖 |
| CD27 | 4 | CD70 的配体 |
| CD40 | 4 | B 细胞生长和记忆细胞产生 |
| 4-1BB | 4 | 表达在小鼠活化 T 细胞表面 |
| OX-40 | 4 | 大鼠 T 细胞标记 |
| Fas(CD95) | 3 | 参与程序性细胞死亡 |
| CD30 | 6 | Hodgkin 氏肿瘤特征性抗原,与淋巴细胞存活、增殖有关 |
2.NGFR 超家族的结构特点 NGFR 超家族成员其胞膜外由 3~6 个约 40 个氨基酸组成的富含 Cys 区域,如 NGFR、TNF-RⅠ、TNF-RⅡ有 4 个结构域,CD95 有 3 个结构域,CD30 有 6 个结构域。所有成员 N 端第一个区域中均含 6 个保守的 Cys 以及 Tyr、Gly、Thr 残基各一个,其它区域亦含 4~6 个 Cys。TNF-RⅠ、CD95、CD40 分子之间胞浆区约有 40~50% 同源性。
(四)趋化因子受体
1988 年 IL- 8 基因克隆成功以来,已形成了称之为趋化因子(chemokine)的一个家族。到目前为止,趋化因子家族的成员至少有 19 个。部分趋化因子的受体已基本搞清,它们都性属于 G 蛋白偶联受体(GTP-binding protein coupled receptor), 由于此类受体有 7 个穿膜区,又称 7 个穿膜区受体超家族(sevenpredicated transmembrane domain receptor superfamily,STR superfamily)。G 蛋白偶联受体(或 STR)包括的范围很广,除了趋化因子受体外,如某些氨基酸、乙酰胆硷、单胺受体,经典的趋化剂(C5a、fMLP、PAF)受体等都属于 G 蛋白偶联受体 /STR。
![]()
图 7 -6
注:TNF-RⅠ和 TNF-RⅡ胞膜外均有 4 个结构域,N 端第一个区域均有 6 个 Cys,TMF-RⅠ其它 3 个区域均含 6 个 Cys,TNF-RⅡ第二个区域含 6 个 Cys,第 3、4 区域各含 4 个 Cys。
1. 趋化因子受体的种类和结构
(1)趋化因子受体的种类:已发现的趋化因子受体种类有 IL-8RA、IL-8RB、MIP-1α/RANTEsR、NCP-1R 和细胞趋化因子受体(red bloodcell chemokine receptor,RBCCKR)。有人将能与 IL- 8 结合的 IL-8RA、IL-8RB 和 RBCCKR(Duffy 抗原)归为 IL- 8 受体家族。趋化因子受体的种类和分布见表 4 -17。
表 4 -17 趋化因子受体的种类和分布
| 趋化因子受体种类 | 受体基因 (a)、(c) 染色体定位 | 受体长度(氨基酸) | 受体分布(b) | 相应配体 |
| IL-8RA | 2q34-q35 | 350 | 中性粒细胞、内皮细胞、单核细胞、T 细胞、黑素瘤细胞、嗜酸性粒细胞、嗜碱性粒细胞 | IL-8 |
| IL-8RB | 2q34-q35 | 355 | 中性粒细胞、髓样细胞前体、成纤维细胞、嗜碱性粒细胞 | IL-8 |
| GROα | ||||
| GROβ | ||||
| GROγ | ||||
| NAP-2 | ||||
| MCP-1R | 3q21 | 355 | 单核细胞、T 细胞、髓样细胞前体细胞、B 细胞、嗜碱性粒细胞、嗜碱性粒细胞单核细胞、髓样细胞前体、嗜碱性粒细胞 | MIP-1α |
| RANTES | ||||
| MCP-1 | ||||
| RBCCKR | 1q21-q25 | 339 | 红细胞、肾脏 大脑 | IL-8 |
| GROα | ||||
| NAP-2 | ||||
| MCP-1 | ||||
| RANTES |
注:(a)趋化因子受体有功能基因目前已克隆成功 4 种。MCP-1R cDNA 最近已分离成功,但尚未见有基因染色体定位的报道。
(b)受体分布主要根据功能试验和 / 或配体结合试验。
(c)α 亚族中 γIP-10、NAP-4、PE- 4 和 ENA-78 以及 β 亚族中 CPP-2、MCP-3、MIP-1β 和 I -309 相应受体尚未鉴定出。
(2)趋化因子受体的结构:所有趋化因子受体都属于 G 蛋白偶联受体 /STR,N 端在胞膜外,C 端位于胞浆内。7 个穿膜区(transmembranedomain,TMD)为 α 螺旋,在 TMDⅡ、Ⅳ、Ⅴ、Ⅵ和Ⅶ由 α 螺旋内保守的肺腑氨酸所扭结(kinked), 胞膜外和胞浆内各有由亲水氨基酸所组成的三个一不,分别简称为 e1~e3(e:extracellular connecting loops)和 il~i3(i:intracellular connecting loops)。e1 和 e2 之间由两个保守的 Cys 形成一个二硫键,有些受体在胞外 N 端和 e3 之间也形成二硫键,如 IL-8Ra30Cys 与 277ys 形成二硫键。在 STR 超家族中,趋化因子受体以及经典的趋化剂受体具有以下特点:(1)其长度在 STR 超家族中最短,约为 350 氨基酸,其主要原因是 N 端、C 端较短,i3 环只含 16~22 个氨基酸;(2)在氨基酸水平上同源性大于 20%;(3)i3 富含碱性氨基酸,带正电;(4)N 端仿酸,带负是电;(5)胞浆区含有多个丝氨酸和苏氨酸,可能是磷酸化位点;(6)mRNAs 多表达于白细胞。
图 4 -7 趋化因子受体结构模式图
2.IL- 8 受体家族 IL-8R 家族是趋化因子受体中能与 IL- 8 结合的不同受体的总称,包括 IL-8RA、IL-8RB 和 RBCCKR。
(1)IL-8RA:IL-8RA cDNA1991 年基因克隆成功,是 Holmes 等从中性粒细胞 cDNA 表达文库中分离得到,人 IL-8RA 基因定位于染色体 2q35,与 IL-8RB 基因密切连锁和高度同源,可能是从同一祖先基因经复制而来。从 cDNA 推算出 IL-8RA 由 350 氨基酸组成,有 5 个 N 连接的糖基化位点。裸肽分子量为 40kDa,糖基化后 55~69kDa,在氨基酸水平上与 IL-8RB 的同源性为 77%。IL-8RA 只与配体 IL-8(碱性,PI8.0~8.5)结合,这与 IL-8RA 的结构有关,IL-8Ra N 端酸性氨基酸是与 IL- 8 结合的位置,N 端 Asp11 和 e3 中 Gly275 和 Arg280 对于与配体结合至关重要,由于 Cys30 与 Cys277 之间形成二硫键,Asp11、Glu275 和 Arg 280 在空间置上十 分接近,共同参与同配体的结合。IL-8RA 基因表达的细胞种类较为广泛,如中性粒细胞、单核细胞、PGA 活化的 T 细胞、单核细胞样细胞系、黑素瘤细胞、滑液成纤维细胞、HL60 细胞和前髓样细胞系 THP- 1 等。
(2)IL-8RB:IL-8RB cDNA 是首先从 HL60 细胞中克隆成功,推断的氨基酸残基数为 335,有一个潜在的 N 连接糖基化位点。IL-8RB 可与 CXC 亚族中 IL-8、GROα、GROβ、GROγ 和 NAP- 2 结合。人 IL-8RB 主要表达于髓样细胞,如中性粒细胞、HL60、THP- 1 和 AML193 细胞。
(3)RBCCKR:这种受体结合配体的特异性较宽,又称 multi-specificreceptor, 可结合 CXC 亚族中的 IL-8、NAP-2、GROα 和 CC 亚族中的 MCP- 1 和 RANTES。人 RBCCKRcDNA1993 年克隆成功,基因定位于 1q21-q25,成熟受体分子由 338 个氨基酸组成,分子量为 39kDa,与 IL-8RB 和 MIP-1α/RANTESR 分别有 27% 和 23% 同源性。胞膜外区为 66 个氨基酸,含有 2 个潜在的 N 连接糖基化点,酸性。C 端胞浆区长 24 个氨基酸残基,RBC-CKR 似乎不 G 蛋白调节,可能是一种 G 蛋白的非偶联受体。最近研究表明,RBCCKR 是人红细胞 Duffy 抗原(gpD),也是微小间日疟原虫(Plasmodium vivax)受体。Duffy 血型阴性个体尽管存在着该血型的原因,但不表达 Duffy 抗原 /RBCCKR。RBCCKR 作为一种清除受体(clearance receptor)清除血液中趋化因子。这种受体与配体结合的亲和力 Kd 为 5nM,正常血清中 IL- 8 水平在 pM 水平。在成人呼吸窘迫综合征(ARDS)、脓毒症时,血清 IL- 8 水平可升高至 8nM,过高水平的 IL- 8 结合到 RBCCKR 而得以清除。IL- 8 等趋化因子结合到红细胞上后即失去了对靶细胞作用。红细胞的这种清除作用的意义还在于维持一个合适的趋化因子浓度,保证中性粒细胞等敏感地从血液中向趋化因子浓度高的炎症部位动。RBCCKR 除表达在红细胞上外,还表达在肾脏、大脑,基因表在这还见于脾、肺和胸腺等。
表 4 -18 IL-8R 家族三个成员的特性比较
| IL-8RA | IL-IRB | RBCCKR | |
| 分子量(kDa) | 60 | 60 | 39 |
| 糖基化 | 有 | 有 | 有 |
| G 蛋白连接 | 有 | 有 | 可能无 |
| 信号转导中 Ca2+ | 有 | 有 | |
| 受体特异性 | IL- 8 特异性 | CXC 亚族中几种配体共同 | 更宽,结合 CXC 和 CC 亚族中多种配体(微小间日疟受体) |
| 配体结合亲和力 | IL-8(lnM) | IL-8(lnM) | IL-8、NAP-2、RANTES、MCP-1(5nM) |
| NAP-2(450nM) | NAP-2(1~2nM) |
3. 受体的信号转导 IL-8RA 和 IL-8RB 中紧接第三个穿膜区(TMDⅢ)的第二个胞内环(i2)有一段高度保守的 DRYLAIVHA 序列,与受体信号的转导密切相关,其中 DRY 对于受体有效地偶联 G 蛋白是必要的,如用突变方法改变此序列,虽然不影响受体与配体的结合,但几乎完全丧失了配体刺激的生物学活性。IL-8R 与配体结合后使与受体结合的异源三体 G 蛋白分解为 α 亚单位和 βγ 亚单位,α 亚单位活化磷脂酶 C(phospholipase C,PLC),导致胞浆内三磷酸肌醇(IP3)和二酰基甘油(DAG)增加,分别诱导胞浆内 Ca 库释放 Ca2+和 PKC 的活化。
此外,IL-8RA 和 IL-8RB C 端丝氨酸和苏氨酸残基的磷酸化可能与信号的转导有关。
4. 趋化因子受体与病毒最近发现某些感染人或灵长类病毒的开放读框产物与某些趋化因子受体有较高的同源性,这可能与病毒的致病以及病毒所具有的某些生物学特性有关。
(1)人巨细胞病毒(human cytomegalovirus,HCMV): 是一种可感染人上皮细胞、髓样和淋巴样细胞的 β 疱疹病毒(βHerpesvirus)。HCMV3 个开放读框 US27、US28 和 UL33 所推断的氨基酸序列在分子结构上均可模拟 STR,其中 US28 产物与人 MIP-1α/RANTEsR 约有 30% 同源性,与该受体 N 端的同源性高达 56%。US28 产物可与趋化因子 β 亚族中 MIP-1α、MIP-1β、MCP- 1 和 RANTES 相结合,但不能结合 α 亚族中的趋化因子。
(2)Saimiri 疱疹病毒(Herpesvirus saimiri,HVS): 是一种感染灵长类动物嗜 T 细胞的 γ 疱疹病毒(γHerpesvirus)。HVS 开放读框 ECRF3 产物与 IL-8R 有近 30% 的同源性,与 IL-8Rb N 端的同源性为 44%。ECRF3 产物与 IL-8、GROα 和 NAP- 2 均可发生一定程度的结合。
HCMV-US28 和 HVS-ECRF3 探针不能与人基因组 DNA 杂交,提示疱疹病毒不仅从宿主体内获得了趋化因子受体基因拷贝,而且进行了修饰。类似的现象见于嗜人 B 淋巴细胞的 γ 疱疹病毒 -EB 病毒(EBV),EBV 开放读框 BCRF1 是从宿主体内获得的 IL-10 基因,BCRF1 产物又称为病毒 IL-10(vIL-10), 可模拟哺乳动物 IL-10 的抗炎症和抗增殖效应。
二、细胞因子受体中的共享链
大多数细胞因子受体是由两个或两个以上的亚单位组成的异源二聚体或多聚体,通常包括一个特异性配体结合 α 链和一个参与信号的 β 链。α 链构成低亲和力受体,β 链一般单独不能与细胞因子结合,但参与高亲和力受体的形成和信号转导。应用配体竟争结合试验、功能相似性分析以及分子克隆技术发现在细胞因子受体中存在着不同细胞因子受体共享同一种链的现象。
(一)细胞因子受体共享链的种类
在众多的细胞因子中,某些细胞因子的作用十分相似,如 IL-3、IL-5、GM-CSF 都作用于造血系统,促进造血干细胞或定向干细胞的增殖。IL-6、IL-11、LIF、OSM 都能作用于肝细胞、巨核细胞、浆细胞瘤,发挥相似的生物学作用。IL-2、IL-4、IL-7、IL- 9 和 IL-13 均具有刺激 T 细胞或和 B 细胞增殖的作用。上述细胞因子功能的相似性已部分在受体水平得到解释,在很大程度上是由细胞因子受体共享链所决定的。目前已知,细胞因子共享链主要有 gp310、GM-CSFRβ 链和 IL-2Rγ 链。
1.gp130/LIFR 为 IL-6R、单抗 MT18 在骨髓瘤细胞系 U266 共沉淀中得到一种 130kDa 的糖蛋白,命名为 gp130。1990 年 Hibi 克隆成功,gp130,属于造血因子受体家族。IL-6、IL-11 均能刺激 IL- 6 信赖的小鼠浆细胞瘤系 T1165 的增殖,能在 IL-3、GM-CSF 的作用下缩短骨髓多能干细胞的 Go 期,增强 IL- 3 依赖的人和小鼠的巨核细胞集落的形成,促进体内、体外的特异性抗体反应,诱导肝细胞急性期蛋白的产生。抗 gp130 能阴断 IL-6、IL-11 两种细胞因子分别诱导的 TF1 细胞的增殖,而抗 IL-5R 只能阴断 IL- 6 诱导的 TF1 的增殖,表明 IL-6、IL-11 受体共用一个信号转导链。OSM 受体存在着低亲和力及高亲和力两种受体,低亲和力受体即 gp130,gp130 与 LIFR 构成高亲和力受体。与在 IL-6R、IL-11R 中不同,gp130 在 OSMR 中只形成低亲和力受体且不能单独转导细胞因子信号。高亲和力的 LIF 受体由 LIFR 和 gp130 组成,OSM 与 LIF 能竞争结合高亲和力 LIF 受体,但不竞争结合低亲和力的 LIF 受体。
表 4 -19 gp130/LIFR 共用链与高亲和力受体组成的关系
| 配体 | 低亲和力、特异性结合配体受体 | 高亲和力受体 | |||
| 多肽链 | 结构特征 | 亲和力(kd≈) | 组成 | 亲和力(kd≈) | |
| IL-6 | IL-6Rα 链 | 1 个 ICSF 结构域 1 个 HCSF 结构域 | 1~2nM | IL6-Rα/gp130、gp130(二聚化) | 40~50pM |
| IL-11 | IL-11Rα 链 | 1 个 ICSF 结构域 2 个 HCRF 结构域 | 10nM | IL011Rα/gp130 | 40~800pM |
| LIF | LIFR | 2 个 HCRF 结构域 | LIFR/gp130 | 20~30pM | |
| OSM | gp130 | 1 个 HCSF 结构域 | 500pM | gp130/LIFR | 5pM |
| CNTF | CNTFRα 链 | 1 个 ICSF 结构域 | 10nM | CNTFRα/gp130、LIFR | 100~200pM |
| 1 个 HCSF 结构域(GPI 锚) | |||||
注:(1)LIF:leukaemia inhibitoryfactor;OSM:oncostatin M;CNTF:ciliary neurotrophic factor.
(2)IGSF:immunoglobulinsuperfamily;GCRF:hematopoietic cytokine receptor family.
(3)gp130 转导 IL-6、IL-11 刺激信号,gp130 与 LIFR 两种链转导 LIF、OSM 和 CNTF 刺激信号。
(4)IL-11Rα 链(小鼠)与 IL-6Rα 链和 CNTFRα 链氨基酸同源性分别为 24% 和 22%。
2.KH97/AIC2B 为 IL-3R、IL-5R、GM-CSFR 所共用。在造血方面,IL- 3 与 GM-CSF 均能促进未成熟细胞、混合细胞及粒细胞 - 巨噬细胞集落的形成,激活单核细胞,促进嗜酸性粒细胞集落形成。IL- 5 除了促进 B 细胞分化和分泌抗体外,也具有刺激嗜酸性粒细胞分化作用。用 GM-CSFRβ 链分别与 IL-3、IL-5、GM-CSFRα 链共转染的试验证明,这三种细胞因子高亲和力受体中的 β 链在小鼠和人分别为 AIC2B 和 KH97,它们有 56% 的同源性。
3.IL- 2 受体 γ 链 除 IL-2R 含有 γ 链外,IL-4R、IL-7R、IL-9R 和 IL-13R 复合物中也共用 IL-2Rγ 链(γc)。这些受体的相应配体是一组主要作用于 T 细胞的生长因子。以 IL-2γ 链异常为主要特征的 X 联锁严重免疫缺陷综合症患者显示出 T 细胞发育异常,T 细胞的缺乏或数量明显减少,提示 IL-2γ 链在 T 细胞的发育中起至关重要的作用。IL-4、IL- 7 均在 T 细胞的发育中起作用,它们共用一条信号转导链 IL-2Rγ 链来传递 T 细胞增殖的信号。在 IL- 2 受体系统中,α 链构成低亲和力受体,中亲和力受体由 β、γ 链组成,高亲和力受体由 α、β、γ 三条链组成,其中,γ 链相当于其它细胞因子受体的 β 链,参参与信号传递,而 αβ 链则相当于 α 链,主要发挥识别和结合配体的作用。
(二)共享链与细胞因子受体信号转导
细胞因子信号转导首先需要配体与受体结合并诱导受体二聚体(或三聚体)的形成,使二聚体(或三聚体)胞浆部分的相互作用,由此引起不同途径的信号转导。在 IL-2R 系统中,受 β、γ 链的二聚作用对于信号的转导是必须的,缺乏 β 链胞浆区的 IL-2R 不能转导 IL- 2 刺激所发生的信号。大多数的细胞因子对细胞的刺激及信号转导与酪氨酸激酶的活化及细胞内蛋白的酪氨酸磷酸化有关,细胞因子与受体结合可以引起受体成分的酪氨酸磷酸化。ERS 胞浆区近膜端的 60 个氨基酸残基是高度保守的,这段同源序列对 IL-6、G-CSF、EPO、IL- 7 的信号转导起着关键作用,提示这些受体可能利用相似的胞膜内信号转导机制。
1.gp130 介导信号转导 在 IL-6R、IL-11R、OSMR、LIFR、CNTFR 的信号转导共用链 gp130 中,其胞浆区约 277 个氨基酸残基中包含丝氨酸富含区、核苷酸结合区及 4 个 GTP 结合模式区。其中的丝氨酸富含区也存在于 G -CSFR、IL-2Rβ、IL-4R 和 EPOR,其它的 ERS 成员有着明显的同源性。其中一个片段在所有 ERS 成员中都是保守的,另一个片段存在于 G -CSFR、EPOR、KH97 中。这两个短的片段中,无论哪个发生突变都将使 gp130 不能发生酪氨酸磷酸化,丧失信号转导的能。LIFR/gp130 异源双体也与酪氨酸磷 gp130 不能发生要酪氨酸磷酸化,丧失信号转导的功能。LIFR/gp130 异源双体也与酪氨酸磷酸化有关。虽然大多数造血因子受体家族成员均不具有酪氨酸激酶结构域,但它们与酪氨酸激酶型生长因子受体相似,生长因子引起与之相关的受体酪氨酸激酶二聚体的形成和激活,而造血因子可能是诱导其受体的二聚体形成并导致相关酪氨酸激酶的活化。已发现在 IL-6、IL-11 刺激的 TF1 细胞中检测出分子量 97/95kDa 的蛋白发生了酪氨酸磷酸化,抗 gp130 的信号转导中很重要。在不同的细胞系 3T3-L1、B 细胞杂交瘤、髓样白血病系中发现有不同分子量蛋白的要酪氨酸磷酸化,提示在不同的细胞系中存在细胞特异的酪氨酸激酶及各自特异的底物,这可能是共用 gp130 的 IL-6、IL-11、LIF、CNTF、OSM 在不同细胞中生物学作用差异的原因一。JAK2 是一种非受体型的酪氨酸激酶,可以被 EPO、IL-3、G-CSF、IL- 6 等多种细胞因子刺激所激活,JAK2 可能是这些不同的细胞因子受体信号转导途径中的一个共同因素,这种与受体相联的 JAK2 激酶可能因受体结构的不同而催化不同的底物,从而导致了 JAK2 介导了许多不同的生和的学功能。此外,gp130 在 IL-6、IL-11、CNTF、LIF 的刺激后也发生了自身的酪氨酸磷酸抡。
2.KH97/AIC2B 介导信号传导在 IL-3、IL-5、GM-CSF 的信号转导链 KH97/AIC2B 的胞浆区内也存在着两个产生不同信号所必需的区域:一个是 Glu517 上游近膜端的约 60 个氨基酸的区域,它是诱导 c -myc 和 pim- 1 所必需的;另一个区域是 Leu623 至 Ser763 约 140 个氨基酸的胞浆区域,是 Ras、Raf、MAP(丝裂原激活的蛋白激酶)的激活以 c -fos、c-jun 的诱导所必需的。hGM-CSFRα、β 链无任何已知酶的催化区,共转染 hGM-CSFα、β 链的 Ba/F3 细胞的地冽同 C -Myc、pim- 1 水平的延长增加相关联的。在小鼠淋巴细胞系转染 GM-CSFα、β 链后可以引韦胞内数种蛋白的酪氨酸磷酸化并引起增殖反应,α、β 链共转染小鼠 NIH3T3 细胞表达 GM-CSFR 高亲和力受体,可引起表达的 β 链胞浆区和另外一个有包浆内 40~45kDa 蛋白的酪氨酸快速磷酸化。
三、可溶性细胞因子受体
在自然关态下,细胞因子受体(cytokinereceptor,CK-R)主要以膜结合细胞因子受体(membrane-bound cytokinereceptor,mCK-R)和存在于血清等体液中可溶性细胞因子受体(soluble cytokinereceptor,sCK-R)两种形式存在。细胞因子复杂的生物学活性主要是通过基与相应的 mCK- R 结合后所介导的,而 sCK- R 却具有独特的生物学意义。近年来,sCK- R 水平变化与某些疾病的关系日益受到学者们的重视。部分重组 sCK-R(rsCK-R)基因工程产品已进入临床验证,关于 sCK- R 的产生机理,结构特点及基免疫学功能等方面的基础研究也取得了长足的进展。
(一)sCK- R 的产生机理及作用特点
人 T 细胞白血病病毒 I 型(HTLV-I)感染的 HUT102B2、MT- 2 等细胞,髓样白血病细胞(HL-60,KG1)及某些人 B 细胞系(Raji)除了表达多种 mCK- R 外还可以通过不同方式产生 sCK-R,如 HUT102B2 细胞培养丰清中也可检出高水平 sCK-2R 和 sIL-6R。人 PMC 体外经 PHA 刺激培养后也产生大量 sCK-2R 和 sCK-6R。
1.sCK- R 的产生大多 sCK- R 主要来自膜受体的脱落,因此将膜受体阳笥细胞溶解是获得大量 sCK- R 的一种方法。大多数 sCK- R 氨基酸序列与 mCK- R 胞膜外区同源,只缺少跨膜区及胞浆区,但仍可与相应配体发生特异性结合所应。除了膜受体的裂解、脱落产生 sCK- R 形式外,另一种产生 sCK- R 的机理是通过受体 mRNA 不同剪接,产生分泌型 mRNA,通过翻译后直接分泌到细胞外,已经证实,细胞内可含有同一种 CK- R 不同形式的 cDNA。sIL-4R、sIL-5Rα 链、sIL-6Rα 链、sIL-7R 以及 sG-CSFR 等可以这种形式产生(表 4 -20)。
表 4 -20 sCK- R 的产生机理(举例)
| sCK- R 种 类 | 分子量(kDa)(可溶型 / 膜结合型) | 受体胞膜外结构 | sCK- R 产生机理 |
| sCK-1R | 47/68(Ⅱ型受体) | IGSF | 膜受体经蛋白酶水解后脱落 |
| sCK-2R | 45/55(α 链) | (未分类) | 膜受体脱落 |
| sCK-4R | /140 | ERS | 分泌型 mRNA 翻译、分泌 |
| sCK-5R | /60(α 链) | ERS | 膜受体脱落和分泌型 mRNA 翻译、分泌 |
| sCK-6R | 50/80(α 链) | IGSF+ERS | 膜受体脱落和分泌型 mRNA 翻译、分泌 |
| sCK-7R | /65 | ERS | 分泌型 mRNA 翻译、分泌 |
| sG-CSFR | / | IGSF+ERS | 分泌型 mRNA 翻译、分泌 |
| sGM-CSFR | /85 | ERS | 膜受体脱落 |
| sIFN-γR | /90 | 干扰素受体家族 | 膜受体脱落 |
| sTNF-R | 33/55 或 75 | NGFR | 膜受体脱落 |
注:IGSF:免疫球蛋白超家族 ERS;红细胞生成素受体超家族 NGFR:神经生长因子受体家族
2.sCK- R 的生物学作用多数 sCK- R 与相应细胞因子结合的亲和力较与 mCK- R 为低,可能与 sCK- R 为单链结构或缺少某些结构区域有关。也有的 sCK- R 如 sIL-4R 同天然 mIL-4R 与相应配体结合的亲和力是相同的,即使低剂量 sIL-4R 也可特异地抑制 IL- 4 诱导的细胞增殖反应。sCK- R 以其多种方式发挥其独特的免疫学功能。
(1)做为细胞因子转运蛋白,将细胞因子运至机体有关产啊位,造成局部细胞因子高浓度区以充分发挥细胞因子的生物学效应。
(2)是膜受体正常代谢途径,有利于处于活化状态细胞恢复至正常水平。
(3)竟争性地结合 mCK- R 相应配体,抑制 mCK- R 所介导的生物学作用。
(二)sCK- R 与临床
1. 检测 sCK- R 水平在临床中的应用检测某些 sCK- R 水平辅助临床对某些疾病的早期诊断,了解病程的发展与转归,并可对患者免疫功能状态及预后进行评估,对临床治疗也有一定指导意义。
(1)sIL-2R 的检测:近年来国内外学者对 sIL-2R 进行了大量研究,发现其在血清及其他体不认中水平的变化与临床多种疾病如器官移植排异反应、病毒性感染、恶性肿瘤、创伤及自身免疫性疾病等的病情、病程密切相关(表 4 -21)。
(2)其他 sCK- R 的检测:最近在尿中发现一种 50kDa sIL-6R 分子称为 IL-6R-SUP,可以促进小剂量 IL- 6 诱导的小鼠浆细胞瘤 T1165 的生长。多发性骨髓瘤病人血浆中 sIL-6R 水平明显升高。风湿性疾病患者血清 sTNFR 水平异常增设,关工了腔滑液中亦可检出高水平 sTNF-R,且活动期水平明显高于非活动期。政党妇女尿中仅可检测到 TNF-RⅡ类型的 sTNFR, 而妊娠妇女尿中 TNF-r I 和 TNF-RⅡ两种类型 sTNFR 均可被检出,随胎龄增加 sTNFR 水平逐渐升高,分娩后随之降低,这可能是使胎儿免受 TNF 作用的一种防护机制。肝脏感染性腹水及癌性腹水中亦可检出高水平 sTNFR。此外还发现,sTNFR 水平的增设与患者肾功能的减退密切相关。
2.sCK- R 在临床应用前景大多数 sCK- R 与细胞因子结合后阴断细胞因子与膜受体结合,从而抑制细胞因子的生物学活性,应用 sCK- R 减轻或防止炎症性细胞因子造成的病理损害提供了新的治疗途径。动物实验结果表明,局部注射 sIL-1R 可抑制 IL- 1 介导的炎症反应。sIL-1R 可降低小鼠同种异体心脏移植的排异反应以及大鼠实验性关节炎和过敏性大脑炎。在体外 sIL-1R 可明显抑制急性髓样白血病病人骨髓细胞的增殖。最近,应用 IL-1R 基因工程产品开始对治疗关节炎、糖尿病以及防治器官移植排斥等进入临床验证。动物体内注射 sIL-4R 可延长同种异人本移植物的存活,抑制 GVHR,降低 I 型超敏反应。应用 sTNFR 可减轻 TNF 在自身免疫性疾病中所介导的病理损害,并可减轻败血症休克。
表 4 -21 血清 sIL-2R 水平升高与人类某些疾病的关系
恶性肿瘤
成人 T 细胞白血病(HTLV- I 相关,CD4+ T 细胞)
毛细胞白血病(对 IFN- α 治疗有效者 sIL-2R 水平下降,复发时上升)
急性淋巴细胞白血病
慢性髓样细胞白血病 blasticphase(sIL-2R 升高先于临床发作)
Hodgkin 氏淋巴瘤(与疗效和预后平行)
非 Hodgkin 氏淋巴瘤(所有 T 细胞淋巴瘤和大部分B细胞淋巴瘤,sIIL- 2 水平与判断预后密切 相关)
肝癌、乳腺癌、胃癌、食道癌、结肠癌、鼻咽癌等
自身免疫或炎症性疾病
类风湿性关工了炎(滑膜液中 sIL-2R 升高有助于与其他关节炎的鉴别诊断)
全身性红斑狼疮
进行性全身性硬皮病
多肌炎(sIL-2R,sCD8 同时升高与急性肌肉炎症平行,常为临床复发前表现)
Kawasaki 病、多发性硬化症、I型糖尿病
病毒感染与其它传染性疾病
甲型病毒性肝炎急性期
乙型病毒性肝炎急性期、慢性活动性肝炎、BHeAg 阳性者(sIL-2R 往往与病情发作、肝脏病 损平行)
丙型病毒性肝炎
艾滋病(与血清抗体和病期发展相关)
传染性单核细胞增多症
麻疹
呼吸道合胞病毒感染
肾综合征出血热急性期
乳头状瘤病毒引起的尖锐湿疣
麻风(与发热、皮肤组织坏死程度正相关,可的松等治疗后 sIL-2R 水平迅速下降)
结核病
疟疾
移植及移植排斥
肾脏移植(急性移植排斥、CD3McAb 治疗后明显升高,有助于区别感染和药物中毒,环孢 霉素A治疗后明显降低)
肝脏(胆汁中 sIL-2R 升高是早期肝脏排斥的敏感指标)
异基因骨髓移植后所发生的 GVHD
其它
烧伤(往往与病情平等,可能与患者免疫抑制状态有关)
慢性肾功衰竭和肾透析
Wegener 氏肉芽肿
评价对体内注射 IL- 2 的免疫反应性
第四节 细胞因子及其受体的检测
细胞因子在机体免疫应答过程中起着十分重要的作用。在某些疾病时,体内细胞因子及其受体表达可发生异常,与机体免疫功能低下或发生病理损伤有关。因此,在临床免疫学中越来越重视对细胞因子及其受体的检测。在基础免疫研究中,常需检测不同条件培养液中细胞因子的活性,并探讨细胞因子产生水平与免疫细胞表型、增殖、杀伤及其它功能的关系。此外,原核细胞和真核细胞中表达的重组细胞因子或经过不同工艺纯化后的产品需测定其活性和含量。
从细胞因子及其受体检测的水平来说,可以分为基因组 DNA、mRNA 和蛋白三个不同的水平,后者又包括胞浆内、膜表面以及分泌到体液或培养上清等三种不同形式细胞因子。目前应用最多的是检测体液或培养丰清中的细胞因子以及膜表面的细胞因子受体。
一、生物活性检测法
细胞因子生物学活性检测法是根据某些细胞因子特定的生物学活性,应用相应的指示系统和标准品来反映待测标本中某种细胞因子的活性水平,一般以活性单位来表示。生物学检测法一般敏感性较高,直接表示待测标本中的活性水平。但实验周期较长,如集落形成法需 10~14;易受细胞培养中某些因素的影响,如血清、pH、药物;易受生物学活性相同或相近的其它细胞因子的影响,如检测 IL- 2 时可受 IL- 4 的干扰,TNF- α 和 TNF-β(淋巴毒素)表现出极为相似的生物学作用;易受待栓样品中某些细胞因子抑制物的干扰,如 IL- 1 活性可被 IL- 1 受体拮抗物(IL-1ra)所抑制,TNF- α 可被 TNF-BP 所阻断;不能区分某些细胞因子的型和亚型,如 IFN-α、β 和 γ,以及 IFN- α 中不同的亚型显示相同的生物学活性;某些指示细胞长期培养易发生突变;不同指示细胞对同一种细胞因子的敏感性不同,所慕名而来结果难于标准化;此外,某些人源的细胞因子如 hIL- 2 对小鼠细胞起作用,但鼠源性的 IL- 2 对人的细胞则无刺激作用。
生物学检测的方法大致可分为增殖或增殖抑制、集落形成、直接杀伤靶细胞、保护靶细胞免受病毒攻击、趋化作用以及抗体形成法等几类。
(一)增殖或增殖抑制法
其基本原理是应用某一细胞因子能特异地刺激或抑制某些指示细胞的增殖,通过3H-TbR 掺入或 MTT 法显色,反映待检细胞因子的活性水平。
(二)集落形成法
其基本原理是应用骨髓干细胞体外半固体培养系统,根据不同造血因子能诱导干细胞或定向造血祖细胞形成某一种或某些种类细胞的集落,通过对形成集落形态学、酶学鉴定,计算不同种类集落形成的数量和比例,反映待测标本中 CSF 的种类和活性水平。
(三)直接杀伤靶细胞
在细胞因子中 TNF-α、TNF- β 具有直接杀伤某些肿瘤细胞的作用,采用 TNF 敏感的细胞株如小鼠成纤维细胞株 L929,以及 WEHI164 亚克隆 13 作为指示细胞,通过3H-TdR 释放法或染料染色等可检测待检样品中 TNF 的活性水平。
(四)保护靶细胞免受病毒的攻击
靶细胞受某些病毒感染后可发生明显病变和死亡,干扰素可保护靶细胞免受病毒的攻击,常用的病毒是水疱性口炎病毒(vesicular stomatitis virus,VSV), 敏感的指示细胞为喉癌的上皮细胞株 Hep2 和羊膜的上皮细胞 WISH,通过干扰素(IFN-α、IFN-β、IFN-γ)抑制病毒致病变的程度,计算出待测样品中 IFN 的活性单位。
(五)趋化作用
IL- 8 对多形核细胞、淋巴细胞具有趋化作用,可用小室法或软琼脂趋化法,PMN 或淋巴细胞作为指示细胞,以细胞趋化的程度来反映样品中 IL- 8 活性水平。
(六)抗体形成法
IL- 6 可在体外刺激某些 B 淋巴细胞系产生和分泌免疫球蛋白,常用的指示细胞有分泌 IgG 的 ARH-77、CESS 和分泌 IgM 的 SKW6.CL-4。在一定的条件下,待检样品中 IL- 6 水平与培养细胞上清 IgG 或 IgM 水平正相关,通过标准 IL- 6 的对照可推算出待检样品中 IL- 6 的活性。
表 4 -22 细胞因子生物学活性检测方法(举例)
| 被检细胞因子 | 实验系统 | 可干扰的因素 | |
| IL-1 | D.10(小鼠 T 细胞) | 增殖法(3H-TdR、MTT) | 人 IL-2;小鼠 IL-2、IL-4、IL-7、GM-CSF、TNF 等 |
| 小鼠胸腺细胞 | 增殖法 | TGF-β1、β2 抑制作用 | |
| IL-4(小鼠胸腺瘤) | CTLL 转换法(增殖法) | 小鼠 IL-4 | |
| 黑素瘤细胞 A352 | 增殖抑制法 | ||
| IL-2 | CTLL(小鼠杀伤性 T 细胞系) | 增殖法 | 小鼠 IL-4 |
| IL-3 | KG1(髓样白血病细胞) | 增殖法 | |
| TF-1(前髓样细胞) | 增殖法 | EPO、IL-5、IL-6、GM-CSF | |
| 小鼠造血细胞系 FDCP-1 | 增殖法 | GM-CSF | |
| 人巨核母细胞白血病细胞系 Mo7E | 增殖法 | GM-CSF、IL-9 | |
| 骨髓半固体造血祖细胞集落形成 | 20α 类固醇脱氢酶 | GM-CSF | |
| 集落种类和数量 | GM-CSF、IL-1、IL-6、G-CSF、M-CSF | ||
| IL-4 | 小鼠 B 细胞 | 诱导 CD23、MHCⅡ类 | IFN- γ 有抑制作用 |
| 抗原表达 | |||
| PHA 刺激的小鼠 T 细胞 | 增殖法 | IL-2 | |
| IL- 4 依赖细胞株 | 增殖法 | IL-2 | |
| 人 IL-4R 转染 CTLL | 增殖法 | IL-2 | |
续表 1
| 被检细胞因子 | 实验系统 | 可干扰的因素 | |
| IL-5 | 抗 Ig(或 SAC)刺激 B 细胞诱导人或小鼠骨髓半固体培养中嗜酸性粒细胞成熟 | 增殖法 | IL-3 |
| 抗 Ig 处理的小鼠 B 细胞 | IgM 分泌 | ||
| BCL-1(B 淋巴瘤细胞) | 增殖法 | IL-4 | |
| IL-6 | TF-1(前髓样细胞) | 增殖法 | EPO、IL-3、IL-5、GM-CSF |
| B9(小鼠杂交瘤细胞) | 增殖法 | 小鼠 IL-4、IL-11 | |
| 7TD1(小鼠杂交瘤细胞) | 增殖法 | IL-11 | |
| BM60 | 增殖法 | ||
| HepG2(肝细胞) | Fibronogen 产生 | LIF | |
| CESS(EBV 转化人 B 细胞) | IgGβ1、TGF-β2 有抑制作用 | ||
| DKW6.CL-4 | IgM 产生 | TGFβ1、TGF-β2 有抑制作用 | |
| IL-7 | 骨髓前 B 细胞 | 增殖法 | |
| IL-8 | 中性粒细胞 | 软琼脂趋化法 | 其它化学趋化物质 |
| 小室趋化法 | G-CSF、M-CSF | ||
| IL-9 | Mo7E(巨核细胞白血病系) | 增殖法 | IL-3、GM-CSF |
| IL-11 | 7TD1(小鼠杂交瘤细胞系) | 增殖法 | IL-6 |
| B9(小鼠杂交瘤细胞系) | 增殖法 | 小鼠 IL-4、IL-6 | |
| T1165 | 增殖法 | IL-6 | |
| IL-12 | PBMC | IFN- γ 产生 | IFNα/β/γ |
| PHA 活化 T 淋巴母细胞 | 增殖法 | IL-2、IL-4 | |
| PBL | LAK 杀伤(与 IL- 2 协同) | IL-2、IL-6 | |
| 骨髓祖细胞 | GM 集落形成 | IL-3;TGF- β 有抑制作用 | |
| TF-1(前髓样细胞) | 增殖法 | EPO、IL-3、IL-5、IL-6 | |
| 小鼠造血细胞 FDCP-1 | 增殖法 | IL-3 | |
| 人巨核母细胞白血病细胞系 Mo7E | 增殖法 | IL-3、IL-9 | |
| AML-193 | 增殖法 | ||
| 造血祖细胞 | 粒细胞集落形成 | IL-3、IL-9 | |
| 中性粒细胞 | 活化后超氧释放 | GM-CSF | |
| WEHI164 亚克隆 13 或 L929 | 杀伤作用 | GM-CSF、IL-6 | |
| TNF- α 和 TNF-β(LT)有相似的杀伤作用 | |||
续表 2
| 被检细胞因子 | 实验系统 | 可干扰的因素 | |
| PDGF | 成纤维细胞和 SS、WHG、WI26、WI28 | 增殖法 | FGF(1、2、5)、EGF、TGF-β、IL-1、TNF 等 |
| INF-α/β/γ | 上皮细胞如 Hep-2、Wish | 抵抗病毒(如 VSV)的致病变作用 | FN-α/β/ γ 有相似的生物学活性 |
| TGF-β | 成纤维细胞(半固体培养) | 增殖法 | |
| 成骨细胞单层培养 | 增殖法 | ||
| PHA 刺激 PBMC | 增殖抑制法 | ||
| ConA/IL- 1 诱导胸腺细胞 | 增殖抑制法 | IL-2、IL-4 | |
| 人黑素瘤细胞 A375 | 增殖抵制法 | IL-1、IL-2、IL-4 | |
二、免疫学检测法
免疫学检测法的基本原理是细胞因子(或受体)与相应的特异性抗体(单克隆抗体或多克隆抗体)结合,通过同位素、荧光或酶等标记技术加以放大和显示,从而定性或定量显示细胞因子(或受体)的水平。这类方法的优点是实验周期短,少受抑制物或相似生物池功能因子的干扰,如抗体的特异性高可区分不同型或亚型的细胞因子(如 IFN),一次能检测大量标本,易标准化。与生物学活性检测方法相比,免疫学检测法在许多情况下敏感性低于前者,所得结果不表示生物学活性,有的 McAb 只能识别重组的细胞因子,在检测天然的细胞因子中受到限制。
免疫学检测的方法多采用 ELISA 和 RIA 法,可以分为平心法、竞争法和间接法。
(一)ELISA(或 RIA)平心法
根据抗体性质和特异性不同可有以下几种不同的平心法 ILISA。
1.PcAb 与 McAb 夹心法 用纯化的多克隆抗体(PcAb)包被板子,加待检细胞因子(或可溶性受体)和标准品,上层加酶标记的 McAb。有时为了增加敏感性,上层加 McAb 后再用酶标记第二抗体显色。
2.McAb 与 PcAb 夹心法 用 McAb 包被板子,加待检样品,上层加酶标记的 PcAb。有时为了增加敏感性,上层加 PcAb 后再用钊对 PcAb 的酶标记抗抗体。
3. 双 McAb 夹心法 选择和应用识别同一个细胞因子(或受体)分子上不同表位的两种 McAb,其中一种包被板子,另一种 McAb 标记酶。由于单克隆抗体亲和力识别表位地匀一,从质量控制角度来看,一般比上两种夹心法易控制。如目前已商品化检测细胞因子(或其受体)的检测盒大多采用双单克隆抗体夹心法。
4. 细胞、McAb 夹心法 用表达 IL-2R 的 MT- 1 细胞包被板子,加入待检 IL- 2 或标准品,上层加125 I 标记的 McAb,根据 γ 计数 cpm 值推算出待检 IL- 2 含量。
(二)竞争法
有报道用况争法检测 IL- 2 水平。用免抗 IL-2PcAb 包袱板子,同时加入125 I 标记的 IL- 2 和待测 IL-2,根据 γ 计数 cpm 值得知待检 IL- 2 对125I-IL- 2 与 PcAb 竞争结合的程度,从而推算出待测标本 IL- 2 的含量。这种方法检测 IL- 2 的敏感性可达 50pg/ml。
为了增加敏感性,在上述系统中可再连接上生物素,再用链霉亲和素(streptavidin)酶标记物进行放大。此外,还可用化学发光、改进显色底物等措施提高检测方法的敏感性。
表 4 -23 细胞因子生物学活性与免疫学检测方法的比较
| 生物学活性法 | 免疫学检测法 | |
| 原理 | 细胞因子特定的 | 细胞因子与相应抗体 |
| 生物学活性 | 特异性结合反应 | |
| 结果表示 | 生物学活性水平 | 含 量 |
| 敏感性 | 一般较高 | 一般较低 |
| (与细胞表面高亲和力受体有关) | (加放大系统可明显升高) | |
| 特异性 | 低 | 高 |
| (识别类型、亚型) | (不能) | (不可能) |
| 周 期 | 较 长 | 短 |
| 受实验条件影响 | ||
| 培养条件 | 大 | 小 |
| 指示细胞敏感性差异 | 大 | / |
| 指示细胞突变 | 可发生 | / |
| 生物学作用相同因子干扰 | 大 | 小 |
| 样品中特异性或非特异性 | 大 | 小 |
| 抑制物干扰 | ||
| 重复性 | 较 差 | 较 好 |
| 标准化、大量检测 | 困 难 | 容 易 |
三、胞浆或胞膜细胞因子(或受体)的检测
许多细胞因子产生过程中,有一个胞浆到胞膜,再释放到体液或培养上清中的动态变化。一般可采用免疫组织化学染色技术或免疫荧光技术检测细胞或组织切片中细胞因子(或受体)定位(胞浆、胞膜),产生细胞的频数,以及胞浆、胞膜、上清中浓度改变的动态变化。目前已报道 IL-2、TNF-α、IFN- γ 等细胞因子以及几科所有细胞因子的受体可用这类方法进行检测。流式细胞仪(FCM)与间接免疫荧光法相结合检测细胞膜表面细胞因子受体,可获得客观正确的结果。用同位素标记配体或标记抗细胞因子受体的抗体,进行竞争结合试验,可检测细胞因子受体表达的数量以及亲和力大小。
四、核酸标记技术检测法
通过核酸标记技术可将细胞因子 cDNA 作为基因探钊检测细胞内细胞因子基因组 DNA 或 mRNA。主要有以下几种方法:
1. 应用同位素(或非同位素)标记的 cDNA 探针,检测经 Northernblot 后细胞因子 mRNA 水平或采用打点杂交法。
2. 应用标记 cDNA 探钊与细胞或组织切片进行原位杂交,然后进行放射自显影。
3. 细胞因子 mRNA 经反转录为 cDNA,用特异性细胞因子引物经聚合酶链反应(PCR)扩增细胞因子 cDNA,Southern blot 后用标记探针检测特异细胞因子 DNA 水平。
(金伯泉)
参考文献
1.Ared WP,et al.An IL-1 inhibitorfrom human monocytes production and characterization of biologic properties.JImmunol,1980;143:1851
2.Baggiolini M and Dahinden CA.CCchemokines in allergic inflammation.Immunol Today 1994;15(3):127
3.Balkwill FR and Burke F.The cytokine network.ImmunolToday,1989;10(9):299
4.Bazan JF.Haemopoietic receptorsand helical cytokines .Immunol Today,1990;11(10):350
5.Cannon J G,et al.Circulatinginterleukin-1 and tumor necrosis of tumors.PNAS,1975;72:3666
7.Chan SH,et al.Induction ofinterferon γ production by natural killer cell stimulatoryfactor:characterization of the responder cells and synergy with other inducers.JExp Med,1991;173:869
8.Chen WF,et al.IL-10:A novelcytotoxic T cell diffeentiation factor.J Immunol,1991;147(2):528
9.Cosman D,et al.A new cytokinereceptor superfamily.TIBS,1990;15-July:265
10.Dinarello CA.Interleukin 1 andinterleukin-1antagonism.Blood,1991;77(8):1627
11.Dower SK,et al.Molecularcharacterization of two types of interleukin-1 recep-tor coding peptide onmurine and human cells.J Leukoc Biol(suppl.),1990;1:103
12.Durum SK and Mealy K.Hiltonhead revisited-cytokine explosion of the80s takes shape for the 90s.ImmunolToday,1990;11(4):103
13.Durum SK,et al.New cytokinesand receptors nake their debut in SanAntonio.Immunol Today,1991;12(2):54
14.Edward A,et al.How B and Tcells talk to each other.Nature,1994;367:425
15.Eisenberg SP.et al.Primarystructure and funtional expression from complementary DNA of a human inteleukin1 receptor antagonist Nature,1990;3:341
16.Engelmann H,et al.A Tumornecrosis factor binding protein purified to homogeneity from human urineprotects cells from tumor necrosis factor toxicity.J Biol Chem 1989;264:11974
17.Fiorentino DF,et al.IL-10 actson the antigen-presenting cell to inhibit cytokine production by Th1 cells.JImmunol,1991;146(10):3444
18.Fong Y,et al. Antibodies tocachetin/TNF reduce IL-1β and IL-6 appearance during lethal bacteremia J ExpMed 1989;170:1627
19.Gasson JC.Molecular physiologyof granulocyte-macrophage colony-stimulating factor.Blood,1991;77(6):1131
20.Gately MK,et al.Synergybetween recombinant interleukin 2(r IL-2)and IL-2 depleted lymphokinecontaining supernatants in facilitating allogeneic human cytolytic T lymphocyteresponses in vitro.j Immunol,1986;136:1274
21.Gately MK,et al.Regulation ofhuman lymphocyte proliferation by a heterodimeric cytokine,IL-12(cyotoxiclymphocyte maturation factor).j Immunol,1991;147:874
22.Gubler V,et al.Coexpression oftwo distinct genesis requird to generate secreted bioactive cytotoxiclymphocyte maturation factor.PNAS,1991;88:4143
23.Hayashida K,et al.Molecularcloning of a second subunit of the receptor for human granulocyte-macrophagecolony-stimulating factor(GM-CSF):reconstitution of a high-affinity GM-CSfreceptor.PNAS,1990;87:9655
24.Himeno T,et al.Expression ofendogenous tumor necrosis factor.Cancer Res,1990;50:4941
25.Hirano T,et al.Biological andclinical aspects of interleukin 6.Immunol Today,1990;11(12):443
26.Horuk R.Theinterleukin-8-receptor family:from chemokines to malaria.ImmunolToday,1994;15(4):
27.Humnum CH et al.Interleukin-1receptor antagonist activity of a human interleukin-1inhibitor.Nature,1990;343:336
28.James K.Interaction betweencytokines and α2macroglobulin.Immunol Today,1990;11(50:163
29.Kishimoto T.The biology ofinterleukin-6.Blood,1989;74:1
tory factor(NKSF),a cytokine withmultiple biologic effects on human lymphocytes.J Exp Med 1989;170:827
31.KrantzS.Erythropoietin.Blood,1991;77(3):419
32.Liu Y and MullbacherA.Hypothesis:immunological help is reciprocally delivered between differentsubpopulations of lymphocytes.Scand j Immunol,1989;30:277
33.Lowenthal JM,et al.Binding andinternalization of interleukin 1 by Tcells direct evidence for high and lowaffinity classes of interleukin-1receptor.J Exp Med 1986;164:1060
34.Moore KW,et al.Homology ofcytokine synthesis inhibtory factor(IL-10)to the Epstein-Barr virus geneBCRFI.Science,1990;248:1230
35.Morgan RA,et al.Selective invitro growth of t lymphocytes.Science,1976;193:1007
36.Murphy PM.The molecularbiology of leukocyte chemoattractant receptors.Annu Rev Immunol,1994;12:593
37.Musash M,et al.Direct andsynergistic effects of interleukin 11 on murine hemopoiesis inculture.PNAS,1991;88:765
38.NacNeil IA,et al.IL-10,A novelgrowth factor for mature and immatureT cell.J Immunol,1990;145:4167
39.Namen AE,et al.Stimulation ofB-cell progenitors by cloned murine interleukin 7.Nature,1988;33:571
40.Paul SR,et al.Molecularcloning of a cDNA encoding interleukin 11,a stromal cell-derived lymphopoieticand hematopoietic cytokine.PNAS,1990;87:7512
41.Pizzolo G,et al.Solubleinterleukin 2 receptor in the serum of patients with Hodgkin’s disease.Br JCancer 1987;55:427
42.Ralop P.A summary of cytokineaspects of the intermational symposium of molecular hematology.1990;Lymphokineand Cytokine research,1991;10(1):77
43.Rot A.Endothelial cell bindingof NAP-1/IL-8 role in neutrophil emigration.Immunol Today 1992;13(8):291
44.Rubin LA,et al.The solubleinterlenkin-2 receptor biology,function and clinical application.Annals ofInternal.Medicine 1990;113(8):619
45.Rubin LA,et al.Solubleinterleukin 2 receptors are released from activated human lymphoid cells in vitro.J Immunol.1985;135:3172
46.Sims JE,et al.cDNA expressioncloning of the IL-1 receptor,a member of the immunoglobulin superfamily.Science1988;241:585
47.SmithKA.Interleukin-2:inception,impact and implications.Science,
1988;240:1169
48.Snouwaert JN,et al.Effects ofsite-specific mutations on biologic activity of recombinant human IL-6.JImmunol,1991;146(2):585
49.Stern AS,et al.Purification tohomogencity and partialcharacterization of cytotoxic lymphocyte maturation factor from humanB-lypmhoblastoid cell.PNAS,1990;87:6808
50.Stotter H,et al.IL-7induceshuman lymphokine-activated killer cell activity and is regulated by IL-4.JImmunol 1991;146(1):150
51.Takaki S,et al.Molecularcloning and expression of the murine interleukin-5 receptor.EMBO,1990;(13):4367
52.Taub DD and OppenheimJJ.Review of the chemokine meeting the third international symposium ofchemotactic cytokines.Cytokine,1993;5(3):175
53.Uckun FM,et al.Interleukin 7receptor ligation stimulates tyrosine phosphorylation,inositol phospholipidturnover,and clonal proliferation ofhuman B-cell precursors.PNAS,1991;88:3589
54.Uyttenhove C,et al.Functionaland structural characterization of P40,a mouse glycoprotein with T cell-growthfactor activity.PNAS,1988;85:6934
55.William E,et al.Structure andfunctional expression of a human interleukin-8 receptor.Science,1991;253:1278
56.Wong HL,et al.Characterizationof a factor(s) which synergizes with recombinant interleukin 2 promotingallogenic human cytolytic T-lymphocyte responses in vitro.CellImmunol,1988;11:39
57.Xing X and Yong SC:Humanrecombinant IL-3 is a growth factor for normal B cells.JImmunol,1992;148(2):491
58.Yin T,et al.Involvement ofIL-6 signal transducer gp130 in IL-11-mediated signal transduction.JImmunol,1993;151:2555
59. 侯云德. 干扰素的不同亚型与临床应用。中国生物物品学杂志 1991;6(4):145
60. 曹广文、杜平. 生药活性多糖对淋巴细胞 / 细胞素的调节与抗肿瘤作用。免疫学杂志,1992;8(4):273
61. 孙红、施渭康. 白血病抑制因子. 细胞生物学,1994;16(2)49
62. 段海清、黄翠芳. 抑瘤素 M 研究进展. 因外医学免疫学分册,1994;17(4):185
63. 朱学军、曹雪涛. 肿瘤坏死因子拮抗剂的种类性质及其治疗作用. 国外医学免疫分册,1994;17(1):21
64. 舒翠玲、金伯泉. 白细胞介素 12(IL-12)的研究概况. 免疫学杂志,1992;8(2):133
65. 孙忱、金伯泉. 可溶性细胞因子受体研究进展. 国外医学免疫学分册,1994;17(2):70
66. 孙凯、金伯泉. 细胞因子受体中的共用链现象及信号转导
67. 黄传书、金伯泉.IL-3、IL- 5 和 GM-CSF 受体研究的进展。国外医学免疫学分册,1995;18(3):121
68. 张新海、金伯泉. 趋化因子研究进展 - 趋化因子家族(一)。国外医学免疫学分册,1995;18(3):130
第五章 补体的分子生物学
补体系统由 30 多种蛋白分子所组成,是迄今所知机体中最复杂的一个限制性蛋白水解系统(limited proteolysis system), 根据各成分功能不同,将它们分为三组。第一组为补体系统的固有成分共 14 个蛋白分子。即 C1(含三个亚组分:C1q、Clr 和 Cls)、C4、C2、C3、C5、C6、C7、C8、C9、B 因子、D 因子和 P 因子。其中 C1、C4 和 C2 仅参与经典激活途径的活化;B 因子、D 因子和 P 因子仅参与替代途径的反应;C5- 9 则为上术两条激活途径共同的末端效应序列。第二组为调节与控制补体系统活化的分子,包括:C1 抑制物(C1INH),C4 结合蛋白(C4bp)、膜辅因子蛋白(MCP)、促衰变因子(DAF)、蛋白 S(PS)、H 因子、Ⅰ因子、血清羧肽酶 N、S 蛋白、CD59、SP40/40 及同种限制因子(HAF),又称 C8 结合蛋白(C8bp)。第三组为补体的受体分子,有 C1q 受体(C1q-R)、I 型补体受体(CR1)、Ⅱ型体受体(CR2)、Ⅲ型补体受体(CR3)、Ⅳ型补体受体(CR4)、Ⅴ型补受体(CR5)、H 因子受体(fH-R)及 C3a 受体(C3a-R)和 C5a 受体(C5a-R)等。
在正常生理情况下,绝大多数补体固有分子均以非活化形式存在于血清中,当受到某种激活剂作用后,即出现一系列级联反应,各种补体固有分子依次活化,最终产生溶细胞性效应。补体分子在活化过程中,可不断形成具有酶活性的中间复合体(如 C4b2a,C4b2a3b,C3bBb 及 C3(b)nBb 等),裂解有关的补体分子产生多种活性肽和蛋白片段,发挥不同的生物学效应。但补体系统的级联活化反应,又受着各种调节分子的严格控制,借以限制补体活化的程度及维持体内补体水平的平衡。
补体系统的主要生理功能是促进吞噬和溶解靶细胞。因此,是机体免疫防御机制的重要组成部分,对消除外来抗原的侵害,维护机体内环境的平衡具有重要作用。但另一方面,在一些非免疫性因素的刺激下,补体系统的活化又可产生炎症反应,并影响凝血及纤溶系统,导致机体正常组织细胞的损伤。因此,补体既是生理性的防御物质,又是造成病理性损伤的介质。
80 年代以来,由于分子生物学技术的进展,已对绝大多数补体分子的基因克隆成功,并揭示了它们的核苷酸和氨基酸序列,从而为研究补体系统各成分的结构及功能创造了有利的条件。本章将着重介绍各种补人本蛋白的结构及其功能。
第一节 补体固有成分的分子结构及功能
补体系统两条激活途径中,涉及到 14 个补体蛋白(C1-9,及 B、D、P 因子)的参与。近年来,由于分子遗传学和分子克隆技术的应用,已阐明许多补体分子的结构、功能、生物合成及遗传特征,从而大促进了人们对补体系统激活过程机理的认识和对各个补体分子功能的深入了解。
一、C1 分子
C1 是经典激活途径中的起始成分。它是由 1 个分子的 C1q 和 2 个分子的 C1r 及 2 个分子的 Cls 借 Ca2+ 连接而成的大分子复合物。分子量约为 750kDa。其中 C1q 为具有识别作用的亚单位,C1r 和 C1s 为具有催化作用的亚单位。
(一)C1q
C1q 为各种补体分子中分子量最大(410kDa)的 γ 球蛋白。其分子结构较特殊和复杂,由 A、B、C 三种不同类型的肽链所组成。其中 A、B、C 链各 6 条,共 18 条。A、B、C 三种肽链的分子量不尽相同,分别为 24、23 和 22kDa,各含有 222-226 个氨基酸残基,且彼此同源。每条肽链由含半胱氨酸残基的一个短的 N 末端区所组成,接着为一段 81 个氨基酸的胶原序列(即重复的三股序列 Gly-X-Y,Y 处通常为羟脯氨酸或赖氨酸残基)。该序列的其余部分为非胶原性的。A、B 链间及两条 C 链间各有一个二硫键相连接。18 条肽链中每三条不同的肽链组成一条三股螺旋,故共有 6 条这样的结构。每条螺旋的肽链均由丝状胶原样成分组成。在 6 条螺旋结构 C 端由于氨基酸序列的随机卷曲而形成 6 个花蕾状的球形头部,呈花朵形展开。在近 N 端约为 1 / 2 全长的螺旋结构呈束状并平行排列,其 N 末端为 C1q 的尾部。因此在电镜下观察,C1q 分子的图像酷似一束盛开的郁金香花(图 5 -1)
图 5 -1 C1q 的结构(模式图)
C1q 的胶原样区有结合 C1r 和 C1s 的部位。并证实聚合的 C1q 刺激 B 细胞增强其产生 Ig 的作用,也是通过其尾部而完成的。C1q 的关部含有能识别 IgFc 片段上补体结合部位的位点(C1q 与 C1q- R 相互作用),且由于 6 个球形头部呈花朵形展开,更增加了其与 Ig 接触的机会。C1q 同 1 个分子的 IgM 结合即可被活化,但至少需同两个 IgG 分子结合才能被活化,而且两个 IgG 分子在细胞膜上的距离不得少于 700nm。C1q 对人 4 种 IgG 亚类的结合亲和力依次为:IgG3>IgG1>IgG2>IgG4。
Reid 等已对 C1q 分子的 A、B 链做了部分氨基酸分析,并完成了 A、B 链的 cDNA 克隆及序列分析。因此,C1q 分子的大部分一级结构已经明确。编码 C1qA、B、C 三条肽链的基因均定位于人的第 1 号染色体的短臂 34.1-36.1 区。
(二)Clr 和 Cls
Clr 和 Cls 均为单一多肽链分子,又都是丝氨酸蛋白酶(原)。Clr 和 Cls 多肽链均由接近 700 个氨基酸所组成。位于 C 末端的约 250 个氨基酸为丝氨酸蛋白酶区,与胰蛋白酶和糜蛋白酶同源。同大多数补体蛋白一样,它们都是镶嵌(mosaic)蛋白,即由不同氨基酸组成的固定基序组合而成,并且很可能代表独立的折叠功能区或结构功能域(module)。
电镜下观察表明,Clr 和 Cls 的分子构型极为相似,均呈一端大一端稍小的哑铃状分子。
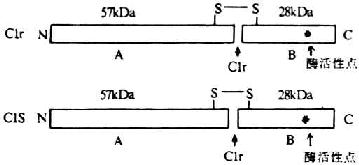
图 5 -2 Clr/Cls 分子的结构
两个分子的 Clr 和同等分了的 Cls 借 Ca2+ 连接成扭曲的“8”字形,盘架于 C1q 近头部的 6 条螺旋结构间(图 5 -3)。Clr 和 Cls 的分子量条螺旋结构间(图 5 -3)。Clr 和 Cls 的分子量均为 85kDa。它们激活后,在分子内的精氨酸与亮氨酸残基间断裂,形成分子量分别为 57kDa 和 28kDa 的 A、B 两个片段,但链间仍以二硫键相连接,故整个分子并末分离。在 B 片段上含有丝氨酸蛋白酶活性点,为其催化英勇区(图 5 -2)。A 片段上有 Clr 和 Cls 相互反应的的功能区。反应功能区朝向中心,催化功能区位于外侧。在一般 C1INH 与 C1r 结合着,而一旦有免疫复合物结合到 Clq 时,C1INH 的抑制作用即行移除,并通过 C1q 的胶原性柄将其头部的移动传递到其核心区,并从此处再传递到与其相连接的 C1r,诱导 C1r 构钟爱改变并裂解活化。活化的 C1r(C1r),再作用于 C1s 使之成为活化型 C1s(C1s)。
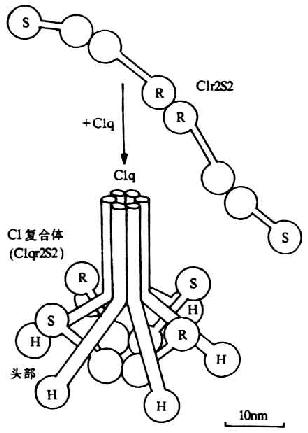
图 5 -3 C1 分子(C1q、C1r 和 C1s)的结构(示意图)
目前 C1r 和 C1s 的 cDNA 克隆均已成功,并进行了全部序列分析。编码 C1r 的基因定位于人的第 12 号染色体短臂 13-ter,与编码 C1s 的基因相连。
二、C4 分子
C4 是经典激活途径中第二个被活化的补体成分,分子量约为 210kDa,由 α(90kDa)、β(78kDa)及 γ(33kDa)三条肽链借二硫键连接组成(图 5 -4)C4 的分子结构较为特殊,其 α 链中含有一个在半胱氨酸和谷氨酸残其间形成的内硫酯键。α 链的 N 端有 C1s 丝氨酸蛋白酶的作用点。当 C1s 将 C4α 链的精氨酸 - 丙氨酸键(76-77 位)裂解后,形成大小不等的两个片段。小片段 C4a(8.6kDa)释放入液相中,其为一弱的过敏毒素,具有激酞样作用,可诱导肥大细胞释放组胺,增加血管的通透性引起局部渗出性炎症,但其活性不到 C3a 或 C5a 的 1%。大的片段 C4b 其 α` 链的内硫酯键被水解,并暴露出一个自由的硫氢基和一个谷氨酰胺残基的高度反应性酰基,通过转酯反应而将 C4b 固定到膜固相上。但 C4b 只能在其产生处或附近部位结合,因高度反应性的酰基能迅速与 H 2 O 反应,生成稳定的无共价结合功能的羧基(详见图 5 -7)。
一个 C1s 丝氨酸蛋白酶可以裂解多个 C4 分子,但产生的 C4b 只有 1 /10 能结合到膜固相上,而且其中也仅少数与 C2 结合。C4b 的功能,除主要参与经典激活途径中 C3 转化酶(C4b2a)和 C5 转化酶(C4b2a3b)的形成进一步介导补体后续成分的级联反应外,还可通过与效应细胞膜上的 CR1 结合促进吞噬、调节补体活化,以及参与防止免疫复合物的沉积及中和病毒的作用。近年认为,C4 可能与免疫识别及维持免疫自稳功能也有关。
编码人 C4 的基因定位于第 6 号染色体的 HLA-DR 和 HLA- B 位点间一段基因组 DNA 上。C4 由两个基因 C4A*和 C4B*所编码,因此血清中的 C4 分子也有两种类型即 C4A 和 C4B,但二者具有高度同源性(仅有少数氨基酸不同)目前 C4A*和 C4B*的 cDNA 克隆均已成功并进行了序列分析。C4A、C4B、B 因子及 C2 均属于 MHC 的第Ⅲ类分子。
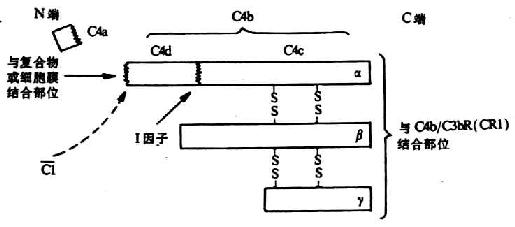
图 5 -4 C4 分子其裂解片段(模式图)
三、C2 分子
C2 的序号似是补体的第 2 个成分,但在经典激活途径的激活顺序上却在 C4 以后被活化。C2 分子的一级结构已全部搞清楚,它是由 723 个氨基酸残基组成的单肽链糖蛋白,分子量约 110kDa(图 5 -5)。当 C2 与已固定于细胞膜固相上的 C4b 结合为复合物时,C1s 丝氨酸蛋白酶可从 C2 肽链的精氨酸和赖氨酸(223-234)间,将 C2 裂解为两个片段,即 C2a 和 C2b。C2b 由 N 端 223 个氨基酸残基构成,分子量为 35kDa,由细胞膜表面释放入液相中,其生物学活性至今不明。C2a 由 509 个氨基酸残基组成,分子量为 75kDa,它是构成经典激活途径中 C3 转化酶(C4b2a)和 C5 转化酶(C4b2a3b)的酶原部分。C2a 的肽链上含有裂解 C3 和 C5 的蛋白酶活性点,C3 转化酶与 C5 转化酶对 C3 和 C5 的裂解,均是由 C2a 的酶活性点起催化作用。
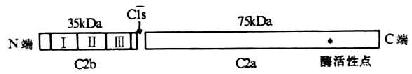
5-5 C2 分子的结构(模式图)
注:Ⅰ、Ⅱ、Ⅲ为 3 个 SCR
通过对 C2 的 cDNA 序列和氨基酸序列分析发现,C2 与 B 因子间具有结构上的同源性。其中 C2a 与 Bb 同源,均含有裂解 C3 和 C5 的酶活性点;C2b 和 Ba 同源,均由 3 个约 60 个氨基酸残基的短同源重复序列(shortconsensus repeat,SCR)构成。编码 C2 的基因定位于人的第 6 号染色体短臂 21 区(基因长度 8kb)。
四、C3 分子
C3 处于两条激活途径的汇合点,在补体系统活化过程中起着枢纽作用,并为替代途径激活的关键分子。C3 的 α、β 两条肽链组成,之间以二硫键相连结,分子量为 195kDa,其中 α 链为 115kDa,β 链为 75kDa(图 5 -6)。其在血清中的含量高于其它补体分子,约为 0.55-1.2mg/ml。同 C4 分子一样,C3 分子的 α 链在半胱氨酸和谷氨酸残基之间也有一个内硫酯键(Cys-S-CO-Glu)。此环状结构水解后,可形成一个转移性结合点,认为这是 C3b 由液相结合到固相上的结构条件,也是 C3 以缓慢的速率水解导致其构象改变出现能与 B 因子具有亲和力的“变构”C3b 的分子基础。当 C3 转化酶从 C3α 链 N 端一个精氨酸 - 丝氨酸键(第 77-78 位)外将 C3 裂解后,可产生一个 9kDa 的小片段 C3a(释放到液相中去),其余部分为 C3b。同时,新生的 C3bα` 链内距 N 端 5kDa 的硫酯键断裂,在谷氨酰胺基上出现一个具有转酯作用的高度或多糖等分子中的羟基(R-OH)共价结合,形成新的酯键。同样,也可与靶细胞上的氨基形成酰键(-CONH-)。这样,新生的 C3b 便可结合于靶细胞表面,而其半胱氨酸则通过接受 1 个质子形成硫氢基(-SH),从而获得转移性。需要提及的是,上述形成的反应性酰基极不稳定,若在 60 秒内未同碳水化物发生转酯反应,则反应性酰基即与水分子反应形成羧基,从而使 C3b 失去共价结合的能力(图 5 -7)。一般细胞表面都有足够的糖类(常以糖蛋白、糖脂或多糖形式存在)因此新生 C3b 得以通过上述转酯作用而固定于细胞上(外来的或自身的)。通过上述转酯反应而获得结合活性的 C3b 可与 c
4b2a 结合形成经典途径的 C5 转化酶(C4b2a3b),或与 Bb 结合形成替代途径的 C3 转化酶(C3bBb)和 C5 转化酶(C 3bnBbC3b 也可在 H 因子和 I 因子的作用下,变为无活性的 C3bi,并再 I 因子裂解为 C3dg 和 C3c(图 5 -8)。C3d 可能是 C3 裂解的最终产物,只有在细菌或炎灶分解产物的作用下,才能裂解为 C3d 和 C3c。还报道有 C3e 片段,可能来源于 C3c。
C3 各个裂解片段的生物学活性不一。C3a 为过敏毒素,能直接作用于肥大细胞和嗜性粒细胞,使之释放组胺,引起血管扩张,通透性增加,平滑肌收缩及局部水肿。但其作用远较 C5a 弱。此外,C3a 还具有使吞噬细胞定向移动以促进吞噬的趋化作用,以及抑制特异抗体反应、非特异性多克隆反应和抑制白细胞移动抑制因子(LIF)产生的作用。C3b 的生物学活性烄广,概括起来有以下几个方面:(1)参与替代途径中两种 C3 转化酶[起始 C3 转化酶(C3bB)和放大 C3 转化酶(C3bBb)],以及两条途径中两种 C5 转化酶(C4b2a3b 和 C3bnBb)的形成;(2)启动替代激活途径中的正反馈放大回路;(3)调理促进吞噬及免疫粘连作用;(4)参与免疫调节,如作为 B 细胞活化的非特异性刺激信号,作为 B 细胞的致有丝分裂原促进 B 细胞增殖,与抗体协同增强 ADCC 作用和刺激单核细胞释放前列腺素 E(PGE),嵌入抗原、抗体复合物的网格结构中,使二者的结合键断裂从而是产生对可溶性免疫复合物的溶解作用等。C3bi 具有促进吞噬和与抗体协同增强 ADCC 反应的作用。C3c 和 C3dg 可的抑制抗原、有丝分裂原或同种异型抗原诱导的 T 细胞增殖,C3e 则可引起白细胞增多。
人的 C3 基因定位于第 19 号染色体,有两种常见的同种型 C3S 和 C3F。此外还有十余种少见型及罕见型,其中 C3F 与肾小球毛细血管性肾炎和部分脂质性营养不良有关。C3 遗传性缺陷少见,但如发生缺陷,则易引起反复化脓性和革兰氏阴性菌的感染。
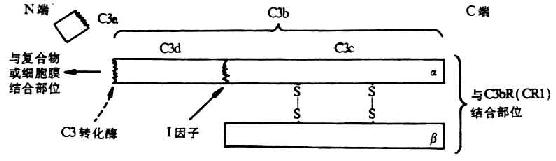
图 5 -6 C3 分子的结构(模式图)
五、C5 分子
C5 是形成膜攻击复合体(MAC)的第 1 个补体分子。C5 由以二硫键相连接的 α、β 链组成,分子量 190 kDa,其中 α 链为 115kDa,β 链为 75kDa(图 5 -9)。C5 与 C3 和 C4 的结构相类似,但没有链内硫酯键。靠近 N 端的第 74-75 位精氨酸一亮氨酸键为 C5 转化酶作用的部位。在 C5 转化酶的作用下,C5α 链 N 末端裂解出一个分子量为 11kDa 的小片段 C5a 进入液相中,其余部分为 110kDa 的大片段 C5b,仍结合在细胞膜表面。亲生的 C5b 在极短时间内能保持与 C6 结合的构象,可与 C6 非共价结合形成一牢固的 C5b6 复合物,并通过与 C3b 的可逆性结合而固定的细胞膜上。但 C5b 生成后其潜在的生物学活性存在时间非常短促,若无 C6 结合则迅速衰变为 C5bi。
C5b 只形成 MAC 参与细胞溶解效应,而 C5a 却具有广泛的生物学活性。概括起来有以下几方面:(1)过敏毒素作用:C5a 是具有过敏毒素作用的补体裂解片段中作用最强的介质,较 C3a 强 20 倍,较 C4a 强 2500 倍。此外,C5a 还可不依赖于肥大细胞释放组胺,即通过直接作用于血管内皮细胞而增加血管的通透性。(2)趋化作用:高浓度的 C5a 是中性粒细胞、嗜酸性粒细胞和单核细胞的趋化剂,可刺激这些细胞沿着浓度定向移动。值得注意的是,被血清羧肽酶 N 切 C5a C 端精氨酸残基而形成的去精 C5a 虽丧失了使肥大细胞分泌组胺的能力,但仍具有较强的趋化活性,是补体活化后产生趋化作用的主要因素。(3)促代谢作用:高浓度的 C5a 可刺激中性粒细胞和单核细胞的氧化代谢,提高其 cGMP 的水平,有利于促进溶酶体与细胞膜的融合,释放溶酶体酶。此外,C5a 还可刺激中性粒细胞粘附及增强其产生超氧化物。(4)免疫调节作用:近年体外研究表明,C5a 对免疫应答有明显增强作用,如可诱导单核细胞分泌 IL-1、IL-6、IL- 8 及 TNF- α 等细胞因子,促进抗原及同种异体抗原诱导的 T 细胞增殖及 B 细胞产生抗体等。C5a 的上述生物学活性的利于增强机体的防御机能,但由其导致的炎症反应也可造成对机体的损伤。编码入 C5 的基因定位于第 9 号染色体长臂 32-34 区。
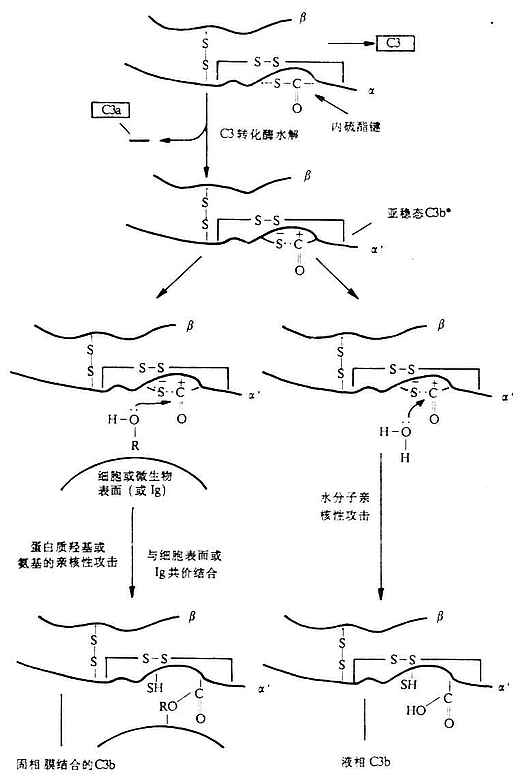
图 5 -7 C3b 的酯化反应(图解)
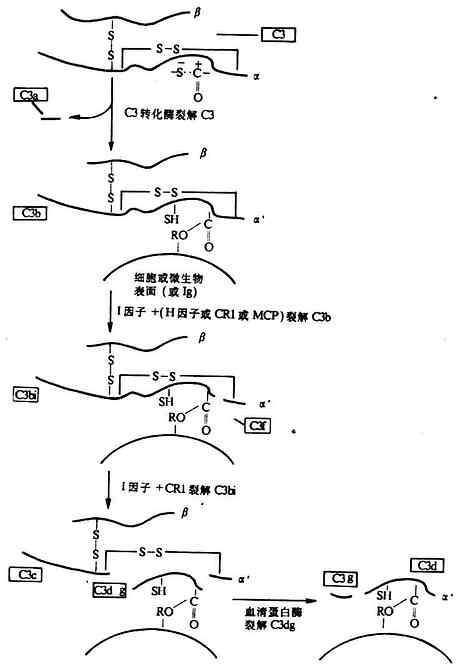
图 5 -8 C3 各种裂解片段的产生(图解)
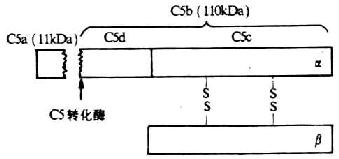
图 5 -9 C5 分子的结构(模式图)
六、C6 和 C7
C6 和 C7 有许多相似之处,均为单链糖蛋白,且分子量也相近分别为 128kDa 和 121kDa。编码 C6 和 C7 分子的基因可能由共同的祖基因进化而来。C6 和 C7 在氨基酸水平上有 33.5% 的同源性。近几年来,对 C6 的结构及功能进行了较深入的研究,由 cDNA 序列推导成熟 C6 的全部多肽链含有 913 个氨基残基,前面还有 21 个独特氨基酸残基组成的信号肽,其碳水化物的含量为 4 -6%。在肽链的第 303 位和 834 位氨基酸残基处,可能为两个天冬酰胺连接的糖基化部位。C6 中还含有大量的半胱氨酸残基(总数为 64 个),集中在多肽链的氨基末端和羧基末端部分,其中氨基末端的位置由半胱氨酸残基所占据。
C6 和 C7 中都含有低密度脂蛋白(LDL)受体结构功能域、EGF 前体结构功能域、Ⅰ型凝血敏感蛋白(TSP-1)结构功能域和 SCR 结构功能域,且排列方式相同。应用滤纸结合的 C6 片段进行研究表明,C6 与 C5b 的结合部位为由 2 个 SCR 和 2 个Ⅰ因子结构功能域(FIMs)所组成的大小为 34kDa 的羧基末端的片段。在 C6 和 C7 活化过程中,二者均无分子的裂解,推测可能是由于其分子构型的改变而成为具有结合活性的形式。C6 和 C5b 以非共价形式结合形成的 C5b6 复合物仍疏松的与 C3b 呈可逆性结合,且具有亲水性不能插入膜内。而一经与 C7 结合,即出现亲水 - 疏水两性转换,同时产生亚稳态膜结合部位。这样,c
5b67 便脱离 C3b 附着部位转移至膜表面,然后通过复合物中 C7 的疏水性紧紧固定在膜脂质双层中。疏水区的暴露系由于 C5b67 复合物的构象变化所致。但新生的亚稳态 C5b67 复合物仅有 100 毫秒的生存其,如不及时同膜结合,又可因复合物重排使疏小区折叠而失去膜结合活性。此外,无论液相或结合到膜上的 C5b67 复合物均可自行聚合而丧失其介导的溶细胞活性,但仍具有趋化作用。C6 和 C7 可能还有触发淋巴细胞母细胞化的作用,因在单相混合淋巴细胞反应(MLR)中,加入抗 C6 及 C7 的抗体 Fab 能抑制淋巴细胞增殖。
编码 C6 和 C7 和的基因定位于人的第 5 号染色体上且相连锁。C6 及 C7 均具有遗传多态性,编码 C6 的两个等位基因(C6A 和 C6B)已确定,东方人群中 C6B 的基因频率较高。C6 及 C7 的 cDNA 已克隆成功,发现它们与 C8 和 C9 具有一定的同源性。
七、C8 分子
C8 是由 α、β、γ 三条肽链组成的三聚体糖蛋白,分子量为 155kDa。其中 α 链和 β 链均为 64kDa,γ 链为 22kDa。α 链和 γ 链间以二硫键共价结合,而 α 链与 β 链间则为非共价键结合(图 5 -10)。C8 分子中也含有 TSP- 1 和 LDL 受体结构功能域。在 C8α 和 C8β 多肽链的中央(157-501 个氨基酸残基间),几科不含半胱氨酸残基,为与细胞毒性 T 细胞及 NK 细胞产生的穿孔蛋白(perforin)有同源性的结构功能域。在 α 和 β 链中含有极高比使的疏水性氨基酸。β 链分布在 C8 分子的表面,其与 C5b 的相互作用是极性的,并具有高度特异性。C8 与 C5b- 7 的结合部位为其 β 链。当 C8 与 c 5b- 7 结合后,通过 C8 分子的构象变化,使其 α 链插入膜脂质双层的烃核中,形成直径约 1.6nm 的空膜孔道,可使细胞同的离子缓缓流出,但不会导致细胞溶解。C5b- 8 复合物能促使 C9 的聚合但机理尚不清楚,可能是降低了 C9 聚合的活化能所致。另外研究表明,C9 是通过 C8 而同 c 5b- 8 结合的,因 C9 不能同 C5b- 7 相结合,而其同 C5b- 8 的结合则可被抗 C8 的抗体所抑制。
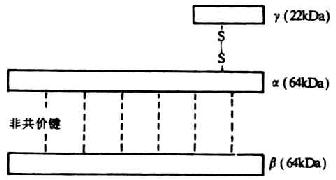
图 5 -10 C8 分子的结构(模式图)
C8 的基因定位较复杂,其中编码 α 链和 β 链的基因 C8A 和 C8B 定位于人的第 1 号染色体,而编码 γ 链的基因 C8G 则定位于第 9 号染色体的长臂。目前已对 C8β 链的 cDNA 克隆成功,并做了序列分析,发现其与 C9 具有高度的同源性,而且二者均含有丰富的半胱氨酸的膜嵌入区。C8 的 α 链和 β 链在遗传上也呈高度多态性,二者约有 33% 的氨基酸序列相同,而与 C7 和 C9 则约 25% 相同
八、C9 分子
C9 是形成膜攻击复合体(MAC)的最后个分子,为一单链糖蛋白,分子量 79kDa。经对 cDNA 推导的氨基酸序列分析发现,C9 为一两性分子。C 端 37kDa 由疏水性氨基酸组成称 C9b,N 端 34kDa 由亲水性氨基酸组成称 C9a 因此 C9 以其羧基端部分嵌入细胞膜的脂质双层中。而 N 端则为与 c 5b- 8 相结合的结构域。C9 具有自发聚合的作用,但聚合很慢,在 37℃下需 3 天才能完成,而在 C >5b- 8 的催化下,10 分钟内即可完成。由 12-16 个 C9 分子聚合形成的多聚体 C9,可形成内径 10nm、壁厚 2nm 的中空穿膜孔道嵌入膜内(图 5 -11)。孔道的内面由许多亲水性氨基酸残基和碳水化物组成,而与双层脂接触的管壁外面则是疏水性氨基酸残基。由于细胞内容物的外漏,最终可导致细胞溶解破坏。C9 分子的多肽链与 C8α 和 C8β 结构上相类似,也含有 TSP-1、LDL 受体前体结构功能域及与穿孔蛋白同源的结构功能域。由于 C9 和穿孔蛋白在结构和功能上均非常相似,推测二者可能具有共同的祖基因。编码入 C9 的基因定位于第 5 号染色体上,末发现 C9 有多态性。
九、B 因子
B 因子(factor B,Bf)替代激活途径中的重要成分,由 Blum 于 1959 年首先发现。B 因子为由 733 个氨基酸残基组成的单链糖蛋白(糖含量约 7%),分子量 93kDa。由于这些氨基酸的迂回折叠形成三个大小相近似的球形区。其中 1 个为 Ba,其余两个呈哑铃状为 Bb。Bb 中靠近 N 端的一个球形区可同 C3b 结合,另一个球形区可能是催化区(图 5 -12)。在 Mg2+存在的情况下,B 因子可与 C3b 结合形成 C3bB,被血清中的 D 因子裂解为分子量为 33kDa 的 Ba 和 63kDa 的 Bb 两个片段。后者 3 再与 C3b 结合形成替代途径的 C3 转化酶(c3bBb)和 C5 转化酶(C3bnBb)。两种酶中的 Bb 均具有丝氨酸蛋白酶活性,是裂解 C3 和 C5 的活性部位,但 C 3bBb 和 C 3bnBb 均不稳定,易衰变失去活性。
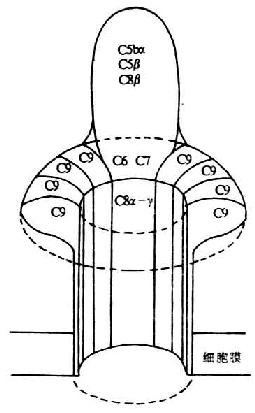
图 5 -11 膜攻击复合体(MAC)的结构(模式图)
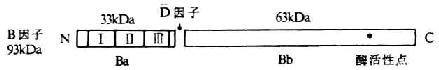
图 5 -12 B 因子的结构(模式图)
注Ⅰ、Ⅱ、Ⅲ为 3 个 SCR
近年研究发现,B 因子的两个裂解片段还具有免疫调节作用。其中 Bb 能促进经金黄色葡萄球菌 Cowan I 株(SAC)刺激活化的 B 细胞增殖,而 Ba 则对 B 细胞生长因子(BCGF)诱导的进入活化状态的 B 细胞增殖有明显抑制作用,且呈浓度依赖关系。B 因子和 C2 均属于补体超家族的成员,二者的编码基因紧密连锁。编码 B 因子的基因定位于人的第 6 号染色体短臂 21 区,基因长度 6kb,含 18 个外显子。
十、D 因子
D 因子是启动替代途径激活的重要成分,为由 222 个氨基酸残基组成的单链丝氨酸蛋白酶,分子量仅 25kDa。D 因子在血清中的浓度很低(1-2μg/ml),主要以活化形式而存在。但可能还有一种以酶原形式而存在的由 239 个氨基酸残基组成的 D 因子。具有活性的 D 因子(D)可能在第 234-235 位的精氨酸 - 赖氨酸键处将 B 因子裂解为 Ba 和 Bb 两个片段,从而启动替代途径的级联活化反应。D 因子的部分 cDNA 已克隆成功,并进行了序列分析,发现其与其它几种丝氨酸蛋白酶(如胰蛋白酶、糜蛋白酶、纤溶酶及弱性蛋白酶)具有同源性。
十一、P 因子
P 因子又称备解素(properdin),是替代途径中除 C3 以外最先发现的一种血浆蛋白。现已探明,P 因子以聚合体形式而存在:即三聚体(54%)、二聚体(26%)和四聚体(20%)都有,但特异活性的顺序依次为:四聚体 > 三聚体 > 二聚体。P 因子为由 4 条相同的肽链(分子量各 55kDa)组成的四聚体分子,链间以非共价键相连接,分子量为 220kDa。P 因子的生物学活性是以高亲和力与 c 3bBb 和 C 3bnBb 相结合,结合后通过发生构象改变而加固 C3b 与 Bb 间的结合力,从而可使其半衰期由 2 分钟延长至 26 分钟。另外,P 因子还可封闭 H 因子的抑制作用,更增加了上述两种酶的稳定性及活性,有利于促进替代途径级联反应的继续进行。因此,P 因子实际上是替代途径中的一个重要的正调节分子。因其常成为 c 3bBb 和 C3bnBb 复合物中的组成成分之一,故将其作为补体系统的固有成分在此一并描述。此外,在膜增生性肾小球肾炎病人血清中发现有一种 C3 肾炎因子(C3nephritic factor,C3NeF)实际为 C 3bBb 的自身抗体,也可与 C3bBb 结合而增加 c 3bnBb 的稳定性,使其半衰期处长 10-30 倍。
关于上述 14 种补体固有蛋白的特性及其生物学活性见表 5 -1。
表 5 -1 补体固有成分的特性及生物学活性
| 补体成分 | 血清浓度(μg/ml) | 分子量(kDa) | 亚单位(链)及分子量(kDa) | 激活产物 | 生物学活性 |
| C1q | 75 | 410 | A:24 各 6 条 | 识别 IgG、IgM Fc 的补体结合点 | |
| B:23 各 6 条 | |||||
| C:22 各 6 条 | |||||
| C1r | 50 | 85 | 1 条 | C1r | 丝氨酸蛋白酶,裂解 C1s |
| C1s | 50 | 85 | 1 条 | C1s | 丝氨酸蛋白酶,裂解 C4、C2 |
| C4 | 200-500 | 210 | α:90 | C4a | 弱的过敏毒素作用 |
| β:78 | |||||
| γ:33 | C4b | 组成 CP 中的 C3、C5 转化酶,促进吞噬、防止 IC 沉积、中和病毒、免疫识别及维持自身稳定等 | |||
| C2 | 20 | 110 | 1 条 | C2b | 不详 |
| C2a | 丝氨酸蛋白酶,组成 CP 中的 C3、C5 转化酶 | ||||
| C3 | 550-1200 | 195 | α:110 | C3a | 过敏毒素、趋化作用等 |
| β:85 | C3b | 组成 CP、AP 中的 C3、C5 转化酶,调理促吞噬、免疫粘附及免疫调节作用 | |||
| C5 | 70 | 190 | α:115 | C5a | 强的过敏毒素作用、趋化作用、 |
| β:75 | 促代谢作用及免疫调节作用 | ||||
| C5b | 形成 C5b67 复合物具有趋化作用 | ||||
| C6 | 60 | 128 | 1 条 | 组成 MAC,触发淋巴细胞母细胞化 | |
| C7 | 60 | 121 | 1 条 | 组成 MAC 的成分 | |
| C8 | 60 | 155 | α:64 | 组成 MAC 的成分,促进 C9 聚合 | |
| β:64 | |||||
| γ:22 | |||||
| C9 | 60 | 79 | 1 条 | 组成 MAC 并聚合形成跨膜孔道 | |
| B 因子 | 200 | 93 | 1 条 | Ba | 抑制人的 B 细胞增殖 |
| Bb | 丝氨酸蛋白酶,组成 AP 中的 C3、C5 转化酶 | ||||
| D 因子 | 1~2 | 25 | 1 条 | D | 丝氨酸蛋白酶,裂解 B 因子 |
| P 因子 | 25 | 220 | 4 条,各 55 | 稳定 AP 中的 C3、C5 转化酶 |
注:CP:红典激活途径;AP:替代激活途径;MAC:膜攻击复合体
第二节 补体调节分子的结构及功
补体系统的激活为一种级联反应,但受到多种调节分子的严格控制,其反应的程度和单一成分的反应都是在生物反馈近代制下而进行的,从而限制了活化的扩大化,以维持补体水平的平衡。调节作用包括两个方面,即自身衷变失活及一些抑制物的灭活作用。前者指已活化的补体分子均不稳定,如不及时与靶细胞膜结合即迅速衰变失活;后者是通过抑制物的作用而使已活化的分子失去活性。这一节中仅涉及后一个方面。
一、C1 抑制物
C1 抑制物(C1INH)是血清中高度糖基化的一种蛋白质,含糖量高达 35-49%。最初由 Ranoff 和 lepow(1957)所发现,称其为 C1 酯酶抑制剂,与引同时 Schultze 等则将其称为 α2 神经氨酸糖蛋白。C1INH 为一单链分子,由 478 个氨基酸残基组成,分子量为 104kDa,由 478 个氨基酸残基组成,分子量为 140kDa,链内有两对二硫键(图 5 -13)。C1INH 调节的主要方式是,与活化的 C1r 或 C1s 结合形成稳定的复合物而导致 C1 丝氨酸蛋白酶失活。其作用机理是,C1INH 通过提供一个酷似 C1r 或 C1s 的正常底物的序列为“锈铒”(“bait”),被 c 1r 或 C1s 裂解暴露出一个活性部位,然后再与 C1r 或 C1s 结合形成共价的酯键而发挥抑制作用。此外,C1INH 还可防止在缺乏抗体时,C1 以很低但仍有一定速率出现的自发激活。正常情况下,血液中的大多数 C1 可被 7 倍于其克分子浓度的 C1INH 所结合,以防止 C1 由于构象改变而引起的自发激活。但 C1 同抗原、抗体复合物的结合,可使 C1 从 C1INH 的抑制作用中而获释。除上述作用外,C1INH 还可抑制凝血因子Ⅻa、Ⅺa、激肽释放酶及纤溶酶,因而其在凝血、激肽和纤溶系统中也有重要的调节作用。
经对 C1INH cDNA 序列的分析发现,C1INH 与其它几种丝氨酸蛋白酶抑制物(serpin)超家族成员(α1 抗胰蛋白酶、α1 抗糜蛋白酶及抗凝血酶Ⅲ等)约有 30% 的氨基酸同源性,物别是在 C 端的 120 个氨基酸。C1INH 的编码基因定位于第 11 号染色体的短臂 11.2~长臂 13 亚区。C1INH 先天性缺陷时,可导致遗传性血管神经性水肿(hereditary angioneurotic edema,HAE)。近年报道应用 C1INH 浓缩剂防治 HAE 效果良好,但尚未广泛用于临床。
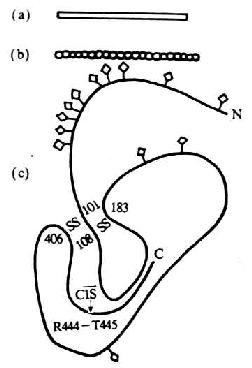
图 5 -13 C1 INH 分子的结构模式图
注:(a)为电镜观察模式图
(b)为中子散射模式图
(c)为园二色谱分析的二级结构模式图
二、C4 结合蛋白
C4 结合蛋白(C4bp)是一种含量丰富的可溶性血清糖蛋白,分子量为 550kDa,1977 年由 Ferreira 等所报道。其分子结构模式现多以 Dahlback 等(1983)描述的“蜘蛛样”(spiderlike)结构来分析其结构及功能。C4bp 由 8 个亚单位组成,电镜下观察形似蜘蛛,其中有 7 条分子量相同(均为 70kDa)的长链(α 链),由 549 个氨基酸残基组成,链间以二硫键相连结,并共同氨基酸残基组成,链间以二硫键相连结,并共同连结于一中心体。α 链含有 8 个 SCR,其 N 端是其头部,为与 C4b 相结合的部位,可能位于第 332-395 位氨基本酸残基。第 8 条链(β 链)较短(45kDa)由 235 个氨基酸残基组成,含有 4 个 SCR 为与蛋白 S(PS)相结合的部位(图 5 -14)。C4bp 以两种方式抑制补体的活化。第一种方式是,通过其与 C2 竞争 C4b,而从 c 4b2a 中取代 C2a,并通过其与 C4b 的结合而阴止剩余的 C2 同 C4b 结合,由此抑制 C3 转化酶的形成。C4bp 与 C4b 的结合能力与细胞表面 C4b 分子的数成正比,且较 C2 同 C4b 的结合能力高 27 倍。第二种方式是,C4bp 作为 I 因子的一种辅助因子,促进 I 因子对 C4b 的裂解。有 C4bp 存在时,I 因子可将 C4b 的 a` 链完全裂解;无 C4pb 时,I 因子的裂解作用不完全。其与 I 因子结合的活性部位位于第 177-322 位氨基酸残基区域。PS 与 C4pb 的第 8 条链(β 链)结合,不影响 C4bp 同 C4b 的结合,但可延长 C4bp 的半衷期,从而强化 C4bp 的抑制作用。
图 15-14 C4bp 的结构(模式图)
C4bp 基因定位于人的第 1 号染色体长臂 32 区,同 CR1、CR2、H 因子、MCP 及 DAF 等的基因相连锁,并均含有数目不同的 SCR。
三、促衰变因子(CD55)
促衰变因子(decayaccelerating factor,DAF)是 Nicholson-Weller 等(1981)用正丁醇提取后,再以层析法从人和豚鼠红细胞基质中纯化的一种膜蛋白。因其具有促进 C3 转化酶衷变的活性故名。经在还原条件下做 SDS-PAGE 并以过碘酸 -Schiff 试剂染色表明,纯化的 DAF 为单链膜糖蛋白。人和豚鼠的 DAF 分了量不同分别为 70kDa 和 60kDa。现已按白细胞分化抗原将其归为 CD55。Davitz 等(1986)通过用磷脂酰肌醇(PI)特异性的磷脂酶 C(PI-PLC)处理人外周血细胞可释放 DAF 的事实探明,DAF 是经糖磷脂酰肌醇(glycosylphodphatidylinositol,GPI)锚而固定于细胞膜中的。即糖蛋白的 C 末端共价结合于含 PI 的糖磷脂上,再经 PI 插入细胞膜脂质双层的外层小叶中。研究表明,膜 DAF 的迁移率接近于膜类脂的迁移率,比大多数膜蛋白迁移率高一个数量级。认为这有助于促进数目有限的膜 DAF 分子与细胞表面大量的 C3b 或 C4b 片段接触。另外 DAF 的糖磷脂酰肌醇结构还可能具有转导细胞信号的作用。
除 Nicholson-Weller 等证实的分子量为 70kDa 的膜 DAF 外,Kinoshita 等(1987)用 Western blotting 在人红细胞表面还检出分子量为 140kDa 的一种膜 DAF,称其为 DAF-2。DAF- 2 在膜上的数目不足 70kDa 膜 DAF 的 1 /10,但也有促进 C3b 转化酶衰变的活性,也含有 GPI 锚结构。由于 DAF- 2 的分子量较 70kDa 的膜 DAF 大一倍,提示其为膜 DAF 的二聚体,但用二巯基乙醇或以 SDS 使基变性,都不能将 DAF- 2 裂解成两个成分,故 DAF- 2 的精确结构仍有待进一步阐明。另外,近年应用两位点 RIA 测定法,在血浆、尿液、泪液、唾液、滑膜液和脑脊液,以及组织培养上清中均检出可溶性的 DAF(sDAF),水平的 40-400ng/ml 范围。并发现尿液中的 sDAF 分子量略低于红细胞上膜 DAF 的分子量,疏水性也较膜 DAF 小,其抑制细胞表面 C3 转化酶内在装配的活性较膜 DAF 约低 100 倍,但仍具有促进已形成的 C3 转化酶衰变的作用,效能类似于 C4bp。
膜 DAF 广泛分布于各种血细胞及其他各处的细胞上,包括红细胞、粒细胞、单核细胞、淋巴细胞(T、B)、血小板、骨髓单个核细胞、红细胞的始祖细胞,角膜、结合膜、消化道粘膜、外分泌腺、肾小管、膀胱、子宫粘膜、胞膜、心包及滑膜的上皮细胞,精子,以及培养的脐静脉内皮细胞上。但 NK 细胞上则缺如。阵发性血红蛋白尿(paroxysmal nocturnalhemohlobulinuria,PNH)病人的红细胞上也缺少 DAF,并以缺乏程度将该病分为三个型。PNH 病人的红细胞对补体介导的溶血作用高度敏感,就是由于红细胞上缺乏 DAF 及基它含 GPI 锚的分子而引起的。DAF 带有 Cromer 抗原。极少数称之为 Inaba 或 IFC 缺乏的 Cromer 相关抗原的个体也缺乏 DAF。
DAF 生物学活性及生理功能已虱到充分证实。它可保护宿主细胞免遭补体介导的溶解破坏。其作用机理是,DAF 不仅可阻止经典或替代途径 C3 和 C5 转化酶的装配,并且可通过诱导催化单位 C2a 或 Bb 的快速解离而使已形成的 C4、C5 转化酶失去稳定性,从而抑制补体攻击单位的活化(图 5 -15)。DAF 的这种抑制作用仅限于直接结合在细胞上的 C3、C5 转化酶,也即 DAF 不抑制靶细胞上正常的补体激活剂如微生物和免疫复合物。但 DAF 不能作为 I 因子裂解 C3b 和 C4b 的辅因子而发挥作用。另外,DAF 虽不能阻止 C2 和 B 因子(分别通过与 C4b 或 C3b 结合)与细胞的最初结合,但却可使 C2a 或 Bb 由它们结合的部位解离出来,以而阻止 C3 转化酶的装配。
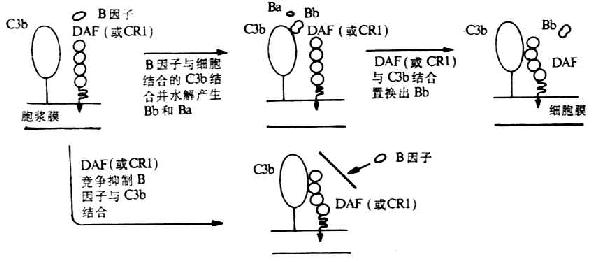
图 5 -15 DAF 抑制替代途径中 C3 转化酶形成的的机理
编码人 DAF 的基因位于第 1 号染色体的长臂上 32 区一个 800kb 片段内,与其它几种补体激活调节剂(RCA)的基因紧密连锁,排列顺序依次为:MCP-CR1-CR2-DAF-C4bp。其中 DAF 基因的长度约为 C4bp。其中 DAF 基因的长度约为 35kb,以限制性酶谱分析表明为一单拷贝基因。在 DAF 基因的非编码区还有 3 个限制性酶切片段长度多态性(RFLP)结构,两个为 HindⅢ酶切位点,1 个为 Bamh Ⅰ酶切位点。DAF 的 cDNA 已克隆成功,并进行了核苷酸和氨基酸序列分析。关于 DAf cDNA 和膜糖蛋白的结构见图 5 -16。DAF 的 cDNA 结构从 5` 端开始依次为:信号肽区、四个 SCR(长度 1143bp)、富含丝氨酸与苏氨酸(S/T)的区(约 70 个氨基酸)及疏水区,最后终止于 3` 端的 poly(A)。由 cDNA 推导的氨基酸序列得出 DAF 蛋白由 381 个氨基酸所组成,包括 34 个氨基酸的信号肽,富含 S / T 的区为 DAF 中大多数延伸的 O - 连接的糖基化部位。SCR 中有 1 上 N - 连接的的糖基化部位。C 末端的疏水区在翻译后被糖磷脂所取代,为 DAF 分子与细胞膜相结合的部位。
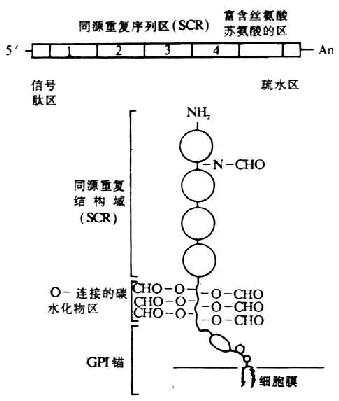
图 5 -16 DAF cDNA 和其膜糖蛋白的结构
四、膜辅蛋白(CD46)
膜辅蛋白(membranecofactor protein,MCP)由 Cole 等(1985)应用 C3b 亲和层析在外周血淋巴细胞上发现的一种膜蛋白。由于其奇特的电泳特征,起初被命名为 gp45-70,但进一步研究发现,它对 I 因子介导的对 C3b 和 C4b 的裂解有辅助活性,故更命为 MCP。鉴于 MCP 的多克隆抗体与促衷变因子(DAF)、H 因子或 CR1 均不起反应,从而认为它是补体系统的一种新的调节蛋白,在第四届国际白细胞分型讨论会上将其命名为 CD46。
MCP 为一单链穿膜糖蛋白,分子量 45-70kDa,属于 RCA 基因簇的成员。也通过 GPI 锚固定于细胞上。MCP 的细胞分布甚广,包括粒细胞、血小板、T 细胞(Th、Ts、Tc)、B 细胞、NK 细胞、造血细胞系、成纤维细胞、表皮细胞、内皮细胞及星状胶质细胞等。但不同类型的细胞上表达的数量有所不同。外周血单个核细胞和粒细胞为 1 万个 / 细胞,造血细胞系为 2 - 5 万个 / 细胞,Hela 和 Hep- 2 细胞分别为 10 万个 / 细胞和 25 万个 / 细胞。这种表达数量的差异,可能反映了 MCP 在正常细胞和肿瘤细胞上不同的分化和活化状态。另外,由于不同细胞上表达的 MCP 不同,因此可调节两条激活途径的 C3 转化酶形成。这一点尤其重要,因为 C3 慢速运转(tickover)的机制,能够连续不断的产生 C3b 与 C4b,有可能形成越来越多的 C3 转化酶。而由于大多数正常细胞上有高水平的 MCP,因此可保护正常细胞免遭补体介导的损伤。相反,许多异物颗粒和致病微生物则缺乏 MCP,这样沉积在它们表面的 C3b 便可得以保持其活化;且 C3b 与 B 因子结合的亲和力高于与 H 因子结合的亲和力,从而促进 c 3bBb 复合物的形成,导致在这些异物颗粒上补体有效地活化,最终将其破环清除。此外,细胞表面唾液酸的含量与其结合 H 因子和 B 因子的亲和力有关,唾液酸含量较高的细胞与 H 因子的结合亲和力超过与 B 因子的结合亲和力,唾液酸含量较低的细胞则与此相反。许多细菌表面涶液酸的含量低于哺乳类动物和人的细胞,因此侵入机体后易同 B 因子结合而导致补体替代途径的激活。
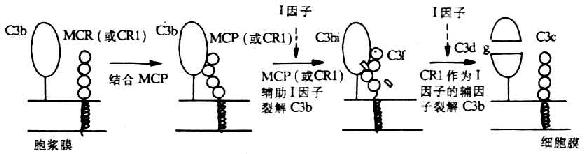
图 5 -17 MCP 辅助 I 因子裂解 C3b 的机理
MCP 作为一种补体调节蛋白具有重要的生物学功能。在低离子强度下,它可与 C3b 或 C3bi 结合,但较 CR1 的亲和力低。MCP 的主要功能是其辅因子活性。即可与 C3b 或 C4b 结合而促进 I 因子对 C3b 和 C4b 的裂解灭活(图 5 -17),从而保护自身宿主细胞免遭补体介导的溶解破环。有人将 MCP 的这种作用称为内源性辅因子活性。Seya 等还发现 MCP 具有增强 C3 转化酶的活性,尤其对替代途径的 C3 转化酶,但其生理意义尚不明了。CR1 和 H 因子也是具有辅因子活性的补体调节蛋白,但 H 因子的这一活性仅为 MCP 的 1 /50。
人 MCP 的基因定位于第 1 号染色体长臂 32 区,基因长度至少为 43kb,含有 14 个外显子和 13 个内含子。Seya 等用从 HSB-2T 细胞纯化获得的 MCP 氨基末端设计了一个 17mer 的反义寡核苷酸探针,以此从 U937 的 cDNA 文库中筛选到一条长 1.5kb 的 cDNA。经测序表明,该 cDNA 中含有一个 43bp 的 5` 端非编码区和一个编码 384 个氨基酸的开读框。其中前 34 个氨基酸为信号肽,后 350 个氨基酸为 MCP 的多肽链,分子量为 39kDa。在多肽链的前 250 个氨基酸中,含有 4 个相邻的 CSR。SCR 后为一段富含丝氨酸、苏氨酸和脯氨酸残基的 29 个氨基酸片段(可能是高度 O - 连接的 糖基化位点),再后依次为 13 个氨基酸的功能不明区、24 个氨基酸的跨膜区、105 个氨基酸的胞浆锚和 23 个氨基酸构成的胞浆尾部。大多数 MCCP 的变异局限在富含丝氨酸 / 苏氨酸(S/T)区和胞浆尾部。在核苷酸序列上 MCP 与 DAF 具有同源性。
五、H 因子
H 因子由 Nilson 等(1965)发现,根据电泳位将其命名为 β 1H,而 Whaley 和 Ruddy 则将其命名为 C3b 灭活剂加速因子。现已确定其为由 1213 个氨基酸组成的单链糖蛋白,分子量 155kDa,既有长杆状部分,也有球形区域。新近用透射电镜检查发现,H 因子的影象为一长而柔顺的分子。伸长型分子长 49.5nn,横截直径为 3.4mm 但大多数不呈线型而呈折叠状,因此分子的实际长度仅为伸展型的一半,但其构象则呈多样化。通过园二色谱分析表明,H 因子既无 α 螺旋也无 β 折叠,借二硫键维持其功能活性的构象。H 因子的功能包括以下几个方面:(1)为Ⅰ因子的辅助因子,可增加 C4b 对Ⅰ因子的敏感性。在无 H 因子时,Ⅰ因子与 C3b 的结合呈丝状;而在有 H 因子存在时,I 因子与 C3b 的结合变为弯丝状,同时与 C3b 的结合亲和力增强(较无 H 因子时至少高 15 倍)。H 因子强化 I 因子的机理,可能是 H 因子与 C3b 结合后,使 C3b 出现某些构象变化,增加了与 I 因子结合的亲和力。H 因子与 C3b 结合的活性部位存在于其 N 端 35kDa 部分。(2)加速 C3 转化酶的衷变:H 因子能将已同 C3b 结合的 B 因子或 Bb 从 C3 酶中逐出,而使之失去酶活性。(3)阻止替代途径中初始和放大 C3 转化酶的形成。已证实 H 因子和 B 因子在 C3b 上有同一结合部位,故 H 因子可同 B 因子或 Bb 竞争与 C3b 的结合。在有 H 因子存在时,B 因子不易与 C3(H2C)及 C3b 结合,因此不易形成 C3(H2C)Bb 或 C 3bBb。但 H 因子对固相上和液相中的 C3b 作用在差别。对液相中或结合于非激活剂固相上裂解。而对于固定到激活剂(如酵母多糖等)表面的 C3b,H 因子则对 C3b 的亲和力与 B 因子相当,二者竞争的结果,可形成部分 C3 转化酶,以保证替代途径的活化。有研究报道,在细胞膜上能增强 C3b 对 H 因子亲和力的化学成分是涎酸和肝素氨基多糖。由于大多数细菌表面缺乏涎酸,因而这些细菌侵入机体后,可活化替代途径,有助于在早期对感染的控制。(4)对已与 P 因子或肾炎因子(NeF)结合形成稳定的 c 3bBbP 或 C 3bBbNeF,H 因子对它们也有一定的作用,但其效力要比 CR1 差得多。H 因子对 C5 转化酶(c 3bnBb 或 C 3bBb3b)的活性也有抑制作用,并能与 C5 竞争结合 C3b 使 C5 不能裂解。此外,近年发现 H 因子还可诱导单核细胞分泌 IL- 1 参与免疫应答的调节。
编码 H 因子的基因定位于人的第 1 号染色体的长臂 32 区,具有多态性。已发现其有 5 个变异型,即 FH1-5。H 因子的核苷酸序列已进行了鉴定,并推导出其全部氨基酸的一级结构,含有 20 个 SCR 借此与 C3b 结合。H 因子与 MCP、CR1、CR2、DAF 及 C4bp 具有同源性,共同属于补体激活调节剂(RCA)基因家族的成员。
六、I 因子
I 因子(旧称 C3bINA)为异源二聚体血清蛋白,呈双球状结构,分子全长 13nm。其中小球(L 链)4.9nm,具有丝氨酸蛋白酶活性;大球(H 链)5.4nm 可与 C3b 结合。I 因子的分子量为 88kDa,重链 50kDa,轻链 38kDa,链间以二硫键相连接。I 因子的生物学活性是,在 C4bp、MCP、H 因子和 CR1 等辅助因子的协同下,将 C4b 裂解为 C4d 和 C4c; 使 C3b 裂解出 C3f 形成 C3bi, 后者再进一步裂解为 C3dg 和 C3c,由此而控制补体系统的活化。
编码入 I 因子的基因定位于第 4 号染色体上。经对 I 因子的 cDNA 序列分析发现,其轻链为丝氨蛋白酶的活性区,与糜蛋白酶、胰蛋白酶及弹性蛋白酶等有同源性。而其重链是具有富含半胱氨酸的功能区,与 C8、C9 和低密度脂蛋白受体等具有同源性。I 因子结构基因的突变,可导致先天性 I 因子缺陷,此类患 C3 的过度消耗面引起反复感染和血管性水肿。
七、过敏毒素灭活剂
过敏毒素灭活剂(AI)又称血清羧肽酶 N,分子量 310kDa,由 8 条相同的多肽链组成,每条分子量各 36kDa。AI 具有羧基肽酶的活性,可去除 C4a、C3a、和 C5a C 末端的精氨酸残基,使这些片段丧失其过敏毒素活性。
八、S 蛋白
S 蛋白(CP 或 S)为血清中一种 α 单链糖蛋白,分子量 83kDa。SP 的主要调节作用是可与 C5b~7 的亚稳态结合部位竞争靶细胞膜脂质,通过形成亲水性的 SPC5b~7(简写为 S5b~7)复合物,而使 C5b~7 失去膜结合活性。这样,便可保护补体活化部位邻近的细胞免遭偶然的攻击。这种亲水性的 SC5b~7 还可集资与 1 个分子的 C8 和 3 个分子的 C9 结合,分别形成 SC5b~8 和 C5b~(9)3 复合物,并 C9 聚合形成孔道,从而可保护补体活化部位邻近的细胞免于遭受补体的攻击而损伤。SP 与 C8 和 C9 的结合部位为这两种分子中富含半胱氨酸的功能功能区。电镜下观察,SC5b~(9)3 复合物呈一楔形结构,SP 位于楔形的宽部可掩盖补体蛋白的疏水区,从而封闭 MAC 的膜结合部位。此外,2~3 个分子的 SP 与 C5b~7 与 C5b~8 复合物的结合,还可使这些复合物易溶,出现亲水向疏水转换。SP 也参与凝血过程,通过干扰抗凝血酶Ⅲ对凝血酶的来活而保护凝血酶。
编码人 SP 基因定位于第 17 号染色体的长臂上,其 cDNA 已克隆成功。经过序列分析表明,其与具有细胞粘附作用的玻璃粘连蛋白(vitronectin)的序列完全相同,已证明二者属同一蛋白。
九、CD59
CD59 是近年(1989)才发现的一种分子量只有 18~20kDa 的膜性调节蛋白。由 Sugita 等(1988 年)首先描述,曾有不同的名称,如同种限制因子 20(homologous restriction factor-20), 保护素(protectin)及膜反应性溶破抑制物(membraneinhibitor of reactive lysis,MIRL)等。CD59 由 103 个氨基酸残基组成,含有单一的 N 端糖基化位点,其 C 端借 GPI 锚固定于细胞表面。CD59 分布甚广泛,已证明皮肤、肝、肾、胰、肺、唾腺、神经系统、胎盘以及各种血细胞(红细胞、淋巴细胞、中性粒细胞及血小板)和精子上均有表达。C59 的主要生理功能是,防止 MAC 对同种或自身细胞的溶解破坏,即同种限制作用(homologous species restriction,HSR)。作用机理为:通过其与 C7、C8 或 C9 的结合而阻止 MAC 组装。当其与 C5b~7 复合物结合后,可阻止其再与 C8 结合;当基与 C8 结合后,则可阻碍结合至 MAC 上的第 1 个 C9 分子的铺展,从而是阻止后继 C9 的结合;而当其与 MAC 中的 C9 结合后,又可阻止 C9 进一步分子的聚合。这样,在有 CD59 存在的情况下,在同种或自身细胞的表面便不能顺利地完成 MAC 的全部组装,或不能组装成 C5b~(9)n 复合物,从而限制了对同种或自身细胞的溶解作用。Rooney 等(1991)的报道表明,CD59 的这种同种限制作用的机理对保护子宫内的胎儿不被 MAC 的攻击也有作用。此外,CD59 还促进 T 细胞粘附与激活,维持精子在女性生殖道内的稳定性与活性,以及参与 PNH 发病机理的作用。
CD59 的 cDNA 已经克隆,并确定 CD59 的基因定位于人的第 11 号染色体短臂,其核苷酸序列与氨基酸序列相对应,并与小鼠的 CD59 有同源性。
十、SP40/40
自 1982 年起,生物科学技术文献中先后提出一批术语。后经鉴定它们都是蛋白质,且结构类同、功能相近,与补体的末端成分相关。这些成分有不同的名称:如 Clusterin、SGP-2、SP40/40、TRRM-2、T64、GP111、SP80、CLI、apo- J 和 NA1/NA2 等。Fritz 等建议用 Clusterin(暂译为群集素)来概括。
群集素的调节作用是在 SP40/40 这一同源体中发现的。SP40/40 是于 70 年代末首先在人精浆中发现的,继后在肾小球沉积的 IC、血液和 MAC 中也检出。并由于基常伴随末端补体复合物而存在,故认为其是末端补体复合物的成员之一。SP40/40 为血浆中的 α 糖蛋白,分子量 80kDa,由分子量均为 40kDa 的 α 和 β 亚单位所组成,所以称其为 SP40/40。现知 SP40/40 由 427 个氨基酸残基所组成,α 亚单位为 222 个氨基酸残基,β 亚单位为 205 个氨基酸残基。α 和 β 亚单位借 3 个二硫键相连接而构成一异二聚体。两个亚单位的氨基酸组成除甘氨酸外,其余均很相似,但氨基酸的序列则相差明显。人血浆中 SP40/40 的含量为 35~105μg/ml(平均 62μg/ml),但在人精浆中却可高达 15mg/ml,认为这与保护精子的活性有关。
SP40/40 是 MAC 组装的调节蛋白。它可与 C5b~7、C5b~8 或 C5b~9 结合,对 MAC 的组装起抑制作用,从而可防止 MAC 的溶细胞作用。此外 SP40/40 与 S 蛋白还具有协同作用,可使 MAC 变为可溶性的而失去溶细胞作用。现知 C8 与 SP40/40 的结合部位是 C8β、C9 与 SP40/40 的结合部位是 C9b。
十一、同种限制因子
同种限制因子(homologousrestriction factor,HRF),又称 C8 结合蛋白(C8bp)。为 Zalman 等(1986)用 C9-Sepharose 亲和层析从人红细胞膜上分离的一个能与 C8、C9 结合并参与 C9 阶段同种限制性的膜蛋白,通过 GPI 锚固定于细胞膜表面。新鲜红细胞膜上的 HRF 分子量为 65kDa,而在冷冻的陈旧性红细胞膜上则降解为 38kDa。HRF 存在于正常人的红细胞、中性粒细胞、单核细胞、淋巴细胞及血小板上。HRF 对反应性溶血作用的严格的种属限制性。如经抗 HPF 抗体处理的人红细胞对人 C8、C9 的反应性溶血作用敏感性增高,而对 8 种动物来源的 C8、C9 的反应性溶血作用则不敏感。体外试验表明,HRF 能抑制 C9 与 C8 的结合及 C9 聚合,从而阻止 MAC 插入自身细胞的膜脂质双层及细胞溶解。HRF 可能还与淋巴细胞杀(C9RP)介导的人大颗粒淋巴对羊红细胞和 PNH 患者红细胞的 ADCC 作用。
关于上述 11 种补体调节分子的特性及生物学活性见表 5 -2
表 5 -2 补体调节分子的特性及生物学活性
| 调节分子 | 分子量(kDa)(分子特征) | 血清浓度(μg/ml)或细胞分布 | 能特异性相互作用的分子 | 生物学活性 |
| 血清蛋白: | ||||
| C1INH | 104 | 200 | C1r,C1s | 与 C1r 和 C1s 共价结合使 C1 失活; |
| (serpin) | 与 C1 结合阻止其自发激活:抑制激肽释放酶、纤溶酶及凝血因子Ⅻa、Ⅺa | |||
| C4bp | 550(12 个 SCR) | 250 | C4b | 抑制 CP 中的 C3 转化酶形成;加速 CP 中的 C3、C5 转化酶衰变;作为 I 因子裂解 C4b 的辅助因子 |
| H 因子 | 155(20 个 SCR) | 480 | C3b | 作为 I 因子裂解 C3b 的辅助因子;加速 AP 中的 C3 转化酶衰变 |
| I 因子 | 88 | 35 | C4b,C3b | 在辅助因子协同下,裂解 C4b 和 C3b |
| AI | 31(羧肽酶 N) | 35 | C3a,C4a,C5a | 水解 C 末端精氨酸残基,灭活过敏毒素 |
| S 蛋白 | 83(Vitronectin) | 505 | C 5b~7 | 与 C 5b~7 结合形成 SC5b~7,使之失去膜结合活性 |
| SP40/40 | 80(异二聚体) | 50 | C5b~9 | 调控 MAC 的组装;保护精子活性 |
| 膜蛋白分子: | ||||
| MCP(CD46) | 40~70(4 个 SCR,GPI 锚) | 除红细胞外的血细胞、上皮细胞、内皮细胞 | C3b,C3b | 作为 I 因子裂解 C3b 和 C4b 的辅助因子 |
| DAF(CD55) | 70(4 个 SCR,GPI 锚) | 绝大多数血细胞、内皮细胞、粘膜上皮细胞 | C 4b2a,C 3bBb | 抑制 C3 转酶形成 促进 CP 和 AP 中的 C3 转化酶衰变 |
| HRF(C8bp) | 65(GPI 锚) | 红细胞、PMN、单核细胞、淋巴细胞、血小板 | C8、C9 | 抑制 C9 与 C8 结合及 C9 聚合;阻止 MAC 插入自身细胞膜 |
| CD59(MIRL) | 18~20(GPI 锚) | 红细胞、PMN、淋巴细胞、血小板 | C7,C8,C9 | 通过与 C7、C8 或 C9 结合而阻止 MAC 的组装,防止 MAC 溶解同种或自身细胞 |
第三节 补体受体的结构及功能
1930 年 Duke 和 Wallace 发现,被补体调理的结合到灵长类红细胞膜上的锥虫可产生免疫粘附现象。其后 Nelson(1953)报道,与红细胞或中性粒细胞的免疫粘附只需要激活 C3,而不需要激活具有溶解活性的补体末端成分,并将红细胞和中性粒细胞上具有免疫粘附作用的结构称为 CR1。以后又相继发现了另外 4 种 C3 受体,即 CR2(1973)、CR3(1979)、CR4(1984)和 CR5(1984)。另外,还有 4 种补体受体则是根据它们的补体配体特异性而命名的,即 C1q 受体(C1q-R.1975).C5a 的受体(C5a-R,1978)、C3a 的受体(C3a-R,1979)和 H 因子的受体(fH-R,1980)等。
目前认为,补体受体是细胞表面的重要膜结构。补体系统激活的级联反应产生的多种生物学效应,诸如调理促吞噬作用、免疫调控作用、粘附作用、清除 IC 及炎症作用等,都是通过补受体而介导的。各种补体受体的细胞分布不尽相同,但其主要作用不外是识别配体、传导信号和诱导细胞应答等。
一、C1q 受体
应用 C1q- 琼脂糖亲和层析由类淋巴母细胞和髓样细胞膜分离的 C1q 受体(C1q-R)为一种类似 65kDa 的糖蛋白,具有非共价结合的蛋白聚糖成分。也可能还有 CD43 参与,从而构成一个多单位的糖蛋白复合体。由于各种细胞上表达的 C1q- R 具有类似的结合亲和力和与抗游离 C1q 抗体有共同的反应性,表明不同细胞上表达的 C1q- R 结构类似。C1q- R 的某些肽段含有与 RO/SSA(一种核糖核蛋白自身抗原)、舒网素、小鼠 B50 黑素瘤抗原、大鼠 425 蛋白等相似的序列,表明它们属于同一蛋白超家族。表达 C1q- R 的细胞类型 B 细胞及其母细胞株、NK 细胞、单核 - 巨噬细胞、中性粒细胞、嗜酸性粒细胞、内皮细胞、成纤维细胞及血小板等。最近报道,外周血 T 细胞及 Molt 4 T 淋巴细胞株也表达 C1q-R。C1q- R 的天然配体为 C1q,C1q 与 C1q- R 的相互作用具有特异性、可饱和性、可逆性及亲和性等特点。由于单独的 C1q 分子对 C1q- R 的亲和力很低,因此 C1q- R 常优先与免疫复合物(IC)结合的 C1q 相结合。C1q- R 的功能主要有两方面:(1)免疫调节作用:C1q- R 具有多种免疫增进作用,如促进 B 细胞产生 Ig,促进吞噬细胞的 ADCC 效应及对 IgC 或 C3bn/C4b 包被颗粒的吞噬作用。通过鲁米诺化学发光法和检测磷酸已糖旁路的活化表明,刺激中性粒细胞的 C1q- R 可激发呼吸爆发,刺激内皮细胞的氧化代谢,促进 IC 的沉积与清除等。(2)调节血小板的功能:已证明游离的 C1q 与血小板上 C1q- R 相互作用可抑制胶原诱导的血小板聚集与释放反应,而结合于 IC 上成簇的 C1q 则可模拟胶原的作用,诱导血小板聚集和释放 5 -HT。此外,C1q- R 与其配体的相互作用,还可刺激成纤维细胞趋化、DNA 合成导致其增生。因此认为,在损伤愈合和组织再生中,C1q- R 也可能起着重要作用。C1q- R 复合体中的 CD43 可能起传导信号的作用。在促进过氧化物产生、增强吞噬作用和对不易吞噬的微生物的细胞毒作用中,C1q 与中性粒细胞、单核 - 巨噬细胞和嗜酸性粒细胞上的 FcR 也可协同而发挥作用。
二、I 型补体受体(CD35)
I 型补体受体(CR1、C3b/ C 受体,又称 CD35)为单链穿膜糖蛋白,分子量 160-260kDa。CRI 有四种同种异型,其分子量与基因频率分别为,A:190kDa(0.83)、B:220kDa(0.16)、C:160kDa(0.01)和 D:260kDa(0.002),但它们的功能相同。CR1 广泛分布于红细胞、粒细胞、单核细胞、肥大细胞、滤泡树突状细胞、肾小球足突细胞、B 细胞及部分 CD4+ T 细胞。CR1 的配体为 C3b/C4b(高亲和力)及 C3bi/C3c(低亲和力)。其主要功能有:(1)作为调理素受体,增强吞噬细胞对 C3b/C4b 包被颗粒及微生物的吞噬作用,以及对较小 IC 的内吞;(2)为 I 因子的辅助因子之一,协同 I 因子裂解 C3b 和 C4b,抑制 C3 转化酶与 C5 转化酶的活性并促使其降解;(3)通过红细胞的 CR1 运送 IC 至肝脏等处经 I 因子裂解 C3b,使 IC 与红细胞解离,再被单核细胞所清除;(4)为 B 细胞激活的调节剂。当 CR1 被含多个配体的 IC 交联时可激活 B 细胞,反之则产生抑制效应。并发现 C1q- R 与 CR1 在激活 B 细胞产生 Ig 的过程中有协同作用。有人认为 CR1 可通过将带有 C3b 或 C3bi 的抗原附着于 B 细胞表面而促进对抗原的识别。此外,CR 还有促进 NK 细胞杀伤结合 CR1(sCR1),存在于血浆中,正常值为 13-81ng/ml。关于 sCR1 的来源,发现体外培养的中性粒细胞、单核细胞和淋巴细胞上清中有 sCR1;将人的外周血白细胞移入严重免疫缺陷(SCID)小鼠体内后在其血清中也可检出 sCR1,表明转移的白细胞可以合成 sCR1。另外,通过以 sCR1cDNA 转染的 COS 细胞既可表达膜 CR1,也可分泌 sCR1,且与膜 sCR1 的分子量相同,说明 sCR1 由细胞分泌产生。血液中 sCR1 的水平与某此疾病具有一定的关联。发现 sCR1 水平升高与机体重要脏器的功能损害相平行,如晚期肾功衰竭和肝硬化的病人血液中 sCR1 的水平明显高于正常人,但经肾移植或肝移植后 sCR1 的水平可明显下降,甚至可降至正常水平。因此测定血中 sCR1 的水平对了解某些疾病的病情和判定治疗反应可能具有一定的意义。
sCR1 的基因位于人的第 1 号染色体长臂 32 区,属于 RCA 家族中的成员。经对 CR1N 端的 cDNA 分析表明,CR1 多肽结构有 3 - 5 个连接的蛋白片段,它们的内部序列有高度的同源性,称为长同源重复序列(long homologous repeat,LHR)。每个 CR1 的 LHR 在数目上的同种异型变异性,说明不同个体的 CR1 在大小有很大差别。此外,每个 LHR 由 7 个 SCR 组成。CR1 最常见的形式有 32 个 SCR,其中 28 个排列成 4 个 LHR。每一个 LHR 的第 2 个 SCR 内具有同 C3b/C4b 相结合的部位。
三、Ⅱ型补体受体(CD21)
Ⅱ型补体受体(CR2)按白细胞分化抗原归类为 CD21。CD2 为分子量 140kDa 的单链糖蛋白,主要分布于 B 细胞、单核细胞、某些 T 细胞、咽上皮细胞及淋巴结滤泡树突状细胞上。其配体 C3bg、C3d 和 C3bi 中的 C3d 部分。CR2 也是 EB 病毒的受体,CR2 与 C3d 结合的部位和同 EB 病毒结合的部位相距甚远。另外,最近报道 CR2 还可与 IFN- α 结合。CR2 主要功能是对 B 细胞的分化、增殖、记忆和 Ig 产生起重要的调节作用。如 B 细胞表面交联的 C3d 为 B 细胞由 G1 其进入到 S 期提供了活化信号,可取代单核因子的作用,而可溶性 C3d 则可通过与 CR2 结合而阻止 B 细胞化分。带有 C3 片段的 IC 可经 CR2 定位于生发中心激活记忆性 B 细胞。另外,多克隆和单克隆 CR2 的 F(ab`)2片段、C3bg- 琼脂糖和 EB 病毒都能通过与 CR2 结合而引起 B 细胞活化。应用抗 IgM 抗体刺激 B 细胞可导致 CR2 磷酸化。而 EB 病毒则可借 CR2 感染 B 细胞(感染性单核细胞增多)或使 B 细胞或上皮细胞恶性转化,引起伯基特淋巴瘤或鼻咽癌。
CR2 的基因定位于人第 1 号染色体上的长臂 32 区,也属于 RCA 家族成员。以 cDNA 探针的分子杂交研究表明,CR2 与 CR1 的 cDNA 顺序有高度的同源性(包括 20 个氨基酸的信号肽、954 个氨基酸的胞膜外区,24 个氨基酸的穿膜区和 34 个氨基酸的胞浆区),以致 CR1 的一些 cDNA 探针,也可同 CR2 基因杂交。氨基酸序列分析表明,CR2 也具有与 CR1 同样类型的 SCR(15~16 个)。
四、Ⅲ型补体受体(CD11b/CD18)
Ⅲ型补体受体(CR3)为由 α、β 两条肽链以非共价键结合而构成的异二聚体糖蛋白,分子量分别为 165kDa 和 95kDa。CR3 属于粘附分子整合素(integrin)家族中的成员,与淋巴细胞功能相关抗原 -1(LFA-1)和 CR4 的结构极为相似,三者的 β 链完全相同(命名为 CD18),而 α 链则各不相同:LFA- 1 为 CD11a、CR3 为 CD11b、CD4 为 CD11c,故 CR3 又称为 CD11b/CD18 分子。CR3 作为整合素家族中的成员,在炎症反应中可介导中性粒细胞粘附于内皮细胞。在体外某些情况下,CR3 还可表达能同胶原蛋白、ICAM- 1 和血纤维蛋白原相结合的部位。经 C5a 刺激的吞噬细胞表达 CR3 和 CR4 可轻度增多,这有助于中性粒细胞粘附于血管内皮成为有粘附性细胞,由血管中游出至炎症部位。感染部位的 CR3 可将吞噬细胞连接到带有 C3bi 和 / 或 β 葡聚糖或 LPS 的细菌或酵母菌上,促进吞噬作用和呼吸爆发。另外,由于 CR3 最初是通过用 Mac- 1 单克隆抗体的白细胞上发现的,因而也称其为 Mac- 1 抗原。CR3 和 CR4 对固相的 C3bi 具有相似的结合特异性,二者均需要有二价的阳离子参与,并均可被 EDTA 所抑制。与 CD4 不同的是,CR3 还具有能与细菌 LPS 和酵母菌细胞壁上 β 葡聚糖相结合的部位,也需 2 价阳离子参与。CR3 分布于中性粒细胞、单核 - 巨噬细胞、嗜酸性粒细胞、NK 细胞及细胞毒性 T 细胞和 B 细胞,其配体为 C3bi。CR3 的主要生物学活性是细胞粘附作用。它可促使效应细胞与靶细胞之间的密切接触增强吞噬作用,因而在抗感染免疫中具有重要作用。CR3 的缺陷可出现反复细菌性感染。另外,CR3 可能还是 HIV- 1 感染细胞的入口之一,并可与 β 葡聚糖结合、激活补体,以及与大肠杆菌、鼠伤寒沙门氏菌、LPS 及脂质 A 等结合。因此,CR3 似乎是一种可结合多种配体的分子。CR3 的 α 链和 β 链由不同染色体上的基因所编码。合成后在细胞膜装配成完整的 CR3。遗传性 CR3 和 CR4 缺陷的病人,是因为编码它们共同 β 链的基因有缺陷,但在细胞浆中仍可检出正常 α 链的前体。
五、Ⅳ型补体受体
Ⅳ型补体受体(CR4)、又称 CD11c/CD18,或 P150,95,也是由 α、β 两条肽链借非共价键而结合的异二聚体糖蛋白,α 链的分子量为 150kDa,β 链与 CD3 的 β 甸相同为 95kDa.CR4 主要分布于中性粒细胞、单核细胞、巨噬细胞和血小板上,其配体为 C3bi 和 C3bg。CR4 的功能是增强 Fc 受体介导的吞噬作用,但也可介导 Fc 受体非信赖性吞噬作用。在组织巨噬细胞上 CR4 呈优势表达,而只表达少量的 CR1 和 CR3。吞噬细胞上表达的 CR3 和 CR4 分子,它们与细胞骨架的连接有别,这可调节两种受体介导颗粒附着与吞噬作用的能力。由于 CR3 受细胞骨架连接的限制较小,因此 CR3 的游动性较 CR4 大。这样便可使数量相对较少的 CR3 很快集聚在与 C3bi 包被颗粒相接触的部位,促使这些颗粒附着于巨噬细胞膜上。通过 CR3 将 C3bi 包被的颗粒捕获在吞噬细胞膜表面后,此时游动性较小但数量较多的 CR4 便可与 C3bi 包被的颗粒结合并促进吞噬作用。
编码 CR4α 链和 β 链基因分别定于第 16 号和第 21 号染色体上。经序列分析表明,CR4 与 CR3 的 α 链有 87% 的同源性。
六、Ⅴ型补体受体
Ⅴ型补体受体受体(CR5)中 C3bi 中的 C3d 部分、C3dg 和 C3d 片段的特性受体,但只能与液相中的上述片段起反应。CR5 的生物学活性是通过125 I 标记的液相 C3dg 二聚体而被确定的。未标记的 C3bi、C3dg 与 C3d 对125 I 标记的 C3dg 二聚体的结合有竞争性抑制作用,而 C3b 则无此作用。曾认为中性粒细胞上的 C3dg 二聚体受体与该细胞上的红细胞 -C3dg 花环形成受体为同一受体,因此将其称为 CR4。后来研究表明,能形成花环的受体活性在几种特性上与 C3dg 二聚体受体不同,如 CR4 与固定的 C3bi 的结合可被 EDTA 阻断,面 EDTA 对 C3dg 二聚体的摄取则无影响。因此将 C3dg 二聚体受体命名为 CR5。除中性粒细胞外,在血小板上也已鉴定有 CR5 的活性。
七、H 因子受体
本节暂缺,如果您能帮助寻找,请与管理员联系,谢谢。
八、C3a、C4a 和 C5a 受体
本节暂缺,如果您能帮助寻找,请与管理员联系,谢谢。
第四节 补体的结构及遗传学特征
近年来,补体的分子生物学进展迅猛,对补体系统的活化机理和功能得到了分子水平的解释。各种补体分子的 cDNA 已克隆成功,绝大多数补体蛋白的基因在染色体上的定位已被确定,并通过对它们的核苷酸序列和氨基酸序列的分析,发现许多补体蛋白的基因在染色体上相连锁,在结构上具有共同性。
一、补体蛋白结构的共同性
通过对补体系统的蛋白结构进一步探查,表现了一些颇具特色的结构功能域(module),并根据它们在氨基酸序列上的同源性,将它们归为几个不同的蛋白家族。同一家族中的各个成员通常具有相类似的结构和功能。此外,根据不同补体蛋白基因间的同源性,提示每个家族的成员可能是由一个共同的祖基因复制而来,出现结构上的多样性,进而使各种补体蛋白又具有各自特定的功能。
(一)C1q 与其相关的分子
C1q 与其相关的分子:甘露糖结合蛋白(mannose-binding protein,MBP)、肺表面活性物质脱辅基蛋白 A 和 D(surfactantprotein A and D,SP-A,SP-D)、类风湿因子(RF)和胶固素(conglutinin)等,为具有以胶原样蛋白和凝集素区结构为特征的一组蛋白。因此有人将 collagen 与 lectin 两字缩合,归纳称为“collectin”(可暂译为胶凝素)。这些相关分子均能以抗体依赖或非依赖的方式被激活,再激活补体系统,或具有结合 C1q- R 的能力,从而模拟和放大 C1q 的功能作用。
(二)丝氨酸蛋白酶补体分子
在补体固有成分和调节蛋白中,共有 6 个丝氨酸蛋白酶(原)。即:C1r、Cls、C2、B 因子(Bf)、D 因子和 I 因子。它们除彼此在氨基酸序列上有同源性外,还与非补体性丝氨酸蛋白酶(如胰蛋白酶和糜蛋白酶)高度同源。但 C2 和 Bf 的催化部位比常见的丝氨酸蛋白酶约多 210 个氨基酸残基。在 6 个补体性丝氨酸蛋白酶中,C1r 和 C1s,C2 和 Bf 又具有更大的相似性。
C1r 和 C1s 均为单链长形结构,两端呈球形似哑铃状,分子量均为 85kDa。二者除在 C 端有共同的丝氨酸蛋白酶结构功能域外,其 N 端有约 450 个氨基酸彼此同源。均含有 2 个拷贝的 SCR 和 1 个拷贝的 EGF 前体结构功能域(图 5 -18)。
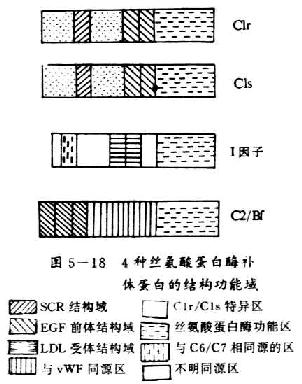
图 5 -18 4 种丝氨酸蛋白酶补体蛋白的结构功能域
C2 和 Bf 均为单肽链糖蛋白,它们除在形成两条补体激活途径中和 C3 转化酶方面十分相似外,在合成部位、合成途径、分子大小、亚单位结构、半胱氨酸位置及数目,以及保守残基替代及活性部位等方面也有很大的相似性(表 5 -4)。C2 和 Bf 分子中相同的结构功能域是均有 3 个 CSR、1 个与 von Willebrand 因子(vWF)共同的氨基酸序列和 1 个丝氨酸蛋白酶结构功能域。
表 5 -4 C2 与 Bf 的特性比较
| C2 | Bf | |
| 分子量 | 110kDa | 93kDa |
| C2a:75kDa | Bb:63kDa | |
| C2b:35kDa | Ba:35kDa | |
| 血清含量 | ~15mg/L | 150~200mg/L |
| 相得益彰活性部位 | C 端侧(C2a) | C 端侧(Bb) |
| 氨基酸 | 723 | 733 |
| C2a:509 | Bb:505 | |
| C2b:234 | Ba:234 | |
| 电镜形态 | 3 个球状结构 | 3 个球状结构 |
| mRNA | 2.9kb | 2.6kb |
| 基因长度 | 18kb | 6kb |
| 3 个 SCR | 1~65,66~127,128~186 | 4~74,75~136,137~194 |
| 形成的 C3 转化酶 | C42a | C3bBb |
(三)末端补体分子
末端补体分子 C6,C7,C8 和 C9 是构成膜攻击复合体(MAC)引起靶细胞溶解破坏的重要组成成分。功能上的相似性反映了它们结构上的共同性。均具有 420kDa 的 I 型凝血敏感蛋白重复序列(thrombospondin type Irepeat,TSP-1),而且与 TSP- 1 特有的 β 片层、和 β 螺旋结构的立体配体也是类似的。此种结构单位也存在于备解素(properdin)和疟原虫的羧箕末端。除 TSP- 1 外,它们还具有 1 个拷贝的低密度脂蛋白受体结构功能域(low density lipoprotein receptor module,LDL-R),1 个表皮生长因子前体结构功能域(EGf precusor module)。在肽链的中央还有 1 个半胱酸贫乏区与细胞毒性细胞和 NK 细胞释放的 perforin 的结构具有相似性(图 5 -19)。其中 C6 和 C7 具有更大的同源性。二者除上述的结构功能域外,在 C 端还存在着富含半胱氨酸的重复序列,即为 2 个 CSR 和 2 个与 I 因子重链中有一个区具有同源性的结构功能域(factor I module,FIM)。二者的分子量也相近似,分别为 128kDa 和 121kDa。显著的差别仅仅是 C6 的 N 端多 1 个由 59 个氨基酸组成的 TSP-1。
图 5 -19 末端补体分子的结构功能域
(四)具有 SCR 的 6 种补体调节蛋白
补体活化调节蛋白(requlatorof complement activation,RCA)包括:CR1、CR2、H 因子、C4bp、DAF 和 MCP。它们共同的结构特征是均具有多个类似的短同源重复序列(SCR)。SCR 也称 Shushi 单位。一个 SCR 约由 60-70 个氨基酸残基所组成,大小为 4.5nm。SCR 之间有 20-40% 的同源性。所有的 SCR 均具有固定的保守骨架序列(其中有 4 个半胱氨酸形成两个二硫键),并与脯氨酸、色氨酸、酪氨酸 / 丙氨酸、甘氨酸相维系而形成一独特的结构单位(图 5 -20)。这一结构单位在 CR1 中有 32 个,CR2 中有 15-16 个,H 因子中有 20 个,C4b 中有 12 个,DAF 和 MCP 中各有 4 个,而且是构成这些补体蛋白肽甸的主要结构。SCR 在 RCA 中的功能是与 C3、C4 和 C5 结合,发挥其调节作用。在前述的 C1r、Cls、C2、Bf、C6 和 C7 中也含有几种非补体性蛋白如 IL-2R、β2 糖蛋白 1(β2-1)、内皮细胞 - 白细胞粘附分子 -1(ELAM-1)、淋巴细胞的归位受体和凝血因子Ⅻ的 b 亚单位中也含有 SCR,但其意义不详。值得注意的是,牛痘病毒具有 SCR 的编码 DNA,且与 C4bp 的 SCR 相类似,可逃避补体经典途径对其发挥作用。
图 5 -20 SCR 的结构(模式图)
注:(A)SCR 结构;有 44% 的 SCR 是保守的,
包括形成链内二硫键的 4 个半胱氨酸
(B)具有重迭链内二硫键(……)的 SCR
此外,在补体的膜性调节分子中,DAF、MCP、C8bp 和 CD59 四种分子者是以糖基磷酯酰肌醇锚(GPI)而固定在细胞膜上的。锚的核心结构是:protein-CO-NH-CH2-PO4-6-man-α1,2-man-α1,6-man-α1,4-G1CN–α1,6MYO-inositol-1-PO4-Lipid。此种结构还存在于多种非补体蛋白中,如碱性磷酸酶、乙酰胆碱酯酶、Thy- 1 及布氏锥虫的变异体表面糖蛋白等。补体蛋白 DAF、MCP、CD59 和 C8bp(HRF)可借助于这样的结构而使补体对自身细胞的损伤减至最小。这就是近日逐渐阐明的补体同源限制性(homologous restriction)。阵发性血红蛋白尿(PNH)之所以对补体攻击敏感,正是由于其红细胞膜上缺乏含有 GPI 锚的分子,因而使机体的正常同源限制性作用失去效能所致。
二、补体的遗传学特征
补体的遗传学特征学特征表现为多种补体分子具有遗传的多态性在染色体上密切连锁的,形成不同的基因家族。
(一)补体的遗传多态性
补体的遗传多态性(geneticpolymorphism)是指在同一集团中,两个或两个以上非连续性突变体或基因型(称型态),以极小的频率有规律地同时发生的现象。补体成分的多态性是 Alpert 和 Propp 1986 年在人的 C3 中首次发现的。此后,已从基因型和表型水平获得有关不同种内补体缺陷与补体多态性的知识,并从四个水平研究了补体的多态性:①通过对血清中天然补体成分同种型的分析(表型水平);②通过确定它们的亚单位组成(亚表型水平);③通过建立群体遗传学和形式遗传学(即同种异型的频率和各个基因 / 等位基因的频率与分离);④通过对它们 DNA 结构的定位和测序,提示限制性片段长度多态性(restriction fragment lenght polymorphism, RFLP)。已发现许多补体分子具有多态性,其中以 C2、Bf、C4、C3 和 C6 最为显著(表 5 -5)。
(二)定位于第 1 号染色体长臂 32 区的 RCA 基因簇
这一基因簇包括:CR1、CR2、H 因子、C4bp、DAF 和 MCP 的基因。由于这一紧密连锁的基因簇调控着补体系统的活性,因此可以得出下面的结论:基因的连锁是维持密切相关功能的进化的现象。变异体的罕见可能是进行选择的有利条件,或有时是一种致病的因子。例如,所有罕见等位基因 CR1※C 的携带者,均均患 SLE。其他可能的关联尚待阐明。
(三)定位于第 5 号染色体上的 MAC 补体基因簇
最近确定在 5 号染色体的短臂存在着补本末端成分 C6、C7 和 C9 的基因簇,并发现 C6 和 C7 的基因通常是紧密连锁着的,证据主要来自一个 C6/C7 联合缺陷的病例。C6 缺陷者与反复发作的脑膜炎奈瑟氏菌的感染有很强的相关性。某些 C7 缺陷的个体也易感染奈瑟氏菌。其余个体则是健康的。惊奇的是所有 C9 缺陷的个体(1 便除外)似乎都健康。这些现象说明,在 MAC 补体分子中,包括定位于其他染色体的基因编码的 C8 在内,存在着某种程度的互补性。即一种补体分子的缺陷,可补其他末端补体分子的功能所补偿。C8 的 3 个亚单位(α、β 和 γ)分别为第 1 号染色体上的 C8A、CIB 基因和定位于第 9 号染色体长臂的基因 C8G 的产物。
表 5 -5 补体成分的多态性与染色体定位
| 名 称 | 等位基因总数 | 补体缺陷 | 染色体定位 |
| C1q | – | + | 1p34.1~36.1 |
| C1r,C1s | >5 | + | 13p13 |
| C2 | <10 | + | 6p21 |
| Bf | >20 | 部分 | 6p21 |
| C4 | >30 | + | 6p21 |
| C3 | >30 | + | 19 |
| C5 | 2 | + | 9q32 |
| C6 | >20 | + | 5p |
| C7 | <5 | + | 5p |
| C9 | ? | – | 5p |
| C8α,β | <10 | + | 1 |
| C8γ | 9q | ||
| I 因子 | <5 | + | 4 |
| H 因子 | <5 | + | 1q32 |
| DAF | 1q32 | ||
| MCP | 1q32 | ||
| C4bp | <5 | – | 1q32 |
| CR1 | <5 | + | 1q32 |
| CR2 | 1q32 | ||
| CR4,α,β | + | 16,21 | |
| CD59 | 11p | ||
| C1INH | + | 12p11.2 | |
| s 蛋白 | 27q |
注:表中缺项者为尚末见报道。
(四)定位于第 6 号染色体短臂 21.3 区的 MHC Ⅲ类基因
已有许多证据表明,C2、C4 和 Bf 由位于 MHC I、Ⅲ类基因间一段长 80kb 的 DNA 所编码。C2 和 Bf 基因的 500kb 之中有一部分相重合。C4 由 2 个紧密连锁的位点上的基因 C4A(22kb)和 C4B(16kb)所编码。纯合性的 Bf 缺陷尚末见报道,但偶可见一纯合性 C4 和 C2 的缺陷。并常与 SLE 或 SLE 样疾病相关联。约有 2 / 3 纯合性 C2 缺陷的个体是健康的,说明 C2 的缺陷至少有一部分可被无缺陷的 C4 所补偿。C2 和 Bf 均具有多态性。人的 C2 主要由三个等位基因(C2A、C2B 和 C2C)所编码。在补体成分的缺陷中,C2 的遗传性缺陷所占比使例较高,为常染色体共显性遗传。C2 缺陷者发生免疫复合物病及 SLE 的危险性较大。Bf 的遗传多态性最常见的表型为 S(slow)和 F(fast),另外还发现近 20 种罕见型,基因频率均 <0.02-0.03。B 因子的多态性与某些自身免疫病和感染性疾病有关。C4A 和 C4B 则具有复杂的多态性,已发现有 30 多个同种异型,分别有 15 和 14 个等位基因。由 C4A 和 C4B 基因编码的两种蛋白有 99% 的序列同源性,但二者在功能上却有明显的差别。两种同型的差别只是 1 个决定簇的不同。如将 1101 位的亮氨酸置换为脯氨酸,在 SDS-PAGE 上即可出现 2kDa 的表观分子量的改变;若将 1106 位的天冬氨酸置换为组氨酸,可使基溶血活性出现 3 - 4 倍的变化。另有 2 个位点含有所谓的“Null”基因称为:“零基因”(C4quantitative zero,C4QO)或静息基因,检不出基因产物的频率为 10-20%,系由于基因的缺失、基因转换或不表达所致。C4A 和 C4B 在功能上的送别表现为:①溶血活性不同,C4B 明显高于 C4A,因 C4B 与羟因形成酯键的速度大于 C4A 的 10 倍,而 C4A 与氨基形成酰胺键的速度大于 C4B 的 100 倍。②C4A 在抑制免疫沉淀中的作用较 C4B 大 1.7 倍,对腮腺炎病毒的中和作用较 C4B 大 10 倍;③抗原性上也有差别;几乎所有 C4A 分子中都含 Rodgers 血型抗原,而 C4B 则含有 Chid O 血型抗原。C4A 缺陷与多种疾病的关联,如 SLE、RA、全身性硬化、亚急性硬化性全脑炎(SSPE)、慢性多发性关节炎、重症肌无力、内脏利什曼病、普通变异型肾小球肾炎、麻风、巴西芽生菌病、IgA 缺陷、胰岛素依赖的糖尿病(IDDS)、恰加氏病(非洲锥虫病)和艾滋病。
近几年来,已对大多数补体分子的结构和遗传学特征进行了较深入地研究,发现许多补体分子遗传上的异常与某些疾病的关联。但将体外功能上的改变就视为与体内的某一现象有关尚为时过早。今后研究的重要任务,在于阐明补体相关疾病发病机理中的致病因子来取代统计学上的相关性。
(李恩善)
参考文献
1.Abbas AK,Lichtmen AH and PoberJ.Cellular and Molecular Immunology.Chapter 13 Complementsystem,1991;W.B.Saunders Company.
2.Ann.Rev.Immunology.1989;35-38.
3.Edwar L,et al.Anti-C5a recetporantibodies.J.Immunol.1993;151(1):377-388.
4.F.S. 罗森等编着,朱立平等编译《现代免疫学词典》,科学出版社,北京,1993 年 4 月第 1 版.
5.Roitt I.M.Eucyclopedia ofImmunology,Academic press.London.1992;63-66;371-391.
6.Fallman M,et al.Signaling propertiesof CR3(CD11b/CD18)and CR1(CD35)in relation to phagocytosis ofcomplement-opsonized particles.J.Immunol.193;151(1);330-336.
7.Stites DP,and Terr A1.Basic andClinical Immunnology.Chapter14,Complement and kinin,7th Edition.1991;Appletonand Lange.
8.Haeflier JA,et al.Completeprimary structure and functional characterization of the sixth component of thehuman complement system.J.Chem.1989;264(30):18041-18051.
9.Hobart MJ,et al.Structure ofthe human C6gene.Biochemistry.1993;32:6198-6205.
10.Pascual M,et al.Circulatingsoluble CR1(CD35).J.Immunmol.1993;151(3):1702-1711.
11.Kojima A,et al.Membranecofactor protein (CD46)protects cell predominantly from alternative complementpathway-mediated C3 fragment deposition and cytolysis.J.Immunol.1993;151:1519-1527.
12. 丁桂凤等编译.《医海陆空免疫学纲要》(高等医药院校教材)等 9 补体系统,北京医科大学、中国专业协和大学联合出版社,北京,1992 年 2 月第 1 版。
13. 林飞卿等主编.《医学基础免疫学》(高等医药院校教材)第 10 章补体系统,上海医科大学出版社,上海,1990 年 6 月第 1 版。
14. 赵修竹. 具有重复同源区的补体蛋白. 免疫学杂志,1988;4(1)1-4.
15. 赵修竹. 田延武综述.C2- 补体第一激活途径中的一个重要分子. 国外医学免疫学分册,1989;12(4):173-176.
16. 赵修竹.CD59:一种具有补体溶破同源限制作用的 GPI 锚蛋白. 国外医学免疫池分册,1993;16(3):113-116.
17. 赵修竹.H 因子. 国外医学分子生物学分册,1993;15(5):201-203.
18. 陈芳琦综述,赵修竹审校.SP40/40 末端补体复合体成员. 国外医学分子生物海陆空分册,1991;13(4):162-163
19. 汪策综述,赵修竹审阅.C4bp- 补体第一途径中一个重要调节蛋白. 国外医海陆空免疫学分册,1987;10(5):233-237.
20. 张页,周凤兰综述. 补体介导溶细胞反应的同种限制现象及其产生机制. 生一时科学进展,1991;22(3):231-234.
21. 陈政良综述,朱锡华审阅.C1qR 研究进展. 国外医学免疫学分册,1993;16(2):65-70.
22. 杨红玉综述,郑珊补阅.C1 抑制物和遗传性血管神经性水肿. 国外医学免疫学分册,1993;16(1):1-4.
23. 何建文综述,汪伟业审阅. 补体 C3 受体及其调节因子的结构和功能. 上海免疫学杂志,1993;11(3):172-175.
24. 崔晓岚综述,严昭仪审阅.C5a 的结构和功能. 国外医学免疫学分册.1990;13(1):29-32.
25. 康 洋搞译,王文余校. 补体系统 B 因子片段 Ba 可抑制人类 B 细胞增殖. 国外医学免疫学分册,1990;13(5):278.
26. 杨红玉综述,郑珊珊审阅. 膜辅蛋白 - 补体活化调节剂家族新成员. 国外医学免疫学分册,1994;17(4):174-176.
第六章 主要组织兼容性复合体
免疫遗传学是基础免疫学中的一个重要分枝,它是研究机体免疫应答遗传控制或基因控制的一门学科。1900 年 Landsteiner 发现 ABO 血型系统开创了免疫遗传学,以后从输血发展到器官移植。随着免疫球蛋白分子水平的研究,在一段时期内,免疫遗传学又主要研究免疫球蛋白多肽链的遗传标记。目前机体免疫应答遗传控制的研究主要集中在以下几方面:一是与主要组织兼容性系统连锁的免疫应答基因,控制着机体对特定抗原产生免疫应答的能力,并通过编码细胞膜上与免疫应答有关的表面抗原分子或可溶性分子,控制免疫细胞之间相互作用。二是免疫球蛋白和 T 细胞受体(TCR)的基因结构和控制以及免疫球蛋白和 TCR 的多样性、同种异型、独特型的遗传控制。此外,免疫遗传学还涉及到免疫系统的进化,血型抗原的基因控制,补体、细胞因子、粘附分子基因表达,H- Y 抗原与性别分化及某些遗传疾病的发病机制等。本章着重讨论主要组织相容性复合体(MHC)及其在临床的应用。
表 6 -1 免疫遗传学发展简史
| 年代 | 学 者 | 主要贡献 |
| 1900 | Landsteiner*(1930) | 确定人红细胞主要的同种抗原 |
| 1912 | Carrell* | 器官移植 |
| 1948 | Snell 和 Gorer | 发现小鼠 H - 2 系统及其与组织移植的关系 |
| 1953 | Snell*(1980) | H- 2 系统由 K、D 两个位点组成 |
| 1958 | Dausset*(1980) | 发现第一个人类白细胞抗原(Mac) |
| 1962 | Van Rood | 鉴定出一个新的等位基因系统,即 HLA- B 座位 |
| 1969 | Amos | 发现 HLA- D 座位 |
| 1967 | Benacerraf*(1980)和 McDevitt | 发现并证明 Ir 基因存在于 MHC 中 |
| 1970 | Sandberg | 鉴定出 HLA- C 座位 |
| 1975 | Doherty | 小鼠 H -2D、K 抗原对 Tc 杀伤病毒感染细胞的限制作用 |
| 1978 | Rosenthal | Ir 基因产物 Ia 抗原参与 Mφ- T 相互作用 |
| 1978 | Zinkernagel | MHC 对 T 细胞发育分化的影响 |
| 1987 | Tonegawa* | Ig 的基因结构 |
| 1990 | Murray 和 Thomas* | 肾移植和骨髓移植 |
* 诺贝尔奖获得者,括号内为获奖年代
1980 年诺贝尔医学和生理学奖授予在免疫遗传学上作出突出贡献的 Snell、Dausset 和 Benacerraf 三位学者。Murray 和 Thomas 在肾脏、骨髓移植研究的成就又获得 1990 年诺贝尔医学和生理学奖。免疫遗传学发展简史参见表 6 -1。目前免疫遗传学的研究已深入到基因和分子的水平。WHO 在上海设立了免疫遗传培训中心,我国从 70 年代初开始了对我国不同民族、地区 HLA 抗原频率调查,组织配型和脏器移植,HLA 和疾病的相关性以及某些基础理论研究工作。
第一节 MHC 基因图及其遗传特征
同种异体移植物(allograft)移植后常发生免疫排斥反应,引起这种排斥反应的抗原称为移植抗原或组织兼容性抗原。动物和人具有多种组织兼容性抗原,根据引起排斥反应的移植抗原的强度将组织兼容性抗原分为:(1)主要组织兼容性抗原系统,编码这一组抗原的是一组连锁基因,称为主要组织兼容性复合体(majorhistocompatibility complex,MHC),或主要组织兼容性系统(minorhistocompatibility complex);(2)次要组织兼容性抗原,由次要组织兼容性复合体(minor histocompatibility comples)或次要组织相容性系统(minorhistocompatibility system)所编码。
MHC 指某一物种的某一号染色体(如人 HLA 在第 6 号染色体,小鼠 H - 2 在 17 号染色体)上一组密切连锁的基因,它在主要组织相容性抗原识别以及清除外来和内在抗原起重要作用。人的 MHC 称为 HLA,在小鼠称为 H -2。其余灵长类和某些非灵长类动物的 MHC 有了新的命名规定与建议,原 MHC 的后两个字母 HC 改为小写,即 Mhc(表 6 - 2 和 6 -3)。
表 6 -2 灵长类动物主要组织相容性复合体的新、旧命名
| 动 物 种 名 | Mhc 名 称 | ||
| 普 通 | 科 学 | 新 名 | 旧 名 |
| Chimpanzee(小黑猩猩) | Pan troglodytes | Patr | ChLA |
| Gorilla(大黑猩猩) | Gorilla gorilla | Gogo | GoLA |
| Orang-utan(猩猩) | Pongo pygmaeus | Popy | OrLA |
| Rhesus macaque(monkey)(猕猴,恒河猴,短尾小猴) | Macaca mulanta | Mamu | RhLA |
| Pigtail macaque(发辫猴) | Macaca nemestrina | Mane | |
| Crab-eating macaque(cynomolgus monkey)(食蟹猴) | Macaca fascicularis | Mafa | |
| Olive Baloon(橄榄狒狒) | Papioanubis | Paan | |
| Northern night(owl)monkey(猫头鹰猴) | Antus trivirgans | Aotr | OMLA |
| Black spider monkey(黑蜘蛛猴) | Ateles paniscus | Atpa | |
| Common squirrel monkey(普通松鼠猴) | Saimiri sciureus | Sasc | |
| Cotton-top tamarin(绒顶柽柳猴) | Saguinus oedipus | Saoe | |
| Common marmoset(绢猴) | Callithrix jaccus | Caja | MaLA |
表 6 -3 某些非灵长类动物主要组织相容性复合体的建议名称
| 动 物 种 名 | Mhc 名称 | ||
| 普 通 | 科 学 | 现用 | 建议 |
| Deer mouse(鹿鼠) | Peromyscus maniculatus | Pema | |
| Cotton mouse(棉鼠) | Peromyscus gossypinus | Pego | |
| Field vole(棉鼠) | Microtus agrestis | Miag | |
| Montane vole(田鼠) | Microtus montanus | Mimo | |
| Wood vole(山鼠) | Apodemus sylvaticus | Apsy | |
| Golden(Syrian)hamster(木鼠) | Mesocricetus auratus | Hm-1 | Meau |
| Mole rat(金仓鼠) | Spalax ehrenbergi | Smh | Speh |
| Guinea pig(豚鼠) | Cauia porcellus | GPLA | Capo |
| Europea rebbit(欧洲兔) | Oryctolagus cuniculus | RLA | Orcu |
| Domestic dog(家犬) | Canis familiaris | DLA | Cafa |
| Domestic cat(家猫) | Felis canus | FLA | Feca |
| Domestic cattle(家牛) | Bos taurus | BOLA | Bota |
| Domestic pig(家猪) | Sus domesticus | SLA | Sudo |
| Domestic horse(家马) | Equus caballus | ELA | Eqca |
| Domestic sheep(家绵羊) | Ovis aries | OLA | Ovar |
| Domestic goat(家山关) | Capra hircus | GLA | Cahi |
各种动物 MHC 的作用基本相似,包括:(1)MHC 编码的抗原广泛颁布于淋巴细胞和其它有核细胞的表面,与同种内移植排斥有关,也是刺激混合淋巴细胞反应(MLR)和移植物抗宿主反应(GVHR)的主要刺激抗原;(2)控制机体对抗原的免疫应答或免疫抑制,以及免疫活性细胞之间相互作用;(3)编码补体系统中的某些组分;(4)MHC 中某些抗原出现的频率与对某些疾病的易感性有关。
一、小鼠 H - 2 基因图
小鼠的组织兼容性抗原有几十种以上,由常染色体 H -1、H-2、H-3……、H-30 等基因编码(H 表示组织兼容性 histocompatibility), 此外,还受小鼠性染色体基因(雄性为 XY,雌性为 XX)控制。其中 H - 2 抗原为小鼠主要组织相窜性抗原系统,而其他抗原均系次要组织兼容性抗原系统。MHC 在小鼠即为 H -2,目前对 H - 2 系统研究得较为清楚,位于第 17 对染色体,长度约占 0.5 分摩。H- 2 抗原具有高度 q 多态性。用血清学方法检出 H -2I 类抗原特异性在 100 个以上,可分为入有抗原(private antigen)和公有抗原(public antigen)。私有抗原是某一近交系(inbred strain)小鼠特有的抗原标志,在某一特定近交系小鼠只能检出一个 K 区和一个 D 区的私有抗原。公有抗原是在不同品系小鼠中都可检出的一些交叉抗原,每一品系小鼠通常都可检出多个公有抗原特异性。根据血清学检定抗原的反应格局,可将近交系小鼠分为不同单体型的品系,用 H - 2 右上方小写的英文字母表示,如 H -2x、H-2d和 H -2b等。
H- 2 基因群中可分为 K、I、S 和 D 四个区,I 区又可分为 I -A、I- E 等亚区。按其编码抗原结构和功能不同,又可将 H - 2 复合体分为三类基因:(1)I 类基因,位于 K 和 D 区,包括 K、D 基因座,最近又增加了 K2、L 和 L2(?)新的基因座;(2)Ⅱ类基因,位于 I 区,包括 Aα、Eβ 和 Eα 等基因座;(3)Ⅲ类基因,包括补体 C4、C2、Bf 和编码雄性激素结合蛋白性限蛋白(sex limited protein Slp)基因座(图 6 -1)。由于小鼠 H - 2 基因群含有 I(罗马字)类基因,不同区中有 I(因文大写)区,应注意鉴别,切勿混淆。此外,H- 2 中有些基因位于 Qa 和 TL 区,可能参与 H - 2 多态性的形成以及 TCRγδ T 细胞识别抗原时的遗传限制。
二、人 HLA 基因图及其遗传特征
在人类 MHC 称为 HLL(human leucocyte antigen),是迄今为止所知的人类最复杂的基因族。除成熟的红细胞外,HLA 抗原几科分布于人体的各种有核细胞以及血小板。由于此组抗原首先在人外周血白细胞上发现,同时表达抗原水平较高,目前多采用外周血淋巴细胞来检测这类抗原的型别,故称为人类白细胞抗原(HLA)。
(一)HLA 基因定位
HLA 基因群定位于第 6 号染色体的短臂(图 6 -2)。
![]()
图 6 -2 人类第 6 对染色体上已知的基因(或基因群)
至 1991 年底,HLA 基因座位已确定确定近 60 个,正式命名的等位基因 278 个。这些基因分类的方式主要有以下两种。(1)传统的分类法,即把 HLA 分为与小鼠 H - 2 相似的 I 类、Ⅱ类和Ⅲ基因,(2)1991 年 Bodmer 建议将它重划分的三类:第一类包括传统分类中的 HLA-Ⅰ类和Ⅱ类,还包括一对 DMA 和 DMB;第二类称为免疫功能相关基因,包括 C4、Bf、C2、TNFA、TNFB、HSP70、TAP1、TAP2 和 TAP7 等;第三类是一些与上述无关的基因。本章仍按传统分类法进行介绍。
HLA 占第 6 号染色体很窄的一个区带,估计占人体整个基因组的 1 /3000,长约 3500kb(图 6 -3、6-4)。
![]()
图 6 -3 人 MHC 基因图(根据 WHO HLA 命名委员会 1991 年修正)
![]()
图 6 -4 人 HLA 基因简图
![]()
图 6 -5 小鼠 H - 2 和人 HLA 中基因座位排列的比较
利用交换率越大基因座位距离越远,交换率越小基因座位距离越近的原理,可以通过交换率的计算作基因图,经过家谱分析和交换率的计算作基因图,A- B 座位的交换率为 0.8 分摩(centiMorgan,cM。是基因交换率在基因图上的图距单位,重组频率在 1% 的两个连锁基因之间的距离为 1cM),A- C 为 0.6cM,B- C 为 0.2cM,B- D 为 0.8cM,HLA 基因群全长距离约为 4cM。
自 1964 年以来,每隔 3 - 4 年召开一次国际组织相容性工作讨论会(InternationalHistocompatibility Workshop,IHW), 最近一次于 1991 年 11 月在日本横滨召开,并预定于 1995 年在法国召开第 12 次 IHW。经过这些会议陆续报告了 HLA 的许多基因及大量的行装位基因。现知在 HLA- I 类基因区中,除已知的 HLA-A、-B、- C 座位外,还发现了 -E、-F、-G、- H 和 -J,新发现的这些 I 因基因座大多数伪基因。现 A 座位已发现等位基因 41 个,B 座位 61 个,C 座位 18 个,E 座位 4 个。在 HLA- A 与 - E 之间可能存在着重组热点。在 HLA-Ⅱ基因中,已发现了近 30 个基因座位,等位基因更多,其中 DR、DQ、DP 均由一条 A 链与一条 B 链组成异源二降体分子(参后述),而 A 链基因与 B 链基因及其等位基因为数甚多,后者如 DRB1 座位 60 个,DRB3 座位 4 个,DRB5 座位 4 个,DRB6 座位 3 个;DQA1 座位 14 个,DQB1 座位 19 个;DPA1 座位 8 个,DPB1 座位 38 等等。DDRA 编码 DRα 链;DRB1 编码 β1 链,决定的特异性为 DR1、DR2、DR3、DR4、DR5 等;DRB2 为伪基因;DRB3 编码 DRβ3 链,决定 DR52 及 Dw24、Dw25、Dw26 等特异性;DRB4 编码 DRβ4 链,决定 DR53 特异性;DRB5 编码 DRβ5 链,决定 DR51 特异性;DRB6、B7、B8、B9 均为伪基因。DQA1 编码 DQα 链;DQB1 编码 DQβ 链;DQA2、B2 尚末得知其表达;DQB3 为伪基因。DOB 编码 DOβ 链 DMA 编码 DMα 链;DMB 编码 DMβ 链。DNA 编码 DNα 链、DPA1 编码 DPα 链;DPB1 编码 DPβ 链;DPA2 和 DPB2 为伪基因。此外与肽运转至内质网有关的基因 TAP1(transporter of antigen peptides)、TAP2 和与抗原加工有关的基因称之为低分子量多肽或称大的多功能蛋白酶 LMP2(low molecular weight polypeptides or large multifunctionalprotease-2)、LMP7 也位于Ⅱ类基因区。Ⅲ类基因区包括补体 C2、C4、B 因子,此外,21 羟化酶 A 与 B、HSP70(heat shockprotein70, 热休克蛋白 70)和肿瘤坏死因子 α、β 基因也在这里。21A 是假基因,21B 具有编码 21 羟化酶功能。21 羟化酶是肾上腺皮质合成皮质醇和醛固醇必不可少的酶,如酶缺乏,可导致先天性肾上腺皮质增生症。
HLA 和 H - 2 基因的比较见图 6 -5。小鼠 H - 2 的 Tla 为存在于胸腺细胞和某些胸腺白血病细胞上的抗原(thymus-leukemia antigen);Tla 与 H -2D 之间还有 Qa 区。Qa 区中有 17 个 Qa 基因,还有 12 个 Qa 基因在 Tla 区,但大部分 Qa 基因是静息基因(silent gene)。目前已测得 6 个 Q 基因有表达,其中 Qa2、Qa3、Qa4、Qa5 由 Qa 区基因编码,Qa1 和 Qa6 由 Tla 区编码。
(二)HLA 血清学抗原的命名
目前已确定的 HLA 敌国清学抗原共有 161 个,其中 A 有 27 个,B 有 59 个,C 有 10 个,D 有 26 个,DR 有 24 个,DQ 有 9 个,DP 有 6 个。C 座位上的抗原编号是公认的,为了避免与补体 C 相混淆特标以“W”。某些抗原数字后带有括号的抗原编号,表示括号前的抗原为括号内抗原的裂解产物,如 A23 和 A24 是 A9 抗原的裂解产物(表 6 -4)。
表 6 -4 HLA 血清学抗原特异性总表(1991)
| A | B | C | D | DR | DQ | DP | |
| A1 | B5 | B49(21) | Cw1 | Dw1 | DR1 | DQ1 | DPw1 |
| A2 | B7 | B50(21) | Cw2 | Dw2 | DR103 | DQ2 | DPw2 |
| A203 | B703 | B51(5) | Cw3 | Dw3 | DR2 | DQ3 | DPw3 |
| A210 | B8 | B5102 | Cw4 | Dw4 | DR3 | DQ4 | DPw4 |
| A3 | B12 | B5103 | Cw5 | Dw5 | DR4 | DQ5(1) | DPw5 |
| A9 | B13 | B52(5) | Cw6 | Dw6 | DR5 | DQ6(1) | DPw6 |
| A10 | B14 | B53 | Cw7 | Dw7 | DR6 | DQ7(3) | |
| A11 | B15 | B54(22) | Cw8 | Dw8 | DR7 | DQ8(3) | |
| A19 | B16 | B55(22) | Cw9(w3) | Dw9 | DR8 | DQ9(3) | |
| A23(9) | B17 | B56(22) | Cw10(w3) | Dw10 | DR9 | ||
| A24(9) | B18 | B57(17) | Dw11(w7) | DR10 | |||
| A2403 | B21 | B58(17) | Dw12 | DR11(5) | |||
| A25(10) | B22 | B59 | Dw13 | DR12(5) | |||
| A26(10) | B27 | B60(40) | Dw14 | DR13(6) | |||
| A28 | B35 | B61(40) | Dw15 | DR14(6) | |||
| A29(19) | B37 | B62(15) | Dw16 | DR1403 | |||
| A30(19) | B38(16) | B63(15) | Dw17(w7) | DR1404 | |||
| A31(19) | B39(16) | B64(14) | Dw18(w6) | DR15(2) | |||
| A32(19)Dw | B3901Dw | B65(14) | Dw19(w6) | DR16(2) | |||
| A33(19) | B3902 | B76 | Dw20 | DR17(3) | |||
| A34(10) | B40 | B70 | Dw21 | DR18(3) | |||
| A36 | B4005 | B(70) | Dw22 | ||||
| A43 | B41 | B72(70) | Dw23 | DR51 | |||
| A66(10) | B42 | B73 | |||||
| A68(28) | B44(12) | B75(15) | Dw24 | DR52 | |||
| A69(28) | B45(12) | B76(15) | Dw25 | ||||
| A74(19) | B46 | B77(15) | Dw26 | DR53 | |||
| B47 | B7801 | ||||||
| B48 | |||||||
| Bw4 | |||||||
| Bw6 | |||||||
(三)HLA 的家系遗传及多态性
1.HLA 的家系遗传 HLA 单体型可作为一个单位遗传给子代,其遗传示意图见图 6 -6。a、b、c、d 是双亲或子代 HLA 单体型的代号;1、2、3 是 HLA- A 抗原,? 为末检出 HLA- A 抗原;5、7、8、12 是 HLA- B 抗原。
基因频率和基因平衡定律基因频率指在群体中某一等位基因出现在机率与该群体全部等位基因可以世代维持不变。HLA 基因频率亦符合这一定律。在群全中,一个抗原频率反映了控制这一抗原的基因频率。
HLA 中的基因之间也有一定的交换和重组机率,一般取决于两个基因之间的距离。但 HLA 多基因座组成的单体型并非完全随机,有些基因比其它基因更多地连锁在一起,称为连锁不平衡(linkage disequilibrium)。换名话说,实际观察到睥两个或更多基因出现在同一条单倍体上的频率大于按照独立分配规律所预期的频率。如在白种人中 A1 的基因频率为 0.12,B8 的基因频率为 0.17,A1 和 B8 基因出现在同一条单倍体上的预期频率为 0.12*0.17=0.02,但实际观察到的频率为 0.09。HLA 的连锁不平衡与对某些疾病的易感有关。
已被检出的众多的 HLA 抗原在不同人种甚至不同地区的人群中的分布存在着很大的差别。如白种人 HLA-A1、A3、D8 检出率较高;黄种人以 A24、B46、B54 的检出率较高,黑种人以 HLA-A36、A43、B53 检出率最高。在单体型的栓出率也同样有情况,如北欧人以 HLA-A1、B8、HLA-A8、B7 两个单体型最常见,黄种人以 HLA-A9、B15HLA-A2、B 空白抗原的单体型较常见,我国汉族人以 HLA-A2、B46、HLA-111、B40 和 HLA-A2、B40 单体型最常见。在研究 HLA 系统与疾病之间的关系时必须以所研究同一地区正常人群作为对照。
表 6 -5 MHC 三类基因产物特征及其功能
| Ⅰ类 | Ⅱ类 | Ⅲ类 | |
| 基因产物 | H-2 K、D | 1 区(Aα、Aβ、Eα、Eβ) | C4、C2、Bf、Slp |
| HLA A、B、C | D/DP、DQ、DR | C4、C2、Bf | |
| 分 布 | 几乎所有细胞表面 | B 细胞、活化 T 细胞巨噬细胞、树突状细胞、郎罕氏细胞、精子等 | 血清及体液中 |
| 多肽链组成 | α44kDa | α34kDa | C4α 90kDa |
| β12kDa | β29kDa | β 70kDa | |
| γ 30kDa | |||
| C2 100kDa | |||
| Bf 90kDa | |||
| 检出方法 | 血清学方法 | HLA-DR、DQ 血清学方法 | 血清学方法 |
| DNA 分型法 | DNA 分型法 | 化学方法 | |
| 高压电泳 | |||
| 等电聚焦 | |||
| 功 能 | 为同种异体抗原,诱导同种异体排斥反应,诱导抗体和 Tc 形成;Tc 杀伤病毒感染靶细的 MHC 限制 | 为同种异体抗原,诱导同种异体排斥反应,诱异抗体产生及 Th 细胞增殖,体外刺激 Mφ、LC 提呈抗原作用;免疫调节(Ir 基因),约束 Mφ-T、T- B 间相互作用。 | 形成 C3 转化酶(C4b2a,C3bBb)激活 C3 |
2.HLA 的多态性(polymorphism)现象多态性指在同一相互交配的群体中,同一基因座可编两种以上的基因产物。HLA 的多态性主要是由于复等位基因和共显性所致:(1)复等位基因(multiple alleles), 位于一对同源染色体上对应位置的一对基因叫等位基因。由于群体的突变,同一基因座的基因系列称为复等位基因,对某一个体来说一个基因座只有一对等位基因,复等位基因是群体的概念。HLA 存在为数众多的复等位基因。(2)共显性(codominant),共显性状态是杂合状态,这一对等位基因所控制的性状都表现出来,HLA 每个基因座上的等位基因都是共显性。
![]()
图 6 -6 HLA 单体型的家系遗传
第二节 MHC 抗原的结构及检测
MHC 编码的抗原为一类同种异体抗原(alloantigen)。其中Ⅰ类和Ⅱ类抗原主要以细胞膜镶嵌蛋白的形式存在,也可脱落成为可溶性的形式。Ⅲ类抗原为补体 C2、C4 和 B 因子,主要分泌到血清等体液中去。
一、MHC 抗原的结构
(一)Ⅰ类抗原的结构和分布
Ⅰ类抗原由非共价键连接的两条多肽链组成,其中重链由 MHCⅠ类基因编码,轻链由另一条染色体(人第 15 对染色体,小鼠第2对染色体)β2m 基因编码。Ⅰ类抗原分布于几乎所有的有核细胞及血小板表面。HLA-A、B 抗原在人类淋巴细胞表面浓度最高,每个细胞约有 103~105 个分子,占淋巴细胞表面蛋白的 1%。
1. 重链 又称 α 链,其裸肽分子量为 40kDa。人Ⅰ类抗原 α 链上有 1 个 N - 连接的寡糖,成熟的 α 链为糖蛋白,分子量的 44kDa;小鼠 α 链上有 2 个 N - 连接的寡糖,分子量略大于人 α 链,为 47kDa。α 链为穿膜结构,根据各结构域的功能以及与 Ig 同源性的比较,α 链可分为肽结合区和免疫球蛋白样区组成的胞膜外区,穿膜区以及胞浆区(图 6 -7)。
(1)肽结合区 (peptide-binding region):α 链氨基端的两个结构域 α1 和 α2,各含约 90 氨基酸残基,α1 与 α2 有很高同源性, 但不属于免疫球蛋白超家族成员。人 α 链有 1 个 N - 连接的寡糖,位于 α1 和 α2 连接处。小鼠 α 链则有 2 个 N - 连接的寡糖, 分别位于 α1 与 α2 连接处和 α2 区的羧基端侧。α2 区内有一个链内的二硫键,两个半胱氨酸间约含 63 个氨基酸残基。α1 区第 60~80 位氨基酸残基和 α2 区第 95~120 位氨基酸残基的组成和排列顺序变化最大, 是Ⅰ类抗原多态性(同种异型) 的分子基础。
图 6 -7 MHCⅠ类分子结构模式图
注: 表示糖,P 为磷酸化位点
表示多态性存在部位
美国哈佛大学 Strominger 实验室用 X 射线晶体衍射图搞清了 HLA-A2 分子的立体结构 (图 6 -8)。α3 和 β2m 结构域靠近细胞膜, 位于分子的底部;α1 和 α2 结构域远离细胞膜位于分子的顶部,所组成的空间结构是与抗原结合部位和被 T 细胞受体(TCR) 识别的部位。与抗原结合部位的构象呈深槽状, 由 α1 和 α2 结构域各 1 条 α 螺旋和 4 条 β 折叠所组成。两条 α 螺旋位于抗原结合部位上部形成两个侧面,8 条 β 折叠位于下部形成底面。所构成的深槽大约长 2.5nm,宽 1.0nm, 深 1.1nm, 可结合 8~20 个氨基酸残基, 其大小和形状适合于已加工处理的抗原片段。MHC Ⅰ类抗原分子的多态性主要位于形成两侧面的 α 螺旋结构上, 与Ⅰ类抗原递呈抗原的功能相关,形成深槽内部氨基酸的侧链主要通过盐键、氢键与抗原多肽结合;位于深槽外部和表面氨基酸是 TCR 识别的部位,上述发现是近年来基础免疫学中分子免疫学领域中最杰出的成就之一,为 TCR 识别 MHC 与加工处理的抗原复合物的理论研究和某些自身免疫性疾病的发病机理提供了重要依据。
(2)免疫球蛋白样区 (immunoglobulin-like region):α3 约含 90 个氨基酸残基,氨基酸组成十分保守, 与 IgC 区同源, 在二级结构上,α3 组成 Ig 样折叠(Ig fold),即七个 β 折叠股形成两个平面,由二硫键相连,属免疫球蛋白超家族(IGSF) 中 C1 结构。α3 结构域是 α 重链的非多态部分(nonpolymorphic),通过 MHC 分子突变分析证实, 此区是与 CD8 分子相互作用的位置。
(3)穿膜区(transmembrane region): α3 结构域的羧基端侧有一段较短的连接区(conn-ecting region),穿膜区约由 25 个疏水性氨基酸残基所组成,可能形成 α 螺旋穿过双层脂质的细胞膜,并使 α 链锚在细胞膜上。
(4)胞浆区 (cytoplasmic region): 含约 30 个氨基酸残基,并具有数个 cAMP 依赖的蛋白激酶(蛋白激酶 A,PKA) 和 PP60 Src 酪氨酸激酶的磷酸化位点。此外,在羧基端含有一个谷氨酰胺残基,作为转谷氨酰胺酶转肽作用的底物。上述结构可能在 MHCⅠ类分子与其它膜蛋白或细胞骨架成分相互作用中起作用,去除 MHCⅠ类分子胞浆羧基端可抑制Ⅰ类分子的内化。
2. 轻链 含 99 个氨基酸残基,分子量为 12kDa,最早在一些镉中毒患者尿中发现,1968 年 Berggard 从肾小管病变的蛋白尿中分离出来,电泳位于 β2 区,称 β2 微球蛋白 (β2-microglobulin,β2m)。A、B、C 抗原所含轻链均一致。β2m 氨基酸排列与 IgGCH2 约有 30%序列同源,故 β2m 有游离免疫球蛋白结构域(free immunoglobulin domain) 之称,属免疫球蛋白超家族 C1 结构。不同种动物之间 β2m 很少有区别。β2m 本身与 HLA-A、B、C 抗原特异性无关,也不直接参与同抗原的结合,但对于 α 重链在细胞膜表面的表达以及执行其正常生理功能是必须的。如人 B 细胞系 Daudi 不能合成 β2m,虽然在 Dandi 细胞Ⅰ类基因能发生转录,并可翻译,但细胞翻译产物是不稳定的。当 Daudi 细胞转染了有功能的 β2m 的基因或与表达 β2m 的细胞融合,Daudi 细胞即可在细胞表面表达Ⅰ类抗原。α 重链与 β2m 的结合可能发生在内织网。有关 β2m 的免疫学功能近来受到重视。用抗 β2m 的单克隆抗体 NAMB1 可抑制 MLR 中的反应细胞。抗原与淋巴细胞接触后 18 小时内,抗 β2m 血清可抑制其抗体应答。此外,β2m 抗血清对 PHA、ConA、PWM 等对淋巴细胞的促有丝分裂作用都有明显的抑制作用。由于 β2m 分子在细胞表面的数量远远大于Ⅰ类抗原分子的数目,故 β2m 可能以作为 HLAⅠ类抗原一部分和游离分子两种形式存在。在某些病理情况下,血清和尿中 β2m 可明显升高。
图 6 -8 人 MHC Ⅰ类分子多肽的折叠
注: 左图侧面观,右图顶部观。白色箭头代表 β 叠股,白圈表示 α 螺旋,黑色线为二硫键
(二)Ⅱ类抗原的结构和分布
1. Ⅱ类分子的结构 MHC Ⅱ类分子是由 α、β 两条链通过结合紧密的非共价键连接组成的异源双体。α 链分子量 32~34kDa, 有 2 个 N 连接寡糖,β 链 29~32kDa,有一个 N - 连接糖基化点(图 6 -9)。Ⅱ类分子 α、β 链是由不同基因所碥码。α、β 链各有 2 个结构域 α1、α2 及 β1、β2。每个结构域约含 90 氨基酸残基,除 α1 区外,α2、β1、β2 每个区各含一个二硫键。α1 和 β1 与 Ig 结构域无相似性, 组成肽结合区。α2 和 β2 区与 Igγ3 和 Cμ4 相似, 属免疫球蛋白超家族 C1 型结构, 非多态性。所有 DR 等位基因编码的 DR 分子 α2 区结构都相同, 但不同于 DPα2 或 DQα2 者。CD4 分子与Ⅱ类分子非多态部分相结合。
图 6 -9 MHCⅡ类分子结构模式图
Ⅱ 类抗原的多态性主要与 DQα、DQβ、DRβ 和 DPβ 链有关。在人类Ⅱ类抗原是 HLA-D/DP、DQ、DR 抗原, 其中 D 和 DP 抗原在 MLR 中为刺激 T 细胞激活的抗原决定簇 (major lymphocyte activating determinants,Lads 抗原), 而 DR 和 DQ 则刺激抗体的产生,这与下述的 HLA 抗原检测的方法有关。
α2 和 β2 羧基端侧有一个短的连接区。穿膜区约含 25 个氨基酸残基。胞浆区可能与信号的转导有关。尽管尚未获得 α 和 β 链的 X - 线晶体衍射图,从 MHCⅠ、Ⅱ类分子结构和功能的相似性以及最近结果提示 MHCⅡ类分子肽结合的多肽折叠形式与 MHC Ⅰ类分子十分相似,α1 和 β1 各形成 4 条 β 折叠股和一条 α 螺旋。8 条折叠股组成一个底层,支撑 2 个 α 螺旋,α、β 链 2 个 α 螺旋形成肽结合区深槽的侧面(图 6 -10)。
最近在细胞内发现与 MHCⅡ类分子相连的第三条链,称之 γ 链,约 30kDa,属免疫球蛋白超家族成员,非 MHC 编码,γ 链氨基端在胞浆内,而羧基端在细胞膜外。在 γ 链到达细胞膜之前它是与 MHCⅡ类分子分离的。γ 链确切的生理功能还不清楚,可能是 (1) 改变 MHCⅡ 类分子 α、β 链翻译后加工的性质;(2)参与Ⅱ类分子细胞内的运行;(3)与Ⅱ类分子将外来抗原提呈给辅助性 T 细胞的功能有关;(4)最近又认为 γ 链可防止机体自身合成的肽与Ⅱ类分子结合,以保证Ⅱ类分子肽结合点为外源性抗原结合之用。
图 6 -10 MHCⅡ类分子多肽的折叠(推测)
注: 本图为顶面观,白色剪头代表 β 折叠股,白圈表示 α 螺旋,黑
色线为二硫键,边缘的虚线方块表示尚未确定的多肽折叠。
2.I 区相关抗关
(1)Ia 抗原的概念: Klein、Shrefler(1974、1975 年) 将小鼠 I 区基因所编码的抗原称为 Ia 抗原(I region associated antigen),也有人将 I 区中的 Ir 基因的产物称为 Ia 抗原。目前一般把人类Ⅱ类抗原,尤其 DR 抗原也称为 Ia 抗原。
(2)Ia 抗原的分布: 小鼠 Ia 抗原主要在 B 细胞、巨噬细胞、表皮细胞、精子、活化 T 细胞、郎罕氏细胞、树突状细胞等。Ia 抗原的组织分布见表 6 -6。
表 6 -6 Ia 抗原的组织细胞分布(细胞荧光染色阳性率%)
Ia 抗原主要分布在脾脏、淋巴结的淋巴细胞、巨噬细胞、胚胎肝细胞、表皮细胞、活化内皮细胞、骨髓细胞和精子细胞上,某些肿瘤细胞也具有 Ia 抗原。而红细胞、血小板、脑组织、肾脏和成年肝细胞未见有 Ia 抗原。
无论是 Th 还是 Tc/Ts 被激活后一部分细胞表达 Ia 抗原。此外巨噬细胞、表皮郎罕氏细胞、树突状细胞也含有较高比例的 Ia 抗原,有人认为 Ia 抗原还与巨噬细胞亚群分类有关。
D 抗原分布还缺乏系统资料。但从现有资料中看到,除 B 淋巴细胞外,T 细胞、单核细胞、上皮细胞、内皮细胞和精子细胞也可以诱导淋巴母细胞反应,提示上述细胞存在 D 抗原,而血小板不存在 D 抗原。
(3)Ia 抗原的功能: Ia 抗原最主要的功能是作为 Ir 基因的产物,参与免疫应答的遗传控制及其应答过程中的遗传限制作用,这将在本章第五节中重点加以讨论。此外还有以下的生物学功能:
①与 B 细胞分化的关系: 分化发育尚未成熟的 B 细胞以及 B 细胞型白血病细胞均可检出 Ia 抗原,成熟的浆细胞表面不能检出 Ia 抗原。
②人类 Ia 抗原与 MLR 刺激: 在单向 MLR 中刺激同种异体 T 细胞增殖的刺激细胞除 B 细胞外,其它的 Ia 阳性细胞如建株 B 细胞、精子、巨噬细胞、郎罕氏细胞的刺激能力与表面 Ia 抗原有关, 巨噬细胞和郎罕氏细胞较强,精子较弱。抗人 Ia 样抗血清或抗 Ia 样单克隆抗体对人类 MLR 均有非常明显的抑制效应。
③人类 Ia 样抗原与免疫辅佐细胞: 只有 Ia 阳性的单核 - 巨噬细胞、表皮郎罕氏细胞和树突状细胞具有执行抗原提呈细胞 (antigen presenting cell,APC) 的辅助免疫应答的功能。最近发现 Ia 阳性 B 细胞也是机体重要的抗原提呈细胞。
④人类 Ia 样与 T 淋巴细胞: T 细胞经活化后 (包括 PHA、ConA、PWM,可溶性抗原,同种异体抗原刺激) 能合成并在细胞表面表达 Ia 抗原,其特异性与同一个体 Ia 抗原相一致。促有丝分裂原激活的 Ia 阳性 T 细胞以 PWM 刺激后比例最高,PHA 次之,ConA 最低。
⑤Ia 抗体与免疫增强: 免疫增强(immunologicalenhancement) 主要是由 Ia 抗体介导的一种特异性免疫抑制作用。有人认为移植前输血所引起移植物存活延长现象是由 B 细胞导致的主动免疫增强现象。免疫增强的机制还不十分明了,可能与 Ia 抗体与 Ia 抗原结合后,阻止了供体 Ia 抗原对 Th 的刺激作用,从而阻断移植排斥免疫应答的致敏过程;另一可能是 Ia 抗体的抗原结合位置可刺激受者产生抗独特型抗体,这种抗独特型抗体可与 Th 细胞上 Ia 抗原识别受体相结合,从而阻止了 Th 细胞对 Ia 抗原的识别,阻断移植后排斥反应的产生。
二、MHC I 类、Ⅱ类基因的结构
MHC I 类、Ⅱ类基因外显子和内含子的组成相似(图 6 -11)。第一个外显子编码先导序列。MHc I 类分子 α1、α2 和 α3 是由三个不同的外显子所编码,空膜区和胞浆区是由数个较小的外显子编码。MHc I 类分子胞浆部分每一个保守的磷酸化位点是由不同的小外显子分别编码。有多个调节 MHC 基因的转录的顺式调节顺序(cis-regulatory sequences)位于 MHC 基因外显子的 5` 端,这些调节顺序是作为反式作用的转录调节蛋白的结合位点。此外,在 MHc I 类基因中也发现有启动子和增强子,并存在着对细胞因子特别是 IFN- γ 应答的核苷酸序列。在 MHc Ⅱ类基因中含有对于Ⅱ类基因表达所必需的、称之为 W(或 H)、X 和 Y 盒的三个保守的核甘酸序列。
![]()
图 6 -11 MHc Ⅰ、Ⅱ类基因外显子内含子结构
IFN- γ 可调节 MHC I 类和Ⅱ类分子的表达。IFN- γ 几乎对所有细胞 MHc I 类抗原的表达有促进作用,其他的细胞因子如 IFN-α、INF-β、TNF 和 LT 也能促进 MHc I 类分子的表达。IFN- γ 等细胞因子促进 I 类分子表达水平升高的机理可能是细胞因子激活的转录因子(cytokine-activatedtranscription factors)结合到 I 类基因 DNA 的调节序列上。IFN- γ 可促进单核 - 巨噬细胞、郎罕氏细胞 NHc Ⅱ类分子的表达,诱导 MHc Ⅱ类分子阴性的内皮细胞、上皮细胞和基质细胞(stromal cell)表达Ⅱ类分子;树突状细胞和活化人 T 细胞可表达Ⅱ类分子,但 IFN- γ 无明显调节作用;对于小鼠 B 细胞,IFN- γ 作用后Ⅱ类分子表达反而降低,而 IL- 4 有促进表达的作用。
第三节 MHC 中的单体型
在 11 次 IHW 报告了 36 个人 MHCⅢ类基因,其中发现最早、知之最祥、并与免疫应答关系最密切的是 C4A、C4B、Bf 和 C2 四个基因。
人 C4A 和 C4B 两个基因座,表现为复杂的多态现象,在每个 C4A 或 C4B 分子上的 C4d 区个别氨基酸的差别形成许多型别,目前已有 40 多种同种异型(allotype)。例如 C4B 与 C4B2 的区别在于 C4d 的 1054 位氨基酸组成,前者为甘氨酸,后者为天冬氨酸。由于基因缺失(genedeletion)、基因转换(gene conversion)等原因 C4 基因有时不能表达,称为零基因(C4 puantity zero,C4QO)或静息基因,常伴有旁侧的固醇 21- 羟化酶的缺乏。如纯合子 C4 零基因,伴有 21 羟化酶缺乏引起的耗盐型先天性肾上腺增生(congenital adrenal hyperplasia,CAH)。此外,C4QO 还与 SLE、IDDM 等有关。
Bf 具有遗传多态现象,最常见的表型是 S(slow)和 F(fast),而 S1(slower thanS)及 F1(faster than F)罗为少见。这四个等位基因属常染色体显性遗传,S 与 F 的结构差别在 Ba,而决定 S1 和 F1 的结构差异在 Bb 片段。除上述四型外,至今还发现了近 20 种罕见型,基因频率均小于 0.02-0.03。现在研究资料表明,Bf 的多态性与某些自身免疫性疾病和感染性疾病易感有关,如胰岛素依赖性糖尿病(IDDM)BfF1 频率显著升高,BfF1 还可能与麻风病有关。
C2 有 3 个等位基因:C2A(basic)和 C2C(common)。基因频率分别为 <1%、2% 和 97%。遗传性 C2 缺乏是由于 C2 结构基因上存在零基因(nullgene), 也称静息基因,写为 C2QO。补体各成分的遗传性缺乏中 C2 所占比例较高,为常染色体共显性遗传。异合子 C2 遗传性缺乏常表现 C2 浓度只有正常值的一半,而纯合子 C2 缺乏者全身性红斑狼疮样病患者发病率较高。C2QO 等位基因常伴有 HLA-A25、B18、DR2、BfS、C4A4、C4B2 这组单体型出现。
在 MHC(人 HLA)各基因座位间常紧密连锁,并有连锁不平衡情况,组成更大范围的型别。这种型别的检测常较单座位提供的遗传信息更多,因此在人类源流考察、法医知鉴定、疾病的遗传易感性研究、免疫调控等方面更为重要,近年受到人们特别的重视。从理论上讲,这些单体型组成形式应该是很多的,而目前提及的是 C4 单体型、补体型与 HLA 扩展单体型三种,于此简略加以介绍。
一、C4 单体型
1978 年 O ’Neill 等发现 C4 存在两个基因座位,分别命名为 C4A*与 C4B*,继后证实血中确有两种 C4 同种型(isotype)C4A 与 C4B,这在补体研究中却属独一无二。接着探明,这两个基因在人均位于 C6p,且中间仅隔 10kb,两基因紧密连锁,构成单体型,即 C4 单型。1981 年 Brun-Petersen 等人首先检出了北欧人 12 个 C4 单体型,嗣后白人、黑人、黄人的资料相继出现,并在 9 次 IHW 上进行了总结。我国也在 1991 年出现了第一篇报道。Mauff 曾对世界范围内的资料进行过统计分析,提出高频率的 C4 单体型一般分布在 A4B2 到 A2B1 等 11 型中,占总频率的 75% 以上,A3B1、A3BO 及 AOB1 三型占 60-74%。我国情况亦同,似乎更为集中。但各人种间也存在着若干差别;如 A4B2 频率在日本人特别高,白人较低,黑人中末见;又如含 A5、A6 等 C4A 快泳带的 C4 单体型黄人中少见,黑人最多,白人居中;等等。
二、补体型
位于 HLA-Ⅲ类中的补体基因,不仅两个 C4 基因紧密连锁,构成 C4 单体型,而且与另外两个补体基因 BF*与 C2*也紧密连锁,构成更大的单体型,Alper 等命名其为补体型(complotype)。Alper 等人提出,在不足 100kb 的 DNA 分段上居有 4 个补体基因,从理论上计算,基因间的随机交换率在 10000 到 2000 次减数分裂中还不到一次。事实上,在无数减数分裂中从未发现这些座位间的交换,总以一个配子单位进得遗传。此外还发现,如果将这 4 个补体座位上发现的所有等位基因按随机组合排列,预计将有千种厂的补体型,但就目前报道的数目来看,常见的不过 10 种上下,加上不常见的,也只有 40 余种。这表示在这些座位间存在着明显的连锁不平衡。
补体型的检测一般需要家系采血,至于 4 个基因型的排列顺序,在其遗传学顺序尚末弄清之前,Alper 等是按 Bf-C2-C4A-C4B 编排的,但在获悉其染色体上排列顺序为 C2-Bf-C4A-C4B(从端粒点到着丝点)后则多用后者顺序表示,且多用缩写形式,如 C2C、BfS、C4A3、C4B1 常写为 CS31 等等。最早报告的正常人补体型为美国白人,至今已积累到 1945 条染色体的数据,其中 CS31 频率最高,约占 40%,其次是 CS01、CF31、CS30、CS42 等,频率超过 0.005 的约占半数;连罕见型在内,一共检出 44 种。继后加拿大人、德国人、法国人、西班牙人、黎巴嫩人、南非黑人、美国黑人、日本人及中国人的资料相断问世,对比这些资料发现,共同点不少,但也有不少分歧,对于这些分歧进行分析表明,有些极易理解(如黑人的 CF31 占首位,因为黑人 BfF 远较其他人种为高),有些尚难解释。
三、MHC 扩展单体型
近年研究表明,在正常人以及某些疾病对 HLA-Ⅰ、Ⅱ、Ⅲ这三类基因还存在连锁不平衡现象,并构成一些具有分布特异性的大单体型,并先后提出不同的术语加以概括,如 MHC 扩展单体型(MHC-extended haplotype,EH)、MHC 祖传单体型(MHCancestral heplotype,AH)、HLA- 补体单体型(HLA-complement haplotype)超型、超单体型、优势等位基因组合等。在目前,EH 与 AH 较常引用。一般目前认为以 HLA-[B-(C2)-Bf-C4A-C4B-DR]等。6 个或 5 个座位的同步检测应是最低要求,而且常用 HLA- B 型进行命名。不过 HLA 基因 DNA 分型技术的快速发展,有些在 HLA-Ⅱ类血清学分型的基础上加上 DNA 分型,看来是当前发展的趋势。Alper 与 Awdeh 等人测定过美国白人 714 条染色体上 EH 频率,其中以 HLA-[B8-CS01-DR3]频率最高,频率超过 0.01 的 EH 共有 12 种。这些 EH 的组合频率约占检出总 EH 的 30%。他们还提出 HLA-EH 固定在 HLA- B 与 DR 之间的距离约 106bpDNA,相当于连锁图距 1cM,或重组分数 0.01。
Dawkins 提出的 MHC-AH 系指无关个体间相同的保留单体型,或者说存在于无关个群体中单体型特异性的等位基因组合,这在 HLA 已知基因座位已有证明,但 C6p 的 HLA 区还是有不少 DNA 区尚末发现具体的基因,用 HLA- B 至 TNF 之间尚末发现具体基因的 DNA 探针进行检查发现,这些区也呈多态现象,各段 DNA 也组成单体型,而且这种单体型也与特定的已知 AH 有连锁关系。这一发现,无疑对 HLA-AH 的本质有了进一步的了解。
EH 或 AAH 在人类学研究上具有意义。Fraser 等在非洲源黑人中检出 4 种过去没有报告过的补体型 CF(1,90)0、CF63、C(F1)17 及 CS(3,2,90)0,其中前两种分别与 HLA-B42(52、53、58)-DR3 和 HLA-B70-DR5 组成 EH,而这两种 EH 在白人中极为罕见,国外认为非洲源黑人具有独特的 HLA-EH。又如中国人与日本人多见的 HA 前半段为 HLA-[A2-Cw11-B46-C2C-BfS-C4A4-C4B2]完全相同,只有 DR 前者为 9,后者为 8,DQ 前者为 9,后者为 6,这表示,中日两个人群的 AH 具有极大的相似性,而在 HLA-Ⅱ类外才有分化。撒丁岛人(Sardinian)HLA-EH 很受人们的重视,在意大利的撒丁岛,15% 的人的 EH 为 HLA-[A30-Cw5-B18-BfF1-DR3-DR52-DQ2], 远远超出至今所知的世界人群,而且其 C4B 与 21A 基因 RELP 缺失,即这一单体型为 C4 及 21 羟化酶基因重复的祖传单体型。
第四节 MHC 的生物学功能
MHC 具有重要的生物学功能,主要包括参与胸腺对胸腺细胞的选择作用,对机体免疫应答的遗传控制,参与免疫细胞相互识别,对免疫细胞相互作用的遗传限制等。有关Ⅲ类抗原 C2、C4 和 B 因子的功能请参见有关补体系统的内容。
一、MHC 与胸腺对胸腺细胞的选择作用
成熟的、有功能的 T 细胞必须经过在胸腺中阳性选择和阴性选择,MHC 在这两种选择中起关键作用。
(一)阳性选择过程(positive selection)
早期的胸腺细胞前体(prothymocyte)不足 3%,为 CD4-CD8- 双阴性细胞(double negative cells),随后发 CD4+CD8+ 双阳性细胞(double positive cells),并受一以严格的选择。假如一个双阳性细胞表面能与胸腺皮质上皮细胞表面 MHc I 类或Ⅱ类分子发生有效结合,就可被选择而继续发育,否则会发生程序性的细胞死亡(programmed cell death)。MHC I 类分子选择 CD8 复合受体(coreceptor),而使双阳性细胞表面 CD4 复合受体减少;MHCⅡ类分子选择 CD4 复合受体,而使 CD8 复合受体减少。这种选择过程赋于成熟 CD8+CD4- T 细胞具有识别抗原与自身 MHc I 类分子复合物的能力,CD4+CD8- T 细胞具有识别抗原与自身 MHCⅡ类分子复合物的能力,成为 T 细胞 MHC 限制现象的基础。
(二)阴性选择过程(negativeselection)
经过阳性选择后的 T 细胞还必须经过一个阴性选择过程,才能成为成熟的、具有识别外来抗原能力的 T 细胞。位于皮质与髓质交界外的树突状细胞(DC)和巨噬细胞(Mφ)表达高水平的 MHc I 类抗原和Ⅱ类抗原,在胚胎发育过程中,机体自身抗原成分与 DC 或 Mφ 表面 MHc I 类、Ⅱ类抗原形成复合物。经过阳性选择后的胸腺细胞如能识别 DC 或 Mφ 细胞表面自身抗原与 MHC 抗原复合物,即发生自身耐受(self tolerance)而停止发育,而不发生结合的胸腺细胞才能继续发育为识别外来抗原 CD4+CD8- 或 CD4-CD8+ 单阳性细胞,迁移到外周血液中去(图 6 -13)。
二、MHC 对免疫应答的遗传控制
人们早已观察到各种不同品系动物的免疫应答是由遗传控制的,如豚鼠对白喉毒素结核菌素的易感性在不同品系间有很大差异人类变态反应性疾病的发生与遗传因素有关。但对这一问题的深入研究主要归功于 60 年代后免疫化学研究中合成多肽抗原的应用,对 H - 2 的深入了解以及同类系和 H - 2 内重组株小鼠的建立。
(一)MHC 对免疫应答遗传控制研究的基本条件
1. 人工合成多肽抗原 化学合成多肽抗原主要有以下两类:
(1)合成分枝多肽抗原:它是以线状的多聚赖氨酸(L)联上多聚丙氨酸(A)的侧链,形成 A - L 骨架结构,然后再在丙氨酸链上偶联不同的氨基酸,形成具有不同抗原特异性的分枝多肽抗原。最常用的是(T,G)-A-L,(H,G)-A- L 和(φ,G)-A- L 等(图 6 -14)。抗原特异性由末端氨基酸所决定,侧枝和主干起载体的作用。
图 6 -13 MHC 与胸腺的选择作用
(2)线状多肽抗原:这是几种氨基酸按不同比例和数量结合而成的线状多肽,具有较强的抗原性,如 GLφ 等。单种氨基酸组成的均一多肽抗原性很弱,但偶联上半抗原后则是很好的免疫原,例如多聚赖氨酸(PLL)与 DNP 偶联形成的 DNP-PLL 被广泛用于豚鼠免疫应答遗传控制的研究。
2. 同类系小鼠(congenic mice)是遗传北景完合相同,只是所需研究的那个基因不同的小鼠。建立同类系小鼠是诺贝尔获得者 Snell 对免疫遗传学作用出的突出贡献。有了同类系小鼠和人工合成多肽抗原,就可以深入研究免疫应答的基因控制以及与 MHC 的关系。同类系小鼠的培育的方法见图 6 -15。
首先近交系(inbredstrain)A 品系小鼠与另一个近交系 B 品系小鼠进行交配,A 品系 MHC 是 a / a 纯合(homozygous)的,B 品系 MHC 是 b / b 纯合的。A 与 B 品系杂交的子一代(F1)全部是 a / b 杂合状态的。然后将 F1 小鼠与亲本 A 品系进行回交(backcross),其子代一半为 a /a,另一半为 a /b,a/ b 杂合状态小鼠的皮片移植到 A 品系小鼠后迅速被排斥,而 a / a 子代小鼠的皮片移植到 A 品系小鼠后并不迅速被排斥。将通过皮片移植后发生迅速排所鉴定的 a / b 杂合小鼠又与 A 品系小鼠进行回交,其子代一半为 a /a,另一半为 a /b,再用上述皮片移植排斥反应的方法鉴定出 a / a 或 a /b,将 a / b 杂合不再与 A 品系小鼠进行回交。如此继续 20 代后,a/ b 杂合小 b 等位基因仍然保留,但原来 B 品系小鼠中其它的遗传座位都消失了,正如连续稀释(serial dilution)一样,F1 小鼠保留了 B 品系基因的 50%,回交后第一代平均只保留了 B 品系基因的 25%,这样经过 20 次回交后除了保留 B 品系的 MHC 等位基因(b)以外,其余 B 品系的基因(非 MHC 基因)都消失。也就是说,经过如此 20 代回交后 a / b 小鼠,除了第 17 号染色体上的 MHC 是 a / b 杂合以外,其余的遗传背景(除 17 号染色体 MHC 以外和其余 39 对染色体)均与 A 品系相同。将经过 20 代回交的 a / b 小鼠进行品种间杂交(interbreed)或称史妹交配,其子代的 MHC 基因 25% 是 a / a 纯合,25% 是 b / b 纯合,50% 是 a / b 杂合的。其中 b / b 纯合小鼠皮片移植的 A 品系小鼠后即发生迅速的排斥。用 b / b 纯合小鼠进行品种间杂交,培育出一个新的品系即 MHC 基因位点上与 B 品系相同,而其它所有的遗传背景与 A 品系相同,我们可称作这个品系小鼠与 A 品系是同类系(congenic to strain A), 或者叫做在 A 遗传背景的 B MHC。常用同类系小鼠单体型见表 6 -7。
图 6 -14 合成分枝多肽抗原示意
注:(T,G)-A–L:(多聚酪氨酸,多聚谷氨酸)- 多聚丙氨酸 - 多聚赖氨酸
(H,G)-A–L:(多聚酪氨酸,多聚谷氨酸)- 多聚丙氨酸 - 多聚赖氨酸
(φ,G)-A–L:(多聚酪氨酸,多聚谷氨酸)- 多聚丙氨酸 - 多聚赖氨酸
L:L 型,D:D 型
3.H- 2 内重组株 通过不同的同类系杂交,根据交换重组定律,在杂交后代中选择新的 H - 2 内重组体(interH-2recombinants)。不同的重组株在 H - 2 内的一些基因位点具有不同的等位基因,即 H - 2 单体型(haplotype)不同。
例如品系 A,B10.A 单体型为 a,它是由 H -2k 和 H -2d 两个双亲单体型的 I - E 亚区和 S 区之间发生交换重组而产生(表 6 -8)。H- 2 内重组株(举例)参见表 6 -9。
表 6 -7 常用同类系小鼠的单体型(标准品系,type strains)
| 品系 | 单体型 | K | I-A | S | D |
| B10(C57BL/10) | H-2b | b | b | b | b |
| B57BL/6 | H-2b | b | b | b | b |
| DBA/2 | H-2d | d | d | d | d |
| Balb/c | H-2d | d | d | d | d |
| B10.D2 | H-2d | d | d | d | d |
| C3H | H-2k | k | k | k | k |
| CBA | H-2k | k | k | k | k |
| B10.BR | H-2k | k | k | k | k |
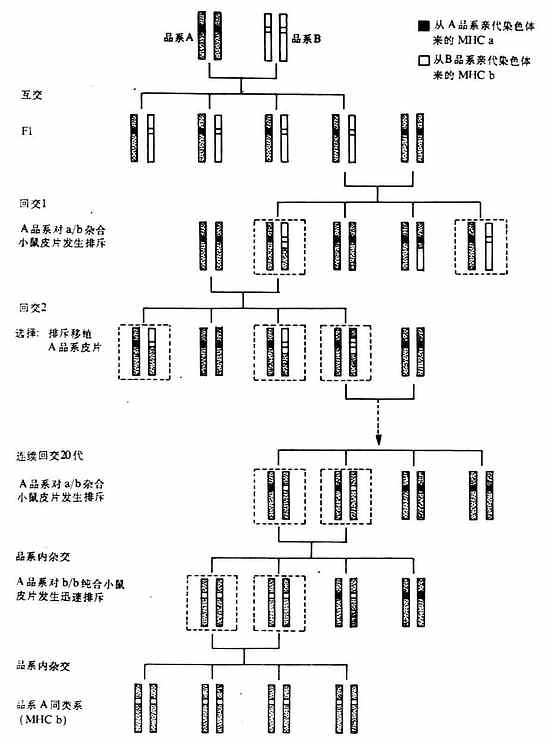
图 6 -15 同类系小鼠培育的方法
表 6 -8 A.B10.AH- 2 内重组株的产生
| 单体型 | K | I-A | I-E | S | G | D | |
| 亲代 1 | k | k | k | k | k | k | k |
| 亲代 2 | d | d | d | d | d | d | d |
| A.B10·A | a | k | k | k | d | d | d |
表 6 -9 H- 2 内重组株(举例)
| 品系 | 单体型 | 双亲单体型 | K | I 区 | S | G | D | |
| A | E | |||||||
| A.B10.A | a | k/d | k | k | k | d | d | d |
| A.AL | a1 | k/d | k | k | k | k | k | d |
| C3H.OL | o1 | d/k | d | d | d | k | k | k |
| C3H.OH | o2 | d/k | d | d | d | d | d | k |
| B10.A(4R) | h4 | a/b | k | k | b | b | b | b |
| B10.AM | h5 | k/b | k | k | k | k | k | b |
| B10.A(3R) | i3 | b/a | b | b | k | d | d | d |
| B10.A(5R) | i5 | b/a | b | b | k | d | d | d |
| A.TL | t1 | s/al | s | k | k | k | k | d |
| A.Th,B10.S(7R) | t2 | s/a | s | s | s | s | s | d |
| BSVS | ts | s/a2 | s | s | s | d | d | d |
| B10.M(17R) | ag1 | s/f | k | k | k | d | d | f |
| B10.M(11R) | ap1 | s/f | f | f | f | f | f | d |
(二)Ir 基因
1. 免疫应答基因的发现 Benacerraf 等(1963)首先证实豚鼠对人工合成抗原 PLL(聚 -L- 赖氨酸)等的抗体应答能力受单个常染色体显性基因(单基因)的控制(表 6 -10)。实验表明,2 和 13 两个品系豚鼠对不同人工合成抗原的应答能力不同。两个品系杂交的子一代(F1)对三种抗原全部有应答能力,说明应答基因为显性。再将 F1 和隐性亲本进行回交,所得下一代对抗原的应答表现出孟德尔定律的分离现象,应答与无应答个体呈 1:1 之比,说明遗传是由单基因控制的。F1 代与显性亲本进行回交,下一代中全部对抗原发生应答。Benacerraf 将控制免疫应答的基因称为免疫应答基因(immune responesgene ,Ir 基因)。具有 Ir 基因的动物对相应抗原呈高应答者(responder), 缺乏核基因者呈无应答或低应答者(non-responder)。
表 6 -10 豚鼠免疫应答基因的发现
| 抗原 | 2 | 13 | (2*13)F1 | (2*13)F1*13 | (2*13)F1*2 | ||
| 50% | 50% | 50% | 50% | ||||
| DNP-PLL | + | – | + | + | – | + | + |
| Glutamyl alanine copolymer(GA) | + | – | + | + | – | + | + |
| Glytamyl tyrosine copolymer(CT) | – | + | + | + | + | + | – |
注:DNP-PLL:二硝基苯—多聚赖氨酸 GA:谷氨酰丙氨酸多聚体 CT:谷氨酰酪氨酸多聚体
2. 小鼠 Ir 基因位一地 H -2 I 区内
(1)小鼠 Ir- 1 基因与 MHC 连锁基因:60 年代中期,McDevitt 和 Sela 等发现小鼠有类似针对合成分枝多肽(T,G)-A- L 抗原的基因,称 Ir- 1 基因,并证明该基因与 MHC 存在着连锁关系;如 C57BL 小鼠对(T,G)-A- L 有高抗体应答,而 CBA 小鼠则为低应答;对(H,G)-A- L 的反应则 CBA 小鼠为高应答,而 C57BL 为低应答。以后又检了一系列对特定抗原高应答、中应答或低应答的小鼠品系(表 6 -11)。并用回交试验证实小鼠 Ir 基因为单个常染色体显性遗传(图 6 -16)。
表 6 -11 不同品系小鼠对三种人工合成抗原的抗体应答
| 小鼠品系 | H-2 | 抗体产生应答 | ||
| 单体型 | 抗(T,G)-A-L | 抗(H,G)-A-L | 抗(φ,G)-A-L | |
| A/J | a | 低 | 高 | 高 |
| A.BY | b | 高 | 低 | 高 |
| C57BL | b | 高 | 低 | 高 |
| B1,LP | b | 高 | 低 | 高 |
| C3H,SW | b | 高 | 低 | 高 |
| BALB/c | d | 中 | 中 | 高 |
| DBA/2 | d | 中 | 中 | 高 |
| CBA | k | 低 | 高 | 高 |
| C3H/HeJ | k | 低 | 高 | 高 |
| B10.BR | k | 低 | 高 | 高 |
| AKR | k | 低 | 高 | 高 |
| DBA/1 | q | 低 | 低 | 高 |
| SJL | s | 低 | 低 | 低 |
| A.SW | s | 低 | 低 | 低 |
(2)Ir- 1 基因定位于 H -2 I 区内:70 年代初,McDevitt 等又利用同类系和 H - 2 内重组系小鼠,将 1r- 1 基因定位于 H -2 I 区内(表 6 -12)。
Milich 等(1982)应用同类系小鼠证实对 HBsAg a 和 d 决定簇的体液免疫应答也受 MHC 内的基因所调节。单倍 H -2q产生高应答,H-2s.f产生低或无应答,H-2a.b.d.k单倍型为中等应答。进一步用 H - 2 内重组系小鼠的实验表明,控制上述体液免疫应答的基因可能位于 K 区和 I - A 亚区。
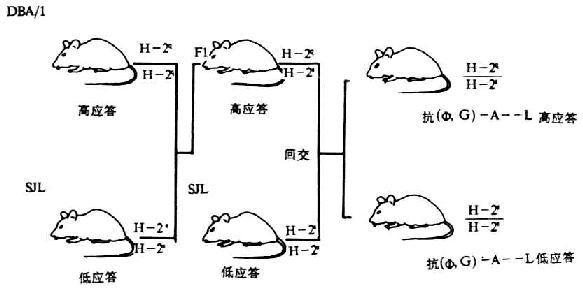
图 6 -16 应用回交试验证实小鼠对(多聚苯丙氨酸,多聚谷氨酸)- 多聚丙氨酸 - 多降赖氨酸 [φG)-A-L] 应答的 Ir 基因为单个常染色体显性遗传
表 6 -12 位 H -2 I 区内 Ir 基因位置(举例)
| 抗原 | Ir 基因 | 亚区位置 | H-2I 区以外 | |
| I-A | I-E | 的影响基因 | ||
| (T,G)-A-L | Ir-1A | + | +(Ig) | |
| (H,G)-A-L | Ir-(H,G)-A-L | + | ||
| GL Pro | Ir-GLPro | + | ||
| GL Leu | Ir-GL leu | +(β) | +(α) | |
| GL Phe | Ir-GL Phe | +(β) | +(α) | |
注:T 酪氨酸 G- 谷氨酸 A- 丙氨酸
L 赖氨酸 H- 组氨酸 Pro- 脯氨酸
Leu- 亮氨酸 Phe- 苯丙氨酸
(3)H- 2 对 DHR 的遗传控制:对人工合成抗原诱导的迟发型超敏应答(DHR)同样受 MHC 的遗传控制。H-2a.b.d.f.j.k.r.u.v单倍单倍型小鼠对多聚体 GAT(谷氨酸 60- 丙氨酸90- 酪氨酸10)的刺激表现为 DHR 应答品系(R),H-2n.p.q.s 单倍型属于无应答品系(NR)。R 品系与 NR 品系杂交,F1 为 R 品系,F1 与 NR 回交,后代 1 / 2 为 R,1/ 2 为 NR,符合单个常染色体显性遗传的规律。DHR 可以通过致敏 T 细胞传递给同基因小鼠,而不能传递给不同基因之小鼠,DHR 也可传递给有一个单体型相同之小鼠,如杂交子一代,但超敏反应程度介于前两者之间。杂交子一代的致敏 T 细胞亦可把 DHR 传递给亲代。Miller 等又进一步证明,对 GAT 迟发型超敏应答的补动传递不要求供体与受体基因型完全相同,而只有 I - A 亚区相同。
3. 人的免疫应答基因 胡蜀山等(1985)请用3H-TdR 法,以体外诱导淋巴细胞增殖刺激指数为指标,发现在无关志愿者中对(H,G)-A-L、(T、G)-A-L、(Phe、G)-A-L、GLPhe 和 GAT 抗原应答的百分率分别为 64%、54%、30%、36% 和 76%。通过家系调查表明:(1)人类对人工合成抗原泊应答也符合孟德尔单染色体显性遗传的规律;(2)控制(T、G)-A- L 和(H,G)-A- L 和 Ir 基因是不同的;(3)通过 HLA 内重组家系的 HLA 抗原的分析,提示控制(T、G)-A- L 和(H、G)-A- L 的 Ir 基因 Ir-TGAL 和 Ir-HGAL 位于 HLA- A 与 B 位点之间而与 D /DR 无关。
Ir 基因与 MHC 连锁的现象,除豚鼠、小鼠和人外,也见于大鼠、恒河猴等多种动物,表明这种现象具有普遍的生物学意义。
4. 免疫应答基因的作用模式 对某些抗原不起应答或呈低免疫应答,可能是由于 Ir 基因缺陷,Ir 基因所编码的 Ia 抗原不能与该抗原结合,或对抗原的提呈能力低,不能激活 Th,或只能引起低免疫应答。有关 Ir 基因通过其基因产物 Ia 抗原在 Mφ 与 Th 间传递抗原的水平上起作用的模式主要有 Benacerraf(1978)提出的决定基选择模型(determinant selectionmodel)(图 6 -17),该模式认为的 Mφ 表面的 Ir 基因产物有数量不限的特异性结合点,能特异地与一定的氨基酸顺序结合,这些特异的氨基酸顺序约由 3~4 个氨基酸组成,使一个复杂的外来抗原物。T 细胞抗原受体(TCR)只能识别复合物分子才发生免疫应答反应。如果某个外来抗原结构中不具备这种特定的氨基酸顺序,或 Mφ 表面 Ir 基因产物不能与外来抗原特定的决定簇结合,都不能被 TCR 所识别,表现出对这种抗原的无应答状态。
5.Is 基因和 Ts 细胞 Debre(1975)发现 GT 抗原可在某些小鼠体内诱导 Ts 细胞而抑制对 GT-MBSA(甲基化的牛血清白蛋白)的免疫应答。这种控制抑制诱导的基因是显性遗传的,与 H - 2 基因复合体有关。为了与位于 H - 2 的 Ir 基因相区别,Debre 等称之为 Is 基因。开始有人认为 Is 基因位于 I - J 亚区,最近的研究表明,Is 基因可能位于 I - A 亚区内,而目前 I - J 亚区并未得到证实。某些小鼠对一些抗原(如 CT,GAT)的无应答性是由于这些抗原诱导产生了 Ts 细胞的结果,小鼠接受这些抗原诱导的能力受 Is 基因控制。如选择性地除去 Ts 细胞后,无应答者可变不应答者。
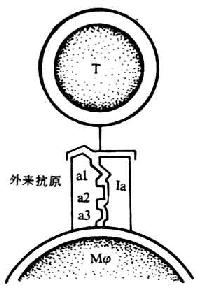
图 6 -17 决定基选择模型
免疫应答基因已逐渐超出原来的概念:一是在 MHC 内除与Ⅱ类基因有关外,还与 I 类基因有关,如流感病与 HLA-B7 亲和性高,DNFB 与 HLA-A2 亲和性高,HLA-B34、B22 者对风疹疫苗接种所产生的抗体效价较高,而 HLA-B16 者对流感疫苗无免疫应答。杂合个体比纯合个体有更多可能性对多种抗原发生应答,即有更强的抗感染能力,称之为“杂交优势”。二是 Ir 基因还可能与非 MHC 基因相连锁,如免疫球蛋白 V H基因、X 染色体以及其它基因等。
三、MHC 参与免疫细胞识别抗原
(一)抗原 /MHC 复合物的形成
外源性蛋白质被 APC 摄入细胞内,在溶酶体内被水解成肽段。同时,MHc Ⅱ类分子在内质网中装配成 αβ 异二聚体,由高尔基器转送到溶酶体,与该处带有免疫原性或主导师决定簇的抗原肽相结合形成抗原肽 /MHC 复合物,补转送到 APC 表面,被 CD4+ T 细胞所识别。
内源性抗原以病毒抗原为例。病毒 DNA 整合到细胞核 DNA 中,通过转录和翻译,在胞浆内生成特异的病毒蛋白质抗原,继而被蛋白酶体(proteasome)摄取并酶解成肽段。与此同时,内质网腔中合成 MHc I 类抗原及 β2 微球蛋白。加工处理后的肽段进入内质网腔与 MHc I 类抗原结合形成稳定的聚合体之后,被高尔基器运往细胞表面,被 CD8+ T 细胞所识别。HLa Ⅱ类基因 DQ 和 DP 之间的蛋白酶体相关基因(proteasome-relatedgenes,)和 ABC 转运物基因(ABCtransporter genes)基因产物参与内源性抗原的处理和抗原片段的转运。
(二)T 细胞识别抗原 /MHC 复合物
T 细胞是一类重要的免疫活性细胞。T 细胞本身的活化及效应功能的发挥,不仅与外来抗原和丝裂原和丝裂刺激和多种细胞因子的调节密切相关,而且有赖于 T 细胞与抗原提呈细胞(APC)之间、不同 T 细胞亚群相互之间以及 T 细胞与靶细胞之间的直接接触。CD4+ 阳性 T 细胞 TCR/CD3 识别外来抗原与 MHc Ⅱ类抗原(多态部分)的复合物,CD8+ T 细胞 TCR/CD3 识别外来抗原与 MHc I 类抗原(多态部分)复合物。此外在 T 细胞识别过程中还有赖于多种细胞表面分子的辅助,这些分子包括 CD4、CD8、MHc I 类、Ⅱ类抗原,LFA-1(CD11a/CD18)、ICAM-1(CD54)、LFA-2(CD2)和 LFA-3(CD58)等。其中 CD4 和 CD8 分子分别与 MHCⅡ类抗原和 I 类抗原的非多态部分(即Ⅱ类分子上 α2 和 β2 结构和 I 类分子上重链 α3 结构域)结合。有关内容请参考“白细胞分化抗原”和“粘附分子”两章。
四、MHC 对免疫应答中免疫细胞相互作用的限制(约束)作用
MHC 另一个重要的生物学功能是约束免疫应答过程中各类免疫细胞的相互作用,又称为 MHC 的约束性(MHc restriction),包括免疫应答感应阶段 Mφ-Th 之间,反应阶段 Th- B 之间,以及效应阶段 Tc- 靶细胞之间的相互作用。MHc I 类和Ⅱ类抗原分别对不同细胞起约束作用。
(一)Mφ、T、B 细胞相互作用过程中的 MHC 约束性
Rosenthal 和 Shevach(1973)首先在豚鼠中观察到 T 细胞只能被具有相同 MHc I 区基因(Ⅱ类基因)的抗原提呈细胞所激活(表 6 -13)。同年 Katz 等人也发现 Th 与 B 细胞相互作用时,只有在两者 MHc I 区(Ⅱ类基因)相同的条件才会出现协作应(表 6 -14)。
表 6 -13 豚鼠 T 细胞对胸腺信赖抗原的免疫应答中 Mφ 提呈抗原与 Ia 抗原的关系
| OVA 预处理 T 细胞 | OVA 加 Mφ | DNA 合成的增加 |
| 品系 2 | 品系 2 | ++++ |
| 品系 13 | 品系 13 | ++++ |
| 品系 2 | 品系 13 | — |
| 品系 13 | 品系 2 | — |
| (2*13)F1 | 品系 2 | +++ |
| (2*13)F1 | 品系 13 | +++ |
| (2*13)F1 | (2*13)F1 | ++++ |
注:豚鼠用卵清蛋白(OVA)加完全弗氏佐剂(CFA)免疫,腹腔渗出物分离的 T 细胞即为 OVA 预处理 T 细胞,在体 外与 OVA 加 Mφ- 起培养,用 3H- 胸腺嘧啶核苷掺入法作为 T 细胞特异性免疫应答。品系 2 和 13 仅在 MHC 的 I 区不同
表 6 -14 小鼠 T - B 细胞协作中受 I 区基因限制
| DNP-KLH 抗原预致敏 B 细胞的品系 | BGG 载体预致敏 T 细胞的品系 | 受照射(a*b)F1 受体对 DNP-BGG 抗体应答再次反应 |
| a | a | ++++ |
| b | b | ++++ |
| a | b | – |
| b | a | – |
| b | (a*b)F1 | ++++ |
| a | (a*b)F1 | ++++ |
| (a*b)F1 | a | ++++ |
| (a*b)F1 | b | ++++ |
注:(1)DNP-DLH:二硝基苯酚 - 钥孔墄血兰素;DGG:牛 r 球蛋白。
(2)DNP-KLH 预致敏 B 细胞为 DNP-KLH 免疫小鼠的脾细胞经抗 Thy- 1 加补体处理去除 T 细胞而获得。
(3)BGG 免疫小鼠脾细胞除去 B 细胞后为 BGG 载体预致敏 T 细胞。
(4)将 DNP-KLH 预致敏 B 细胞和 BGG 预致敏 T 细胞输入经照射后(a*b)F1 受体,再用 DNP-BGG 抗原刺激,检测机体对 DNP 抗体应答的再次反应。
(二)MHC 对 Tc 杀伤病毒感染靶细胞的约束
1.Zinkernagel-Doherty 现象 Zinkernagel 和 Doherty(1974)道德证明受牛痘病毒感染的 CBA(H-2k)小鼠中的 Tc 只能杀伤 H - 2 单体型相同的病毒感染靶细胞,而不能杀死牛痘苗病毒感的 H -2b细胞,称为“Zinkernagel-Dohertyphenomenon”。1975 年 Doherty 用淋巴细胞脉络膜脑膜炎病毒(lymphocyte-choriomeningitis virus,LCM 病毒)感染 H -2d小鼠,取出 Tc 在体外只能杀伤 LCM 病毒感染的 H -2d单体型细胞,不能杀伤 LCM 病毒感染的 H -2k细胞(见图 6 -18)。上述实验表明,Tc 对于只具有 MHC 抗原或病毒抗原中单独一种抗原的靶细胞都不起杀伤作用。
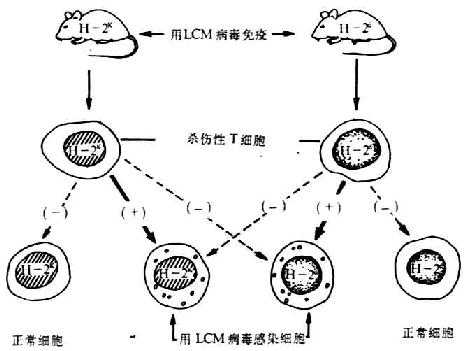
图 6 -18 MHC 对 Tc 杀伤病毒感染靶细胞的约束作用
2. MHC I 类抗原对 Tc 杀伤靶细胞的限制作用 参与免疫应答杀伤相(效应相)的 H - 2 抗原是由 K、D 区决定的,I 区并不参与,这不同于前述的免疫应答感应阶段中 Mφ-Th,Th- B 细胞之间相互作用受 I 区控制(表 6 -15)。
用三硝基苯(TNP)修饰自体的脾细胞为靶细胞也同样证实了 MHC 对 Tc 杀伤 TNP 修饰靶细胞的约束现象。在人类杀伤病毒感染或半抗原修饰的靶细胞也同样受到 I 类抗原的约束,如 McMicheal 等(1977)发现杀伤流感病毒感染的靶细胞主要受 HLA- B 位点抗原的约束,Dickmeiss(1977)实验表明杀伤 DNFB 致敏淋巴细胞诱导 Tc 杀伤靶细胞中,HLA- A 抗原必须一致。
由于自身 MHC 约束 Tc 细胞杀伤靶细胞的特异性,使体内受病毒感染或癌肿恶变的靶细胞得以迅速有效地清除,从这个意义上来讲,MHC 参与机体抗感染及免疫监视功能。
Tc 对同种异体靶细胞的杀伤作用不受自身 MHC 的约束,Longo(1982)认为体内存在着两类不同的 T 应答细胞:一类针对外来抗原 + 自身 MHC 抗原发生免疫应答;另一类对同种异体细胞发生免疫应答。
表 6 -15 小鼠特异性 Tc 细胞的杀伤作用与靶细胞 H - 2 的关系
| 靶细胞感染的病毒 | 靶细胞 H - 2 遗传背景 | 杀伤作用 | ||
| K | I | D | ||
| LCM | s | k | d | + |
| LCM | q | p | q | – |
| LCM | s | s | s | + |
| LCM | d | d | d | + |
| LCM | k | k | k | – |
| 仙台病毒 | s | k | d | – |
注:小鼠特异性 Tc 细胞取自受 LCM 病毒致敏、H- 2 型别为 K sIkDd小鼠的脾脏
八十年代初,采用基因转染技术,将 H -2b及 H -2d的 I 类基因转染小鼠白血病细胞系(L 细胞系)。这些受 I 类基因转染的细胞表面有 I 类抗原的表达。特异性 Tc 不能杀伤未经 I 类基因转染的病毒感染 L 细胞,但可杀伤经 I 类基因转染的病毒感染 L 细胞,表明转染后所表达的 I 类抗原起约束作用。Ozato 等切割 I 类基因的不同片断进行基因杂交,并将其转染到 L 细胞系,成功地得到嵌合 I 类抗原分子,如 α1 及 α2 结构域取自与杀伤细胞 I 类基因相同的基因片段,而 α3、穿膜及胞浆区取自与杀伤细胞 I 类基因不同基因片段,则杀伤细胞可杀伤病毒感染的靶细胞,所之则不然。上述试验证明,α1 及 α2 结构域是参与杀伤和约束的有效部位。
利用突变品系小鼠研究发现靶细胞 I 类抗原突变分子的微小变化便能改变 Tc 细胞对它的识别。使如 H -2kbml 突变株(b 为单倍体,m 为突变)来自 H -2Kb突变品系,只有个别氨基酸的差异,Kb约束病毒抗原特异性的 CTL 就不能识别和裂解多种病毒感染的 K b突变的 bm1 靶细胞,表明 1~3 个氨基酸的变化足以使 I 类抗原失去原有的约束作用(表 6 -16)。
3.MHC 对 Tc 杀伤病毒感染靶细胞约束的机制 目前关于 MHC 对 Tc 细胞杀伤病毒感染靶细胞约束的机制一般认为是通过联合识别(associativerecognition), 即 Tc 表面一个受体识别 MHC 编码的抗原与病毒抗原的复合物。
Benacerraf 认为 MHC I 类Ⅱ类抗耕牛具有双重功能,在诱导阶段通过其结合部位选择抗原决定基,激活 Th、Ts、Tc 等效应细胞;在效应阶段,靶细胞上的 I 类和Ⅱ类抗原又约束 Th、Ts、Tc 发挥效应。
(三)载体效应(cerriereffect)
Benacerraf 认为载体不是单纯起运载半抗原的作用,还具有载体特异性。载体处于耐受状态的动物,虽给予半抗原载体复合物,也不能诱导产生抗半抗原的抗体。对半抗原再次应答的发生有赖于对半原记忆的 B 细胞和对载体记忆 T 细胞同时存在时才能发生(图 6 -19)。
表 6 -16 K(b)- 约束的 CTL(a)对 K b(b)突靶细胞上抗原的识别
| CTL 针对病毒抗原 | 对 K b突变靶细胞的裂解 | ||||||
| bm5(1)(c) | bm6(2) | bm9(3) | bm3(2) | bm8(3) | bm11(1) | bm1(3) | |
| LCM 病毒 | ++ | ++ | ++ | + | – | ||
| 小鼠脱脚病病毒 | ± | + | + | – | |||
| SV40 | ++ | ++ | + | + | – | ||
| Moloney 氏病毒 | ++ | ++ | ++ | ++ | – | ++ | – |
| Seudai 病毒 | ++ | ++ | ++ | + | + | – | – |
| 痘苗病毒 | ++ | + | + | – | |||
| VSV | ++ | (+) | + | – | |||
| 甲型流感病毒 | ++ | (+) | – | – | |||
注:(a)CTL 是 Tc 细胞,取自各种病毒致敏的小鼠脾,其本身的 H - 2 型别为 K b;
(b)所有品系自 B6 突变而来,b 为单倍型,m 为突变;
(c)突变后氨基酸结构改变的数目
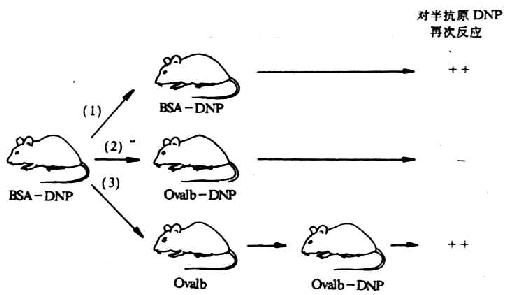
图 6 -19 载体效应
注:①第二次注射与第一次相同的半抗原(DNP)和载体(牛血清白蛋白 BSA),结果产生对 DNP 的再次反应。
②第二次反注射的抗原中,半抗原与第一次相同,载体(卵白蛋白 ovalbumin)与第一次注射抗原的载体不同,结果不产生再次反应;
③第一次注射后,单独注射卵白蛋白,经过一定时间后再注射载体为卵白蛋白、半抗原为 DNP 的抗原,结果产生再次反应。
Mitchison 等载体效应的过继转移(adoptive transfer of carrier effect)试验,证实了上述关于载体效应的结论(图 6 -20)。
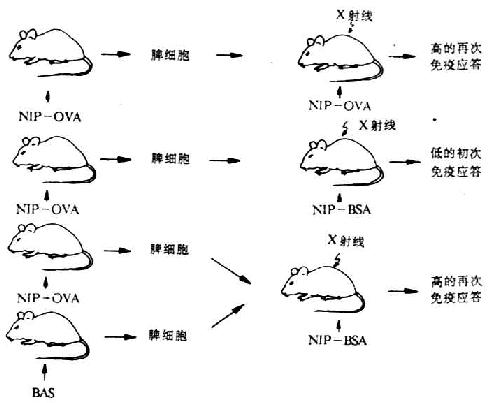
图 6 -20 载体效应的过继转移试验(Mitchison)
Raff 等载体效应阻断实验进一步证实 T 细胞是载体特异的载体反应细胞(carrier-reactivecell),B 细胞是半抗原反应细胞(hapten-reactivecell)(图 6 -21)。
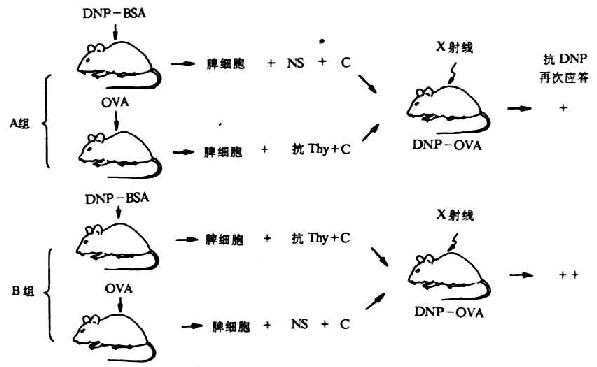
图 6 -21 半抗原、载体反应淋巴细胞的鉴定(Raff 等)
第五节 HLA 的临床应用
MHC 的研究不仅与基础免疫学有着密切的联系,而且还涉及到临床许多领域,如 HLA 与某些疾病的相关性、移植外科、输血、母胎关系,法医以及其他临床学科。
一、HLA 与疾病的相关性
(一)相关分析常用参数
在估计某一基因座位与疾病相关时,有几个常用术语,如相对危险率与归因危险、于此略予介绍。
1.RR 相对危险度的计算
| 抗 原 | ||
| + - | ||
| 疾病 +- | a b c d | a+bc+d |
| 总数 | a+c b+d | a+b+c+d=n |
a 和 b 分别代表患有某种疾病已检出和未检出某种抗原的人数;c 和 d 分别代表正常对照(末患该病)检出某种抗原和末检出某种抗原的人数;n 为调查总数,表示样本的大小。然后按 X 公式计算:
X2=(│a·d-│b·c│-n/2)2·n/(a+c)·(b+d)·(a+b)·(c+d)
根据所得的 X 2值然后从 X 2表中求出 P 值。若 P <0.05 则认为是差异显著。
如果抗原与疾病有关,则进一步计算它们关联的程度。通常用相对危险度(relative risk)RR 值来表示,RR 值越大表示相关程度越大。
RR=α·d/b·c
另一种 RR(relative risk)值计算公式是:
RR=Fp(1-Fc)/Fc(1-Fp)
Fp 为病人抗原频率,Fc 为该地区正常对照人群中的抗原频率 RR 值表示某一特定 HLA 抗原和疾病之间的相关强度,即具有该 HLA 抗原的个体较缺乏这一抗原的个体易产生这种疾病的可能性。
RR= 1 时,无区别
RR>4 时,相关较为肯定
RR<1 时,表明有抵抗基因,是一种保护而不是易感
2. 归因危险 另一个公式称归因危险(attributable risk),又叫病因系数(etiologic factor), 表示群体中病人组中有百分之多少归因于 HLA:
归因危险 =B(R-1)/[B(R-1)+1]
B 为患者人群的百分率;R 为相对危险率。如强直性脊椎炎的归因危险为 0.89 即患该病人群中有 89% 是与 HLA-B27 抗原相关。
(二)HLA-I、Ⅱ类抗原与疾病的相关情况
Lilley(1964)在动物实验中证明小鼠 Gross 病毒所致白血病的发病与 H - 2 相关(表 6-17),并提出对 Gross 型白血病易感的基因可能位于 H -2I 区内。在人类首先证实强直性脊椎炎(ankylosingspondylitis,AS)与 B27 有强相关性。以后通过群体的流行病学调查和家系调查发现许多内分泌病、类风湿性疾病、自身免疫性疾病、肿瘤和感染性疾病等与 HLA 相关。
从 1976 年 6 月在巴黎举行 HLA 系统与疾病的相关性的第一次国际性综合报告会以后,世界各地陆续报道了 HLA 与疾病的相关性研究,表 6 -18 是关于 HLa I 类与Ⅱ类基因座位与一些疾病的相关情况。从表中可见,HLA 与疾病易感相关的主要位点是 DR2、DR3、DR4 和 B27 等。此外,近年来发现某些疾病与 DQ、DP 等位基因相关,如:IDDM 与 DQA1*0301/DOB1*0302;发作性睡眠与 DQA*0102/DQB1*0602;Hodgkin 病与 DPB1*0301(欧洲白人)、DPB1*0401(明显降低,黄种人)。
表 6 -17 不同小鼠品系对 Gross 病毒致白血病的易感性
| 品 系 | H- 2 单体型 | 白血病发生率 |
| C57 | b/b | 90 天时 1% |
| 300 天时 26% | ||
| C3H | k/k | 90 天时 100% |
| (C3H*C57)F1 | b/k | 90 天时 0% |
| 300 天时 8% | ||
| 1/2(F1*C3H) | k/k | 140 天时 90% |
| 1/2(F1*C3H) | b/k | 140 天时 50% |
采用家系调查证明,HLA-B27 与某些疾病的相关情况(图 6 -22)。
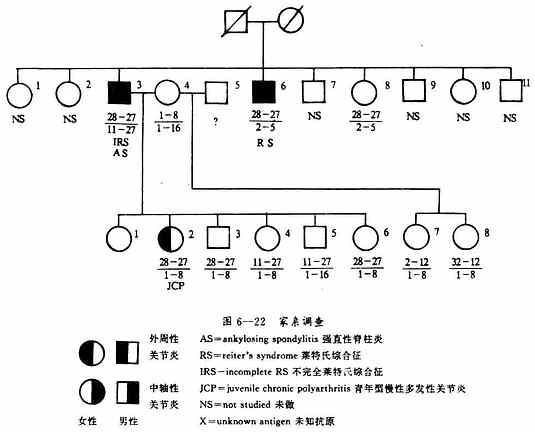
Cudworth 提出一个青年型糖尿病易感基因和抗性基因连锁不平衡的模型。糖尿病病人 HLA 某些抗原型之间有连锁不平衡现象,如 DR3、D3、B8(或 B18)A1,DR4、D4、B15(或 B40)A2 常同时出现,而 DR2、D2、B7、A3(A11)则不见于患者,即所谓抵抗基因。
从 70 年代开始,我国学者开始进行 HLA 与胰岛素依赖型糖尿病(IDDM)以及 Graves 病相关性的研究,发现 IDDM 病人组 A11 和 Cw4 的表现型频率低,而 DR3 和 DR9 表现频率比对照组高。认为 DR3、DR4 是与白种人、黄种人 IDDM 易感基因连锁的抗原;DR8、DR9 分别为日本人和中国人 IDDM 患者所特有与 IDDM 易感基因连锁的基因。Gravas 病(毒性弥漫性甲状腺肿)RR 值在 A2、B8、Cw4 和 A9 分别为 2.44、8.33、8.65 和 0.41。认为 B8 与国外报告结果相似,可能为不同人种共同特征;A2 可为东方人和黑种人共有特征;而 Cw4 则可能为中国人 Graves 病所特有的相关抗原。上海地区研究结果显示,类风湿性关节炎中 DR4 阳性百分率(43.8%)要明显高于同地区对照组(17.3%)。
近年在单座位的分子水平深入研究中真正取得了突破性进展,例如,国内外研究均证实,IDDM 的易感性在于 DQα 链 52 位精氨酸和 DQβ57 位非门冬氨酸的共同作用(白人,中国汉人)。此外关于各种疾病 HLA 各基因的等位基因标记也在陆续报道中。
表 6 -18 HLA 与疾病的关联
| 疾 病 | HLA | 相对危险率(RR) |
| 与Ⅱ类抗原相关的疾病 | ||
| 淋巴瘤甲状腺炎 | DR5 | 3.2 |
| 类风湿性关节炎 | DR4 | 5.8 |
| 疱疹样皮肤病 | DR3 | 56.4 |
| 慢性活动性肝炎 | DR3 | 13.9 |
| 粥样泻 | DR3 | 10.8 |
| 干燥综合征 | DR3 | 9.7 |
| 阿狄森氏病 | DR3 | 6.3 |
| 胰岛素依赖型糖尿病 | DR3 | 5.0 |
| DR4 | 6.8 | |
| DR3/4 | 14.3 | |
| DR2 | 0.25 | |
| DR3,DQ8 | 100.0 | |
| 甲状腺毒症 | DR3 | 3.7 |
| 肺 - 肾综合征 | DR2 | 13.1 |
| 结核样型麻风 | DR2 | 8.1 |
| 多发性硬化症 | DR2 | 4.8 |
| 嗜睡病 | DR2 | 100.0 |
| 与 I 类 HLA-B27 抗原相关的疾病 | ||
| 强直性脊柱炎 | DR27 | 103.5 |
| Reiter 氏病 | DR27 | 37.0 |
| 沙门氏菌感染后的关节炎 | DR27 | 29.7 |
| 耶尔森菌感染后的关节炎 | DR27 | 17.6 |
| 前葡萄膜炎 | DR27 | 14.6 |
| 与 I 类其他抗原相关的疾病 | ||
| 亚急性甲状腺炎 | B35 | 13,6 |
| 寻常型牛皮癣 | Cw6 | 13.3 |
| 血色素沉着病 | A3 | 8.2 |
| 重症肌无力 | 88 | 4.4 |
HLA 与某些疾病相关的机理目前尚不完合明了,可能与以下几种假说有关。
1. 分子模拟假说(molecular mimicry hypothesis)某些病原微生物的抗原与 HLA 抗原分子结构相似,即为共同抗原,可能导致两种后果:(1)机体对这种病原微生物产生交叉免疫耐受,不能产生有效的免疫应答,保护了病原微生物;(2)病原微生物刺激机体产生相应的抗体,损伤了具有共同抗原的组织细胞。如强直性脊椎炎或莱特氏综合征患者细胞表面 B27 抗原与肺炎杆菌蛋白成分有一段共同的氨基酸序列。与胰岛素依赖性糖尿病(IDDM)相关的风疹病毒膜蛋白上存在与患者 MHc Ⅱ类抗原 β 链上相同的氨基酸序列。
2. 受体学说(receptor hypothesis)HLA 抗原作为某种病毒的受体。如小鼠 MHc Ⅱ类抗原是乳酸脱氢酶病毒(lactate dehydrogenasevirus,LDV)的受体。
3. 免疫应答基因 Ir 基因通过其产物 Ia 抗原影响巨噬细胞提呈抗原或与其它细胞间相互作用,使机体对某些疾病易感。如 IDDM 的发生至少需要 DR 抗原 β 链 57 位或 DQ 抗原 β 链 57 位氨基酸之一为非天冬氨酸。
4. 连锁不平衡学说 HLA 基因与真正疾病的易感基因连锁不平衡。如几乎所有发作性睡眠病患者都是 DR2、DQ1,在 DNA 分型上常是 DQA1*0102/DQB1*0602 组合。先天性肾上腺肥大症病人,体内缺乏固醇 -21 羟化酶,常为 HLA-B47。贝切特氏病(Behcet’s disease)与 HLAB51 相关,如患者 B22 则不表现眼部症状。IDDM 患者 C4AQO,C4B3,BfF1,DR3-D3-B8(或 B18)-A1,与 DR4-D4-B15(或 B40)-A2 常同时出现。
5. 补体基因缺陷或扩展单倍型连锁不平衡 如全身性红斑狼疮为 C4AQO、C4BQO,引起补体 C4 等缺乏,尤以 C4QO 与 HLA-DR2 同时出现时发病率更高。先天性肾上腺肥大症(CAH):C4QO。慢性活动性肝炎:C4AQO、C4BQO,HAL-A1-B8-DR3-C2C-BfS-C4AQO-C4B1。Graves 病:C4B3。精神分裂证;C4BQO。IDDM:HLA-A1-Cw7-D8-C4AQO-C4B1-BfS-DR3,HLA-A30-Cw5-B18-C4A3-C4BQO-BfF1-DR3,HLA-A2-Cw3-B62-C4A3-C4B29-BfS-DR4。
表 6 -19 补体基因或补体基因缺陷和扩展单体型连锁不平衡与疾病的相关性(举例)
| 疾 病 | 补体基因(或基因缺陷)和扩展单位体型 |
| C2 缺乏症 | C2QO,HLA-A25-B18-DR2-CS42 |
| 发作性睡眠 | 德国白种人 HLA-B-DR2-CS31 |
| 欧洲人 BfS、C4A3、C4B1,常与 DR2 连锁不平衡 | |
| 全身性红斑狼疮(SLE) | C4AQO(尤与 DR2 同时出现),C4BQO |
| 胰岛素依赖性糖尿病(IDDM) | BfF1,C4QO,C4B3 |
| HLA-B8-DR3-CS01-GLO2 | |
| HLA-B18-DR3-C(F1)30 | |
| HLA-B15-DR4-CS33 | |
| HAL-B38-DR4-CS21 | |
| 慢性活动性肝炎 | C4AQO,C4BQO |
| HLA-A1-B8-DR3-CS01-GL02 | |
| 麸质过敏性肠病(或乳糜泻,GSEP) | HLA-B8-DR3-CS01 |
| HLA-B44-DR7-CF31 | |
| Graves 病 | HLA-B8-DR3-CS01 |
| HLA-B18-DR3-C(F1)30 | |
| 先天性肾上腺增生综合症(CAH) | HLA-B14-DR1-CS2(1,2) |
| HLA-B47-DR7-CF031 |
(三)HLA-Ⅲ类基因及 MHC-EH 与疾病的相关情况
HLA-Ⅲ类基因及 MHC-EH 与疾病相关的报道近年不断增加,但因与人种间的差异交叉混合,有时甚难分析,现选择比较公认的几项作为便证,略于介绍。
C4QO 的出现机制及其与疾病的关联近年颇受重视。不少实验证实 C4QO 的出现只有 50% 左右是由于 C4 基因的缺失,其作 50% 是由于基因不表达(伪基因)与基因转换(gene conversion, 如 C4A 基因表达为 C4B 产物或反之)。SLE 时 C4QO 频率增加,且在 C4RFLR 实验中证实,C4 基因的缺失频率也增高。还有报告称,白种人 C4AQO 常与 HLA-[A1-B8-DR3],C4BQO 常与 HLA-[B18-DR3]呈明显的连锁不平衡。此外 C4QO 增加的疾病还报告有 IDDM、Graves 氏病、亚急性硬化性全脑炎等。C2QO 与 SLE 的关联也较明显。至于 B f至今未见 QO 的报道。
关于 C4 单体型及补体型与疾病的关联材料不多,曾有报导法国人 IDDM 的易感补体型为 BfF-C4A3-C4BO 和 BfS1-C4A2,中性补体型为 BfF1-C4B3 和 BfF-C4A3-C4BO,保护性补体型为 BfS(或 F)-C4A3-C4B1。曾有报告称,SLE 时 CS00 较多见,重症肌无力时 CS42 较多见。
至于 HLA-EH 与疾病的关联情况报道很多,且各有不同,今选择一些如表 6 -19 供参考。
二、HLA 与器官、骨髓移植
移植免疫与免疫遗传有着密切的联系,当今器官、骨髓移植的成活率大大提高主要归功于(1)免疫遗传学理论和技术的发展;(2)强有力的免疫抑制药如环发孢素 A(cyclosprinA,CsA)和 FK506。
(一)移植排斥反应的免疫机制
前已所述,移植排斥反应的本质是一种免疫应答,移植物细胞表面 HLa I 类和Ⅱ类抗原都是强移植抗原,体液免疫和细胞免疫都参与了对移植物的排斥反应(图 6 -23)。移植排斥反应可分为三个阶段。
(1)致敏阶段:移植和抗原激发受者的免疫应作主要通过两个形式。①移植物释放出可溶性抗原或脱落的细胞碎片,随淋巴或血液到邻近或远处的淋巴组织,经过受者的抗原提呈细胞处理后,刺激并活化受者的免疫活性细胞。②受者外周血循环中的免疫细胞流经移植物时可接受移植物细胞表面移植抗原的刺激而致敏,被致敏的淋巴细胞在局部或再循环到淋巴组织中增殖。Ⅱ类抗在主要来自未能灌洗干净脏器(肾、心)中微循环中 B 细胞等(又称过路细胞 passenger cells)以及皮肤上皮细胞。I 类抗原存在更为广泛。
(2)增殖反应阶段:供体和移植抗原刺激受体的 Th 细胞发生增殖,并产生 IL-2、IL-4、IL-5、IL-6、IL- 9 和 IFN- γ 等多种细胞因子,为 B 细胞和杀伤性 T 细胞前体(CTLp)增殖和分化提供条件,并促进 Mφ 和 NK 细胞的杀伤功能。HLA- I 类抗原和Ⅱ类的 DR、DQ 抗原经巨噬细胞处理后分别刺激 CTLp 和 B 细胞,分化为效应 CTL 和抗体产生细胞,后者产生 IgG、IgM 等抗体。
(3)效应阶段:针对移植抗原的抗体通过抗体介导的细胞依赖的细胞毒作用(ADCC)或补体信赖的细胞毒作用(CDC), 直接杀伤移植物细胞;CTL 发挥细胞介导的溶细胞作用(CML); 此外,MAF、IFN- γ 和 IL- 2 等细胞因子活化后的巨噬细胞、NK 细胞可直接杀伤靶细胞。
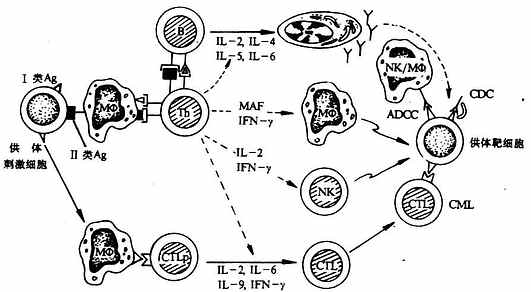
图 6 -23 移植排斥反应的免疫学机制
[环孢菌素 A 与 FK506 免疫抑制剂的抗移植排斥反应的机理]环孢菌素 A(cyclosporin A,CsA)是由 11 个氨基酸组成的环状分子,分子量 1203,70 年代初由 Sandoz 公司从真菌中发现。80 年代日本 Fujisawa 公司发现的 FK506 为大环内酯抗生素,分子量 228。CsA 和 FK506 免疫抑制作用十分相似,其机理主要是 T 细胞活化过程中 IL-2、IL-4、TNF-α、IFN- γ 等基因的转录,抑制细胞因子合成,降低 IL-2R 和转铁蛋白的表达,抑制 B 细胞针对胸腺依赖抗原的抗体形成。CsA 和 FK506 分别与作用靶细胞内环亲和素和 FK506 结合蛋白(FK506binding protein,FKBP)结合形成复合体,这类复合体的靶分子为一种称之为 Calcineurin Ca2+/ 钙调蛋白依赖性的 Ser/Ther 磷酯酶,使 Calcineurim 磷酯酶活性受到抑制,阻止活化 T 细胞核子(neulear factor of activated T cells,NFATC)的去磷酸化,从而阻止了 NFATC 向细胞核内转移,影响 IL- 2 等基因的转录。
(二)肾脏移植和异基因骨髓移植(allo-BMT)已使数以万计的肾功能衰竭患者以及急性白血病、慢性粒细胞白血病、重症再生障碍性贫血、重症联合免疫缺陷(SCID)等患者获得新生。器官和骨髓移植的存活率与供体和受体之间的组织配型密切相关,除 ABO 血型相符外,HLA 要相同或尽可能相近。HLAⅡ类基因的相合对于避免和减轻 GVHR 和肾脏等移植器官的长期存活非常重要。这是因为供者和受者 HLA-Ⅱ类抗原相合或相合较好,受者的 Th 细胞不发生或只发生轻度活化的增殖,产生细胞因子的量不足于诱导 B 细胞和 CTL 的增殖和分化。因此在 HLA-Ⅱ类抗原相合前提下,有时即使 I 类抗原不相合,受体不会发生明显的针对移植抗原的抗体应答和 Tc 的杀作用。
1. 肾脏移植 1954 年 Murray 第一次施行同卵双生姐妹之间的肾移植获得长期存活;1959 年 Murray 在美国和 Hambrager 在法国各自第一次为异卵双生同胞间施行肾移植获得长期存活;1962 年第一次用尸体肾进行人的异体移植获得长期存活。我国肾移植首次报道于 1974 年。由于分型技术和外科技术的改进,免疫抑制药物的应用以及术说输供体血,移植肾成功能率和患者存活率稳步升高。
Vredevoe(1965)报千了供者与受者间淋巴细胞抗原相容性程度与肾移植物的存活率有关。存活率由高到低的顺序是,同卵双生 > 同胞 > 亲子 > 无亲缘关系(表 6 -20)。在肾脏移植史的初期,主要检测 HLA-A、B 位点的抗原,以后有采用 MLR 配型检测 D 位点。由于 DR 与 D 抗原相关性很好,而且 DR 抗原可用血清学方法加以检测,故从 1980 年以来多采用检测 DR 抗原。Van Rood(1980)发表的欧洲移植中心的尸体肾移植 HLA-A、B 和 DR 位点抗原全部相符时,1 年移植肾存活率高达 89%,在 HLA-DR 相符而 A、B 有一个位点不符时,1 年移植肾存活率仍高达 89%,相反,如 HLA-A、B 位点完全相符而 HLA-DR 有一个不相符时移植肾 1 年存活率下降到 70%。目前倾向于 DR 和 B 位点抗原同时检测。
表 6 -20 供受者 HLA 配型与肾移植存活率(%)的关系(举例)
| 供受者 HLA 配合情况 | 存活率(%) | ||
| 3 年 | 5 年 | 10 年 | |
| 完全一致(同卵双生) | 80 | 81 | 70 |
| 一个单体型一致(父母与子女间) | 65 | 55 | 40 |
| 完全不配 | 50 | 36 | 20 |
至于尸体肾移植,在 11 次 IHW 上,Terasaki 作为“用于肾移植的 HLA 表型匹配”的专题报告,认为简单计算 HLA 特异性或错配对判断尸体供肾移植成功与否意义不大。但对 HLA 特异性氨基酸序列分析的新知识使我们有可能寻找更具免疫原性的表位,已发现“构象表位”(conformational epitopes)对移植物的长期存活具有重要作用。
2. 骨髓移植 骨髓移植的适应症有:(1)重症联合免疫缺损(CSID);(2)再生障碍性贫血;(4)放射病。
HLA 不符,尤其是 D 位点不同会引起严重的移植物抗宿主反应(GVHR)。Dupout(1977)报导了第一例重严联合免疫缺陷患者经过骨髓移植重建免疫功能。患者的基因型为:A1B3D3/A1B15D4 血型 A,供者的表型为 A1A2B8B15D4,血型 AB,共移植骨髓 7 次。我国北京医科大学血液病研究所 1981 年成功地治疗了第一例白血病女性患者,由胞兄提供同种异基因骨髓,移植后半年检查患者染色体、血型和酶的类型与胞兄完全相同,达到国际上规定的骨髓持久性植活标准。
单克隆抗体的问世给骨髓移植开辟了新途径,应用单抗加补体可去除供体骨随中成熟的 T 淋巴细胞,而供体骨髓中的干细胞在受体内经过胸腺的受训而发育的成熟 T 细胞不会把受体的组织细胞作为外来物质加以排斥,可有效地防止 GVHR 的发生。
异基因骨髓移植受益于 MHC 的研究成果最为明显,经 HLA 相合的异基因骨髓移植已使数以万计的急性白血病、慢性粒细胞白血病、重症再生障碍性贫血、SCID、代谢性疾病等患者获得了新生。
表 6 -21 全球器官移植统计资料(截止 1991 年底)
| 移植器官 | 移植中心数 | 移植病人累计数 |
| 肾脏 | 442 | 241048 |
| 心脏 | 222 | 19445 |
| 心 / 肺 | 75 | 1600 |
| 肺 | 55 | 1184 |
| 肝脏 | 155 | 21324 |
| 胰腺 | 94 | 2144 |
| 肾 / 胰 | 72 | 2854 |
| 骨髓 | 262 | 41764 |
| 其它 | 50 | 1000 |
| 总计 | 1427 | 332363 |
表 6 -22 各种器官移植存活时间最长者统计表(截止 1991 年底)
| 移植器官 | 受者存活最长时间(年) |
| 肾 脏 | 29.5 |
| 肝 脏 | 22.5 |
| 心 脏 | 21.0 |
| 骨 髓 | 23.5 |
| 胰 腺 | 14.0 |
在器官移植方面,随着免疫抑制剂(如环孢素 A)应用后排斥反应的缓解,曾一度认为选择 HLA 相容性供者已可有可无。然而近年对组织配型的重要性再次取得共识,特别认识到 HLA-Ⅱ类基因包括 DP 的相容性对移植器官存活仍是极为重要的,对骨髓移植避免 GVHR 尤为如此。但由于 HLA 多态性,Ⅰ类和Ⅱ类基因座完全相合的供受配对几乎仅见于同胞兄弟组妹之间,供者的来源相当受限。目前的解决办法有两个,一是采用单体型相同的家庭成员为供者,一是转向无血缘关系者(URD),此类 DMT 称为 UBMT。近来年,世界范围内 URD 库急剧扩大,至今已有 50 万以上 URD 的 HLA- A 和 - B 的分型记录在案,其中 18,000 人还有一 DR 和 -DQ 分型资料。这类移植中,组织配型价值更显突出。我国推行独生子女政策,对 URD 库的建立似更近切。要求供 / 受相容性的选择精确而又快速,趋势是作 DNA 分型。
三、HLA 其他临床意义
1.HLA 与输血的关系 多次输血后可使受体产生抗 HLA 抗体,白细胞膜受到破坏,释放内源性热原质,引起发热反应和白细胞下降。有建议输血小板进行治疗时,最好测定 HLA-A、B 抗原,防止由于患者产生针对血小板膜 HLA 抗原的抗体,避免血小板被破环所造成的“无反应(refractory)”现象。
2.HLA 与母关系 反复流产、胎儿血小板减少性紫瘢、粒细胞减少症、早产、畸胎、子痫前期等可能与母胎的 HLA 系统兼容有关。
3. 与老年医学关系 HLA-A1、A8、D3 连锁组与某些自身免疫病发病相关。HLA-A8 也与 T 细胞功能衰退和老年妇女的存活率下降有关。
4. 法医 应用 HLA 分型技术,排除父子关系或证实生父可靠性可达 95% 以上。上海市中心血站运用 HLA 和红细胞血型已开始办理“滴血液”的业务。HLA 和 DNA 水平的分型使法医从单根头发,极少的细胞或精子判定出个体的组织抗原型别。
目前肾、肝、心脏移植的 1 年存活率已分别达到 90-100%、70-75% 和 80-90%;其中 5 年存活率已分别达到 80-90%、60-65% 和 50-60%。在防治器官移植排斥反应中,环孢素 A(CsA)、硫唑嘌呤、皮质激素仍是目前最常用的免疫抑制剂。抗 T 细胞球蛋白(ATG)、OKT3 单克隆抗体等在防治急性排异中的应用也越来越普遍。CsA 目前趋向于采用低剂量长期应有和的方法,既发挥其防治排异的作用,又可尽量减少副作用的发生。FK-506 是一种 1986 年研制成功的免疫抑制药,是一种大环内酯类药物,对 T 细胞功能,IL- 2 和 IFN- γ 的产生均有明显的抑制作用。在肝移植、肾移植病人中均取得很好疗效,病人与器官存活率稍高于应用 CsA 的患者,但其副作用明显小于 CsA,病人无多毛症,肾毒性和致高血压作用也较轻。
(金伯泉)
参考文献
1.Abbas AK,et al.Cellular andMolecular Immunology.lst ed Philadelphia:W.B.Saunders Company,1991;98-114
2.Bjorkman PJ,et al.Structure ofthe human class i histocompatibility antige,HLA-A2.Nature,1987;329:506
3.Davis M,Bjorkman PM.T-cellantigen receptor genes and T-cell recognition.Nature,1988;334:395
4.Miller JFAP.The role of thethymus in immunity-thirty years of progress.The Immunologist,1993;1:9
5.Nagy ZA,et al.Why peotides?Their possible role in theevolution of MHC-restricted T-cell recognition.Immunol Today,1989;10:132
6.Roitt IM.Encyclopedia ofImmunology.London:Academic Press Ltd,1992;638-646,683-691,1050-1064
7.Roitt IM.EssentialImmunologly.6th ed Oxford:Blackwell Scientific Pub,1988:43-54,229-230
8.Rosen FS,et al.MaCmillanDictionary of Immunology.lst ed London Basingstoke;The MaCmillan PressLtd,1989:115-119
9.Trowsdale J,et al.Map of thehuman major histocompatibility complex.Immunol Today,1991;12:443
10.Unanue ER,Benacerraf B.Textbook of Immunology.2nd edBaltimore:Willians & Wilkins,1984:122-140,212-220
11.Zinkernagel RM,et al.MHCrestricted cytotoxic T cells:Studies on the biological role of polymorphicmajor transplantation antigen and responsiveness.Adv Immunol,1979;27:52
12. 田丁、王伟综述.HLA 系统命名. 国外轿海陆空免疫分册,1992;15(6):315
13. 膨光炎综述.TCR- 抗原肽 -MHC 产物构成的三分子复合物 - 特异性免疫应答的分子基础. 上海免疫学杂志,1993;13(1):60
14. 林剑. 免疫遗传学基因,北京大学出版社,1982:1-104
第七章 淋巴细胞群及其亚群
继胚胎早期卵黄囊、胎肝造血后,骨髓是胚胎和生后主要的造血器官。髓骨不仅提供了所有免疫细胞的来源,而且是许多免疫细胞分化成熟的场所,因此骨髓是机体重要的中枢免疫器官。
骨髓的多能造血干细胞(multipotentialhaemopoietic stem cell)具有复制和分化的特点,在骨髓微环境中基质细胞、各种集落刺激因子(colonystimulating factor,CSF)和其他造血因子(如红细胞生成素、白细胞介素)诱导下,分化为各种免疫细胞(图 7 -1)。
本章主要讨论 T 淋巴细胞及其按功能和表面标志不同所区分的 T 细胞亚群,B 细胞发育和分化,NK 细胞的表面标志和功能特点,以 T 细胞或 NK 细胞在高剂量 IL- 2 刺激下所诱导的 LAK 细胞的功能。
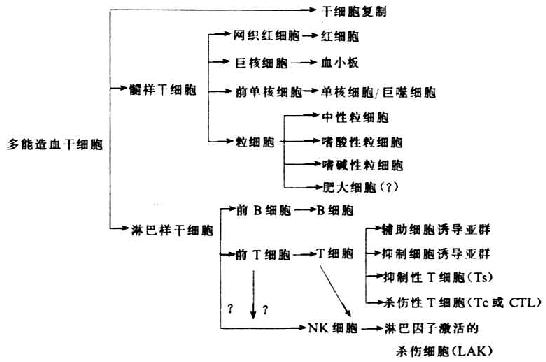
图 7 -1 骨髓干细胞和免疫细胞的分化
第一节 B 淋巴细胞的分化和表面标志
与其他造血细胞相似,B 淋巴细胞的祖细胞存在于胎肝(胚胎小鼠 14 天或通顺儿 8 - 9 周)的造血细胞岛(islanksof haemopoietic cells)中,此后 B 淋巴细胞的产生和分化场所逐渐被骨髓所代替。B 淋巴细胞(b lymphocytes)简称 B 细胞,是淋巴干细胞在鸟类法氏囊和哺乳类动物的骨髓中分化成熟而来,成熟的 B 细胞主要定居于淋巴结皮质浅层的淋巴小结和脾脏的红髓和白髓的淋巴小结内。B 细胞在抗原刺激下可分化为浆细胞,合成和分泌免疫球蛋白,主要执行机体的体液免疫(humoralimmunity)。
一、B 细胞的分化
哺乳类动物 B 细胞的分化过程主要可分为前 B 细胞、不成熟 B 细胞、成熟 B 细胞、活化 B 细胞和浆细胞五个阶段。其中前 B 细胞和不成熟 B 细胞的分化是抗原非信赖的,其分化过程在骨髓中进行。抗原依赖阶段是指成熟 B 细胞在抗原刺激后活化,并继续分化为合成和分泌抗体的浆细胞,这个阶段的分化主要是在外周免疫器官中进行的。
1. 前 B 细胞(pre-B cell)前 B 细胞是从骨髓中淋厂干细胞分化而来,只存在于骨髓和胎肝等造血组织。前 B 细胞胞浆中可检测到 IgM 的重链 μ 链,但无轻链,也无膜表面 Ig 的表达,因此缺乏对抗原的反应能力。末端脱氧核甘酸转移酶(terminal deoxynucleotidyl transferase,TdT)以及共同型急性淋巴母细胞白血病抗原(common acute lymphoblastic leukaemia antigen,CALLA)即 CD10 可表达在前 B 细胞,进入非成熟 B 细胞后这两种标志即消失,因此 TdT 和 CD10 对于区分前 B 细胞与 B 细胞其它发育阶段非常有用。CD19、CD20 和 MHCⅡ类抗原在此阶段开始表达。前 B 细胞对抗原沅应答能力。
2. 不成熟 B 细胞(immature B cell)开始表达 mIgM,但如与抗原结合,则产生负应答,使 B 细胞转变为受抑制状态,不能继续分化为成熟的 B 细胞,这是形成自身免疫耐受的机制之一。不成熟 B 细胞 CD19、CD20 和 MHCⅡ类抗原表达量增加,并可开始表达 CD21 抗原。
3. 成熟 B 细胞(matrue B cell)骨髓中发育成熟 B 细胞经血液迁移至外周淋巴器官,此时膜表面同时表达 mIgM 和 mIgD,mIgD 的表达防止了 B 细胞与抗原结合后所引起的免疫耐受。成熟 B 细胞表达补体受体 1(CR1)、致有丝分裂原受体以及多种细胞因子受体。
4. 活化 B 细胞(activated B cell)成熟 B 细胞被相应抗原或多克隆刺激剂刺激后成为活化 B 细胞,断而发生增殖和分化,在此过程中,膜结合 Ig 水平逐渐降低,而分泌型 Ig 逐渐增加,并可发生免疫球蛋白基因重链类别的转换。活化 B 细胞中的一部分可分化为小淋巴细胞,停止增殖和分化,并可存活数月至数年,当再次与同一抗原接触时,很快发生活化和分化,产生抗体的潜伏期短,抗体水平高,维持时间长,这种 B 细胞称为记忆 B 细胞(memory Bcell)。
5. 浆细胞(plasma cell,PC)又称抗体分泌细胞(antibodysecreting cell)。成熟 B 细胞接受抗原刺激后,在抗原提呈细胞和 Th 细胞的辅助下成为活化 B 细胞,进而分化为浆细胞,合成和分泌各类免疫球蛋白,同时获得了 PC-1(plasma cell antigen-1)等浆细胞特异性标志,而 mIg,MHCⅡ类抗原、CD19、CD20、CD21 等标记消失。
二、B 细胞的膜表面分子
B 细胞表面有多种膜表面分子,籍以识别抗原、与免疫细胞和免疫分子相互作用,也是分离和鉴别 B 细胞的重要依据。B 细胞表面分子主要有白细胞分化抗原、MHC 以及多种膜表面受体(图 7 -2)。
(一)CD 抗原
在 B 细胞表面重要的 CD 抗原参见第一章表 1 -1,与 B 细胞识别、粘附、活化有关的 CD 分子结构和功能参见第一章第二节。应用某些 B 细胞 CD 抗原相应的单克隆抗体可鉴定和检测 B 细胞的数量、比例、不同的分化阶段和功能状态。
(二)主要组织兼容性复合体抗原(MHC)
B 细胞不仅表达 MHC I 类抗原,而且表达较高比便和密度的 MHCⅡ类抗原。除了浆细胞外,从前 B 细胞至活化 B 细胞均表达 MHCⅡ类抗原。B 细胞表面的 MHCⅡ类抗原在 B 细胞与 T 细胞相互协作时起重要作用,此外,还参与 B 细胞作为辅佐细胞的抗原提呈作用。有关内容参见第六章“主要组织相容性复合体”。
(三)膜表面受体
B 细胞膜表面具有多种类型的受体。
1. 膜表面免疫球蛋白(surface membrane immunoglobulin,mIg)这是 B 细胞特异性识别抗原的受体,也是 B 细胞重要的特征性标志。不成熟 B 细胞表达 mIgM,成熟 B 细胞又表达了 mIgD,即同时表达 mIgM 和 mIgD,有的成熟 B 细胞表面还 mIgG、mIgA 或 mIgE。在 B 细胞分化过程中,前 B 细胞的胞浆中可有 IgM 的重链 μ 链,但无 mIgM;当发育为不成熟 B 细胞时,胞浆中 μ 链消失,胞膜上开始表达 mIgM。在单个 B 细胞表面所有 Ig 的可变区都由相同的 V H和 V L基因所编码,因此它们的独特型和结合抗原的特异性是相同的。抗原刺激后的 B 细胞 mIgD 很快消失,记忆 B 细胞表面不存在 mIgD。最近研究发现,作为 B 细胞受体(bcell receptor,BCR)的 mIgM 外,还有 Igα 和 Igβ 两种多肽链,分别命名为 CD79a 和 CD79b,共同与 mIg 形成 BCR 复合物。
| 分化阶段→定向干细胞→前 B 细胞→不成熟 B 细胞→成熟 B 细胞→活化 B 细胞→浆细胞 | ||||||
| 抗原在增殖←———– 抗原非依赖 ———-→│←——— 抗原诱导的 -→ | ||||||
| 中的作用 | ||||||
| 存在部位←———————- 骨 髓 ——————–→ | ||||||
| ←——————— 外 周 —————→ | ||||||
| 功能状态 | B 细胞前体 | 抗原无反应性 | 抗原刺激引起免疫耐受 | 抗原刺激正应答 | 抗体应答早期 | 初次和再次抗体应答 |
| IgRNA | ? | μ 重链基因重排,μmRNA | μ 重链、κ、λ 轻链基因重排,μmRNA、κmRNA、λmRNA | 初级 RNA 转录本不同剪接,形成 μmRNA 和 δmRNA | RNA 不同剪接,形成膜结合或分泌型 mRNA,重链类别转换 γ、ε 或 α 链 | 主要形成分泌型重链 mRNA |
| 表面标记 | ~ | |||||
| 胞浆 Ig | - | +(μ) | - | - | - | - |
| 膜结合 Ig | - | - | mIgM | mIgM+mIgD | mIgD↓或-重链类别转换 | ± |
| 分泌 Ig | – | – | – | – | + | +++ |
| MHCⅡ类分子 | + | + | + | + | + | – |
| CD10(CALLA) | + | + | – | – | – | – |
| C19 | + | + | ++ | + | + | – |
| C20 | – | + | ++ | + | + | – |
| CD21(CD2) | – | – | ± | + | – | – |
| CD23 | – | – | – | – | +(部分) | – |
| CD80(B7/BB1) | + | |||||
| PC | – | – | – | – | – | +++ |
| TdT | + | + | – | – | – | – |
2. 补体受体(complement receptor,CR)B 细胞膜表面具有 CR1 和 CD2。CR1(CD35)可与补体 C3b 和 C4b 结合,从而促进 B 细胞的活化。CD2(CD21)的配体是 C3d,C3d 与 B 细胞表面 CR2 结合亦可调节 B 细胞的生长和分化。详性请参见第五章第三节。
3.EB 病毒受体 CR2(CD21)也是 EB 病毒受体,这与 EB 病毒选择性感染 B 细胞有关。在体外可用 EB 病毒感染 B 细胞,可使 B 细胞永生化(immortlaized)而建成 B 细胞母细胞样细胞株,在人单克隆抗体技术和免疫学中有重要应用价值。在体内,EB 病毒感染与传染性单核细胞增多症、Burkitt 氏淋巴瘤以及鼻咽癌等的发病有关。
4. 致有丝分裂原受体 美洲商陆丝分裂原(pokeweed mitogen ,PWM)对 T 细胞和 B 细胞均有致有丝分裂作用。在小鼠,脂多糖(lipopolysaccharide,LPS)是常用的致有丝分裂原。此外金黄色葡萄球菌 CowanI 株(Staphylococcus aureus strain Cowan I,SAC)因含有金黄色葡萄球菌 A 蛋白(staphylococcal protein A,SPA), 可通过与 mIg 结合刺激人 B 细胞的增殖。此外,大豆凝集素(soybean a gglutinin,SBA)可凝集 B 细胞。
5. 细胞因子受体 多种细胞因子调节 B 细胞的活化、增殖和分化是通过与 B 细胞表面相应的细胞因子受体结合而发挥调节作用的。B 细胞的细胞因子受体主要有 IL-1R、IL-2R、IL-4R、IL-5R、IL-6R、IL-7R、IL-11R、IL-12R、IL-13R、IL-14R、IL-γR、IL-αR 和 TGF-βR 等。有关细胞因子及其受体对 B 细胞的调节作用参见第四章“细胞因子及其受体”。
第二节 T 淋巴细胞及其亚群
应用抗 T 淋巴细胞分化抗原背地里克隆抗体、流式细胞仪(folw cytometry)和免疫组织化学技术以及功能性实验,已对 T 淋巴细胞群和亚群进行了较为详尽的研究。
一、T 淋巴细胞在胸腺中的分化
(一)T 细胞在胸腺分化过程中的表型改变
淋巴干细胞早其即在胸腺内开始分化,应用小鼠胸腺细胞实验模型研究表明,在胚胎 11-12 天淋巴干细胞已进入胸腺,在胸腺微环境的影响下胸腺细胞迅速发生增殖和分化。
目前已知,诱导 T 淋巴细胞在胸腺内分化、成熟的主要因素包括:(1)胸腺基质细胞(thymus stromal cell,TSC)通过细胞表面的粘附分子直接与胸腺细胞相互作用,其中胸腺中的“抚育细胞”(nurse cell)对于 T 细胞的成熟和分化可能超着重要的调节作用;(2)胸腺基质细胞分泌多种细胞因子(如 IL-1、IL- 6 和 IL-7)和胸腺激素(如胸腺素、胸腺生成素)诱导胸腺细胞分化;(3)胸腺细胞自身分泌多种细胞因子(如 IL-2、IL-4)对胸腺细胞本身的分化和成熟也起重要的调节作用。此外,胸腺内上皮细胞、巨噬细胞和树突状细胞对于胸腺细胞分化过程中的自身耐受、MHC 限制以及 T 细胞功能性亚群的形成起着决定性作用。最近研究表明,胸腺中的 T 细胞对于胸腺基质细胞的发育和功能同样是必不可少的。
1. 功能性 TCR 的表达 应用胚胎小鼠实验系统研究发现,胚胎发育后期的胸腺细胞才有完整的 TCRα 链和 β 甸宾基因重排,并转录为功能性的 α 链和 β 链。功能性和 TCDR 表达使 T 细胞具有识别抗原多肽片段 /MHC 复合物的功能,并形成克隆分布 T 细胞抗原识别受体库。
2.TCR/CD3 复合体的表达 胸腺内的前胸腺细胞(prethymocytes,pre-T)多数表现为 CD3 阴隆,在胸腺皮质中只有部分 T 细胞为 CD3 阳性,而胸腺髓质细胞均为 CD3 阳性。随着胸腺细胞的逐渐分化和成熟,TCRα 和 β 链(或 γ 和 δ 链)以及 CD3 分别得到表达,并组成 TCR/CD3 复合体,其中 TCR 能特异性识别抗原,CD3 分子与信号转导(signal transduction)有关。
3. 功能性 T 细胞亚群的 胸腺中不同功能性 T 细胞亚群是经过一定的发育顺序而形成的。目前认为人 T 细胞在胸腺中的发育顺序见表 7 -1。
表 7 -1 人 T 细胞在胸腺内的化化和 T 细胞亚群的形成
| 部位 | 表 型 | 占胸腺细胞 % | ||
| 胸腺皮质 | CD2+CD3-CD4-CD8-TCR- | 双阴性细胞 | 2~4 | |
| ↓ | ||||
| CD2+CD3+CD4-CD8-TCR+ | 双阴性细胞 | |||
| ↓ | ||||
| CD1+CD2+CD3+CD4+CD8+TCR+ | 双阴性细胞 | 81 | ||
| ↓ | ||||
| 胸腺髓质 | CD2+CD3+CD4+ | CD2+CD3+CD4- | 单阳性细胞 | 15 |
| CD8-TCR+ | CD8+TCR+ | |||
| ↓ | ↓ | |||
| 迁移到外周血和外周淋巴器官 | ||||
小鼠胸腺细胞还具有 Thy- 1 抗原和胸腺白血病抗原, 与胸腺细胞的分化有关。
Thy- 1 抗原是 1964 年用血清学方法鉴定的小鼠 T 淋巴细胞的同种异体抗原,是小鼠全 T 细胞标志,但与 CD2 和 CD3 的结构不同,为 GPI 连接分子,25-35kDa,已命名为 CDw90。不同 T 细胞亚群 Thy- 1 抗原密度不同。外周神经组织、脑组织、成纤维细胞、上皮细胞和胎鼠骨骼肌表面也有 Thy- 1 抗原,但膜表面 Ig 阳性的 B 细胞缺乏之种抗原。用抗 Thy- 1 加补体除去 Thy- 1 阳性细胞可使 T 细胞应答完全丧失。在 T 细胞分化过程中,调节 Thy- 1 分子的表达可能与细胞与细胞之间相互作用有关。Thy- 1 与神经细胞粘附有关,并可能在免疫系统与神经系统的联系中起作用。在 T 细胞分化过程中,Thy- 1 首先表达在小鼠胸腺皮质区迅速分裂的考地松敏感细胞,皮质胸腺细胞 Thy- 1 密度高,在髓质区具有免疫潜能 T 细胞的 Thy- 1 密度降低,外周血 T 细胞表面此抗原密度相对较低。裸鼠少部分脾细胞也有低密度 Thy-1,提示 T 细胞前体具有 Thy- 1 抗原,可能相当于成鼠骨髓中低密度 Thy- 1 阳性细胞。小鼠 Thy- 1 有 112 个氨基酸残基。Thy- 1 有 2 个等位基因,所编码的抗原分别命名为 Thy-1,1 和 Thy-1,2,两者仅在第 89 位氨基酸有差别:Thy-1.1 是精氨 Thy-1.2 是谷氨酰胺。Thy- 1 氨基酸组成与免疫球蛋白恒定区和 β 微球蛋白有高度的同源性同属于免疫球蛋白超家族。
胸腺白血病抗原(thymus-leukemiaantigen,TL 或 TLa)是一类同种异体抗原,仅表达于某些白血病和不成熟的 Thy- 1 阳性胸腺细胞,为早期分化抗原。TL 抗原与小鼠 H -2K、H-2D 和 H -2L 抗原的结构相似。正常不成熟的胸腺细胞表面只出现 TL1、TL2、TL3、TL5 和 TL6 等 5 个表型,TL4 仅出现在白血病胸腺细胞上。TL 与人的 T6/Leu6 是类同物,属 CD1。
(二)T 细胞在胸腺中的选择
成熟的、有功能的 T 细胞必须经过在胸腺中阳性选择和阴性选择。主要组织兼容性复合体(MHC)抗原在这两种选择中起着关键的作用。
1. 假如一个双阳性细胞表面能与胸腺皮质上皮细胞表面 MHc I 类或Ⅱ类分子发生有效结合,就可能被选择而继续发育,否则会发生程序性的细胞死亡(programmed cell death)。MHC I 类分子选择 CD8 复合受体(coreceptor),而使同一个双阳性细胞表面 CD4 复合受体减少;MHc Ⅱ类分子选择 CD4 复合受体,而使 CD8 受体减少。这种选择过程赋于成熟 CD8+CD4- T 细胞具有识别抗原多肽片段与自身 MHc I 类分子复合物的能力,CD4+CD8- T 细胞具有识别抗原多肽片段与自身 MHc Ⅱ类分子复合物的能力,成为 T 细胞 MHC 限制现象的基础。
2. 阴性选择过程(negative selection)经过阳性选择后的 T 细胞还必须经过一个阴性选择过程,才能成为成熟的、具有识别外来抗原的 T 细胞。位于皮质与髓质交界处的树突状细胞(dendritic cell,DC)和巨噬细胞表达高水平的 MHc I 类抗原和Ⅱ类抗原,自身抗原成分与 DC 或巨噬细胞表面 MHC I 类或Ⅱ类抗原形成复合物。经过阳性选择后的胸腺细胞如能识别 DC 或巨噬细胞表面自身抗原与 MHC 抗原复合物,即发生自身耐受(self tolerance)而停止发育,而不发生结合的胸腺细胞才能继续发育为 CD4+CD8- 或 CD4-CD8+ 单阳性细胞,离开胸腺迁移到外周血液中去。
机体的某些自身抗原可通过以下几种方式来躲避免疫系统的识别,从而在胚胎期和出生后避免应答:(1)以一种免疫学上特免位置隐蔽起来,包括免疫屏障(immunologicalbarrier)和隐蔽抗原(inaccessible antigens);(2)自身抗原暴露在不表达 MHC 分子的细胞表面;(3)自身抗原浓度过低,不足于被 T 细胞所识别;(4)自身抗原与 TCR、分子结合的亲合力(avidity)还达不到 T 细胞有效刺激的水平。
(三)T 细胞在胸腺中获得 MHC 限制的能力
T 细胞识别外来抗原时,需要运用自身 MHC 抗原分子,这种能力是 T 细胞在胸腺中通过与胸腺上皮细胞的接触而获得的。来自(H-2kx H-2b)F1 小鼠的 T 细胞能够识别 KLH 与 H -2k或 H -2b单体型抗原提呈细胞表面 MHC 抗原结合的复合物。如果来自(H-2kXH-2b)F1 小鼠骨髓细胞移植到切除自身胸腺(H-2bxkF1)移植有 H -2k小鼠胸腺又进行照射的小鼠,从这种小鼠发育成熟的 T 细胞只能识别 KLH 与 H -2k单体型 APC 细胞 MHC 结合的复合物,而不能识别 KLH 与 H -2bAPC 细胞 MHC 结合的复合物(表 7 -2)。
表 7 -2 T 细胞在胸腺中获得 MHC 限制能力
| 切除胸腺小鼠的单体型 | 移植胸腺供体小鼠的单体型 | 动物照射后移植骨髓的供体小鼠单体型 | 致敏抗原 | 致敏动物 T 细胞对 KLH+ 下列不同单体型 APC 的增殖反应 | |
| H-2b | H-2k | ||||
| H-2bxkF1 | H-2bxk | H-2bxkF1 | KLH | ++ | ++ |
| H-2bxkF1 | H-2b | H-2bxkF1 | KLH | ++ | – |
| H-2bxkF1 | H-2k | H-2bxkF1 | KLH | – | ++ |
(四)成熟 T 细胞的膜表面分子
T 细胞表面有多种膜表面分子,这是 T 细胞识别抗原,与其它免疫细胞相互作用,接受信号刺激等的分子基因,也是鉴别和分离 T 细胞和 T 细胞亚群的重要依据。T 细胞膜表面分子主要有白细胞分化抗原(CD)、主要组织兼容性抗原(MHC)以及各种膜表面的受体。
1. 主要的分化抗原群 T 细胞的分化抗原群和 T 细胞膜表面分子和受体的结构和功能参见第一章“人白细胞分化抗原”,有关 T 细胞膜表面分子和 TCR 介导的信号转导参见第八章“淋巴细胞活化过程中信号转导的分子基础”。
(1)CD2 分子:表达于全部人 T 细胞以及 NK 细胞表面。人 T 细胞表面的 CD2 分子即为绵羊红细胞受体(erythrocyte receptor ,ER),在一定的体外实验条件下,绵羊红细胞可与 T 细胞 CD2 分子结合,形成玫瑰花,称 E 花环形成试验(rosette formation test),为一种细胞免疫功能的检测方法。用单克隆抗体研究证明 CD2 分子上存在着功能不同的表位:T111、T112和 T113。T111为与绵羊红细胞结合的表位,抗 T111McAb 可以 E 花环的形成。T111与一种称为淋巴细胞功能相关抗原 3(lymphocyte function associatedantigen-3,LFA-3)结合,可能与早期胸腺细胞的增殖和分化有关,也参与细胞间相互识别和粘附作用。T112与绵羊红细胞结合无关,表达在静止 T 细胞上。T113是 T 细胞活化 CD2 分子构型变化暴露出来的表位。
(2)CD3 分子:CD3 分子表达在人全部 T 细胞上,是鉴定 T 细胞的重要标记。CD3 分了是由 γ、δ、ε 和 η 等几种多肽链组成,并与 T 细胞识别抗原受体形成 TCR/CD3 复合物。其中 TCR 特异性识别抗原,而 TCR 与抗原结合后所产生的活化信号是由 CD3 分子传递到 T 细胞内部。
(3)CD42 分子:CD4 分子分布在 T 细胞的辅助细胞诱导亚群和抑制细胞诱导亚群(helper inducer/suppressor inducer)表面,在 T 细胞亚群的鉴别中具有重要意义。CD4 分子在胞膜外有 4 个结构域,其中第一结构域是人类免疫缺陷病毒(HIV)外壳蛋白 gp120 识别的部位,因此 CD4 分子是引起人类爱滋病 HIV 的受体。由于 CD4 阳性 T 细胞具有重要的免疫功能,HIV 感染 CD4 阳性 T 细胞后细胞数量明显减少,功能降低,是发生获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)的主要原因。CD4 分子可与抗原提呈细胞表面的 MHCⅡ类抗原非多态部分相结合,协助 Th 细胞识别 APC 细胞表面外来抗原与 MHCⅡ类抗原的复合物。
表 7 -3 用于测定 T 细胞表面分子的常用单克隆抗体
| 分化抗原群 | 分子量 | OKT | Leu | 分布特点 |
| (CD) | (kDa) | McAb | McAb | |
| CD1a | 49 | T6 | Leu6 | 皮质胸腺细胞 |
| CD2 | 50 | T11 | Leu5b | 绵羊红细胞受体,全 T 细胞和 NK 细胞 |
| CD3 | 16/19/20/21/26 | T3 | Leu4 | 成熟的全 T 细胞 |
| CD4 | 55 | T4 | Leu3a | 辅助细胞诱导亚群 / 抑制细胞诱导亚群 |
| CD8 | 32/36 | T8 | Leu2a | 杀伤 / 抑制性 T 细胞,少部分 NK 细胞 |
| CD5 | 67 | T1 | leu1 | 全 T 细胞,部分 B 细胞 |
| CD25 | 55 | Tac | IL- 2 受体 α 链,活化 T 细胞,部分活化 B 细胞 | |
| CD7 | 40 | Leu9 | 部分 T 细胞和 NK 细胞 | |
| CD28 | 44 | CD8+CD28+ 与 CTL 有关,活化 B 细胞 |
(4)CD8 分子:由 α、β 两条链组成,常用的 CD8 单克隆抗体如 OKT8、Leu2 等是识别 CD8 分子的 α 链。CD8 分子分布在抑制性 T 淋巴细胞(suppressor T lymphocyte,Ts)和杀伤性 T 淋巴细胞(cytotoxic T lymphocyte,CTL 或 Tc)表面,在鉴别 T 细胞亚群中有重量要作用。CD8 分子可与 MHc I 类抗原非多态部分相结合。Tc 杀伤病毒感染靶细胞时,Tc 必须同时识别外来抗原(如病毒抗原)和靶细胞上 MHc I 类抗原的复合物。
2. 主要组织相容性复合体抗原(MHC)T 细胞胞膜上表达的 MHC 抗原 I 类和Ⅱ类抗原,其中 MHc I 类抗原表达在所有发育阶段的 T 细胞表面,静止 T 细胞无 MHc Ⅱ类抗原,但 T 细胞活化后即可表达。
3. 膜表面受体(suface receptor)T 细胞表面具有多种受体,主要有以下几类。
(1)T 细胞受体(T cell receptor,TCR)为 T 细胞特异性识别抗原的受体。成熟 T 细胞功能性的 TCR 大多由 α 和 β 两条肽链所组成,称为 TCRαβ,少部分为 TCRγδ。与免疫球蛋白轻链和重链的结构相类似,TCR 的 α 和 β 链各有一个靠近 N 端和可变区(V 区)和靠近胞膜的恒定区(C 区)。由于 α 和 β 链是由 V -J- C 及 V -D-J- C 基因片段重排后所编码的,因此不同的 T 细胞克隆 TCR 的氨基酸组成和排列不同,所识别抗原的特异性也不同,形成了 T 细胞识别抗原的多样性。
(2)补体受体:已发现 T 细胞表面有 CR1(CD35),但生物学功能尚不明了。
(3)病毒受体:CD4 分子胞膜外第一个结构区是 HIV 包膜 gp120 的受体,因此 HIV 具有选择性感染 CD4 阳性 T 细胞,导致获得性免疫缺陷综合征。此外,人类嗜 T 淋巴细胞逆转录病毒(human T lymphotropicretrovirus,HTLV)或称人 T 细胞白血病毒(humanT cell leukemia virus,HTLV)主要感染人 T 细胞,与人类 T 细胞白血病发病有关。
表 7 -4 人 T、B 淋巴细胞表面分子的比较
| T 细胞 | B 细胞 | |
| PBMC 中 % | 65~80 | 10~15 |
| 表面抗原 | ||
| MHC I 类抗原 | ++ | ++ |
| MHCⅡ类抗原 | 激活的 T 细胞 | ++ |
| CD19、CD20、CD21 | – | ++ |
| CD4 或 CD8 | T 细胞亚群 | – |
| 表面受体 | ||
| mIg | – | ++ |
| TCR | ++ | – |
| CD3 | ++ | – |
| 绵羊红细胞受体(CD2) | ++ | – |
| PHA | ++ | – |
| onA | ++ | – |
| PWM | ++ | ++ |
| LPS | – | ++(小鼠) |
| SAC | – | ++ |
| HIV 受体(CD4) | ++(CD4+ 亚群) | – |
| EB 病毒受体(CR2,CD21) | – | ++ |
(4)致有丝分裂原受体:致有丝分裂原(mitohen)是指能刺激细胞发生有丝分裂的物质。在免疫学中,主要是指刺激多克隆淋巴细胞增殖的物质。不同的致有丝分裂原对 T 细胞和 B 细胞有作用有很大差别。常用的诱导 T 细胞发生增殖的致有丝分裂原有刀豆素 A(concanavalinA,ConA), 植物血凝素(phytohemagglutinin,PHA)和 PWM。在临床上常用 PHA 来刺激人外周血的 T 细胞,观察 T 细胞增殖的程度,称为淋巴细胞转化试验(lymphocyte transformation test), 是一种细胞免疫功能的体外检测方法。被转化的淋巴细胞表现为细胞体积增大,胞浆增多,细胞核着色变浅,疏松,可见到核仁。
外源凝集素(lectin)是指来自植物种子中可与某些糖和寡糖特异性结合的蛋白质,大多数外源凝集素分子含有 2 个或 4 个同源亚单位,可与细胞膜表面的糖或寡糖结合而凝集细胞。许多外源凝集素如 PHA、ConA 和 PWM 等可作为致有丝分裂原,在免疫学中广泛用于刺激淋巴细胞的增殖。
(5)细胞因子受体(cytokine receptor,CKP):多种细胞因子可作用于 T 细胞,这是由于 T 细胞表面表达有多种细胞因子的受体,如白细胞介素 - 1 受体(IL-1R)、IL-2R、IL-3R、IL-4R、IL-6R、IL-7R、IL-8R、IL-9R、IL-12R、IL-αR、G-CSFR 和 TGF-βR 等。静止和活化 T 细胞表面细胞因子受体的数目以及亲和力可有很大差别,如静止 T 细胞 IL-2R 表达 β 链,T 细胞活化后可同时表达 IL-2R 的 α 链,并与 β 链、γ 链组成与 IL- 2 结合的高亲和力受体。
表 7 -5 常用具有促有丝分裂原作用外源凝集素的特征
| 名 称 | 来 源 | 分子量(kDa) | 糖特异性 | 特性及应用 |
| 刀豆素 A | 刀 豆 | 102 | α-D-mannosyl- | T 细胞促有丝分裂原, |
| (ConA) | (jackbean) | α-D-glucose | 分离细胞膜糖蛋白 | |
| 植物血凝素 | 肾 豆 | 120 | N-acetyl-D- | T 细胞促有丝分裂原 |
| (PHA) | (kidney bean) | galactosamine | ||
| 美洲商陆丝 | 美洲商陆 | 32 | β-N-acetyl-D- | B 细胞、T 细胞促有丝 |
| 裂原(PWM) | (pokeweed) | glucosamine | 分裂原 | |
| 花生凝集素 | 花 生 | 110 | D-glalctosyl- | 分离胸腺细胞亚群 |
| (PNA) | (peanut) | (β1-3)-N-acetyl | (皮质不成熟胸腺细胞 PNA+) | |
| -D-galactosamine | 凝集免疫活性 B 细胞, | |||
| 大豆凝集素 | 大 豆 | 120 | N-acetyl-D-galac- | 净化人骨髓,用于骨髓移植 |
| (SBA) | (soybean) | tosamine D-galactose |
T 细胞表面还具有多种内分泌激素、神经递质和神经肽等受体,如生长激素、雌激素、甲状腺素、肾上腺皮质激素、肾上腺素,前列腺素 E、胰岛素等激素受体,内啡肽、脑啡肽、P 物质等神经肽受体,5- 羟色胺、多巴胺等神经递质受体。免疫细胞表面的激素、神经肽和神经递质受体是机体神经内分泌免疫网络中的一个重要环节。
二、T 淋巴细胞亚群
应用 CD4 和 CD8 单克隆抗体可将外周淋巴器官或外周血中的 T 细胞分为 CD4+CD8- 和 CD4-CD8+ 两个主要的亚群。每个亚群按照某些表面标志和功能又可分为不同的功能亚群。
(一)CD4 阳性细胞群
1.Th1 和 Th2 亚群 应用 Th 细胞克隆培养技术和细胞因子产生的不同,已发现小鼠 CD4 阳性细胞群是一个不均一的亚群,可分为 Th1 和 Th2,主要区别见表 7 -6。
Th1 细胞能合成 IL-2、IFN-γ、,LT、IL-3、TNF- α 和 GM-CSF,但不能合成 IL-4、IIL-5、IL-6、IL-10 和 IL-13;而 Th2 能合成 TNF-α、IL-3、GM-CSF、IL-4、IL-5、IL-6、IIL-10(细胞因子合成抑制因子,CSIF)和 IL-13,不能合成 IL-2、IFN- γ 和 LT。此外 Th1 和 Th2 都能分泌三巨噬细胞炎症蛋白和前脑啡肽原。Th1 和 Th2 都能辅助 B 合成抗体,但辅助的强度和性质不同。体外实验表明,IL- 4 明显促进 B 细胞合成和分泌 IgE,如使 LPS 刺激小鼠 B 细胞合成 IgE 能力增强 10-100 倍。少量 IFN- γ 能完全阴断 IL- 4 对 IgE 合成的促进作用。Th2 分泌 IL- 4 对 IgE 合成有正调节作用,而 Th1 分泌 IFN- γ 则起负调节作用。此外,Th2 通过分泌 IL- 4 和 IL- 5 辅助 IgA 合成,分泌 IL-10(CSIF), 抑制 Th1 细胞合成细胞因子,而 Th1 对 IgG1 合成则有抑制作用,但辅助其它几种类型 Ig 的合成。由于 Th1 和 Th2 合成淋巴因子的种类不同,因而介导不同的超敏反应。IL- 3 和 IL- 4 均能促进肥大细胞增殖,且相互有协同作用,IL- 5 除辅助 B 细胞合成 IgA 外,还能刺激骨髓嗜酸性粒细胞的集落形成,因而 Th2 与速发型超敏反应关系密切。Th1 通过产生 IFN- γ 阻断 IgE 合成,对速发型超敏反应有抑制作用。Th1 与迟发型超敏反应有关,可能与 IL-2、IFN- γ 等对巨噬细胞活化和促进 CTL 分化作用有关,此外 LT 也有直接杀伤靶细胞作用。两群 Th 克隆均能诱导抗原提呈细胞(APC)表达 MHCⅡ类抗原,Th1 通过 IFN- γ 诱导 Mφ 表达 Ia 抗原,而 Th2 通过 IL- 4 对 Mφ 和 B 细胞 Ia 抗原表达起正调节作用。在人类 Th1 和 Th2 细胞亚群尚未得到最后证实。从目前发表资料来看,CD4+CD45RO+ 前体细胞向 Th2 效应细胞分化,而 IFN- γ 则对前体细胞向 Th2 分化过程起抑制作用,因此 IL- 4 和 IFN- γ 在决定 CD4+CD45RO+ 前体细胞向 Th1 或 Th2 分化过程中起着重要的调节作用。人 T 细胞经多克隆活化后,在 CD4 阳性细胞中 IL-4mRNA 阳性比便不到 5%,而 60% 的 CD4+ 细胞有 IFN- γ 和 IL-2mRNA 的转录。
表 7 -6 小鼠 Th1 和 Th2 亚群的比较
| Th1 | Th2 | ||
| 合成淋巴因子种类 | IL-2 | + | – |
| IFN-γ | + | – | |
| LT | + | – | |
| IL-3 | + | + | |
| TNF-α | + | + | |
| GM-CSF | + | + | |
| IL-4 | – | + | |
| IL-5 | – | + | |
| IL-6 | – | + | |
| IL-10 | – | + | |
| IL-13 | – | + | |
| 辅助 B 细胞 | + | ++ | |
| 辅助 IgE 合成 | – | + | |
| 促进肥大细胞增殖 | – | + | |
| 介导超敏反应类型 | 迟发型 | 速发型 | |
| 促进 Ia 表达细胞 | Mφ | B,Mφ |
介导迟发型超敏反应(delayedtype hypersensitivity,DTH)的 T 细胞亚群称为 T DTH,表面标志 CD3+CD4+CD8-,可能相当于小鼠的 Th1 亚群。当曾被变应原致敏的 T DTH再次与变应原相遇后,可释放出多种细胞因子,参与迟发型(Ⅳ型)超敏反应的发生。
表 7 -7 TDTH释放细胞因子参与迟发型超敏反应
| 作用对象 | 细 胞 因 子 | 生物学活性 |
| 巨噬细胞 | 巨噬细胞趋化因子(MCF) | 招引、聚集、活化巨噬细胞, |
| 巨噬细胞移动抑制因子(MIF) | 增强巨噬细胞吞噬和杀伤功能 | |
| 巨噬细胞活化因子(MAF) | ||
| IFN-γ | ||
| 白细胞 | 白细胞移动抑制因子(LIF) | 招引、聚集白细胞 |
| 淋巴细胞 | IL-2 | 淋巴细胞局部浸润、增殖 |
| IFN-γ | 增强杀伤功能 | |
| 皮肤血管 | 皮肤反应因子(SRF) | 增加血管通透性 |
| 靶细胞 | 淋巴毒素(LT) | 杀伤靶细胞 |
MCF: macrophagechemotactic factor
MIF: macrophage migrationinhibition factor
MAF: macrophage activating factor
LIF: leukocyte migrationinhibitory factor
SRF: skin reactive factor
LT: lymphotoxin
2. 抑制细胞诱导亚群和辅助细胞诱导亚群 应用 CD45RA、CD45RO、CD29 和 CD31 单克隆抗体可将 CD4 阳性细胞群分为抑制细胞诱导亚群和辅助细胞诱导亚群。两个亚群的表面标志和功能比较见表 7 -8。
(1)CD31:最近发现 CD31 是一种新的、激活后表达水平不发生明显变化的抑制细胞诱导亚群的表面标记。CD31 是一种血小板 - 内皮细胞胞粘附分子(PECAM,gpⅡa),分子量为 140kDa,其结构属于免疫球蛋白超家族成员。从外周血新鲜分离的 CD4 细胞中,CD31McAb 主要与 CD45RA 亚群反应,对 B 细胞合成 IgG 辅助作用不明显,对 ConA 和自身 MHC(自身 MLR)反应较为敏感;而 CD31- 的 CD4 细胞群中,发现有大量辅助 B 细胞合成 IgG 的活性和对某些抗原刺激的回忆反应。CD45RA+ 的 CD4 细胞大激活后,尽管细胞表面丢失 CD45RA,但表面 CD31 的表达仍不发生明显变化;而 CD45RO+CD45RA- 的 CD4 细胞激活后不能获得 CD31 表达。由于 CD31 在 CD4 细胞激活后仍不变化,对于鉴别抑制细胞诱导亚群和辅助细胞诱导亚群是一种有用的标志。
迄今为止,许多粘附分子如 CD11a/CD18(LFA-1),LFA-3,CD2 和 CD29(VLAβ 链)主要表达在 CD45RO+ T 细胞表面。而 CD31 则表达在 CD45RA+CD4 细胞表面。抗 CD31McAb 作用于 naive T 细胞能触发其 VLA- 4 介导的粘附作用。内皮细胞表面 CD31 及其配体与 T 细胞表面 CD31 及其配体相互作用很可能触发整合素介导的粘附作用。CD31 如何参与 CD45RA+CD4+ T 细胞功能以及诱导抑制性 T 细胞产生还有待进一步研究。
(2)CD45:CD45 为异构型分子。CD45 细胞膜外部多肽链可由 A、B 和 C 三种外显子编码。人幼稚 T 细胞只表达被抗 CD45RA 识别的 CD45A 型;记忆 T 细胞不表达任何 A、B、C 外显子产物而被抗 CD45RO 识别。抗 CD45RA 和抗 CD45RO 识别的都是休止型细胞,抗 CD45RO 所识别的记忆 T 细胞往往也可低水平表达一系列活化表面标记,如 CD25、MHCⅡ类抗原、CD54、CD26 等,提示这类细胞可能新近被激活过,由此推论记忆 T 细胞可能是由于持久性抗原或交叉抗原的低剂量、持续刺激得以维持其长时间存活。体外实验观察到细胞活化后见有从 CD45RA 向 CD45RO 的单向性转变,这与幼稚 T 细胞向记忆 T 细胞分化相平行。
表 7 -8 抑制细胞诱导亚群和辅助细胞诱导亚群的比较
| 抑制细胞诱导亚群 | 辅助细胞诱导亚群 | |
| 表 型 CD4 | + | + |
| CD29 | 低密度 | 高密度 |
| CD31 | + | – |
| CD45 | CD45RA | CD45RO |
| 粘附分子(LFA、) | + | +++ |
| 增殖功能 | + | +++ |
| CD3McAb | + | +++ |
| +++ | + | |
| 抗原刺激再次反应 | – | +++ |
| 同种异体抗原 | +++ | +++ |
| 自身 MLC | +++ | + |
| 诱导和辅助功能 | ||
| 辅助 B 细胞产生抗体 | ± | +++ |
| 诱导 Ts | +++ | – |
| 诱导细胞介导的淋巴细胞溶解作用(CML) | ± | +++ |
| 细胞发育阶段 | 天然(naive) | 记忆(memory) |
(3)自身混合淋巴细胞反应:外周血 B 细胞和单核细胞等非 T 细胞在体外培养时能诱导某些自身 T 细胞发生增殖反应,称为自身混合淋巴细胞的应(autologous mixed lymphocyte reaction ,AMLR)。这一部分 T 细胞称为自身反应性 T 细胞。作为刺激细胞的 B 细胞和单核细胞主要是通过其细胞表面的 MHCⅡ类抗原来刺激自身反应性 T 细胞,在体外培养时加入抗 MHCⅡ类抗原的抗体可阻断 AMLR。关玩弄 AMLR 的生理意义尚不清楚,可能是机体的一种免疫调节机制。
(二)CD8 阳性细胞群
根据 CD28 阳性或阴性可将 CD8+ 细胞分为细胞毒性 T 细胞(CD8+CD28+)和抑制性 T 细胞(CD28+CD28-)。CD28McAb 能与 60-80%T 细胞发生反应,包括全部 CD4 细胞和部分 CD8 细胞。
1.Tc(CTL) 在人类 CTL 表型为 CD3+CD4-8+CD28+。小鼠 CTL 表型为 Thy-1+、Lyt-1+、Lyt-2+/Lyt-3+。
(1)CTL 的分化:静止的 CTL 以前体细胞(precursor)(CTL-P)形式存在,外来抗原进入机体被抗原提呈细胞(APC)加工处理,形成外来抗原与 APC 自身 MHc I 类抗原的复合物,被相应 CTL 克隆细胞膜表面 TCR/CD3 所识别,抗原刺激信号和 APC 释放 IL- 1 共同存在的条件下,CTL- p 被活化,并表达 IL-2R、IL-4R、IL-6R 等多种细胞因子受体,在 IL-2、IL-4、IL-6、IFN- γ 等细胞因子诱导下,迅速增殖,并分化为成熟的效应杀伤性 T 细胞(effector CTL)。CTL 具有识别抗原的特异性,即能杀伤具有特定的外来抗原(如病毒感染靶细胞膜表面的病毒抗原)与自身 MHc I 类抗原结合的复合物的靶细胞。有关 CTL 杀伤靶细胞受到 MHC I 类抗原的限制,参见第五章“主要组织相容性复合体”第四节。从肿瘤组织周围分离获得的 CTL 称为肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte , TIL)。TIL 在体外加 IL- 2 培养后,具有很高的杀伤肿瘤作用,目前已用于临床的肿瘤治疗。
(2)CTL 的识别机制:多种粘附分子参与 CTL 对靶细胞的识别和粘附,主要有:①LFA-1/ICAM-1、ICAM-2、ICAM-3,可溶性 ICAM-1(sICAM-1)可抑制 CTL 杀伤肿瘤细胞;②CD2/LFA-3(CD58),抗 CD2McAb 或抗 CD58McAb 均可抑制 CTL 效应细胞对靶细胞的杀伤;③CD8/MHcI 类抗原的非多态性结构域。
(3)CTL 的杀伤机制:TCL 杀伤靶细胞的机理目前认为主要通过释放多种的介质和因子介导的。
①穿孔素(perforin): 又称成孔蛋白(pore-foming protein,PFP)、C9 相关蛋白(C9 related protein)或溶细胞素(cytolysin),贮存于电子稠密胞浆颗粒(electron-densecytoplasmic granules),成熟的穿孔素分子由 534 个氨基酸残基组成,分子量为 56-75kDa,IP 为 6.4,穿孔素分子中央部位 170-390 之间的氨基酸序列与 C9328-560 氨酸酸序列约有 20% 同源性,这个区域与穿孔素和 C9 的多聚化和以管状形式插入到细胞膜有关。在杀伤相时,CTL 细胞脱颗粒,穿孔素从颗粒中释放,在 Ca2+存在下,插入靶细胞膜上,并多聚化形成管状的多聚穿孔素(polyperforin),约含 12-16 个穿孔素分子,分子量可达 1000kDa。多聚穿孔素在靶细胞膜上形成穿膜的管状结构,内径平均 16nm。这种异常的通道使 Na+、水分进入靶细胞内,K+ 及大分子物质(如蛋白质)从靶细胞内流出,改变细胞渗透压,最终导致细胞溶解。此过程与补体介导的溶细胞过程类似,溶解细胞过程比较迅速。CTL 本身可能释放 A 型硫酸软骨素蛋白聚糖(proteoglycans of chondroitinsulphate A type)、硫酸软骨素 A 限制因子(homologous restriction factor,HRF),因此可避免穿孔素对 CTL 自身细胞的攻击。
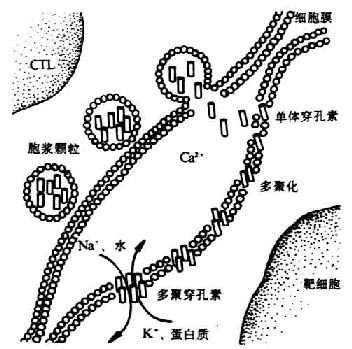
图 7 -3 CTL 释放穿孔素杀伤靶细胞机理示意图
②丝氨酸酯酶(serine estersse): 活化 CTL 释放多种丝氨酸酯酶,如 CTLA-1(又称 CCP1 或 granzyme B)、CTLA-3(又称 H 因子或 granzyme A),其作用可能类似补体激活过程中的酯酶作用,通过活化穿孔素而促进杀伤作用。
③淋巴毒素(lymphotoxin,LT): 又称肿瘤坏死因子 -β(TNF-β),LT 可直接杀伤靶细胞,但杀伤过程较慢,其杀伤机理参见第四章“细胞因子及其受体”第二节中肿瘤坏死因子。
2.Ts 和 Ts 亚群 抑制性 T 细胞(suppressor T lymphocyte,Ts)对免疫应答有重要的负调节功能,抑制性 T 细胞功能的异常,常与 T 自身免疫性疾病、第 I 型超敏反应等疾病发生有关。
(1)抑制性 T 细胞的证实:绵羊红细胞(sheep red blood cell , SRBC)对于小鼠是良好的免疫原,合适剂量的 SRBC 可诱导小鼠产生高效价的抗 SRBC 抗体。当过高剂量 SRBC 免疫小鼠时,则抗体合成水平反而明显下降,称为高剂量免疫耐受。动物实验研究发现,将高剂量免疫耐受小鼠脾细胞转移到免疫原剂量刺激的小鼠体内时,则小鼠抗体应答水平明显下降。如高剂量免疫耐受小鼠脾细胞经抗 Thy- 1 和补体处理后再转移到免疫原剂量免疫的小鼠体内,则高剂量免疫耐受小鼠脾细胞的抑制作用消失。实验证明了在高剂量免疫耐受小鼠的脾细胞中存在有抑制作用的 T 细胞。
表 7 -9 抑制性 T 细胞的证实
| (1) | 免疫原剂量 —→抗体应答 +++ |
| SRBS 免疫小鼠 | |
| (2)高剂量 SRBC———————————→抗体应答 + | |
| 免疫耐受小鼠 | |
| (3)高剂量免疫 -→转移未处理脾细胞 -→免疫原剂量 -→抗体应答 + | |
| 耐受小鼠 免疫小鼠 | |
| (4)高剂量免疫 -→转移抗 Thy-1+ —-→免疫原剂量 -→抗体应答 +++ | |
| 耐受小鼠 补体处理脾细胞 免疫小鼠 | |
进一步研究证明,这种抑制细胞的表型为 CD3+CD4-CD8+(小鼠 CD8 单抗常用 Lyt-2)。人的抑制性 T 细胞表型为 CD3+CD4-CD8+CD28-。Ts 细胞不仅对 B 细胞合成和分泌抗体有抑制作用,而且对 Th 辅助作用、迟发型超敏反应以及 Tc 介导的细胞毒作用都有负调节作用。
(2)Ts 细胞的亚群:Ts 细胞还可分为 Ts1、Ts2 和 Ts3 不同亚群,分别起着诱导抑制、转导抑制和发挥抑制效应的作用。它们之间相互作用的确切机理还不十分清楚,可能是通过释放可溶性介质相互作用的。Ts1(Tsi,抗原特异性抑制性 T 细胞)分泌 TsF1(TsiF,抑制诱导因子)→作用于 Ts2(Tst,抑制转导细胞),分泌 TsF2(Tst F)→作用于 Ts3(Tse,抑制效应细胞),分泌 Ts3F(TseF),作用于 Th 细胞,通过对 Th 的抑制作用,从而对各种免疫功能起负调节作用。Ts 细胞群具有高度异质性,除 Ts1、Ts2、Ts3 亚群外,还有一群反抑制性 T 细胞亚群(contra-suppressor T cel,Tcsl)。Tcs 活化后分泌反抑制性 T 细胞因子 TcsF,直接作用于 Th 细胞,解除 Ts 细胞的抑制作用,使 Th 细胞恢复辅助活性。
第三节 自然杀伤细胞
自然杀伤细胞(natural killer cell, NK)是机体重要的免疫细胞,不仅与抗肿瘤、抗病毒感染和免疫调节有关,而且在某些情况下参与超敏反应和自身免疫性疾病的发生。
一、NK 细胞的来原
NK 细胞确切的来源还不十分清楚,一般变人直接从骨髓中衍生,其安育成熟信赖于骨髓的微环境。小鼠和人的体外实验表明,胸腺细胞在体外 IL- 2 等细胞因子存在条件下培养也可诱导出 NK 细胞。小鼠脾脏在体内 IL- 3 诱导下可促进 NK 细胞的分化。NK 细胞主要分布于外周血中,占 PBMC5-10%,淋巴结和骨髓中也有 NK 活性,但水平较外周血低。
由于 NK 细胞具有部分 T 细胞分化抗原,如 80-90%NK 细胞 CD2+,20-30%NK 细胞 CD3+(表达 CD3ζ 链),30%NK 细胞 CD8+(α/α)和 75-90%NK 细胞 CD38+,而且 NK 细胞具有 IL- 2 中亲和性受体,在 IL- 2 刺激下可发生增殖反应,活化 NK 细胞可产生 IFN-γ,因此一般认为 NK 细胞与 T 细胞在发育上关系更为密切。
二、NK 细胞的表型
与 T 细胞、B 细胞相比,NK 细胞表面标志的特异性是相对的。人 NK 细胞 mIg-,部分 NK 细胞 CD2、CD3 和 CD8 阳性,表达 IL- 2 受体 β 链(P75,CD122),CD11b/CD18 阳性。目前常用检测 NK 细胞的标记有 CD16、CD56、CD57、CD59、CD11b、CD94 和 LAK-1(见表 7 -10)。
最近发现的一种稳定表达在 NK 和 LAK 细胞表面的 LAK- 1 分子,120kDa,NK 细胞在 IL- 2 条件下培养 30 天 LAK- 1 仍为阳性,而 HNK-1(CD57)和 CD16 部分消失。LAK 的杀伤活性可被抗 LAK-1McAb 所抑制。
表 7 -10 检测人 NK 细胞常用的标志
| CD/ 代表性 McAb | 识别膜成分 | 主要反应细胞 | NK 细胞中的阳性率(%) |
| CD16/HUNK2,Leu11 | FcγRⅢ | NK,粒细胞,巨噬细胞,T 亚群 | 80~90 |
| CD56/NKH1,Leu19 | N-CAM(神经细胞粘附分子)的异构体 | NK,激活淋巴细胞,NKC | >95 |
| CD57/HNK-1,Leu7 | gp110 | NK,T、B 亚群,NEC | 50~70 |
| CD59/NEM-43 | gp18~20,GPI 联接分子 | 活化 NK,广泛分布 | |
| CD11b/Mol,OKM1 | Mac- 1 分子的 α 链 | NK,粒细胞,单核细胞 | 80~90 |
| CD94/HP3Bi | 43/43kDa(同源二聚体) | NK | |
| 未命名 /LAK-1 | 120kDa | NK,LAK |
表 7 -11 NK 细胞和其它细胞毒效应细胞的表面标志(%)
| 表面标志 | NK 细胞 | T 细胞 | 单核细胞 | 中性粒细胞 |
| CD2 | 70~90 | >95 | <5 | <5 |
| CD8 | 20~30(抗 ζ) | >95 | ||
| CD8 | 30~40 | 30~40 | <5 | <5 |
| CD11b | 80~90 | 10~15 | >90 | >90 |
| CD15 | <5 | <5 | 60~80 | >95 |
| CD16 | 80~90 | <5 | 10~15a | >95 |
| CD56 | >95 | <5 | <5 | <5 |
a:大多数培养的或活化单核细胞均表达 CD16
三、NK 细胞的活化
NK 细胞可通过多种途径被活化,包括膜表面的 CD2、CD3 分子和多种细胞因子。
1. 通过 CD3 分子的 ζ 链 NK 细胞不表达 TCR/CD3 复合物,但部分 NK 细胞表达 CD3ζ 链,当用 CD16 抗体刺激 NK 细胞活化时,ζ 链发生酪氨酸磷酸化,引起胞浆内 Ca2+浓度升高,IP3 水平增加,促进细胞因子合成和 ADCC 作用。
2. 通过 CD2 分子 CD2 与 CD58 相互作用或用 CD2McAb 刺激可活化 NK 细胞,CD3ζ 链发生酪氨酸磷酸化。
3. 自然杀细胞刺激因子 自然杀伤细胞刺激因子(natrualkiller cell stimulatory factor ,NKSF)对 NK 细胞有刺激作用。
IL-2、IL-12、IFN-α、TNF- α 以及白细胞调节素(liukoregulin,LR)对 NK 细胞的活化和分化有正调节作用,体外培养时加入上述细胞因子可明显提高 NK 的杀伤活性。前列腺素(PG)E1、E2、D2 和肾上腺皮质激素等对 NK 细胞的活性有抑制作用。
NK 细胞表面具有 IL- 2 中亲和性受体,IL- 2 诱导 NK 的杀伤活性约需 18-24 小时,此外,IL- 2 还可诱导 NK 细胞的增殖,一般在刺激后 3 - 4 天开始发生增殖,其机理为 IL- 2 可诱导 NK 细胞表达 IL-2Rα 链,新表达的 α 链与原先细胞表面的 β 链和 γ 链结合形成高亲和性受体,在 IL- 2 存在下刺激 NK 细胞发生增殖。IL- 2 诱导 NK 细胞的活性机理尚不清楚,可能与增加细胞粘附分子的表达,提高对 NK 抵抗靶细胞的杀伤活性的关,还可能增加 NK 细胞胞浆中的颗粒以及丝氨酸酯酶 mRN 的表达,活化和促进杀伤介质的杀作用。
四、NK 细胞的功能
(一)自然杀伤活性
由于 NK 细胞的杀伤活性无 MHC 限制,不依赖抗体,因此称为自然杀伤活性。NK 细胞浆丰富,含有较大的嗜天青颗粒,颗粒的含量与 NK 细胞的杀伤活性呈正相关。NK 细胞作用于靶细胞后杀伤作用出现早,在体外 1 小时、体内 4 小时即可见到杀伤效应。NK 细胞的靶细胞主要有某些肿瘤细胞(包括部分细胞系)、病毒感染细胞、某些自身组织细胞(如血细胞)、寄生虫等,因此 NK 细胞是机体抗肿瘤、抗感染的重要免疫因素,也参与第Ⅱ型超敏反应和移植物抗宿主反应。
1. 识别靶细胞 NK 细胞识别靶细胞是非特异性的,这与 CTL 识别靶细胞机理不同,但确切的机理尚未明了。现已知淋巴细胞功能相关抗原 -1(LFA-1)与靶细胞表面的细胞间粘附分子 -1(ICAM-1)的作用参与 NK 细胞的识别过程,抗 LFA- 1 或抗 ICAM-1McAb 可抑制 NK 细胞的杀活性。此外 CD2 与 LFA-3(CD58)结合以及 CD56 也可能介导 NK 细胞与靶细胞的结合。有关白细胞分化抗原和粘附分子分别参见第一章和第二章。
2. 杀伤介质 主要有穿孔素、NK 细胞毒因子和 TNF 等。
(1)穿孔素:穿孔素是一种由 NK、CTL、LAK 等杀伤细胞胞浆颗粒释放的杀伤靶细胞的介质,有关穿孔素的结构和功能参见本章第二节。从胞浆颗粒中纯化的穿孔素在体外能溶解多种肿瘤细胞,抗穿孔素抗体可抑制杀伤活性。IL- 2 可提高穿孔素基因的转录。IL- 6 可以促进 IL- 2 对穿孔素基因转录的诱导作用。丝氨酸酯酶可能有活化穿孔素的作用。
(2)NK 细胞毒因子:NK 细胞可释放可溶性 NK 细胞毒因子(Nk cytotoxic factor,NKCF),靶细胞表面有 NKCF 受体,NKCF 与靶细胞结合后可选择性杀伤和裂解靶细胞。
(3)TNF:活化的 NK 细胞可释放 TNF- α 和 TNF-β(LT),TNF 通过①改变靶细胞溶酶体的稳定性,导致多种水解酶外漏;②影响细胞膜磷脂代谢;③改变靶细胞糖代谢使组织中 pH 降低;④以及活化靶细胞核酸内切酶,降解基因组 DNA 从而引起程序性细胞死亡等机理杀伤靶细胞。TNF 引起细胞死亡过程要明显慢于穿孔素溶解细胞的作用过程。
表 7 -12 人和小鼠 NK 敏感和敏感靶细胞
| 敏感的靶细胞 | 不敏感的靶细胞 | |
| 人 | K562 髓样白血病细胞 | Daudi Burkitt 淋巴瘤 |
| Molt- 4 急性 T 淋巴细胞白血病细胞 | Raji Burkitt 淋巴瘤 | |
| JM 急性 T 淋巴细胞白血病细胞 | LiBr 黑钯素瘤细胞 | |
| Jurkat 急性 T 淋巴细胞白血病细胞 | ||
| U-937 前单核细胞 | ||
| 某些新鲜肿瘤细胞 | ||
| 小鼠 | Yac-1 Moloney 病毒诱导的 T 淋巴病 | EL-4 Benzpyrene 诱导的胸腺 |
| (A/Sn 小鼠) | 淋巴瘤(C57BL/6) | |
| MPC-11 矿物油诱导的浆细胞瘤 | P815 Methlycholanthrene 诱导 | |
| (BLAB/ c 小鼠) | 的肥大细胞瘤(DBA/2) | |
| X-63 |
注:本表中 NK 不敏感细胞可作为 LAK 的靶细胞;NK 细胞体外在高剂量 IL- 2 诱导下可成为 IAK 细胞。
(二)ADCC(antibody-dependent cell-mediated cytotoxicity)
NK 细胞表面具有 FcγRⅢA,主要结合人 IgG1 和 IgG3 和 Fc 段(Cγ2、Cγ3 功能区),在针对靶细胞特异性 IgG 抗体的介导下可杀伤相应靶细胞。IL- 2 和 IFN- γ 明显增强 NK 细胞介导的 ADCC 作用。以前认为在淋巴细胞中由 K 细胞介导 ADCC,但至今仍未发现 K 细胞特异的表面标记,也不能证实 K 细胞是否属于一个独立的细胞群,很可能 NK 是介导 ADCC 的一个主要淋巴细胞群。具有 ADCC 功能的细胞群除 NK 外,还有单核细胞、巨噬细胞、嗜酸性粒细胞和中性粒细胞。
(三)分泌细胞因子
活化的 NK 细胞可合成和分泌多种细胞因子,发挥调节免疫和造血作用以及直接杀伤靶细胞的作用。
此外,NK 细胞可抑制 PWM 体外诱导 B 细胞的分化及抗体应答,其机理可能通过直接抑制 B 细胞或抑制辅佐细胞的抗原提呈作用。
表 7 -13 NK 细胞产生的细胞因子
| 细胞因子 | 静止 NK 细胞 | 活化的 NK 细胞 |
| IL-1 | – | – |
| IL-2 | – | – |
| IL-3 | – | + |
| GM-CSF | ?+ | + |
| G-CSF | – | – |
| M-CSF | – | + |
| IFN- α 或 β | – | ?+ |
| IFN-γ | – | + |
| IFN-α | – | + |
| TNF-β | – | + |
NK 细胞通过自然杀伤和 NDCC 发挥的细胞毒作用,在机体抗病毒感染、免疫监视中起重要作用。(1)抗病毒感染:NK 可选择性地杀伤病毒感染的靶细胞。由辅佐细胞或 NK 细胞所产生的 IFN 可协同 NK 的抗病毒作用,而对正常细胞有保护作用。另一方面,病毒感染细胞表面的病毒抗原和其它表面分子使得其对 NK 的杀伤细胞作用变得更加敏感。在体外,NK 可溶解疱疹病毒、牛痘病毒、麻疹病毒、腮腺炎病毒、巨细胞病毒和流感病毒感染的靶细胞。体内试验表明,NK 低活性小鼠品系对某些病毒感染更加敏感;注射抑制 NK 细胞的抗 Asialo GM1 抗体可加重小鼠流感病毒发生肺炎。此外,NK 细胞在体外还可杀伤某些细菌、真菌、原虫等,可能与 NK 细胞释放某些杀伤介质有关。(2)NK 细胞在免疫监视、杀伤突变的肿瘤细胞可能比 T 细胞具有更重要的作用。某些疾病如 Chediak-Higashi 或 X 性联淋巴增殖综合征患者,由于 NK 功能缺陷对恶性淋巴细胞增殖疾病特别易感。(3)参与骨髓移植后移植物抗白血病效应(graft-versus-leukemiaeffect,GVL): 在体外 NK 细胞可杀伤某些淋巴样和髓样白血病细胞。骨髓移植后数周内,来自供体的 NK 细胞的 PBL 中占相当高的比例。此外,在体内 NK 细胞还可杀伤某引起不成熟细胞如髓髓干细胞、胸腺细胞亚群等。
第三节 LAK 细胞
严格来说,LAK 细胞并非是一个独立的淋巴群或亚群,而是 NK 细胞或 T 细胞体外培养时,在高剂量 IL- 2 等细胞因子诱导下成为能够杀伤 NK 不敏感肿瘤细胞的杀伤细胞,称为淋巴因子激活的杀伤细胞(lymphokine activated killer cells,LAK)。目前应用 LAK 细胞过继免疫疗法(adoptiveimmunotherapy)与直接注射 IL- 2 等细胞因子联合治疗某些肿瘤,已获得一定的疗效。
一、LAK 细胞
1.LAK 的发现 1982 年 Grimm 等首先报道外周血单个核细胞(PBMC)中加入 IL- 2 体外培养 4 - 6 天,能诱导出一种非特异笥的杀伤细胞,这类细胞可以杀伤多种对 CTL、NK 不敏感的肿瘤细胞。目前尚未发现 LAK 细胞特有的表面标志,许多实验表明,LAK 细胞的前体细胞是 NK 细胞和 T 细胞。
2.LAK 的临床应用 1984 年 11 月 Rosenberg 研究组经美国食品和药品检验局(Us Food and Drug Administration,FDA)批准下,首次应用 IL- 2 与 LAK 协同治疗 25 例肾细胞癌、黑素瘤、肺癌、结肠癌等肿瘤患者。治疗用 LAK 细胞数量在 0.6-18.4*1010,IL- 2 用量 2.8*105-3.32*106U/kg。其中 11 例肿瘤缩小超过 50%,1 例黑素瘤完全消退。1988 年该研究组总结了 IL- 2 与 LAK 细胞协同治疗 222 例肿瘤患者,其中 16 便患者肿瘤转移灶完全消退,26 例患者肿瘤消退 50% 以上,该疗法对转移性肾细胞癌、黑素瘤、结肠癌和非何杰金氏淋巴瘤患者的疗效较显著。有报道乳腺癌、膀胱癌局部应用 IL- 2 进行治疗也获得明显疗效。
由于 IL- 2 用量大,在治疗过程中可出现毒副反应,最常见和最严重的毒副作用是出现毛细血管渗漏综合征(capillary leak syndrome,CLS),主要表现为全身性水肿和多器官功能失调,可引起胸腹腔积液、肺间质水肿和充血性心力衰竭。引地卢 CLS 的机理可能与内皮细胞损伤和产生血管活性物质有关。
二、肿瘤浸润淋巴细胞
1986 年 Rosenberg 研究组首先报道了肿瘤浸润淋巴细胞(tumorinfiltrating lymphocyte,TIL)。TIL 细胞表型具有异质性,一般来说,TIL 中绝大多数细胞 CD3 阳性。不同肿瘤来源的 TIL 细胞中,CD4+ T 细胞、CD8+ T 细胞的比例有差异,大多数情况下以 CD8+ T 细胞为主。新鲜分离的 TIL 中 CD25+ 细胞百分率较低,随着体外加 IL- 2 培养时间的延长,CD25+ 细胞百分率逐渐升高。NK 细胞的标记(CD16,CD56)在 TIL 体外加 IL- 2 培养过程中有先增高后降低的趋势。
用机械处理和酶消化方法,从肿瘤局部分离出肿瘤浸润的淋巴细胞,加入高剂量 IL- 2 体外培养,残存的肿瘤细胞 7 -13 天全部死亡。经 IL- 2 活化的 TIL 与来自 PBMC 的 LAK 细胞比较,其特点是:(1)50-100 倍,因此在治疗中可以减少效应细胞和 IL- 2 的用量,而且对 LAK 治疗无效的晚期肿瘤仍有一定治疗效果;(2)主要由 CD8 阳性细胞诱导而来,在动物实验中发现 TIL 杀伤肿瘤作用具有特异性;(3)宿主的抑制状态有利于 TIL 的杀伤作用,因此治疗时加用环磷酰胺(Cy)100mg/kg 可明显提高疗效,可能与免疫抑制药能消除抑制性细胞或因子,增强过继免疫治疗作用有关,因而可减少 IL- 2 的用量,降低毒副反应;(4)可从手术切下肿瘤组织、肿瘤引流淋巴结、癌性胸腹水中获得淋巴细胞,经加 IL- 2 培养后,其生长、扩增能力强于 LAK 细胞。已有报道应用 TIL 治疗 14 例转移性肺癌等晚期肿患者,其中 4 例肿瘤缩小 50% 以上,副作用明显低于 IL-2/LAK 疗法。
应用 LAK 或 TIL 细胞治疗肿瘤国内外进展都很快,今后发展的方向是:(1)提高 LAK 细胞的纯度,应用活化 LAK 细胞贴壁的特性,纯化粘附 LAK(adherent-LAK,A-LAK)细胞。在 IL- 2 诱导下数量可增加 100 倍,而且抗肿瘤转移的作用比 LAK 强 20-50 倍。(2)改变继承转移细胞在体内的分布,如改变注射细胞途径和方法,达到局部 / 区域继承免疫疗法的目的。(3)与其它细胞因子如 IL-12、IFN、TNF- α 和 CSF 联合治疗,增强 LAK 的杀伤活性,另有报道,抗 CD3 单抗与 IL- 2 协同,能显著提高 LAK 细胞的数量和杀伤活性。应用 CD3 单抗诱导的杀伤细胞称为 CD3 抗体激活的杀伤细胞(CD3McAb activated killer cells,CD3AK),抗体含量在 10-20ng/ml 即可达到刺激杀伤活性的高峰,体外培养数天后即可出现明显的杀伤活性。CD3AK 激活需要单核细胞存在,其增殖速度和细胞毒活性均高于 LAK。所有的 D3+CD8+ T 细胞和 1 -6%CD3+CD4+ T 细胞可诱导出 CD3AK。CD3AK 已开支应用于临床。(4)将某些细胞因子(如 IL-2、TNF 等)cDNA 转染 LAK 或 TIL 用于基因治疗。
表 7 -14 影响 LAK 效应的因素及机理
| 影响因素 | 调节方式 | 效 应 | ||
| 促进作用 | 抑制作用 | |||
| 细胞 | 单核 - 巨噬细胞 | 双向 | T、NK 产生 IL-2,表达高亲和性 IL-2r | 产生 PGE2,抑制 IL- 2 产生,消炎痛(indomethacin)可解除 Mφ 抑制作用 |
| 肿瘤细胞 | 双向 | 肿瘤细胞及其提取物增强混合淋巴细胞肿瘤细胞培养和体外致敏的 LAK 活性 | 肿瘤细胞分泌的因子抑制 LAK 活性 | |
| 中性粒细胞 | 负 | 产生超氧化阴离子(O2-) | ||
| 红细胞 | 正 | 分泌超氧化物歧化酶,抑制 O 2- 作用,促进淋巴细胞分泌 IL-2、IFN- γ 和表达 IL-2R | ||
| 细胞因子 | IL-1 | 正 | IL-2、IFN- γ 产生和 IL-2R 表达,增强 LAK 的 ADCC 效应 | |
| IL-3 | 正 | + | ||
| IL-4 | 双向 | +,多为小鼠实验系统 | -,抑制 IL- 2 诱导的 LAK 活性 | |
| IL-5 | 正 | 协同 IL- 2 诱导 LAK 活性 | ||
| IL-6 | 正 | 协同 IL- 2 诱导 LAK 活性 | ||
| IL-7 | 正 | 单独可诱导 LAK 活性 | ||
| IL-12 | 正 | 协同 IL- 2 诱导 LAK 活性 | ||
| GM-CSF | 正 | 促进 Mφ 分泌 IL-1、TNF-α | ||
| TNF-α | 正 | 与 IL- 2 有协同作用,LAK 分泌 | ||
| TNF- α 直接作用 | ||||
| IFN-γ | 双向 | 促进 LAK 分化 | 可通过单核 - 巨噬细胞分泌 PGE2 抑制 LAK 活性 | |
| IFN-β | 负 | 抑制细胞因子产生和受体 | 抑制细胞因子产生和受体表达 | |
| LR | 正 | 促进 LAK 杀伤活性 | ||
| 抗体 | 抗肿瘤细胞 | 正 | 促进 LAK 的 ADCC | |
| 抗 CD3 | 正 | 与 IL- 2 联合应用,促进 LAK 活性,增加 LAK 数量 | ||
| 抗 Tac,抗 TfR | 负 | 封闭细胞表面结构 | ||
| 抗 IFA-1 | 负 | 抑制效应细胞 - 靶细胞粘附 | ||
| 抗 LAK-1 | 负 | |||
| 双特异性抗体 | 正 | 抗肿瘤和 CD3McAb 重构的双特异性抗体 | ||
| 多糖激素神经肽 | 蘑菇多糖、黄芪 | 正 | ||
| 去甲肾上腺素 | 正 | 激活 PKC | ||
| 生长抑素 | 正 | 抑制腺苷酸环化酶 | ||
| 糖皮质激素 | 负 | – | ||
| PGE2 | 负 | |||
| β- 内啡肽 | 负 | |||
| 环孢菌素 A | 负 | – | ||
表 7 -15 生药活性多糖对细胞因子产生、淋巴细胞功能和抗肿瘤的增强作用
| 名称 | 调节作用 | 应用范围 |
| 香菇多糖(Lentinan) | 促进 IL-1、IL- 2 产生 | 免疫增强剂抗肿瘤 |
| 提高 Th 功能 | ||
| 促进 T 细胞分化和 CTL 杀伤活性 | ||
| 协同 IL- 2 激活的 LAK 杀伤活性 | ||
| 协同 IL- 2 激活的 LAK 杀伤活性 | ||
| 枸杞子多糖(Kycium Bsrbarum polysaccharide,LBS) | 促进 IL- 2 分泌 | 调节免疫功能 |
| 抗衰老 抗肿瘤(动物实验) | ||
| 刺五加多糖(polysaccharide of Acanthopanax Senlicosus,PAS) | 促进淋巴细胞对丝裂原的 | 抗癌、抗白血病 |
| 增殖反应 协同 ConA 诱导淋巴细胞分泌 IL- 2 诱生 IFN 促进 CTL 活性 | (动物实验) | |
| 黄芪多糖(Astragalus polysaccharide,APS) | 促进淋巴细胞增殖 | 治疗化疗引起 |
| 增强 Th 功能 | 的免疫抑制 | |
| 增强病毒诱生 IFN | ||
| 促进 IL-1、IL- 2 产生 | ||
| F3 成份增强 LAK 活性 |
第四节 免疫细胞中的凋谢
生存和死亡是存在于所有生物的一对矛盾,它们维持着生物界的平衡,机体的免疫系统亦不例外,免疫细胞的增殖和死亡是免疫系统得以保持自身平衡的重要条件。
细胞的死亡是人们很早就注意到的现象。1972 年 Kerr 首先提出了有别于一般死亡意义的一种新的概念,称之为凋谢(apoptosis)。对凋谢的研究近年来进展很快,引起了多学科的广泛重视,为肿瘤和自身免疫性疾病的防治等研究方面提供了新的思路。
一、凋谢的生物学特征
(一)凋谢的概念
细胞的死亡有两种方式,第一种是细胞在受到严重的操作后发和的死亡,通常表现为细胞的突然死亡。在死亡过程的最早期,线粒体的功能和形态即发生变人经,继之,细胞失去自身平衡,细胞膜的操作导致渗透压平衡的失调,细胞出现肿胀,最后胞膜破裂,胞浆内容物外泄,引起组织器官的炎症反应,这种方式被称为坏死(necrosis)。
另一种细胞死亡的方式是 1972 年 Kerr 等在正常的生理状态下观察到的,这处死亡方式最初被描述为一种正常生理状态下的形态学改变。8 年以后,这个实验小组将这种形式的细胞死亡命名为凋谢,以区别于坏死。凋谢是机体的正常细胞在受到生理性和病理性刺激后启动的自发的死亡过程,是一种主动的、信号依赖的过程,包括胞浆内 Ca2+、cAMP 升高,RNA 和蛋白质合成增加。其典型的特征是一种内源性核酸内切酶的激活和由此导致的细胞染色体 DNA 的降解,DNA 在核小体外被切断,形成约 185bp 或整数倍长度的 DNA 片段,DNA 电泳时形成特征性的梯形(ladder)电流条带。这种细胞死亡方式的另一个特点是,降解的胞浆及胞核成份被包裹于膜性成分中而形成凋谢小体(apoptosis bodies),胞膜成份和结构的改变可以被吞噬细胞表面的粘附分子及磷脂酰丝氨酸受体(phosphatidylserine receptor)快速识别,凋谢细胞被吞噬并降解,因此不引起局部的炎症反应。
(二)凋谢与坏死、程序化细胞死亡
坏死是由于补体或裂解性病毒等致细胞裂解因素造成的细胞胞膜的直接损伤,或是由于其它因素干扰胞膜上的能量依赖泵的功能而造成细胞水分、离子浓度的失衡,导致细胞膜破裂,胞浆内容物外泄,进而引起炎症,是一种病理状态下的细胞死亡。
在描述细胞死亡的术语中,还有一个概念是程序化细胞死亡(programmed cell death,PCD)。PCD 最初是发育学的一个术语,是指机体发育过程中出现的一系列与发育相关的细胞生理性死亡过程。后来,这个概念被用来指由基因介导的细胞死亡,例如放射性照射的未成熟 T 细胞经历的死亡过程。启动 PCD 的因素通常为正常的生理信号,其发生需要有某些基因的表达,给将发生 PCD 的细胞加入 RNA 或蛋白质合成抑制剂,不但不会促进 PCD 的发生,反而延迟或阻止 PCD 的发生。
凋谢和程序化细胞死亡并不是完全相同的,大部份的 PCD 过程伴有凋谢的形态学改变。但某些物种组织细胞在发育过程中经历的 PCD 并没有凋谢典型的胞膜出泡、染色质局限化和 DNA 降解。本文中,我们把凋谢和程序化细胞死亡当成是一种通用的概念。
(三)与凋谢相关的基因
所有的 PCD 过程都有新基因的表达和蛋白质的合成,在绝大多数凋谢也是如此。PCD 所需的蛋白在正常的细胞中是非组成性表达的,即这些基因的表达是诱导性的。已报道有大量的基因可能与 PCD 的发生有关,它们促进或抑制 PCD 的发生,如 c -fos、c-myc、TGF-β、p53、bcl-2、apt-4、apt-5、nuc-1、ces-2、ced-3、egl- 1 等。到目前为止,这些基因中只有小部分被确定为 PCD 所必需,如 p53 和 cel- 1 等。到目前为止,这些基因中只有小部分被确定为 PCD 所必需,如 p53 和 c -myc 的表达可以诱导某些 T 细胞和白血病细胞发生 PCD,将 p53 基因转入白血病细胞中即可迅速引起 PCD。bcl- 2 是抵抗 PCD 的基因,bcl- 2 基因的缺失突变将促进 PCD 的发生。目前,这些基因影响 PCD 的机制还不十分清楚。
二、免疫细胞中的凋谢
各种免疫细胞都存在有凋谢的现象,这对保持免疫系统的平衡十分重要。诱导免疫系统 PCD 的因素有生理性和非生理性的。生理性因素如细胞因子浓度的改变、B 细胞发育过程中 Ig 基因的重排等。非生理地因素如电离辐射、加热、药物等。体外培养的淋巴细胞对电离辐射尤为敏感,即使暴露在 2 -5Rad 下也能产生形态改变,X 身线和 Y 射线可诱导静止期的淋巴细胞出现典型的凋谢改变,这一过程有赖于大分子的合成。加热对于胸腺细胞来说是一种 PCD 凋谢特征的 DNA 降解。其它因素如甲醇、DMSO 等在低浓度条件下可诱导 PCD,浓度过高时则引起细胞的坏死。
(一)干细胞
干细胞在骨髓的造血环境中受到基质细胞、细胞外基质、生长因子和抑制因子的作用。这些因素共同作用,控制造血干细胞的自我更新和分化。细胞因子在造血干细胞的凋谢过程中发挥重要的作用,IL-3、GM-CSF、IL- 6 等不仅对于造血干细胞的增殖分化是必须的,而且对保持干细胞的存活也是必不可少的。去除这引起细胞因子将是致干细胞发生凋谢。因此,有的学者提出了一类新的造血因子概念,即造血挽救因子(survival factors),这类因子的存在可以阻断细胞凋谢的机制,通过其尝试的变化影响凋谢,达到地造血干细胞调节的作用。EPO、IL-3、GM-CSF、G-CSF 等对造血干细胞凋谢均有抑制作用。目前认为 EPO 对凋谢的抑制机理是,红系干细胞发育从 CFU- E 或更早的 BFU- E 开始进入对 EPO 的依赖阶段,在这一时期,如果失去 EPO 的维持,红系干细胞将发生凋谢,EPO 的作用只是抑制干细胞发生凋谢,但对细胞的 DNA 合成并汉骨促进作用。CFU- E 中的红系干细胞在无 EPO 存在的条件下培养 16 小时,70% 的 DNA 被降解,在 EPOSCF 存在的条件下,DNA 的降解比率分别为 3% 和 42%。
(二)T 细胞
1. 胸腺细胞的发凋谢 淋巴干细胞通过血流进入胸腺,在胸腺中的发育成熟过程中要发生基因的重排和分化,同时,胸腺细胞要经历严格的选择过程,只有那些对自身 MHC 分子亲和力较高的细胞克隆才被允许发育为 CD4+ 和 CD8+ 双阳性细胞(阳性选择)。其中那些对自身抗原和力较高的胸腺细胞必须清除(阴性选择)。胸腺细胞在胸腺中的阳性选择和阴性选择是通过凋谢机制来实现的,其机制与胸腺细胞和胸腺基质细胞间的相互作用有关。大部分的胸腺细胞是未经阳性选择或阴性选择过的,因此其平均寿命很短,只有 3 - 4 天,代表了胸腺中凋谢的整体水平。在胸腺细胞中,凋谢与内源性糖皮质激素有关,未成熟胸腺细胞对糖皮质激素是敏感的,而成熟 T 细胞对糖皮质激素则是抵抗的。
2. 活化 T 细胞与凋谢 静止 T 细胞受到丝裂原 CD3-TCR 抗体的诱导而发生增殖,产生细胞因子。同样的信号在未成熟 T 细胞和 T 细胞杂交瘤则诱导细胞的凋谢,这种凋谢也称为活化诱导的细胞死亡(activation-inducedcell death, AICD)。决定这种差别的因素目前还不完全清楚,可能与 Ca2+流量和蛋白激酶 C(PKC)有关。蛋白激酶 C 可以阻断引起核酸内切酶海参性所需的 Ca2+流,它可能通过抗原刺激依赖的第二因子(如 IL- 1 激活的蛋白激酶 C)的存在与否来诱导凋谢或增殖。
活化诱导的细胞死亡并不仅仅限于未成熟的胸腺细胞和 T 细胞杂交瘤,在成熟的外周 T 细胞也发现了类似的情况。表达 TCRαβ 或 TCRγδ 的小鼠和人 T 细胞在受到抗 CD3-TCR 抗体、PHA 或抗 Fas 单抗的诱导时发生凋谢。
(1)活化状态的外周 T 细胞更易发生凋谢:经丝裂原活化和体外扩增培养的人外周 T 细胞对凋谢更为敏感。小鼠脾脏 T 细胞在对凋谢易感之前也需要受到抗原的激活。在活化的 T 细胞中,对凋谢的敏感性在 CD4+ 和 CD8+ T 细胞亚群之间无差异,在小鼠 CD4+ 细胞中,Th1 和 Th2 亚群之间亦无明显的区别。
(2)细胞因子在凋谢中的作用:目前关于细胞因子在体外诱导和阻止凋谢中发挥作用的报道不尽一致。在辅助性 T 细胞亚群和细胞毒 T 细胞亚群中,不仅其激活和增殖需要依赖 IL-2,其存活也需要 IL- 2 的支持。如在上述细胞的培养基中支除 IL- 2 可使细胞在 6 小时内进入 PCD。在体内,这种对细胞因子的信赖性与机体在抗原清除后扩增的效应淋巴细胞亚群的消失有关。以防止过高和维持时间过长的免疫应答。
(3)抗原诱导的 T 细胞的凋谢:抗 CD3 单克隆抗体及 PHA 虽然能有效地诱导外周 T 细胞的活化,但它们不是生理性的刺激剂。目前认为 AICD 也能以抗原特异性的方式发生于 T 细胞,如超抗原葡萄球菌肠毒素(SF)能在体外及体内诱导活化 T 细胞的凋谢。抗原诱导的 T 细胞的凋谢也发生于同种异体抗原的刺激,当同时异体抗原再次刺激机体时,有 20%-30% 的同种异体反应细胞发生了 AICD。
(4)AICD 的调节及其意义:相同的抗原在通过 CD3-TCR 刺激静止 T 细胞活化的同时,也启动了活化 T 细胞的凋谢过程。那么,静止细胞和活化细胞发生凋谢是如何调节的呢?一种可能的机制是某一特定的 T 细胞克隆的活化和凋谢是同时进行的,抗原的量决定增殖抑或凋谢。SE 超抗原在诱导部分活化细胞(40%-50%)凋谢的同时,也有 MHCⅡ抗原阳性的抗原提呈细胞的作用下诱导其余 T 细胞(50%-60%)的增殖。AICD 是外周 T 细胞克隆清除(clonal deletion)的一种机制,有助于机体免疫耐受机制的建立,也是对细胞免疫调节的补充。当抗原活化的 T 细胞与特异性抗原接触时诱导部分 T 细胞发生 AICD,使得机体能在一定范围内限制免疫应答的强度。
(三)B 细胞
B 细胞根据其分化的不同阶段对抗原的刺激有不同的反应。前 B 细胞在发育过程中必须经历免疫球蛋白的基因重排。基因重排未成功的 B 细胞将发生凋谢,重排成功的前 B 细胞最先表达膜表面 IgM,如果前 B 细胞在这个阶段接触抗原,它们将会夭折,这是机体去除自身抗原反应细胞的一种机制。因为大多数出现在骨髓的抗原是自身抗原。mIgM、mIgD 阳性 B 细胞如无抗原刺激一般于 24 小时之内在脾脏中死亡,脾脏 B 细胞胞核有高浓度的 Ca2+、Mg2+,可诱导内源性的核酸内切酶,与无抗原刺激 B 细胞的凋谢有关。B 细胞 mIg 结合相应抗原的亲和力成熟在保持 B 细胞的存活中起重要作用,只有对抗原刺激能产生高亲和力抗体的 B 细胞才能逃避凋谢。
(四)髓样细胞
免疫系统其它细胞中的嗜酸性粒细胞、中性粒细胞和单核细胞都与炎症发生密切相关。体外实验表明,它们各自在炎症中的作用可通过细胞因子对凋谢的发生来加以调节。髓样细胞系 HL-60 细胞在培养时,除小部分细胞自发分化外,大部分细胞在经历 5 - 7 天的培养时间后发生凋谢。单核细胞在失去某些刺激时将发生 PCD,FMLP、C5a、MCP-1、TGF-β、IL-2、IL- 4 和 IL- 6 都不能阻止单核细胞的凋谢,而适当浓度的 IL-1β、TNF-α、TIFN- γ 和 GM-CSF 等炎症因子则能阻断单核细胞 PCD 过程。活化的单核细胞也通过自分泌方式产生 IL-1β、TNF- α 和 GM-SCF。有趣的是,TNF- α 在成熟单核细胞和单核细胞系 U937 中对 PCD 的诱导作用是完全相反的。新鲜分离的嗜酸性粒细胞在体外培养 72-96 小时后即进入 PCD,而具有促进嗜酸性粒细胞集落形成作用的 IL- 5 能使嗜酶性粒细胞的 PCD 过程推迟 80 小时。LPS、C5a 和 FMLP 在体外能以剂量依赖式推迟中性粒细胞的 PCD 过程。炎症因子对嗜酸性粒细胞和中性粒细胞 PCD 的推迟,有助于死亡的细胞被巨噬细胞完整地摄入并加以清除。
(金伯泉 孙凯)
参考文献
1.Ewijk WV ,et al .Crosstalk inthe mouse thymus. Immunol Today,1994;15(5):214
2.Joag S, et al. Mechanisms oflymphocyte-mediated lysis . J Cell Biochem,1989;39:239
3.Kirshenbaum AS, et al.Demonstration of the origin of human mast cell from CD34 + bone marrowprogenitor cell. J Immunol,1991;146(5):1410
4.Kobayash M, et al.Identification and purification of natural killer cell stimulatory factor(NKSF), a cytokine with multiple biological effects on human lymphocyte. J ExpMed,1989;170:827
5.Lanier LL ,et al.Co-association of CD3ζ with a receptor (CD16)for IgG Fc on human natural killercells.Nature,1989;342:803
6.Miller JFAP. The role of thethymus in immunity. Thirty years of progress. The Immunologist,1993;(1):9
7.Mosmann and Moore. The role ofIL-10 in cross regulation of Th1and Th2 responses. Immunol Today,1991;12:A49
8.Nitta T, et al.CD56(NKH-1/Leu19antigen) as an adhesion molecule in natural killer-target cell interaction. JExp,Med,1989;170;1757
9.Ritz J, et al. Characterizationof functional surface structures on human natural killer cells. Advances inImmunology,1988;42:181
10.Robertson MJ and Ritz J.Biology and clinical relevance of human natural killercells.Blood,1990;76(12):2421
11.Sanders EM, et al. Human naive and memory t cells:reinterpretation of helper inducer and suppressor- inducer subsets.ImmunolToday,1988;9(7):195
12.Torimoto Y, et al.CD31,a novelcell surface marker for CD4cells of suppressor lineage, unaltered by state ofactivation. j Immunol,1992;148(2):388
13.Zocchi MR et al. A Novel 120kdsurface antigen expressed by a subset of human lyphocyte. Evidence thatlymphokine- activated killer cells express this molecule and use it in theireffector function. J Exp Med,1987:166:319
14. 陈国友、曹雪涛.LAK 细胞识别、结合及杀伤肿瘤细胞分子机制的研究进展. 国外医学免疫学分册,1994;14(3):123
第八章 淋巴细胞活化过程中信号转导的分子基础
淋巴细胞是免疫系统中重要的免疫活性细胞,其活化过程的信号转导(signal transduction)及其分子基础极为复杂,是目前分子免疫学及免疫生物学中研究的热点。目前对 T 淋巴细胞活化过程中信号转导及其分子基础的研究较深入,而对 B 细胞的研究资料还较缺乏。本章着重介绍 T 淋巴细胞活化过程中信号转导的分子基础。
所谓信号转导是指外部的信号通过细胞膜上的受体蛋白传到细胞内部,并激发出诸如离子通透性、细胞形状或其它细胞功能改变的应答过程。信号转导的最终结果是活化了某些蛋白分子,活化后的蛋白发生构型变化,具有了转录因子的功能,它们作用于靶基因,使一些基因打开或使一些基因关闭,从而引起细胞功能的改变。T 淋巴细胞活化是一个涉及多种细胞表面受体以及一系列相关多肽的复杂过程。T 细胞受体(TCR)提供了识别和结合配体的结构,而多种相关分子则是作为信号转导途径中的介体(mediators)。抗原或 T 细胞受体(TCR)复合体相应抗体的刺激,激活了 T 细胞多种信号传导途径,它们各自发挥级联(cascade)反应,调节最初的活化步聚,并将信号转导进入细胞核内,触发在遗传上预先确定的若干个途径中的某一个或几个途径,并诱导 T 细胞的增殖和分化,从而发挥其效应功能。
目前认为 T 细胞的活化途径除经典的磷脂酰肌醇(phosphatidylimositol)代谢途径之外,还包括蛋白酪酸激酶途径以及 T 细胞活化旁路途径。磷脂酰肌醇代谢途径可在 T 细胞及其它多种细胞类型中发挥作用,通过磷脂酰 4,5- 二磷酸肌醇(PIP2)的水解以及 1,4,5- 三磷酸股醇(IP3)和 1,2- 二酰基甘油(diacylglycerol,DAG)第二信使的形成,导致细胞内钙离子的流动,从而活化丝氨酸 - 苏氨酸特异的蛋白激酶 C(proteinkinase C,PKC)(图 8 -1)。蛋白酪氨酸激酶途径是一种不同于磷脂酰肌醇代谢途径的新的 T 细胞活化途径,主要是通过蛋白酪氨酸激酶(protein tyrosinedinase,PTK)以及一些调控 PTK 的酶而活化 T 细胞的。T 细胞活化旁路途径是指由 T 细胞表面多种分子参与活化信号传递的途径,在小鼠 T 细胞参与旁路途径活化的表面分子有 Ly-6、Thy- 1 和 Qa-2;有人类有 CD2、CD5、CD28、CD55、CD59、CD73 和 VLA-5(CD49e/CD29)等。酪氨酸磷酸化及去磷酸化是 T 细胞淋巴活化过程中重要的早期事件,并受到多种酶的控制,这些酶通过与 T 细胞活化过程中的其它分子的密切联系,一起控制淋巴细胞活化过程中的信号转导。
T 淋巴细胞活化通常需要克隆型 TCR(clonotypic TCR)同抗原提呈细胞(APC)表面主要组织相容性复合体(MHC)分子所提呈抗原多肽相互作用。TCR/CD3 复合物中 TCR 提供特异性结合抗原的结构,CD3 分子参与受体的装配及信号传递。目前认为,在 TCR/CD3 结合抗原后可以导致一个或多个与之相关 PTKs 的活化,随后发生多种底物酪氨酸磷酸化以及磷酶 Cγ1(phospholipase C γ1,PLCγ1)的活化,后者使 PIP2 水解形成 DAG 和 IP3,这些第二信使可引起细胞内钙离子尝试突然升高,最后导致 T 细胞的活化增殖。经 TCR 介导信号传递过程中涉及到许多相关分子,主要包括 TCR/CD3 复合体、G 蛋白、PTKs、蛋白酷氨酸磷酸酯酶(protein tyrosine phosphatase,PTPase)、PLC 以及 PKC 等。
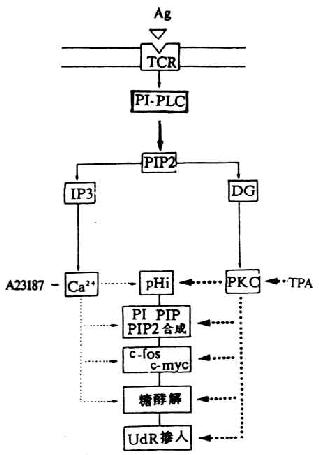
图 8 -1 磷脂酰肌代谢途径(模式图)
注:抗原与 TCR 结合后可激活磷脂酰肌醇特异的磷脂酶 C,随后它作用于 PIP2,使之产生 IP3 和 DAG。IP3 和 A23187 可使细胞内钙离子浓度升高;DAG 和 TPA 可以激活 PKC。
TCR:T cell receptor,T 细胞受体
PLC:phospholipase C, 磷脂酶 C
PI:inositol phospholipids, 磷脂酰肌醇
PIP2:phosphatidyl inositol P2, 磷脂酰肌醇二磷酸
IP3:inositol P3, 肌醇三磷酸
PKC:protien kinase C, 蛋白激酶 C
DAG:diacylglycerol, 二酰基甘油
A23187: 钙离子载体
TPA:12-0-tetradecanoylphordol-13-acetate, 乙酸豆寇佛波酯
PI-PIC,磷脂酰肌醇特异性的磷脂酶 C
第一节 TCR/CD3 复合体
TCR/CD3 复合体中的两个多态型亚单位(TCRαβ 或 TCRγδ)主要功能是识别结合 MHC 分子的抗原,而胞浆区非常短;CD3 分子的主要功能是参与 TCR/CD3 复合体的装配和稳定以及信号转导(表 8 -1)。CD3 分子亚单位的胞浆内部分含有一个共同的序列,即 D /EX2YX2L/IX8YX2L/I,其中含有两个 YXXL/ I 结构。由于其序列同淋巴细胞抗原识别后淋巴细胞的活化及信号转导关系密切,因而把此序列称为抗原识别活化基序(antigen recognition acivation motifs,ARAMS)其中含有两个 YXXL/ I 结构。由于其序列同淋巴细胞抗原识别后淋巴细胞的活化及信号转导关系密切,因而把此序列称为抗原识别活化基序(antigen recognition activation motifs,ARAMS)。其中 CD3γ、ε、δ 各含一个 ARAM,η 链含二个,ζ 链含三个。此外,在 B 细胞受体(b cell receptor ,BCR)α 链(Igα、CD79a)和 β 链(Igβ、CD79b)、FcγRⅢ以及 Fcεr I 的 γ 链、FcεR I β 链等中也含有类似结构的 ARAM。经突变及嵌合分子等研究证实,ARAM 是 TCR 信号转导的结构基础,单独分离的 ARAM 能够转 TCR 介导的信号。TCR 与抗原结合后可激活一些 PTKs,包括 TCR 相连的 p59fyn、ZAP-70(ζassociated protein-70)、CD4/CD8 相连的 p56lck以及其它 src 相关的 PTKs(图 8 -2),随后引起多种底物的酪氨酸磷酸化。
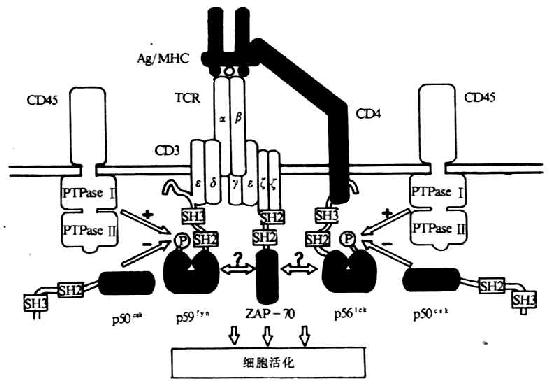
图 8 -2 TCR 与抗原结合后导致一些激酶的活化
目前证实 TCR 激活的 PTKs 底物有原癌基因产物 Vav、42kDa 的微管相关蛋白激酶(Mi-crotubule-associated protein kinase,MAPK)、PLCγ1 及 CD3ζ 链(图 8 -3)。这些磷酸化的蛋白在信号转导中具有重要作用。
TCR/CD3 复合体根据结构特点可分为三组:(1)两个多态型亚单位即 TCRβ 或 TCRγδ,属免疫球蛋白超家族成员,各含有一个 V 区和一个 C1 区;(2)CD3γ、δ 和 ε 链,亦属免疫球蛋白超家族成员,各含有一个 C2 区;(3)ζ 和 η 链,胞膜外区很短,不属于免疫球蛋白超家庭的成员(图 8 -4)。
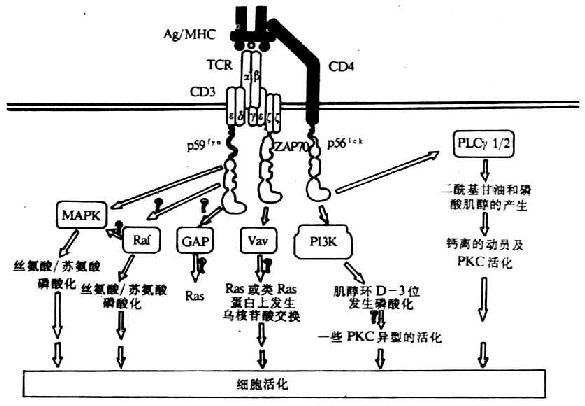
图 8 -3 TCR 同抗原结合后所引起的 PTKs 底物磷酸化
一、TCRαβ 和 TCRγδ
TCRαβ 和 TCRγδ 中两个多态型亚单位具有类似免疫球蛋白可变区(V)和恒定区(C)的结构域,其中 V 区能同抗原特异地结合。αβ 或 γδ 链通常以异源二聚体形式表达在 T 细胞表面,成熟的 T 淋巴细胞根据其细胞表面表达的异源二聚体受体类型不同可分为两个亚群:TCRαβ 亚群,包括大多数的外周成熟 T 细胞;TCRγδ 亚群,主要是定居在组织上皮中大多数淋巴细胞。
(一)TCRαβ
CD4 阳性 TCRαβ T 细胞可识别非已 MHCⅡ类抗原(同种异体抗原)或自身 MHCⅡ类抗原与外来抗原复合物。CD8 阳性 TCRαβT 细胞则可识别非已 MHC I 类抗原或自身 MHC I 类抗原与外来抗原的复合物。α 链分子量 44-60kDa,等电点为 4.4-4.7;β 链 40-55kDa,等电点 6.0-6.2。α 和 β 链各由一个可变区(V 区)和一个恒定区(C 区)组成,与 Ig 的 V 区和 C 区大小相似。每个功能区系由二硫键相连的 50-60 氨基酸残基组成的环肽。此外还有一个穿膜区和一个烄短的含亲水氨基酸的胞浆部分(5 个氨基酸残基)。α 和 β 链的连接肽(connecting peptide)处由二硫键连接为双体。在空膜部分各含一个赖氨酸,可能同 CD3 中 γ、ε 和 δ 键穿膜部分的天冬氨酸或谷氨酸形成盐桥,与 TCR 信号通过 CD3 传递有关。
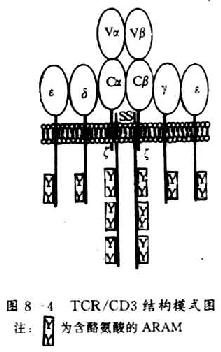
(二)TCRγδ
γ 链分子量为 40-60kDa,δ 链为 40-60kDa,γ 与 δ 链由非共价键相连。在小鼠和部分人的 TCR 中,γ 和 δ 也可由二硫键相连接,这种二聚体中 γ 和 δ 链分子量分别为 36-40kDa 和 43kDa。
二、CD3γ、δ 和 ε 链
CD3ε、γ 和 δ 链的 cDNA 序列分析表明,它们都属于 I 型跨膜蛋白,都含有一个约有 50 氨基酸残基组成的类似免疫球蛋白胞外功能域,编码这些肽链的基因密切连锁,可能起源于同一祖先基因。在复合体中,CD3γ、δ 和 ε 以二种非共价键形式 γε 和 δε 异源二聚体存在。
ε 链分子量为 20-25kDa,从编码 ε cDNA 推算出多肽链的结构,包括氨基端 104 个亲水性氨基酸,穿膜部分为 26 个氨基酸残基,胞浆内为 81 个氨基酸残基。编码 ε 基因与 δ 链基因连锁在一起。研究表明,ε 链胞浆内功能域的缺失不会导致明显的信号转导障碍,且缺乏 ε 链的 TCDR/CD3 复合体足以产生抗原介导的细胞活化和 IL- 2 的产生。但通过构建嵌合分子进行基因转染试验证实,在缺失 ζ 链的淋巴细胞中,ε 链胞浆功能域可以转导淋巴细胞活化信号。另外,ε 和 ζ 胞浆功能域活化 T 细胞可引起不同方式的蛋白磷酸化,提示 ε 和 ζ 亚单位可能涉及到两种不同的独立的跨膜信号转导生化途径。目前研究发现,ε 链主要介导抗原或超抗原(superantigen)的活化信号;ζ 链除介导抗原的活化信号外,还可介导经淋巴细胞表面分子(如 CD2)以及致有丝分裂原(如 PHA、PMA)所产生的活化信号。
三、CD3ζ 和 η 链
从基因水平研究发现,ζ 和 η 链是同一基因的两种不同的拼接形式。ζ 链由前 1 - 8 外显子编码,而 η 链是前 1 - 7 加上第 9 外显子编码。在遗传和结构上,与 CD3γ、ε 和 δ 三个亚单位不同,ζ 和 η 链只有一个短的细胞外功能域(9 个氨基酸残基)。ζ 和 η 链在氨基酸水平的主要差异存在胞浆内,η 链比 ζ 链多 42 个氨基酸残基,但缺少 6 个潜在的酪氨酸残基磷酸化位点中的一个。沁 ζ、η 和 Fcεr Iγ 多肽链共同表达于同一个细胞时,一个 ζ 亚单位可同 ζ、η 或 Fcεr Iγ 三个亚单位中的任何一个通过二硫键形成三种不同的二致辞体如 ζ -ζ、ζ- η 或 ζ -Fcεγ(Ige Fc I 型受体 γ 链),因此有人将 ζ、η 和 FcεR Iγ 链称之为 ζ 家族(ζfamily)。以 TCRαβ 多态型为例,可有 TCRαβγεδεζζ 或 TCRαβγεδεηζ 不同组合的 TCR/CD3 复合物,并可能共同存在于同一个细胞表面,把某一抗原与不同信号转导途径连接起来。
(一)ζ 链
ζ 链绝大多数以同源二聚体即 ζ - ζ 形式存在,仅有 10% 以异源二聚体(ζ-η)形式存在。ζ 链是一种高度保守的结构,分子量为 10kDa,从小鼠 ζ 链的 cDNA 推算出信号肽 21 个氨基酸残基,胞膜外区为 9 个氨基酸残基,穿膜区 21 个氨基酸残基,胞浆区 113 个氨基酸残基。目前已知,ζ 链是一种受体激活的蛋白酪氨酸激酶底物,当受体与配体结合后,ζ 链很快发生酪氨酸磷酸化,参与淋巴细胞活化信号的转导。用基因转染方法证实,ζ 链胞浆内功能域具有将受体结合与细胞内信号转导途径连接起来的功能。目前发现,ζ 链并非为 TCR/CD3 复合体所特有,它可以不依赖 CD3 的其它亚单位而存在于 NK 中,并同 FcζγRⅢ(CD16)相连。此外,在 TCR 触发后,ζ 链可以同一胞浆内称为 ζ 链相关蛋白 70(ZAP-70)相结合,AP-70 为一种胞浆内具有 PTK 活性的信号蛋白,含有两个 SH-2(srchomology region 2,SH-2)结构域以及一个与猪脾中 PTK syk 相关的激酶结构域,ZAP-70 分子中 SH- 2 与 ζ 链中磷酸化的酪氨酸残基相结合,ζ 链的酷氨酸磷酸化是由 p59fyn或 p56lck催化所致。
(二)η 链
小鼠 η 链分子量为 21kDa,可与 ζ 以异源二聚体形式存在。在人体细胞中至今还缺乏分子水平的证据来证明 η 蛋白产物及其在细胞中转录物的存在。采用不同探针在体外进行核糖核酸酶保护试验证明,人及某些哺乳动物有 η 样区产物表达,对其序列分析表明,η 样区产物是 ζ 基因经选择拼接后所产生,但在人类 η 样区表达水平很低,仅有 ζmRNA 水平的 0.25%. 不同物种 η 样区基因在核苷酸水平高度保守, 但由于读框改变使得它们在氨基酸水平无明显同源性。
表 8 -1 T 细胞抗原受体复合体中的蛋白多肽
| 名称 | 功能 | 分子量(kDa) | 多聚体形成 | 特点 | |
| 人 | 鼠 | ||||
| TCRα | 作为 MHC-Ag 复合体识别受体的肽链 | 45~60 | 44~55 | α β | IGSF 成号;基因重排;CD4+ 或 CD8+ T 细胞 |
| TCRβ | 作为 MHC-Ag 复合体识别受体的肽链 | 40~50 | 40~55 | α β | IGSF 成员;基因重排;CD4+ 或 CD8+ T 细胞 |
| TCRγ | 作为 MHC-Ag 复合体识别受体的肽链 | 45~60 | 45~60 | γδ 或 γγ | IGSF 成员;基因重排;为 CD4-CD8- T 细胞 |
| TCRδ | 作为 MHC-Ag 复合体识别受体的肽链 | 40~60 | 40~60 | γ δ | IGSF 成员;基因重排;主要为 CD4-CD8- T 细胞 |
| TCRγ | 作为 αβ 和 γδTCDR 信号转导分子 | 25~28 | 21 | IGSF 成员;丝氨酸残基磷酸化 | |
| TCRδ | 作为 αβ 和 γδTCDR 信号转导分子 | 20 | 28 | IGSF 成员;丝氨酸残基磷酸化 | |
| TCRε | 作为 αβ 和 γδTCDR 信号转导分子 | 20 | 25 | IGSF 成员;丝氨酸残基磷酸化 | |
| TCRζ | 作为 αβ 和 γδTCDR 信号转导分子 | 16 | 16 | ζζ 或 ζη | 酪氨酸残基磷酸化 |
| TCRη | 作为 αβ 和 γδTCDR 信号转导分子 | ? | 21 | ζη | |
| TCRψ | 参与胞浆内质网 | 28 | 28 | 不表达在细胞表面 | |
| (或 TRAP) | CD3 分子的装配 | TCR/CD3 复合体中 | |||
注:TRAP:T cell receptor-associated protein,T 细胞受体相关蛋白
IGSF:immunoglobulin superfamily, 免疫球蛋白超家族
在 T 细胞成熟过程中,TCR/CD3 复合体中任何一个亚单位缺陷,可能导致细胞功能低下,甚至引起临床症状。TCR/CD3 复合体形成过程通常是按以下顺序进行的;首先 CD3γ、δ 和 ε 三种肽链通过形成 γ - ε 和 δ - ε 两种异源二聚体成为稳定的复合物核心,TCRαβ(或 TCRγδ)与之结合,随后 ζ - ζ 或 ζ - η 二聚体同 TCRαβ(或 γδ)/CD3γεδε 复合物结合,最后转移到 T 细胞表面。CD3γ 和 δ 的缺陷可能影响 TCR/CD3 复合物的装配和表达。γ-TCRID(TCr immunodeficiencies)患者的 TCR/CD3 复合物在外周血 T 细胞膜中的表达较正常人低两倍,可发生腹泻和致命性病毒性肺炎。ε–TCRID 患者的 TCR/CD3 复合物在外周血 T 细胞膜中表达较正常人低 10 倍,但这些患者的临床症状较轻微,提示患者 T 细胞表达的 TCR/CD3 的功能基本是正常的。
组成 TCR/CD3 复合体的分子以及这些分子在一系列生化事件中将信号转导核内方面的研究也取得很大进展。TCR 通过两种或更多不同的独立的途径中某一途径传递信号,取决于被选择的 TCR/CD3 和 / 或 TCR/CD3 相关分子的活化,这些分子在某个途径起作用,并决定着细胞所获得的效应功能的转归。TCRαβ 或 γδ 克隆型异源二聚体,能同 CD4 或 CD8 复合体分子相连,并可具有 CD3 中 ζ -ζ、ζ- η 甚至 ζ - γ 二聚体蛋白,在同一个 T 细胞中可以表达一种类型以上 TCR 分子。不同 TCR 以及它们相关信号转导途径反映了:(1)存着许多功能上不同的 T 细胞亚群;(2)分化的 T 细胞对在不同途径中的所需要的条件取决于它们分化的不同阶段。例如:抗原刺激可以诱导某个分化阶段 T 细胞发生增殖,对另外一群 T 细胞可能诱导程序性细胞死亡,而在 T 细胞第三亚群中可能诱导免疫无反应性。另外,单独一个成熟 T 细胞在免疫应答过程中发挥辅助功能或细胞毒作用,可能同选择与相应受体相连几种信号传递途径的不同有关。
由于分子生物学和基因工程技术的应用,TCR/CD3 中新成员以及它们相关分子方面的研究获得了相当大的进展。但是,还不能回答关于抗原刺激如何选择几种信号转导途径中的某一种,以及它们在每个途径中起何作用,因此,涉及到经 TCR 途径信号转
导的新分子及其作用机理还有待进一步鉴定和阐明。
第二节 蛋白酪氨酸激酶
蛋白酷氨酸激酶(proteintyrosine kinase,PTK)是一类催化 ATP 上 γ - 磷酸转移到蛋白酪氨酸残基上的激酶,能催化多种底物蛋白质酪氨酸残基磷酸化,在细胞生长、增殖、分化中具有重要作用。迄今发现的蛋白酪氨酸激酶中多数是属于致癌 RNA 病毒的癌基因产物,也可由脊椎动物的原癌基因产。根据 PTK 是否存在于细胞膜受体可将其分成非受体型和膜受体型。
1. 非受体型 以 src 基因产物为代表,此外还有 Yes、Fyn、Lck、Fgr、Lyn、Fps/Fes 及 Ab1 等。徐后两者外,其余非受体型蛋白酪氨酸激酶 src 家族分子理约为 60kDa 的蛋白质,它们之间除了 N 末端 80 个氨基酸组成不同外,其作部分都非常相似。
2. 受体型 根据它们的结构不同,受体型酪氨酸激酶可以分为 9 种类型,其中较常见的有 4 种类型(图 8 -5)。
(1)表皮生长因子受体(EGFR)家族:EGF- R 家族成员包括 EGF-R(分子量为 170kDa,广泛表达于多种组织细胞中)、erbB2/neu 及 erbB- 3 基因表达产物。其家族成员的特点是在胞膜外有两个富含半胱氨酸的区域,胞浆内含有一个有酪氨酸激酶活化性的区域。
(2)胰岛素受体家族:其家族成员包括胰岛素受体(insulin receptor,IR)、胰岛素样生长因子 - 1 受体(insulin-like growth factor-1receptor,IGF-1R)以及胰岛素相关受体(insulin related receptor,IRR)。胰岛素受体家族成员是由二个 α 亚单位和二个 β 亚单位通过链间二硫键形成的异源四聚体。其中 α 亚单位为配体结合部位;β 亚单位的胞浆内部分含有酪氨酸激酶活性区域。
(3)PDGF/MCSF/SCF 受体家族:其家族成员包括血小板衍生的生长因子 α 受体(PDGF-αR)、PDGF-βR、巨噬细胞集落刺激因子受体(M-CSFR)以及干细胞生长因子受体(SCFR)。以上成员的特点是胞膜外含有 5 个免疫球蛋白样结构域,胞浆内含有两个呈串联结构的酪酸激酶功能区。
(4)成纤维细胞生长因子受体(FGFR)家族:FGFR 家族成员有 FGFR1、FGFR2、FGFR3 以及 FGF4。它们的特点是在胞膜外含有 3 个免疫球蛋样结构域,其中在第 1 和第 2 结构域之间有一个含 8 个连续的酸性氨基酸结构,又称酸性盒结构域(acid box domain);胞浆内含有两个呈串联结构的酷氨酸激酶功能区。
图 8 -5 受体型酪氨酸激酶示意图
家体型酪氨酸蛋白激酶所介导的信号传递途径中涉及到一种重要的蛋白激酶即丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)。MAPK 属于一种 Ser/Thr 蛋白激酶,可在多种不同的信号转导途径中充当一种共同的信号转导成份,且在细胞周期调控中发挥重要的作用。目前 MAPK 家族中至少有 4 个成员已被纯化和深入研究。如 p42mapk,p44erk1,p54MAPK 及 p44mpk。这些 MAPK 最初由于不同的研究目的而被发现,因而它们各自还有着其它一些名称。如 p42mapk也称为微管相关蛋白激酶(microtubule-associatedprotein-2 kinase,MAP-2k)及细胞外信号调节的激酶 2(extracellular signal-regulated kinase2,ERK2)等。
属于 src 家族的蛋白酪氨酸激酶是一组膜结合蛋白,包括 p60arc、p56lck、p59fyn、p59yes、(p62ues)、p56lyn、p59hck、p55fgr和 p55blk等成员。但由于 src 家族 PTKs 缺乏胞外及跨膜序列,因此这些 src 家族 PTKs 通过其 N 末端与细胞膜表面蛋白的胞浆内结构域相连接,从而发挥信号转导作用(表 8 -2)。已证实 p56lck参加 CD4 和 CD8 介导的信号传递;p59fyn参加 TCR/CD3 复合体介导的信号传递;p56lyn参加 B 细胞受体(BCR)介导的信号传递。经 TCR 途径 T 细胞活化后最早生化事件是几种内源性底物酪氨酸磷酸化水平的升高。这种酪氨酸磷酸化可能由 p56kk或一个与 PTK 相关的称为 p59fyn所介导。p59fyn主要表达于 T 淋巴中,发挥某些独特的调节功能。然而,还有一些调节功能更为广泛的 PTKs 表达于包括 T 细胞在内的多种细胞类型中,包括:(1)最初从小鼠脾细胞中发现的 tk1 蛋白产物;(2)在 T 细胞有丝分裂中数量可见增加并同 T 细胞瘤的发生有关的 p34pim;(3)表达于 T 细胞中 c -abl、ltk、c-kit 和其它原癌基因蛋白产物。这些 PTKs 的确切功能还不清楚。
表 8 -2 同 src 家族 PTKs 相连接的细胞表面蛋白
| 细胞表面蛋白 | 细胞类型 | src 家族 PTK |
| TCR-CD3 | T | Fyn |
| CD2 | T | Fyn |
| CD4 | T | Lck |
| CD8 | T | Lck |
| CD45 | T | Fyn、Lck |
| BCR | B | Blk、Lyn(Fyn)、Lck |
| FcγRⅢ(CD16) | NK | Fyn |
| IL-2R | T,NK | Lck、Lyn |
| FcεR I | 肥大细胞、嗜碱性粒细胞 | Yes、Lyn(src) |
| FcεR Ⅱ(CD23) | 肥大细胞、嗜碱性粒细胞 | Fyn |
| CD36 | 血小板 | Lyn、Fyn、Yes |
一、p56[SB]lck[/SB]
p56lck属于以 p60v-src/c-src 为代表的蛋白酪氨酸激酶家族成员。同这个家族的其它成员一样都具有酪氨酸激酶活性。目前发现,p56lck相对特异地存在于淋巴细胞中,尤其是成熟的静止 T 淋巴细胞中。p56lck可能在 T 细胞活化信号转导以及分化调节过程中起着重要的作用。
(一)p56lck结构和功能特点
1.p56lck的结构 p56lck是由 lck 基因编码的分子量为 56kDa 的单链分子,由 509 个氨基酸残基组成。在小鼠,lck 基因定位于 4 号染色体,人 lck 基因定位于 1 号染色体的 1p32-35 区间。同其它具有 PTK 活性的生长因子受体如 EGF- R 和 PDGF- R 等比较,p56lck分了属于非受体型蛋白酪氨酸激酶,无胞膜外区,其 N - 端通过豆蔻酸(myristic acid)与细胞膜内侧面相连。p56lck分子结构可以分为四个功能区:(1)膜接触区,位于 N - 端,N- 端第 2 位 Gly 能结合豆蔻酸,通过豆蔻酸与细胞膜内侧面相连;(2)底物作用区,该区的氨基酸结构不同于 src 家族的大部分其它成员;(3)催化区或激酶区,这一区域在氨基酸组成上与其它 src 家族成员高度同源;(4)调节区,位于羧基端,可能与 p56lck的 PTK 活性的特异调节有关(图 8 -6)。

图 8 -6 p56lck分子的功能区
2.p56lck的功能特点 p56lck底物作用区存在几个位置尚不明确的 Ser 磷酸化位点;催化区 Lys273 是 ATP 结合点,Tyr394 为自身磷酸化位点;调节区 Tyr505 是调性磷酸化位点。在静止细胞中,p56lck在 Tyr505 上发生磷酸化,但当细胞活化时这个残基则发生去磷酸化,随之发生激酶的活化以及 Tyr394 的自身磷酸化。目前研究认为,CD45 通过使 Tyr505 去磷酸化对 p56lck起正调控作用;而 p50csk是使 Tyr505 发生磷酸化对 p56lck则起负调控作用。CD45 和 p50csk对其它 src 家族 PTKs 也发挥着同样的调节作用。
(二)p56lck与 CD4/CD8 分子
1.p56lck的分布 CD4 和 CD8 以共受体形式(coreceptor)表达于成熟的 T 淋巴细胞,尽管 CD4 和 CD8 跨膜分子都属于免疫球蛋白超家族,但它们之间仅存在有限的同源性。CD4 和 CD8 分子分别与 MHCⅡ类和 MHc I 类分子的恒定区决定簇相互作用。CD4 是分子量为 55-60kDa 的糖蛋白,以单体形式表达。CD8 是由二致辞体组成,有两种形式:一种是由两条 α 链(32-34kDa)组成的同源二聚体;另一种形式是由 α 链和 β 链(25-26kDa)组成的异源二聚体。CD4 和 CD8 分子中胞浆内部分子不具有激酶功能区,因此它们与受体酪氨酸激酶如 EGF- R 或 PDGF- R 无同源性。目前已经证实 CD4 和 CD8 均与信号转导成份 p56lckPTK 相连接。p56lck几乎在所有淋巴细胞中表达,包括全部成熟 T 细胞和胸腺细胞,提示它可能在 T 细胞活化和分化调节过程中起作用。有关 p56lck在 T 细胞活化信号中正调节作用的最初发现是 p56lck直接同 CD4 或 CD8 复合受体分子胞浆内功能域相连接,在体外具有酪氨酸激酶活性,在体内,T 细胞受到刺激后酪氨酸磷酸化水平增加。即使在静止的鼠 CD4- T 细胞中也有大约 50% 细胞内 p56lck是同 CD4 糖蛋白相连接。
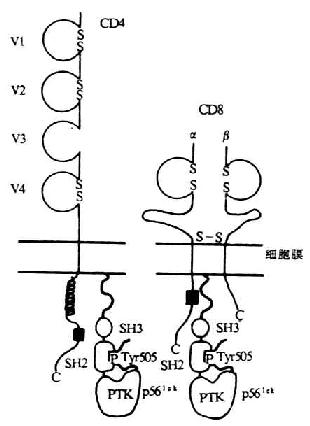
图 8 -7 p56lck同 CD4、CD8 作用的模式图
2.p56lck与 CD4/CD8 分子的连接 p56lck同 CD4/CD8 相互作用的区域位于分子的氨基端的底物作用区(图 8 -7),此区域在 src 相关 PTKs 中是独特的,含有 4 个半胱氨酸,这对于 p56lck与 CD4 和 CD8 相互作用是必须的。底物作用区中 6 个带负电荷的氨基酸可使 p56lck与 CD4/CD8 结合位点内相对应的碱性氨基酸残基相结合。在 CD4 和 CD8α 分子的胞浆内有一个含 13 个氨基酸的相似区域,经突变研究和肽竞争分析法证实此区域可能为 p56lck结合区域。CD4 和 CD8α 含有两个对于 p56lck结合起关键作用的半胱氨酸以及与 p56lck氨基末端负电荷相互作用的 5 个带正电荷的氨基酸。证实此区域中有 6 个氨基酸直接与 p56lck结合有关,如果把这 6 个氨基酸残基从 CD8α 胞浆功能域转移到一个非相关蛋白水泡性口炎病毒糖蛋白(VSV-G)胞浆功能区域上,p56lck即可结合到这个杂交分子上去。
3.p56lck参与 T 细胞活化 用蛋白激酶 C 激活剂刺激 T 淋巴细胞可引起 p56lck从 CD4 分子上解离下来,随后发生 CD4 内化。CD8 分子在这方面不同于 CD4,CD8+ T 淋巴细胞经 PKC 激活剂刺激事对 CD8 分子内化以及 CD8-p56lck的解离影响极微。现已提示,p56lck可能以生长因子 PTK 受体相同方式起作用,即 TCR 结合与 MHC 相连的抗原后,CD4 中 CD8 与 MHC 相互作用,与 CD4 或 CD8 相连接的 p56lck补充到 TCR 多肽胞浆内部分靠得很近的区域,然后发生 PTK 的活化以及 TCR 内底物(?)和 / 或其邻近分子(PLCγ1?)的磷酸化。p56lck除参与抗原诱导的淋巴细胞活化外,还可能参与 T 细胞的分化和成熟。在 T 细胞分化的所有阶段,包括 CD4、CD8 双阳性胸腺细胞都可检测到 p56lck与 CD4 和 CD8 形成的复合物。
(三)p56lck与非 CD4/CD8 分子
p56lck除了同 CD4 和 CD8 形成复合体外,还可能同另外一些参与信号转导的细胞受体分子形成稳定的复合物。
1.p56lck与 IL-2R 的关系 IL-2R 由 α、β、γ 三条肽链组成。三条肽的不同组合即 αβγ,βγ 以及单独 α 分别构成 IL- 2 的高、中、低三种亲和力的受体。由于 IL-2Rα 链在胞浆内仅有一个较短的功能域(13 个氨基酸残基),所以介导 IL-2R 信号转导主要为 β 和 γ 链。IL-2Rβ 链胞浆内有两个结构域:其中一个靠近细胞膜,富含丝氨酸,对于 IL- 2 诱导的增殖信号具有重要作用;另一结构域远离细胞膜,富含酸性氨基酸,为酪氨酸激酶物理连接部位。经 IL-2Rβ 链免疫沉淀后进行免疫印迹也证实了 IL-2Rβ 链同 p56lck相连。体外系统中也发现 IL- 2 结合到 IL-2R 后可促进 p56lck活性,引起 IL-2Rβ 链的酪氨酸磷酸化。IL-2Rγ 链胞浆内含 86 个氨基酸,无激酶功能区,但具有一个与 SH- 2 同源的区域,可能参与 IL-2R 介导的信号转导。最近研究表明,IL-2Rγ 链为 IL-4、IL-7、IL-9、IL-13 等细胞因子受体所共用(common chain,γC)。
2.p56lck与其它分子的关系 同 p56lck相互作用的其它一组分子有人 T 细胞糖磷脂酰肌醇(glycophosphatidylinositol,GPI)连接的蛋白包括 CD59、CD55、CD48 以及小鼠 T 细胞中的 Thy-1。应用免疫沉淀方法均能使这些分子同 p56lck发生共免疫沉淀。此外,将 T 淋巴细胞同针对 GPI 连接的膜分子特异性抗体孵育,然后加入二抗使其交联,均发生几种内源性底物的酪氨酸磷酸化。
许多 GPI 连接的细胞表面分子可能以两种不同的形式表达在 T 细胞中,这是由相应分子 mRNA 不同拼接所致。一种形式是通过 GPI 附着在细胞膜上,另一种形式具有跨膜区和胞浆的 PLC 去掉所有 GPI 相连的膜蛋白后进行免疫沉淀,并分析它们相连的激酶活性,发现大多数酪氨酸磷酸化活性已丧失,表明 GPI 连接物对于同 p56lck相结合是必需的。
采用烷基化试剂或金属离子结合试剂进一步证实了 CD4/CD8 多肽和 GPI 连接膜蛋白是分别通过两种不同的机理与 p56lck相互作用的。这些试剂可以干扰 p56lck同 CD4 或 CD8 分子的相互作用,因为 p56lck同 CD4 或 CD8 的相互作用依赖游离半胱氨酸的存在,并需要金属离子使之稳定这种结合;而 p56lck与 GPI 相连结的蛋白的结合则不受这些试剂影响。这些结果表明,p56lck通过两种或更多不同相互作用机理,直接或间接地同多种细胞表面蛋白形成复合物。
二、p59[SB]fyn[/SB]的
1.p59fyn的分布和结构 p59fyn为非受体 PTKs src 家庭的一个成员,见于多种细胞中。由于基因拼接的差异产生了两种不同形式的 p59fyn。一种以高水平表达于大脑中(p59fyn),另一种主要存在于 T 淋巴细胞中(p59fyn)。p59fyn基本结构类似于 p59fyn和 p60src。它通过氨基末端豆蔻酸的基团共价结合于胞浆膜内面,羧基末端有一个负调控功能域,包括含有一个酪氨酸磷酸化位点 Tyr528,与 p59lckTyr505 和 p60srcTyr527 所起的功能相似。此外,p59fyn还一个自身磷酸化位 点 Tyr417。
2.p59fyn的功能 p59fyn可能与 T 细胞活化调节有关的证据最初来自对带有 lpr(lymphoproliferation)或 gld(generalizedlymphoproliferative disease)常染色体隐性基因小鼠 T 淋巴细胞特性的研究,这些 T 细胞可以表达高于正常 T 细胞 10 倍的 p59fyn活性。由于大量不成熟 T 细胞扩增,lpr 和 gld 纯合子小鼠可发生严重的淋巴结病和自身免疫性疾病。进一步研究发现,这些 T 细胞存在着固有的酪氨酸磷酸化的 TCR- ζ 链,并提示 ζ 链磷酸化可能是由 p59fyn所介导的。lpr 小鼠的 T 细胞不能经 TCR/CD3 途径对刺激剂产生应答,可能是由于 ζ 链磷酸化可能是由 p59fyn所介导的。1pr 小鼠的 T 细胞不能经 TCR/CD3 途径以刺激剂产生应答,可能是由于 ζ 链内在的磷酸化而使 TCR 与 PLCγ1 脱偶联有关。p59fyn同 TCR/CD3 复合物相连结,用温和去垢剂抽取细胞膜后与抗 CD3ε 体一起孵育时,p59fyn可与 CD3 组份发生共免疫沉淀。上述所有推测表明,p59fyn是 TCR 连接的信号结构所必需的,与 p59fyn相连 TCR/CD3 亚单位是 CD3ε。
不成熟 CD4+CD8+ 胸腺细胞中 p59fyn表达水平相对较低,当分化为 CD4+CD8- 或 CD4-CD8+ 成熟 T 细胞时,p59fyn表达水平增加了 10 倍。表明 p59fyn有利于 T 细胞的分化。用 fyn cDNA 同 lck 启动子融合后建立的转基因小鼠,p59fyn表达水平升高约 20 倍,并对 T 细胞系具有严格的限制性。虽然转基因小鼠胸腺细胞静脉型类似于正常鼠胸腺细胞,但对 TCR 介导的刺激应答增强,同时伴有酪氨酸磷酸化、细胞内钙离子浓度、IL- 2 产生和细胞增殖水平明显升高。
三、SH- 2 结构域的调节作用
(一)SH- 2 结构域的结构特点
前已所述,PTKs src 家族包括 p59lck和 p59fyn,这两个分子的氨基端有三个同源的区域。其中一区域对于豆蔻酸的附着是必需的,豆蔻酸可以通过疏水的相互作用和 / 或同一种胞浆膜蛋白结合的方式使得激酶定位于质膜上,这种胞浆膜结合蛋白实际上是豆蔻酸化多肽特异性受体。第二区域称为 src 同源区 3(src homology3,SH-3),为一个保守的氨基酸序列,约含 50 个氨基酸,可见于多种胞浆信号蛋白(signaling protein)以及肌动蛋白结合蛋白中,如肌球蛋白、血影蛋白以及酵母细胞骨架蛋白。目前研究发现 SH- 3 识别的部位是一些富含脯氨酸的区域。但对于 SH- 3 结构域的功能研究还不太清楚,可能与以下几种功能有关:(1)在信号转导过程中调节蛋白与蛋白之间相互作用;(2)调节 src 相关 PTKs 与细胞骨架中某些成份相互作用;(3)连接酪氨酸激酶途径与小 G 蛋白(smallG protein)所调控的途径。第三区域称为 src 同源区 2(src homology2,SH-2),能够识别蛋白中磷酸化的酪氨酸残基,是一个保守的蛋白序列,约有 100 氨基酸残基组成。通过 X 光衍射晶体分析法发现 SH- 2 的中心为反平行 β 片层结构,为 SH- 2 同磷酸化酪氨酸残基作用部位,两侧为 α 螺旋结构。SH- 2 主要存在于多种胞浆信号蛋白中(见图 8 -8),如 IP2 特异的 PLC、磷脂酰肌醇 3 激酶(phosphatidylinositol 3 kinase,PI-3K)的调节亚单位(P85),调节 ras 活性的 ras-GTP 酶激活蛋白(GTPase activating protein,GAP)以及 crk、abl 和 vav 原癌基因产物等。
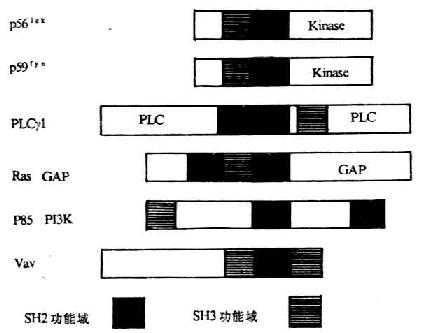
图 8 -8 参与 T 细胞活化并含 SH-2、SH- 3 结构域分子的模式图
注:GAP:GTPaseactivating protein,GTP 酶激酶活蛋白
SH-2:src homology region2,src 同源区 2
SH-3:src homology region 3,src 同源区 3
PLC:phospholipase C, 磷脂酶 C
(二)SH- 2 结构域的功能
SH- 2 的主要功能是介导胞浆内多种信号蛋白的相互连接,形成蛋白异聚体复合物,从而调节信号转导途径中的信号传递。信号蛋白的相互连接是通过的一个多肽分子上 SH- 2 结构域与另一分子磷酸化的酪氨酸残基直接相互作用而完成的,并通过酪氨酸残基的磷酸化或去磷酸化而得到调控。胞浆内信号蛋白分子中 SH- 2 作为一种具有识别功能的结构可以同具有 PTK 活性的细胞因子受体或 PTK 相关分子相结合(图 8 -9)。如小鼠血小板衍生的生长因子受体 β(PDGF-βR)本身具有酪氨酸激酶活性,当与配体 PDGF 结合后,受体本身可以发生二聚体化(dimeration),形成二聚体的两条链互相交叉催化导致受体自身酪氨酸磷酸化,某特定位点的磷酸化的酪氨酸可以同胞浆内某些信号蛋白中的 SH- 2 结合,使得具有 PTK 活性的激酶接近信号蛋白,然后使信号蛋白发生酪氨酸磷酸化,从而启动多种信号转导途径。例如(1)PLC 中 γ 发生酪酸磷酸化后激活 PLC,水解 PIP2 产生 DAG 和 IP3 第二信使物质,进一步发挥信号转导作用;(2)GAP 的激活可以提高 GTP 酶活性;(3)PI-3K 中的酪氨酸残基磷酸化后即被激活,提高 PI-3K 产物水平[PtdIns3P、PtdIms(3、4)P2、PtdIns(3、4、5)P3],进而在信号转导过程中发挥重要作用。
图 8 -9 胞浆内信号蛋白通过其 SH- 2 与生长因子受体中磷酸化的酪氨酸残基相互作用模式图
注:Y:酪氨酸残基
(三)Vav 蛋白
Vav 癌基因产物是 T 细胞活化过程中另一种含 SH- 2 蛋白。Vav 蛋白含一个 SH- 2 和两个 SH- 3 结构以及其它一些常见于转录因子中的结构,包括一个碱性区域螺旋 - 环 - 螺旋亮氨酸拉链结构域,可使蛋白形成二聚体并具有 DNA 结合活性的锌指结构以及一个核定位信号(nuclear localizationsignal)。TCR 发生交联后的 T 细胞以及经 EGF-R、PDGF-R、IgE- R 以及 IgM- R 刺激途径的其它细胞类型如成纤维细胞、嗜碱性粒细胞、B 淋巴细胞均有 Vav 蛋白酪氨酸磷酸化的发生。Vav 酪氨酸磷酸化可能使 Vav 从膜附着的受体复合物中释放出来并进入细胞核内,通过直接结合琶 DNA 上调节基因的转录。因此 Vav 代表了一个独特的酪氨酸磷酸化底物,它可以通过把细胞表面受体与转录调控连接起来的方式,在信号转导中发挥独特的作用。
综上所述,在信号转导过程中涉及到多种信号蛋白的相互作用,这些信号蛋白的相互作用通常是由信号蛋白中某些特殊功能域来实现的,除以上提到的 SH-2、SH- 3 功能域外,还有一些信号蛋白中 GAP、PLCγ 等,含有一同源区域,此区域约由 100 氨基酸残基组成,由于它最初发现于 pleckstrin 中,因而被称为 pleckstrin homology(PH)。PH 功能域可用同 G 蛋白相互作用,如 β 肾上腺素能受体激酶(β-adrenergicreceptor kinase,βARK)中 PH 功能域可以同 G 蛋白中 β 和 γ 亚单位相结合,目前对 PH 在信号转导过程中的确切作用还不清楚。
第三节 蛋白酪氨酸磷酸酯酶
T 细胞活化中所发生的多种蛋白分子酪氨酸磷酸化提示必需有蛋白酪氨酸磷酸酯酶(protein tyrosine phosphatase,PTPase)来拮抗这种作用,通过负反馈来维持机体生理功能的平衡。PTPase 基因是一个多基因家族,主要位于人第 20 号染色体上,不同来源的 PTPase cDNA 在结构上差别较大,其表达的产物一般分为受体和非受体样 PTPase 两类,每类又分为许多亚类,各类之间及亚类之间在结构上既有差别,又有一定的同源性。PTPase 在调节受本连续信号转导途径中具有重要作用。目前所知涉及 T 细胞活化 PTPase 的种类为数不多。CD45(也称 T200,白细胞共同抗原或 Ly-5)是一个典型代表。
一、CD45 的基因结构及异型
(一)CD45 的基本结构
CD45 是位于白细胞表面的白细胞共同抗原(leukocytecommon antigen,L-CA)。CD45 可以高水平(>106个分子 / 细胞)表达在淋巴细胞以及除了红细胞和血小板之外的其它所有的造血细胞上。CD45 的序列分析表明它具有受体蛋白的结构特征,为单链跨膜蛋白,包括三个不同的区域:(1)一个长的胞浆 C 末端,约含 700 个氨基酸残基,由两个串联的具有 PTPase 活性的结构域组成,这两个结构域之间有 33% 个氨基酸同源性;(2)跨膜区域,含 22 个氨基酸残基;(3)胞膜外糖基化氨基末端区域,约含 400 个氨基酸残基,这个功能域在种间有高度的保守性,约有 85% 的氨基酸同源性,它具有同配体相结合的功能。
(二)CD45 的异型
CD45 分子一个明显的特点是存在结构和分子量不同的异型(isoform),大约在 170-240kDa 之间,氨基酸序列以及碳水化合物含量方面也都不同。CD45 异型产生的分子基础是由于 CD45mRNA 水平的不同拼接所致,CD45 基因通过选择性地使用氨基端的三个相邻外显子(外显子 4、5、6)产生了 8 种可能的 mRNA 分子(图 8 -10),其中已有 6 种异型的 cDNA 得到证实。除了多态的蛋白骨架外,由于翻译后糖基化修饰不同,更增加了 CD45 分子的多样性。
在 T 淋巴细胞中,不同的细胞亚群活化过程中 CD45 的表达也可发生变化,经不同的细胞表面受体而起作用的致有丝分裂原刺激剂,可诱导细胞产生不同异型的 CD45 分子。CD45 多态的特性以及它在不同特性 T 细胞亚群中的不同的表达,很可能说明它具有重要的功能,不同 CD45 异型可能与不同配体相结合。所有 CD45 异型可用特异性单抗归类为 D45RA、CD45RB、CD45RC 及 CD45RO。CD45RA 识别的是外显子 4 的表位;CD45RB 识别的是外显子 5 的表位;CD45RCV 识别的为外显子 6 的表位;而 CD45RO 识别的表位则不含外显子 4、5、6。其中 CD45RA 存在于天然(naive)t 细胞中,CD45RO 存在于被激活或记忆 T 细胞中。既然不同 CD45 异型以一种保守的细胞型特异方式表达于 T 细胞中,显然在 T 细胞分化过程中不同外显子的选择以及它们选择性使用是以一种精确方式调控的预程序过程。
二、CD45 在信号转导中的调节作用
(一)CD45 在活化信号转导中的调节作用
在确定 CD45 为一种 PTPase 之前就已证实了 CD45 参于细胞的活化和生长调节。抗 CD45 抗体可以(1)抑制 PHA 或 CD3 交联所介导的 T 细胞增殖;(2)抑制 NK 或细胞毒性 T 细胞对靶细胞的杀伤;(3)抑制经 CD2、CD3 以及 CD8 膜分子介导的信号转导。
![]()
图 8 -10 CD45 8 种可能 mRNA 分子产生模式图
注:h: 人,m:小鼠,r;大鼠
当 CD45 和 CD2、CD3 和 CD28 等受体通过分子共凝集(co-aggregation)作用使之紧密相连时,要比单纯 CD45 交联所得到的部分抑制应更为有效;相比之下,CD45 和 CD4 共凝集反而使 T 细胞应答增强。提示 CD45 在信号转导过程中正确节或负调控主要取决于 CD45 与之相邻的相应受体的种类。
(二)CD45 参与特异性抗原活化 T 细胞的过程
CD45 直接参与抗原诱导的 T 细胞活化过程已在小鼠 I -EK 限制的鸽细胞色素 C 应答的 T 细胞克隆中得到证实,这种细胞克隆是用 CD45 抗体加补体进行诱变后筛选行到的。表达 TCR/CD3 但无细胞表面 CD45 的细胞克隆不能对抗原或 CD3 交联发生增殖反应;而当获得 CD45 时,对抗原的应答也同时恢复了。这些结果提示 CD45 是抗原特异活化 T 细胞所需要的起始信号。
(三)CD45 调节作用的机理
1.p56lck的去磷酸化 CD45 在体内作用的底物目前还不完全清楚,一种可能的底物是参与 T 细胞活化途径中的蛋白酪氨酸激酶。静止 T 细胞中 p56lck是无活性的,其分子的 505 位点氨基酸被磷酸化。p56lck激酶活性的升高是与 Tyr505 去磷酸化相一致。CD45 可使有活性激酶中主要自身磷酸化 Tyr395 发生去磷酸化,从而引起激酶活性的抑制。
2.MAP-2K 的去磷酸化 T 细胞活化中,CD45 另一种可能催化的底物是丝氨酸特异的微管相关蛋白 - 2 激酶(serine-specific microtubule-associatedprotein-2 kinase,MAP-2K)。MAP-2K 在 TCR/CD3 与配体结合后可以发生酪氨磷酸化而被活化,随着酪氨酸磷酸化的去除,酶的活性随之降低。CD3 诱导的 MAP-2K 活性可因 CD3 和 CD45 的共凝集而降低,同时伴有 MAP-2K 酪氨酸磷酸化水平的降低。纯化的 CD45 能够使部分纯化的 MAP-2K 上已磷酸化的酪氨酸残基在体外发生去磷酸化。
3.Ca2+浓度与 CD45 活化的关系 活化 T 细胞内酷氨酸磷酸化水平升高与细胞内钙离子浓度升高相关,推测高浓度钙离子可能对 CD45 具有负调控作用。用 Ca2+载体离霉素(iono-mycin)处理小鼠胸腺细胞和 T 细胞可降低 CD45PTPase 活性,同时伴有 CD45 分子丝氨酸残基磷酸化水平的降低。这些结果支持这样一个模型,即抗原同 TCR 结合,随后 CD4 和 CD45 发生共凝集,从而导致 CD45 介导的 p56lck去磷酸化而活化,细胞内钙离子水平的突然升高又可灭活 CD45,从而使二级底物发生短暂的酪氨酸磷酸化以及活化信号的传递;随后细胞内钙离子水平又回到最初的水平,CD45 也从无活性状态中恢复过来,使 p56lck在在 Tyr394 位点发生去磷酸化而灭活,以及其它能终止信号转导途径起始步骤中起关键作用的酶发生去磷酸化。但也有认为高浓度离子霉素影响 CD45 可能通过一个钙离子非依赖的机理。
4.CD45 可能与相应的配体结合 CD45 活性调节另外一种机理可能是通过目前还不清楚的配体与 CD45 细胞外结构域结合所介导的。CD45 胞膜外区长而复杂的结构、多态性以及细胞表面高密度 CD45 分子都支持这个假说。CD45 同配体相互作用引起了分子的构象改变,从而导致磷酸酯酶的活化或抑制。目前证实 CD45RO 的配体为存在于 B 细胞表面的 CD22 分子,与 B 细胞信号转导的调节有关。
除些之外,CD45 胞浆尾部中具有潜在的 PKC、酷蛋白激酶Ⅱ和 PTKs 磷酸化位点,CD45 酶活性可能在细胞内通过这个区域磷酸化或去磷酸化而得到调节。当抗 TCR 抗体刺激静止 T 细胞时,存在于高尔基体细胞内池的 CD45 被转位到浆膜上,提示 TCR 介导的信号可能调节 PTPase 接近质膜内面的一些关键底物。
第四节 G 蛋白和磷脂酶 C
G 蛋白在 TCR/CD3 与磷脂酶 C(phospholipaseC,PLC)的结合过程中起到重要的调节作用。通过 G 蛋白可使 PLC 发生活化,从而激活磷脂酰肌酰肌醇代谢途径,引起淋巴细胞活化和增殖。自 80 年代中期发现 G 蛋白发现 G 蛋白及 ras 等 GTP 结合蛋白以来,G 蛋白与信号转导关系的研究已获得重大突破,因之获得 1994 年诺贝尔医学和生理学奖。
一、G 蛋白
受体与配体结合后即与膜上的偶联蛋白结合,使其释放活性因子,再与效应器发生反应。位于受体与效应器之间的则是偶联蛋白。目前所知的偶联蛋白种类较多,都属于结构和功能极为类似的一个家族,由于它们都能结合并水解 GTP,所以通常称 G 蛋白,即鸟苷酸调节蛋白(guanine nucleotide regulatory protein)。
(一)G 蛋白的分类
G 蛋白的种类已多达 40 余种,大多数存在于细胞膜上,由 α、β、γ 三个不贩亚单位构成,总分子量为 100kDa 左右。其中 β 亚单位在多数 G 蛋白中都非常类似,分子量 36kDa 左右。γ 亚单位分子量在 8 -11kDa 之间,除 Gt 外,大多数 G 蛋白的 γ 亚单位都是相同的。βγ 两个亚单位的不同可以将 G 蛋白分为 Gs、Gi、Go、Gq、G? 及 Gt 等六类。这些不同类型的 G 蛋白在信号传递过程各种发挥不同的作用。除此之外,在细胞内还存在另一类 G 蛋白,这类 G 蛋白具有鸟核苷酸的结合位点,有 GTP 酶活性,其功能也受鸟核苷酸调节,但与跨膜信息传递似科无直接相关。在结构上不同于前述的 G 蛋白,分子量较小,在 20-30kDa 之间,不是以 α、β、γ 三聚体方式存在,而是单体分子,因此被称为小 G 蛋白(small G proteins)。如 ras 表达产物为一种小 G 蛋白。小 G 蛋白同 ras 蛋白具有同源性,同属于 ras 超家族(ras superfamily)。哺乳动物 G 蛋白中属 ras 超家族约有 50 多个成员,根据它们序列同源性相近程度又可以分为 Ras、Rho 和 Rab 三个主要的亚家族。
(二)G 蛋白与信号传递
细胞表面的受体通过与其相应配体作用后,可经不同种类的 G 蛋白偶联,分别发挥不同的生物学效应。与 G 蛋白偶联的多种受体具有共同的结构功能特点:分子量 40-50kDa 左右,由 350-500 氨基酸组组成,形成 7 个由疏水氨基酸组成的 α 螺旋区段,反复 7 次穿越细胞膜的脂质双层。肽链的 N 末端在胞膜外,C 末端在细胞内。N 末端上常有许多糖基修饰。从功能上看,受体的识别区域并不象一般想象的那样在胞膜的外部,实际上是由 7 个跨膜区段间通过特定氨基酸残基之间的相互作用形成复杂的空间构象。配体结合于识别区域之后,即导致整个受体构象的变化。受体肽链的 C 末端和连接第 5 和第 6 个跨膜区段的第三个胞内环是 G 蛋白结合部位。目前研究发现,趋化因子受体家族(chemokine receptor family)以及一些神经递质受体都属于 G 蛋白偶联的 7 次跨膜受体的超家族。例如 IL-8RA 胞膜外 N 端 Asp11、Llu275、Arg280 以及可形成二硫键的 Cys30 和 Cys277 在与配体结合中起重要作用;紧接第三个空膜区第二个胞浆环中 DRY 序列对于与 G 蛋白的结合是必要的。
(1)Gs:细胞表面受体与 Gs(stimulating adenylate cyclase g protein,Gs)偶联激活腺苷酸环化酶,产生 cAMP 第二信使,继而激活 cAMP 依赖的蛋白激酶。
(2)Gi:细胞表面受体同 Gi(inhibitory adenylate cyclase g protein,Gi)偶联则产生与 Gs 相反的生物学效应。
(3)Gt:可以激活 cGMP 磷酸二酯酶,同视觉有关。
(4)Go:可以产生百日咳杆菌毒不导致的一系列效应。
(5)Gq:同 PLC 偶联,在磷脂酰肌醇代谢途径信号传递过程中发挥重要作用。
(6)小 G 蛋白:近年来研究发现小 G 蛋白,特别是一些原癌基因表达产物有着广泛的调节功能。Ras 蛋白主要参与细胞增殖和信号转导;Rho 蛋白对细胞骨架网络的构成发挥调节作用;Rab 蛋白则参与调控细胞内膜交通(membrane traffic)。此外,Rho 和 Rab 亚家庭可能分别参与淋巴细胞极化(polarization)和抗原的提呈。某些信号蛋白通过 SH- 3 功能区将酪氨酸激酶途径同一些由小 G 蛋白所控制的途径连接起来,如 Rho(与 Ras 有 30% 同源性)调节胞浆中微丝上肌动蛋白的聚合或解离,从而影响细胞形态。这一事实解释了某些含有 SH- 3 的蛋白同细胞骨架某些成份相关联或调节它们的功能(见第二节有关 SH- 3 的功能)。
二、磷脂酶 C
PLC 是存在于胞浆膜上一个关键酶,有 9 种异构体,分为 α、β、γ 和 δ 四组。PLC 作用于 PIP2 产生三磷酸肌醇(IP3)和二酰基甘油(DAG),IP3 和 DAG 是
T 细胞活化的重要信号。除 PLCα 组外,其余 PLC 组均不具有跨膜序列,所以 PLC 在水解 PIP2 时必须与细胞膜结合。在 T 细胞活化过程中,参与信号转导的主要为 PLCγ。
第五节 蛋白激酶 C
蛋白激酶 C(protein kinase C,PKC)是一类 Ca2+、磷脂依赖性的蛋白激酶,在跨膜信号传递过程中起着重要作用。PKC 通过催化多种蛋白质上 Ser/Thr 磷酸化,调节多种细胞的代谢、生长、增殖和分化。
表 8-3 哺乳动物组织内的 PKC 亚类
| 亚 类 | 氨基酸残基 | 分子量(kDa) | 激 活 剂 | 表达组织 |
| A 组:经典 PKC | ||||
| α | 672 | 76 | PS、Ca2+、DAG、FFA、LysoPC | 广泛 |
| βI | 671 | 76 | 同 上 | 某些组织 |
| βⅡ | 673 | 76 | 同 上 | 多种组织 |
| γ | 697 | 78 | 同 上 | 脑 |
| B 组:新型 PKC | ||||
| δ | 673 | 77 | PS、DAG | 广 泛 |
| ε | 737 | 83 | PS、DAG、FFA | 脑 等 |
| η(L) | 683 | 77 | ? | 肺、皮肤、心脏 |
| θ | 707 | 81 | ? | 骨骼肌 |
| C 组:非典型 PKC | ||||
| ζ | 592 | 67 | PS、FFA | 广 泛 |
| λ | 586 | 67 | ? | 卵巢、睾丸等 |
注:PS:磷脂酰丝氨酸 FFA:游离脂肪酸
DAG:二酰基甘油 LysoPC:溶血磷脂酰胆碱
一、PKC 的亚类及其结构特点
(一)PKC 亚类
到目前为止,在哺乳动物组织内已确定 10 种 PKC 亚类(8-3),分为 A、B、C 三组,A 组称为典型或传统的 PKC(classicalor conventional PKC,CPKC),包括 α、βI、βⅡ和 γ 亚类,其中 βI 和 βⅡ有高度的同源性,是由同一 mRNA 的不同剪接而成,A 组成员分子量在 76-78kDa。B 组为新型 PKC(atypical PKC,aPKC),包括 δ、ε、η(L)和 θ 亚类,分子量在 77-83kDa。C 组为非典型 PKC(atypicalPKC,aPKC),由 ζ 和 λ 亚类组成,分子量较小为 67kDa。
(二)PKC 的结构
PKC 的所有亚类都由一条单肽链组成(图 8 -11),分子量大约为 67-83kDa,其结构可分为四个保守区 C1-C4(mPKC 和 aPKC 缺少 C2 区)和五个可变区 V1-V5。基中 C1 区可能是膜结合区,并且含有富含半胱氨酸的随机重复序列 Cys-X2-Cys-X13(14)-Cys-X2-Cys-X7-Cys-X7-Cys(X 代表任何一种氨基酸),这段顺序与在许多金属 - 蛋白质及转录调节有关的 DNA 结合蛋白中的半胱氨酸 - 锌 -DNA 结合指形区(cysteine-Zinc-DNabinding finger)保守顺序 Cys-X2-Cys-X13-Cys-X2-Cys 相似。最近对 PKC 的多肽片段进行分析发现,该序列与佛波酯和二酰基甘油(DAG)的结合有关。C2 区与 PKC 对 Ca2+的敏感性有关。C1 和 C2 在结构上不同于其它蛋白激酶,能结合 Ca2+、磷脂、DAG 和 TPA,因此 C1 和 C2 区又称为调节区。C3 区包括一个 ATP 结合序列 Gly-X-Gly-X-X-Gly-Lys, 该区域与其它蛋白激酶的 ATP 结合位点具有很高的同源性,又称催化区。C4 区包含一个底物结合区,是识别磷酸化底物所必需的。
图 8 -11 PKC 亚类的分子结构
二、PKC 的转位与激活
1.PKC 的转位 PKC 广泛分布于多种组织、器官和细胞,静止细胞中 PKC 主要存在于胞浆中,当细胞受到刺激后,PKC 以 Ca2+依赖的形式从胞浆中移位到细胞膜上,此过程称之为转位(translocation)。一般将 PKC 的转位作为 PKC 激活的标志。
2.PKC 的激活 PKC 的活性依赖于钙离子和磷脂的存在,但只有在磷脂代谢中间产物二酰基甘油(DAG)存在下,生理浓度的钙离子才起作用,这是由于 DAG 能增加 PKC 对底物亲和力的缘故。磷脂酰肌醇 -4,5- 二磷酸(PIP2)在磷脂酶 - C 作用下水解生成 DAG 和 IP3。IP3 促进细胞内钙离子的释放,在激活 PKC 过程中与 DAG 起协同作用。乙酸豆塞外佛波酯(12-o-tertradecanoylphordol-13-acetate,TPA; 或 phorbol-12-myristate-13-acetate,PMA)是一种促肿瘤剂,由于基结构与 DAG 相似(图 8 -12),可在很低尝试下模拟 DAG,活化 PKC,使 PKC 亲和力增至 10-7M。PKC 是 TPA 的受体,当 TPA 插入细胞膜后可以替代 DAG 而直接活化 PKC。当过高剂量 TPA 处理细胞可使靶细胞中 PKC 迅速耗竭,反而影响细胞的信号传递。
我种化学物持或抗生素对 PKC 活性具有抑制作用,根据抑制剂作用 PKC 靶部位的不同可以将抑制剂分为二组:一组是作用于催化区的抑制剂,它们可与蛋白激酶的保守残基结合,因此对 PKC 无明显的选择性;另一组是作用于调节区的抑制剂,它们可与 Ca2+、磷脂和二酰基甘油 / 佛波酯相结合,因而有较高的选择性(图 8 -4)。
表 8 -4 蛋白激酶 C 的抑制剂
| 靶部位 | 抑 制 剂 | 来 源 |
| 催化区 | staurosporine | 放线菌属 |
| UCN-01 | 放线菌属 | |
| UCN-02 | 放线菌属 | |
| K252a | 放线菌属 | |
| H-7 | 合 成 | |
| 氨基吖啶 | 合 成 | |
| 桑吉瓦霉素 | 放线菌属 | |
| 调节区 | 氯丙嗪 | 合 成 |
| 三氟拉嗪 | 合 成 | |
| 三苯氨胺 | 合 成 | |
| 多粘菌素 B | 细 菌 | |
| 阿霉素 | 放线菌属 | |
| calphostin | 真 菌 | |
| cercosporin | 真 菌 |
图 8 -12 TPA 与 DAG 结构的比较
第六节 T 细胞基因的转录激活及其表达
TCR/CD3 复合物与配体结合后,经多种信号转导途径传递信号,最终导致 T 细胞活化和增殖。信号转导中所涉及的基因根据其活化时间可以分为早早期、早期、晚期基因三种类型(表 8 -5)。早早期基因的转录不需蛋白的合成,而早期及晚期基因的转录则需蛋白的合成。早早期及早期基因转录在有丝分裂期之前,而晚期基因转录在有丝分裂期之后。根据活化 T 细胞内转录的基因表达蛋白功能的不同,活化 T 细胞基因可以分为以下三种类型:(1)细胞原癌基因;(2)细胞因子基因;(3)细胞因子受体基因。
表 -8-5 活化 T 淋巴细胞表达的基因产物
| 名 称 | 功能范围 | 最早检测 mRNA 的时间 | 基因产物存在部位 | 活化后增加倍 数 |
| 早早期 | ||||
| c-fos | 核结合蛋白 | 15min | 胞核 | <100 |
| c-myc | 核结合蛋白 | 30min | 胞核 | 20 |
| NF-AT | 核结合蛋白 | 20min | 胞核 | 50 |
| NF-κB | 核结合蛋白 | 30min | 胞核 | >10 |
| 早 期 | ||||
| TFN-γ | 细胞因子 | 30min | 分泌 | >100 |
| IL-2 | 细胞因子 | 45min | 分泌 | >1000 |
| TGF-β | 细胞因子 | ≤2hr | 分泌 | >10 |
| IL-2R(p55) | 细胞因子受体 | 2hr | 浆膜 | >50 |
| IL-3 | 细胞因子 | 1~2hr | 分泌 | >100 |
| LT | 细胞因子 | 1~3hr | 分泌 | >100 |
| IL-4 | 细胞因子 | <6hr | 分泌 | >100 |
| IL-5 | 细胞因子 | <6hr | 分泌 | >100 |
| IL-6 | 细胞因子 | <6hr | 分泌 | >100 |
| Tf-R | 受体 | 14hr | 浆膜 | 5 |
| c-myb | 细胞癌基因 | 16hr | 胞核 | 100 |
| GM-CSF | 细胞因子 | <20hr | 分泌 | – |
| 晚 期 | ||||
| HLA-DR | MHC-Ⅱ类分子 | 3~5d | 浆膜 | 10 |
| VLA-1 | 粘附分子 | 7~14d | 浆膜 | – |
一、细胞原癌基因
细胞原癌基因是一种正常细胞基因,它们的产物存在于细胞的不同部位,参与细胞的生长和分化,这些细胞基因研究室所以称为细胞原癌基因,是因为这些基因的过分表达或其基因的突变形式的表达可以导致细胞恶性增生。T 细胞在经 TCR/CD3 介导的刺激后,几种细胞原癌基因转录水平明显升高,而且许多非淋巴细胞类型在相应配体刺激后也表达这些细胞原癌基因。这些基因中研究最多的是 c -fos 和 c -myc,它们都属于早早期基因范围。c-fos 和 c -myc 转录本分别在 T 细胞刺激 15min 和 30min 内可以检测到,转录水平分别在 1hr 和 6hr 内到达最高水平,这两种细胞原癌基因被认为是通过在细胞核内发挥作用而调节细胞生长。Fos 蛋白还参与其它基因的转录调节,包括 IL- 2 基因。Myc 蛋白可能对于 DNA 合成的起始是必需的,但它发挥作用的方式还不清楚。其它细胞原癌基因在 T 细胞活化后期阶段才转录活化,而且需要其它基因的预先表达,例如 c -myb 仅在自分泌 IL- 2 刺激 T 细胞后才转录,Myb 蛋白发现于细胞核中,但它的功能还不清楚。
二、细胞因子基因
T 细胞中多种细胞因子基因转录水平的 TCR/CD3 介导的刺激 4hr 后明显提高。IL- 2 基因可以作为 T 细胞活化期间细胞因子基因转录调节的典型,IL- 2 对于大多数正常 T 细胞来说是一种自分泌生长因子,因此,其基因的转录调节对于 T 细胞活化是必需的,IL- 2 基因在 TCR 介导的正常 T 细胞刺激 45nim-1hr 内开始转录。细胞因子基因转录本 RNA 水平升高大部分是由于转录的增加,而不是由于 RNA 降解减少。
[AP-1]转录因子 AP-1(activator protien-1)是由 Fos(55kDa)和 Jun(39kDa)组成的异二聚体,通过亮氨酸拉链(leucine zipper,LZ)与 DNA 结合。AP- 1 结合点又称佛波酯(12-0-tet-radecanoyll-phordol-13-acetate,TPA)反应元件(TPa responsive element,TRE), 其序列为 5`-TGACTCA-3`)。TRE 命名是因为 TPA 可通过活化 PKC 而诱导 AP- 1 并与 AP- 1 结合位点结合。
图 8 -13 IL- 2 基因转录调控模式图
IL- 2 基因在转录起始部位的 5` 端含有一个增强子,它仅存在 T 细胞中以细胞特异性的方式控制 IL- 2 基因的转录,几种结合到 IL- 2 基因增强子区域的 DNA 结合蛋白被认为是 MHC/Ag 结合 TCR 与 IL- 2 基因转录调节之间重要的联系环节。这个增强子中的一些序列可以特异性地同一个称为 AP- 1 的转录激活蛋白相结合。AP- 1 可存在于不同细胞类型中,许多不同基因的调节区域都存在 AP- 1 的结合。AP- 1 可存在于不同细胞类型中,许多不同基因的调节区域都存在 AP- 1 的结合位点,AP- 1 大部分由 c -jun 癌基因的蛋白产物组成,但当它同 c -fos 基因的蛋白产物形成复合物时,其与 DNA 结合的亲合力大大增加。Fos 和 Jun 是通过多种亮氨酸残基之间的疏水作用即一种“亮氨酸拉链”(lucinezipper)结构结合在一起的,采用某些 T 细胞肿瘤细胞系分析表明 AP- 1 在 IL- 2 基因转录调节中的作用是非常重要的,采用某些 T 细胞肿瘤细胞系分析表明 AP- 1 在 IL- 2 基因转录调节中的作用是非常重要的,这些细胞系仅在 TCR 介导的信号以及 IL- 1 共同作用下才出现 IL- 2 基因的转录。PHA 刺激 c -fos 转录,IL- 1 刺激 c -jun 转录,因此,PHA 和 IL- 1 可以诱导 AP- 1 核因子的出现(见图 8 -13)。在正常 T 细胞中情况更加复杂,IL- 2 基因的转录可能还需要其它的核因子参与。T 细胞中细胞子基因转录的一个明显的特点是它们对免疫抑制药 CsA 的作用非常敏感,CsA 主要是通过抑制 T 细胞因子的产生起免疫抑制作用的,从而抑制 T 细胞生长和效应功能,IL- 2 基因增强子区域是 CsA 抑制 IL- 2 基因转录的作用位点,推测 CsA 是干扰一种或多种转录激活 DNA 结合蛋白的功能。
三、细胞因子受体基因
IL-2R 基因的转录是 T 细胞活化过程中的重要表现,它对于 T 细胞自分泌生长是必需的。目前证实 IL-2R 由三条肽链组成,即 α、β、γ 链。TCR 介导的 T 细胞刺激可以导致 IL-2R 亚单位 p55(α 链)表达升高。IL-2Rα 基因有一个 5` 增强子区域,它可以同 PMA 诱导的核因子结合。有关 IL-2Rβ、γ 链的转录调节还不清楚。编码其它细胞因子受体基因(如 IL-4R)转录的 T 细胞受到刺激后也可得到激活,其转录调控方式类似于 IL-2R 基因。
第七节 经 B 淋巴细胞抗原受体介导的信号转导分子基础
B 淋巴细胞是另一群重要的免疫活性细胞,它有两个基本的功能:一方面作为免疫效应细胞直接参与免疫应答,介导体液免疫;另一方面作为特异性的抗原提呈细胞选择性地捕获抗原并提呈给 T 细胞,协同和调节 T 细胞免疫应答。B 细胞以上的两个基本功能是通过其表面的抗原受体所介导。B 细胞抗原受体的信号介导由许多分子参与,主要包括 B 细胞抗原受人本(b cell receptor,BCR)和 BCR 相关联的分子。通过信号蛋白激活 B 细胞内的多种酶活化途径,最终导致 B 细胞的增殖、活化,合成和分泌免疫球蛋白。
一、BCR 的组成及功能
同 TCR/CD3 复合体一样,BCR 也是一种由异源寡聚体形成的复合体。目前证实 BCR 至少同二部分组成:(1)膜表面免疫球蛋白(surface membrane immunoglobulin,mIg);(2)Igα 和 Igβ(图 8 -14)。
1.mIg mIg 是由二和要重链和二条轻链通过二硫键相连形成的四聚体结构,同分泌形式的 Ig 不同,mIg 的重链是穿膜的多肽链。重链的胞膜外区由 1 个 V 区、3- 4 个 C 区组成,其胞浆尾部由数目不等氨基酸组成,μ 和 δ 含 3 个相同的氨基酸残基,α 含 14 个氨基酸残基,γ 和 ε 含 28 个氨基酸残基。成熟的 B 细胞含有 mIgD 和 mIgM 两类 mIg;而未成熟的 B 细胞仅含 mIgM。mIg 主要的功能是识别外源性抗原。
2.Igα 和 Igβ Igα 和 Igβ(分别为 CD79a 和 CD79b)都是免疫球蛋白超家族结构相关基因的表达产物,又分别称为 MB-1(为 mb- 1 基因表达产物)和 B29(为 B29 基因表达产物)。Igα 和 Igβ 在物种之间有高度的保守性。人和小鼠 Igα、Igβ 在 DNA 水平上有 90% 的同源性。在人 B 细胞中 Igα 和 Igβ 的分子量分别为 47kDa 和 37kDa;在小鼠 B 细胞中 Igα 和 Igβ 的分子量分别为 34kDa 和 39kDa。Igα 和 Igβ 都属于 I 型跨膜糖蛋白,在 B 细胞中以二硫键相连形成异源二聚体,并同 mIg 相连接。Igα 和 Igβ 胞膜外结构域同 TCR/CD3 复合体中 CD3 的 γ、δ、ε 链相似,各含有 1 个免疫球蛋白样结构域,此外,MB- 1 和 B29 同 CD3 的 γ、δ、ε 和 ζ 亚单位一样,胞浆内也含有一个含酪氨酸的 ARAM。Igα 和 Igβ 的功能有二个方面:(1)作为一个主要的信号传导分子传递外界抗原结合受体所产生的刺激信号;(2)参与 mIg 的表达及其转运。B29(Igβ)单独足以转运 IgM 到细胞膜上,且参与由免疫球蛋白所介导的抗原特异性信号传导。在垂体细胞系中,Igα 和 Igβ 可以完全导致 mIg 的产生,并部分重建由 IgM 所介导的信号转导。
二、BCR 相关联的分子
1.BCR 与激酶相连 除了 BCR/Igα/Igβ 外,B 细胞表面还存在着一些 BCR 相关联分子,参与 BCR 的信号转导。BCR 交联后可引起 Igα 和 Igβ 的酪氨酸磷酸化,Igα 和 Igβ 胞浆内功能区无激酶同源序列,但 Igα 和 Igβ 确与一些激酶相关联。尽管 Igα 和 Igβ 有着高度的同源性,但它们胞浆尾部连接激酶分子的种类有所不同。Igα 胞浆内同 src 家族激酶 p56lyn和 p59fyn相连结,而 Igβ 胞浆尾部则同磷脂酰肌醇 - 3 激酶(PI3K)及尚末明确的磷酸化蛋白 pp40 和 pp42 相连结。
2.BCR 与 CD19、CD21 相连 成熟人 B 细胞 mIg 可以同 CD19 和 CD21 跨膜蛋白相连。CD19 是一种 B 细胞特异的抗原,为 Ig 超家族成员,表达于除浆细胞外所有 B 细胞上。CD21 为 C3dg 和 iC3b 的受体(CD2)。抗原一方面可以与 BCR 结合,另一方面可以通过 C3dg 与 CD21 相连,构成了 B 细胞的双重抗原识别(dual antigen recognition)(图 8 -15)。这种双重抗原识别可以使 BCR 与 CD19、CD21 形成多聚化,为 B 细胞的活化提供了最佳刺激信号。此外,MHC-Ⅱ类分子,Fcγr Ⅱ以及胞浆 p21ras蛋白与 mIg 发生共帽(co-capping)现象,从而参与 B 细胞的信号转导,但它们的调节作用不同。MHC-Ⅱ类分子在人 B 细胞转导激活信号,在 LPS 激活的 B 细胞中介导负信号;Fcγr Ⅱ的交联可以加速由 mIg 交联所致升高 Ca2+的清除,并阻止 mIg 介导的信号转导给 G 蛋白;p21ras是一种 GTP 酶,可将浆膜上的生长信号同胞质中 c -raf 和 c -erk 激酶连接起来。
图 8 -15 B 细胞双重抗原识别模式图
三、PCR 介导的信号转导途径
BCR 的交联可以激活多种酪氨酸激酶,引起许多蛋白酪氨酸磷酸化,酪氨酸激酶底物有 Igα 和 Igβ 链、LC 的 γ1 和 γ2 异型、p21ras蛋白以及 PI-3K 等。这些分子发生要酪氨酸磷酸化后可被激活,从而介导信号的传导。B 细胞活化过程中涉及到多种磷脂酰肌醇的产生及其调节(图 8 -16)。其中某些磷脂酰肌醇产物主要参与信号传递,如 IP3 为一种第二信使,引起胞浆内 Ca2+浓度升高,激活 Ca2+浓度升高,激活 Ca2+依赖的蛋白激酶。3,4- 二磷酸磷脂酰肌醇 [phosphatidylinositol3,4-bisphosphate,PtdIns(3,4)P2] 及 3,4,5- 三磷酸磷脂酰肌醇 [PtdIns(3,4,5)P3] 均可以充当第二信使,在体外可激活 PKCζ 异型。
BCR 交联后通过 PI-3K 和 PLC 二种酶介导的不同的信号转导途径调节磷脂酰肌醇的产生,产生不同种的磷脂酰肌醇可分别激活下游的信号蛋白,使得信号逐级传递,最终引起 B 细胞的活化、增殖,并发挥其生物学功能。
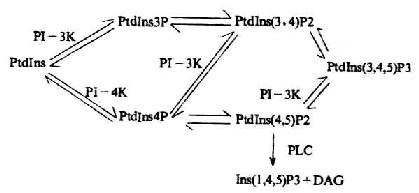
图 8 -16 不同磷酸化磷脂酰肌醇的产生及调节
注:PtdIns: 磷脂酰肌醇
PtdIns3P: 磷脂酰肌醇 3 磷酸
PtdIns4P: 磷脂酰肌醇 4 磷酸
PtdIns(3,4)P2:3,4- 二磷酸磷脂酰肌醇
PI-3K:磷脂酰肌醇 3 激酶
PI-4K:磷脂酰肌醇 4 激酶
PtdIns(3,4,5)P3:3,4,5- 三磷酸磷脂酰肌醇
Ins(1,4,5)P3:1,4,5- 三磷酸肌醇
PLC:磷脂酶 C
DAG:二酰基甘油
第八节 淋巴细胞信号转导研究中常用方法
信号转导是目前分子免疫学中研究的热点。免疫学中所涉及的信号转导主要包括淋巴细胞的信号转导以及细胞因子 / 细胞因子受体的信号转导,其研究手段多种多样,包括细胞生物学、分子生物学以及蛋白质化学等技术。本节将扼要介绍目前信号转导研究中常用的方法和技术。
一、磷酸化的信号转导分子的鉴定
在淋巴细胞信号转地过程中可发生多种蛋白底物的磷酸化,包括酪氨酸磷酸化、苏氨酸残基磷酸化及丝氨酸残基磷酸化。它们分别由不同的蛋白激酶所催化。这些磷酸化蛋白通常都为信号转导分子,在信号传递过程中发挥重要的作用。一些信号蛋白结构中含 SH- 2 结构域可同某些磷酸化的酪氨酸残基相结合,使信号得以逐级传递。含酪氨酸磷酸化的蛋白鉴定通常是首先分离粗提蛋白,采用针对含这些氨基酸残基磷酸化蛋白的单克隆抗体进行免疫沉淀(immunoprecipitation),SDS-PAGE 电泳,然而采用 Western blotting 及 immunoblotting 鉴定其分子量,进一步利用分子生物学技术克隆信号蛋白,搞清其基因结构和氨基酸序列。
二、信号转导中第二信使含量的测定
信号转导过程中,第二信使(second messenger)含量的高低同信号传递密切相关。目前测定的第二信使主要包括细胞内 Ca2+([Ca2+]i)、二酰基甘油(DAG)、三磷酸肌醇(IP3)以及环腺苷酸(cAMP)等。
1.[Ca2+]i 的测定 细胞内 Ca2+的测定方法有原子吸收光谱法、离子微电极测定法、放射示踪法及标记示踪法等。目前常用标记示踪法,即用荧光探针标记靶细胞。常用的荧光探针有 quin-2/Am、Fura-2/Am 及 Indo- 1 等。Fura-2/Am 和 Indo- 1 较为敏感。
2.IP3 的测定 采用 3H-TdR 标记的肌醇标记靶细胞后,用不同的刺激剂刺激细胞,分离磷脂酰肌醇混合物,通过阴离子交换层析柱(Serva 公司 Dowex1*8)分离洗脱,收集 IP3 洗脱峰后进行液闪测定。此外,还可以使用 Amersham 公司生产的 D -myo-IP3[3H] 分析系统直接测定粗提物中的 IP3 含量,此方法简易、敏感。
3.DAG 的测定 首先提取含 DAG 的样品,然后采用 Amersham 公司生产的 DAG 分析系统进行测定。此系统测定的原理是用 DAG 激酶催化底物 DAG,使之发生磷酸化,外源加入32γ-ATP,最后将反应产物进行分离后测定放射性含量,根据标准品计算出样品中 DAG 的含量。
4.cAMP 的测定 可选择不同的方法:(1)cAMP[3H]分析系统,其优点是放射性半衰期长,可用于大量样品的分析;(2)cAMP[125I]分析系统,用于小量样品的分析;(3)cAMp ILISA 测定方法,此方法简便、敏感。
三、激酶活性的测定
信号转导过程中往往涉及多种激酶的活化,因而对这些激酶活性的测定可以作为信号转导研究中的一种重要指标。常见激酶活性的测定有 PTK、PKC 及 PI-3K 等。均有商品化的试剂盒。检测原理是根据激酶可以催化特定底物发生磷酸化,外源加入32γ-ATP,通过分离反应产物后测定放射活性,从标准曲线推算出样品酶的活性。前已提及,PKC 从胞质向胞膜的转位是 PKC 活化的一个重要指标,因而分离胞质和胞膜中的 PKC 并分别测定其活性,计算胞膜上 PKC 活性占总 PKC 活性的比例,从而判定 PKC 的活化程度。
四、细胞核转录因子的分离和鉴定
信号转导的结果是细胞核内一些转录因子同 DNA 上某些特定的序列结合,调节转录活性和基因的表达水平。因而分离鉴定细胞内核转录因子在信号转导研究中具有独特的意义。根据核转录因子可与一些特定的核甘酸序列结合的特点,将其特定的核苷序列标记上同位素,来鉴定信号转导中的核转录因子。核转录因子具有一些特征性的结构域,即亮氨酸拉链(lucine zipper)、锌指结构(zinc finger)和螺旋 - 转角 - 螺旋(helix-turn-helix)结构。并且受用足迹法(foot printing)分析新发现核转录因子结合 DNA 的位置和核甘酸序列。
随着分子生物学核技术的发展,信号转导研究取得很大进展。采用基因克隆技术发现了越来越多的信号蛋白分子;嵌合分子的构建及基因转染等技术的应用为细胞因子的信号转导研究提供了有效的手段;点突变、肽竞争等技术使信号蛋白中某些功能区的作用的研究变得更为精确。
(夏海滨 金伯泉)
参考文献
1.Abraham N, et al. Activation ofp56lckthrough mutation of a regulatory carboxylterminal tyrosineresiduse intact sites of autophosphorylation and myristylation.
2.Altman A, et al. Molecularevents mediating T cell activation. Adv Immun,1990;48:277.
3.Andrea M, et al. The PH domain:a common piece in the structural patchwork of signallingprotein.TIBS,1993;18:343.
4.Barber EK, et al. The CD4 andCD8 antigens are coupled to a protein tyrosine kinase (p56lck) thatphosphorylates the CD3 complex.Proc Natl Acad.Sci USA,1989;86:3277.
5.Baixeras E, et al. Signal transduction pathways involved in Bcell induction. Immunological Reviews,1993;132:5.
6.Blumberg RS, et al. Structureof the T cell antigen receptor: Evidence for two CD3 subunits in the T cellreceptor CD3 complex. Proc Natl Acal Sci USA,1990;87:7220.
7.Burgess EK, et al. Biochemicalidentification of a direct physical interaction between the CD4:p56lckand Ti(TCR)/CD3complexes. Eur J Immunol,1991;21:1663.
8.Carel JM, et al. Dual antigenrecognition by Bcells. Immuol Today,1993;14(1).
9.Christopher ER, et al.CD4,CD8and the TCR-CD3complex: a novel class of protein-tyrosine kinase receptor.Immunol Today,1990;11(11):400.
10.Cooke MP, et al. Expression ofa novel form of the fyn protooncogene in hematopoietic cells. NewBiol,1989;1:66.
11.Damjanivich S, et al.Transmembrane signalling in cells. Immunol Today,1992;13(8):12.
12.Glaichenhaus N, et al.Requirement for association of p56lckwith CD4 in antigen specificsignal transduction in T cells.Cell,1991;64:511.
13.Gold M, et al. Bothphosphatidylinositol 3-kinase and phosphatidylinositol 4-ki-nase products areincreased by antigen receptor signaling inB cells. J Immunol,1994;152:42.
14.Irving BA, et al. Thecytoplasmic domain of the T cell receptor chain is sufficient to coupled toreceptor-associated signal transduction pathways.Cell,1991;64:891.
15.Julius M, et al. Distinct rolefor CD4 and CD8 as co-receptors in antigen receptor signalling. ImmunolToday,1993;14(4):17.
16.Kishomoto T, et al. Cytokinesignal transduction.Cell,1994;76:253.
17.Koch C, et al.CH-2 and SH-3domains: elements that control interactions of cytoplasmic signalingproteins.Science,1991;252:668.
18.Kwang-myong K, et al.Signaling function of the B cell antigen receptors. ImmunologicalRevievs,1993;132:125.
19.Noah Isakov. Tyrosinephosphorylation and dephosphorylation in T lymphocyte activation. MolecularImmunolgy,1993;30(1):197.
20.Pawson T, et al.SH-2 and SH-3domains: from structure to function.Cell,1992;71:359.
21.Philippe CH, et al. Animmunologist’s look at Rho and Rab GTP binding proteins. ImmunologyToday.1993;14(9):440.
22.Takeshita T, et al. Cloning ofthe γ chain of the human IL-2receptor.Science,1992;257:379.
23.Mustelin T and Burn P.Regulation of src family tyrosine kinase in lymphocytes.TIBS,1993;18:215.
第九章 免疫网络学说及其在医海陆空中的应用
1974 年,Jerne 根据现代免疫学对抗体分子独特型的认识,在 Burnet“克隆选择学说”的基础上提出了著名的免疫网络学说(immune network theory)。该学说认为,任何抗体分子或淋巴细胞的抗原受体上都存在着独特型,它们可被机体内另一些淋巴细胞识别而刺激诱发产生抗独特型。以独特型同抗独待型的相互识别为基因,免疫系统内构成“网络”联系,在免疫调节中起重要作用。Jerne 的网络学说强调了免疫系统是各个细胞克隆之间相互联系、相互制约所构成的对立统一整体,这是免疫学中的一重大突破,它对于免疫学理论研究以及在生物学和医学领域中的实际应用都具有重大意义。由于 Jerne 对免疫学理论研究的贡献,他与外两位科学家一起分享了 1984 年的诺贝尔医学和生理学奖。
第一节 独特型和抗独特型
一、独特型发现
本世纪中叶,人们发现将 Ig 注入同种或异种动物体内可诱导产生抗 Ig 的抗血清。随后发现了在 Ig 分子上有两类抗原决定簇,即同种型(isotype)和同种异型(allotype)。1955 年 Slater 等在研究兔抗人骨髓瘤蛋白抗血清的特异性时,发现抗某一些骨髓瘤蛋白抗血清用无 Slater 等在研究兔抗人骨髓瘤蛋白抗血清的特异性时,发现抗某一些骨髓瘤蛋白抗血清用无关的其它骨髓瘤蛋白或正常人 Ig 充分吸收后,仍然与最初用作免疫原的那种骨髓瘤蛋白起反应,他们把存在于 Ig 上这种新的抗原特异性称为“个体”抗原特异性(‘individual’antigenicspecitficities)。
1963 年 Oudin 等用伤寒沙门氏菌免疫 50 只家兔,将其中一只家兔血清中分离的抗伤寒沙门氏菌抗体作为免疫原,免疫正常家兔,并分离其血清得到抗抗体。研究发现,这种抗抗体只能与作为免疫原的抗伤寒少门氏菌抗体发生常常反应,但不能与其余 49 只伤寒沙门氏菌免疫家兔的血清发生沉淀反应,也不能与其它抗原免疫家兔血清或正常家兔血清发生反应。上述结果表明,这只家兔产生的抗伤寒沙门氏菌抗体具有特殊的抗原决定簇,它既不同于其它个体(家兔)针对同一抗原(伤寒沙门氏菌)所产生抗体分子上所具有的抗原决定簇,也不同于同一个体针对不同抗原所产生抗体分子上的抗原决定簇,Oudin 将这种不同于同种型(isotype)和同种异型(allotype)的抗原决定簇称为 idiotype, 意为个体基因型。后来人们发现,在在多数情况下,不同个体针对同一抗原的抗体存在着交叉反应,因此不再认为 idiotype 有严格的个体差异。idiotype 现译为独特型。随着名次化学的研究进展,进一步了解到独特型存在于 Fab 段,它是编码抗体可变区基因的标记。
图 9 -1 独特型抗原特异实验(Oudin,1963)
二、独特的分类
独特型主要是通过抗独特型抗体(anti-idiotypicantibodies,αId)的血清方法来进行分类的。
(一)结合点相关独特型和骨架区相关独特型
通过观察用 αId 对抗体与相应抗原分子结合是否有抑制作用,可将独特型分为两类:对抗原和抗体的结合有抑制作用的独特型,称为结合点相关独特型(idiotypes associated with combining site);对抗原和抗体的结合无抑制作用的独特型,称为骨架区相关的独特型(framework associated idiotypes)。
(二)私有独特型和交叉反应性独特型
1. 私有(或个体)独特型 私有独特型(individual Id,IdI)是指某一特异的抗体分子所特有的独特型,一般认为 V 区中 D 基因片段所编码的 CDR3 与此关系较为密切。
2. 交叉反应性独特型 交叉反应性独特型(cross-reactive idiotype,CRI 或 IdX)是指来自不同个体但具有相同特异性 Ab 或 TCR 上的独特型,也可以是来自不同种动物具有相同抗原特异性抗体上的独特型。V 基因片段编码的 CDR2 区域中的某些氨基酸序列(如 54、55 位氨基酸)常与 IdX 有关,极少数 IdX 与重链骨架区和 J 基因片段所编码的氨基酸序列有关。例如:用葡聚糖(Dextran)免疫 BALB/ c 小鼠制备的两组抗葡聚糖单克隆抗体 J558 和 M104,所有单克隆抗体轻链为 λ 型,这两组单克隆抗体之间除具有 IdX 外,各自还具有 IdI。它们的交叉反应独特型定位于可变区中的 HR(CDR)2;而 IdI 则定位于 HR(CDR)3。换言之,两者在 HR2 具有共同的抗原决定簇,而在 HR3 的抗原性彼此不同(图 9 -2)。
图 9 -2 抗葡聚糖抗体上的 IdX 和 IdI 与结构的相关性
注:N:天冬酰氨酸 Y:酪氨酸 H:组氨酸 M:甲硫氨酸 S:丝氨酸
D:天冬氨酸 R:精氨酸 K:赖氨酸 V:缬氨酸
根据 IdX 与表达 IdX 动物种系关系的不同,Bona 等又反 CRI(IdX)分为以下三类。
(1)与同种异型相关的 IdX:这种交叉反应独特型表达于所有近交品系或重组近交品系动物相同的同种异型 Ig 重链或轻链上。
(2)品系间独特型(interstrain idiotypes):这种交叉反应独特型存在于多种近交品系或者一种远系繁殖种中大部分个体。
(3)种间独特型(interspecies idiotypes):不同种不同个体针对相同抗原特异性抗体上的 IdX,种间独特型是生物进化过程中胚系基因保守的标记。例如小鼠和大鼠对人工合成抗原 GAT 的抗体有交叉反应性独特型。再如小鼠、兔和人针对肾综合征出血热病毒抗体上也存在这种类型的 IdX。
(三)常规性独特型和调节性独特型
1. 常规性(或传统性)Id(conventional idiotypes) 这种 Id 在机体免疫应答过程中不发生变化,主要存在于天然抗体和自身抗原受体上,前者是由遗传获得,后者在个体发生时已产生了免疫耐受。因此这种 Id 在机体内的含量很低,不能激活它们的互补性克隆的增殖,在免疫调节上也无重要作用。
2. 调节性 Id(regulatory idiotypes) 这种 Id 主要存在于外源性抗原刺激产生的抗体分子上,可激活互补克隆的增殖,在机体免疫应答过程中可发生改变,并参与机体对抗原应答的调节作用。
三、独特型的分布
1974 年 Jerne 提出把抗原决定簇称为表位(epitope,E), 抗体分子上与 E 互补的结合部位称为补位(paratope,P)。Jerne 假设一个表位可被若干种补位以不同的精密度所识别,同样,一种补位可被几种不同的表位所结合。Jerne 把抗体分子上 V 区内存在的若干个表位称为独特位(idiotope,i)如 il、i2……等,并认为抗体的独特型是由抗体分子上所有独特位所组成。抗体分子上每个 Fab 段都有一个补位和一组数量约 5 - 6 个的独特位(图 9 -3)。
图 9 -3 抗体分子上独特位、独特型、补位以及与抗原表位相互作用的示意图
注:(a)抗体的补位与抗原表位相结合,独特位 a、b、c、d、e 和 f 组成独特型
(b)一种补位可结合几种不同表位
(c)一种补位可结合几种不同补位
应用免疫印迹方法,或免疫化学方法所制备的重链 - 轻链杂交分子,以及免疫球蛋白可变区蛋白序列的合成肽研究表明,Ig 分子特定的独特位主要以单独存在于重链或者单独存在于轻链的方式存在。这在天然 Ig 分子中也能见到,如 E -109 骨髓瘤蛋白的 Id 主要由轻链决定,而 A4 骨髓瘤蛋白 Id 主要由重链组成。但在有的情况下,Id 分子上的 Id 依赖于重链和轻链共同组成的天然构象。
四、抗独特型的分类
Bona 等根据 Id 与抗 Id 的血清学反应和 Ab2 的功能,将 Ab2 分为四种类型(图 9 -4)。由于这种分类方法的实验依据充分,与实际应用联系密切,故应用较为广泛。
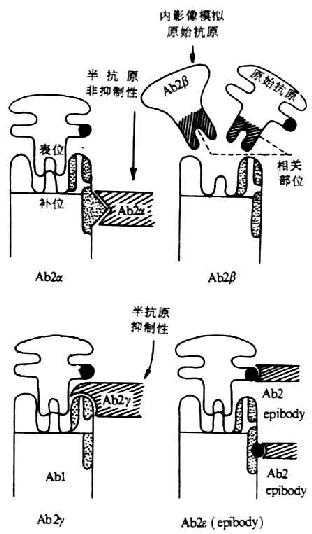
图 9 -4 Bona 抗 Id 分类模式图
1.Ab2α 这类抗体能识别 Ab 上与免疫球蛋白骨架区(framework)相关的独特型决定位,Ab2α 与 Ab1 的结合不影响抗原与 Ab1 的结合,属半抗原非抑制性 Ab2(hepten-noninhibitable Ab2)。Ab2α 具有调节作用,促进或抑制 Ab1 克隆。例如抗流感病毒神经氨酸酶特异性抗体所共有的 IdX 的单克隆抗体,具有促进动物特异性免疫应答,但 Ab2α 本身并不能诱导动物产生抗神经氨酸酶抗体。
2.Ab2β 具有抗原“内影像”(internal image)的作用,可模拟抗原诱导机体产生针对始动抗原的特异性抗体或细胞免疫应答,因而可抑制 Ab1 与相应抗原的结合反应,Ab2β 在体外可与 Ab1 上 IdX 相结合。
已有实验表明,某些 Ab2β 与模拟的抗原之间的特定部位有较高的同源性,Abβ2 可诱导出特异性与 Ab1 相同的 Ab3,这为在分子水平上 Abβ2 模拟原始抗原提供了证据。需要注意的是,除了蛋白质一级结构外,分子三维结构的相似性,或者与 Ab1 补位结合点的相似性也可能是 Ab2β 模拟抗原的分子基础。例如某些 b2β 可模拟非蛋白质的抗原分子,如细菌的果聚糖、磷酸胆碱、醛固酮、糖脂性质的肿瘤相关抗原等,这可能是 b2β 某个区域原子核和电子的排列与抗原表位相似,因此可以相似的方式与 Ab1 的补位相结合。
3.Ab2γ 这类 Ab 可识别 Ab1 上与补位(paratope)相关的独特位,能抑制抗原与 Ab1 的结合,属于半抗原抑制性 Ab2(hapten-inhibitable Ab2)。Ab2γ 也具有调节作用,可促进或抑制带有相应 Id 克隆细胞增殖。
4.Ab2ε 又称 epibody,一种双特异性抗体,它能识别 Ab1 骨架区上的抗原决定簇,同时识别自身或外来抗原上的抗原表位。这种抗独特型抗体对于自身免疫性疾病的研究可能具有意义。
第二节 免疫网络学说
免疫网络学说最早由 Jene 提出,在免疫网络学说的发展过程中不断得到完善和发展。
一、Jerne 的免疫网络学说
Jerne 强调免疫系统中各个细胞克隆不是处于一种独立状态,而是通过自我识别、相互刺激和相互特约构成一个动态平衡的网络结构。构成相互刺激和相互特约的物质基础是独特型和抗独特型。
1.Jerne 的免疫网络结构 见 9 - 5 示意图。
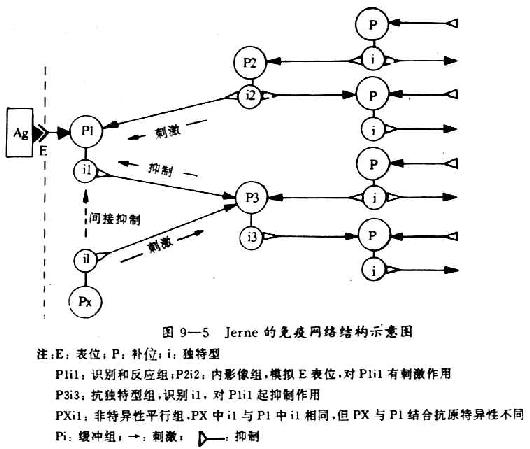
2.Jerne 免疫网络解释免疫应答
(1)启动免疫应答:正常生理情况下,体内 i2 对 P1 的正调节和 P3 对 il 的负调节,使 Plil 处于一个动态抑制性稳定状态。外来抗原(E)进入机体后打破了识别和反应组、内影像组、抗独特型组以及非特异平行组之间保持的抑制性平衡状态。进入机体的抗原,一部分刺激识别组细胞,一部分立即与识别组预先产生的自然抗体相结合并消除这部分抗体,这就暂时减弱了识别组对内影像组的抑制效应和对抗独特型组的刺激效应。由于内影像组抑制效应的减弱,使该组细胞发生增殖并产生抗体,增强了内影像组对识别组的刺激效应。同时识别组对抗独特型组的刺激效应减弱,使独特型组处于更可抑制的状态,以致减弱了对识别组的抑制效应。因此,抗原的刺激、内影像组刺激效应的增强和抗独特型组抑制效应的增强等多种因素促进了识别组的增殖和抗体的分泌。
(2)免疫应答的自控:由于抗原启动免疫应答,识别组分泌抗体增加,恢复了对内影像组的抑制效应和对抗独特型组的刺激效应,使免疫应答水平得到控制,免疫网络的动态趋于恢复平衡。如刺激的抗原在体内持续存在,对识别组的刺激效应持续超过对该组的抑制效应,可使免疫应答持续发生。当抗原被清除后,对识别组的抑制效应超过对其的刺激效应,使免疫应答恢复到原先的平衡状态。
图 9 - 6 是简化的 Jerne 免疫网络结构示意图。机体的免疫网络同四组淋巴细胞构成。第一组为抗原反应细胞(ARC),可通过其抗原受体对外来抗原起反应,并以 ARC 为主体与另外三组淋巴细胞构成网络。第二组为独特型反应细胞(IRC)或独特型组(idiotype set)。能识别 ARC 上的独特型决定簇,从而抑制 ARC 对外来抗原起反应。第三组为内部影像组(internal image set)。其抗原受体上的独特型与外来抗原相同,故能被 ARC 识别,激发 ARC 增殖。第四组为非特异性平行组(nonspecific parallel set), 它的抗原 ARC 不同,但其抗原受体上的独特型(Id)与 ARC 上的 Id 相同,故能被 IRC 识别,从而间接抑制 ARC 的增殖,加强了对网络的抑制作用。二、三、四组淋巴细胞又可各为主体,再分别与另外的三组淋巴细胞组成网络,如此下去,在体内形成网络系统。从总的效应来看,是一种均衡性抑制。
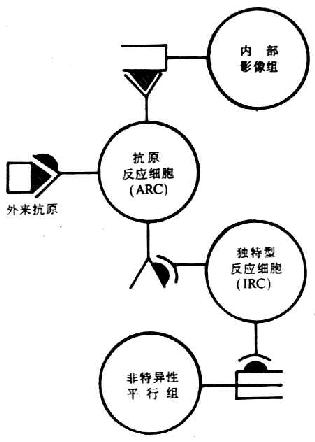
图 9 -6 免疫网络学说(Jerne)
免疫网络学说和内影像可解释医学上的一些现象,如记忆淋巴细胞的存在、Weigle 现象以及非特异性的反应等。
(1)记忆淋巴细胞:Ab2β 不仅可激发针对外来抗原或自身抗原 Ab1 产生前体细胞(precursors),使机体对入侵到体内的抗原迅速发生免疫应答,而且与记忆细胞的存在有关。当抗原被其诱发的免疫清除后,由于记忆细胞识别抗原受体具有更高的亲和力,因而 Ab2β 替代原始抗原可能足够刺激记忆细胞的增殖和存活。
(2)Weigle 现象:现已发现,与自身成份有交叉反应的抗原能够使机体原有的免疫耐受丧失,这与某些自身免疫病的发生有关。例如,链球菌与心肌组织有共同抗原,正常情况下,机体对自身的心肌组织存在着免疫耐受。某些病人感染链球菌后,由于足够量的交叉反应性抗原刺激,增强了内影像组对 ARC 组的刺激效应,减弱了 IRC 组对 ARC 组的抑制效应,致使 ARC 组逃脱抑制,耐受性丧失,从而发生风湿性心肌炎。
(3)非特异性反应:某些抗原刺激机体后,可诱导出现非特异性抗体应答。Oudin 发现,这一非特异性抗体与特异性抗体的独特型是相同的。依照网络学说,当抗原的刺激使 ARC 组增殖并分泌抗体时,加强了对 IRC 组的刺激,继而 IRC 组的增殖又加强了对非特异性平行组的刺激并使后者增殖和抗体分泌,这些抗全具有与 ARC 相同的 Id,但结合抗原的特异性与 ARC 不同,即所谓非特异性抗体。
二、免疫网络的其它模型
Jerne 的网络学说奠定的用整体的、联系的观点解释免疫调节和免疫现象的基本思想。以此免疫学说为基础,Richter、Hoffmann 等又加以修改补充提出了新的网络模型。
Richter 把各种不同的克隆称为功能单位,以 Ab0、Ab1、Ab2、Ab3 等表示,每一个克隆包括 T 细胞、B 细胞、抗体分子及 T 细胞因子。Ab1 识别外源性抗原决定基,Ab2 识别 Ab1 的 Id,Ab3 识别 Ab2 的 Id,以此类推。Ab1 除能识别外源性抗原外,还能识别该抗原的网络中的内影像,即 Ab0。在网络内部,Ab0 刺激 Ab1,Ab1 刺激 Ab2,Ab2 刺激 Ab3……;反之,Ab3 抑制 Ab2,Ab2 抑制 Ab1,Ab1 抑制 Ab0。其中,刺激效尖所需要的抗体分子浓度高于抑制效应所需之浓度。这种刺激与抑制的相互调节使免疫网络处于相对稳定的状态。
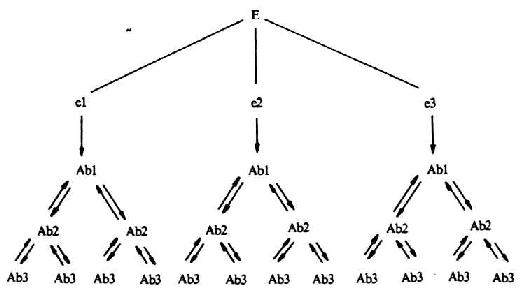
图 9 -7 Richter 网络模型
按照 Richter 模型,可对免疫应答的抗原剂量信赖性反应进行解释。
1. 正常免疫应答 适量的抗原刺激进入机体后,刺激相应的 B 细胞克隆产生 Ab1,Ab1 带有与产生 Ab1B 细胞表面 BCR 相同的独特型,当 Ab1 产生到一定水平时,可刺激体内识别 Ab1 上 Id 的另一组 B 细胞克隆产生 Ab2;以类似的方式 Ab2 刺激机体产生 Ab3。由于适量抗原刺激,反应只能使 Ab3 产生一定水平,此水平足以抑制 Ab2,但尚不能刺激 Ab4。这样,使 Ab1 克隆细胞得以活化增殖,产生较高水平的针对入侵抗原的抗体(Ab1)。
2. 低剂量耐受性 低剂量抗原刺激机体产生较低水平的 Ab1,只能微弱地刺激产生 Ab2,其浓度恰好能够抑制 Ab1 但不足刺激 Ab3,因此发生低剂量免疫耐受。
3. 高剂量耐受性 高剂量抗原的刺激信号强,可产生较高水平的 Ab3,进而刺激产生 Ab4,Ab4 对 Ab3 的反馈抑制,导致 Ab2 逃脱 Ab3 的抑制而增殖,从而抑制了 Ab1 克隆表现为高剂量耐受性。
Id 除分布于 Ig 分子或 BCR V 区外,还存在于 T 细胞受体(TCR)α 和 β 链,包括 t h、Ts、TDTH和 Tc 等不同 T 细胞亚群。TCR 上的 Id 可用抗 IdAb 或抗 IdT 细胞来鉴定。一般来说,TCR 上的 Id 与 Ig 或 BCR 上的 Id 有所差别,这可能是 TCRα、β 链的 V 基因与 Ig 重链、轻链 V 基因同源性较低的原因。抗 TCr Id 也能模拟抗原而活化 T 细胞。最近研究表明,抗原特异性 B 细胞上 Id 不仅可被 Ab2B 细胞所识别,也可被独特型特异性 Th、Ts 或 Tc 所识别;同样抗原特异性 T 细胞上 Id 可被 TCR 特异性 T 细胞和 Ab2 B 细胞所识别,这可能与淋巴细胞 V 基因库中,TCRα、β 链 V 基因库与 BCR 免疫球蛋白重量链和轻链 V 基因库有一定程度的同源性有关。
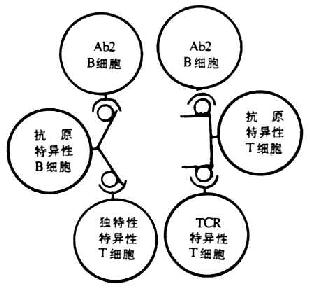
图 9 -8 TCR 和 BCR 上 Id 相互被识别的示意图
第三节 抗独特型抗体及其在医学研究中的应用
针对外来抗原的抗体分子(Ab1)可变区上 Id 可刺激机体产生相应的抗 Id 抗体(Ab2)。Ab2β 具有与外来抗原相似的氨基酸排列顺序或空间构型,它能够在体内模拟始动抗原的作用。应用 Ab2β 的这一特性,可有目的地制备 Ab2β,将其作为抗原的替代物用于基础和临床医学研究。
一、抗独特抗体的制备
(一)抗原及其用量的选择
由于 Ab2 是针对 Ab2Id 的抗体,因而制备 Ab2 时应选择适当的 Ab1 作为免疫原。所用抗原的用量依照给予抗原的种类、次数、途径以受体动物的耐受性而有所不同。一般来说,当受体动物为小鼠时,常用 Ab1 最为 50-200μg;若受体动物为家兔时,使用的 Ab1 量可达 100-200μg。
(二)免疫动物的选择
抗独特型抗体可在自身体内、同类系、同种异体以及异种动物中诱导产生,因此在制备抗独特型抗体时可根据不同情况选用同类系、同种异体或异种动物(表 9 -1)。从制备技术上讲,可以制备单克隆抗 Id 和多克隆(免疫血清)抗 Id。
表 9 -1 不同宿主免疫系统识别的抗体决定簇及抗独特型抗体的制备
| 受体动物(应答者) | 提供 Ab1 的动物(刺激者) | Ab1 分子上的抗原决定簇类型 | 产生 Ab2 的类型 |
| 家兔 | BALB/ c 小鼠 | 同种型 | 抗同种型 |
| 独特型 | 抗同种型 | ||
| C59BL/ 6 小鼠 | BALB/ c 小鼠 | 同种异型 | 抗同种异型 |
| 独特型 | 抗同种型 | ||
| BALB/ c 小鼠 | BALB/ c 小鼠 | 独特型 | 抗同种型 |
1. 同类系动物 用某一种抗原免疫某一品系的动物,分离纯化的 Ab1 再免疫相同品系的另外一只动物,可获得抗独特型体。例如 Uytdegaag 等将Ⅱ型脊髓灰质炎病毒免疫 BALB/ c 小鼠,经杂交瘤技术制备了单克隆抗体(Ab1), 再用 Ab1 免疫 BALB/ c 小鼠,制备了单克隆 Ab2。
2. 同种异型动物 Seto 等从一只品系为 a3b4 家兔血清中纯化出 IgG 作为 Ab1,然后免疫 B / J 品系家兔,得到了含有 Ab2 的免疫血清。用此方法制备的抗血清中,除了含有抗 Id 外,还含有抗同种异型决定簇的抗体。
3. 异种动物 例如用人 IgM 作为 Ab1 免疫小鼠制备单克隆 Ab2。由异种动物免疫制备的 Ab2 血清中,除抗 Id 外还含有抗同种型的抗体。
(三)抗独特型抗体的检测
抗 Id 抗体的鉴定至关重要。通常采用免疫学检测方法如 ELISA、RIA、免疫荧光和中和试验等,可根据具体条件和需要加以选用。抗 Id 的鉴定必须设置充分的对照,确保检测结果的可靠性。例如,在鉴定小鼠源性抗原特异性人 IgM 抗独特型抗体时,用正常人 IgM 作为对照。将 Ab1(抗原特异性人 IgM)包被微孔板,然后加检测样品(小鼠源性抗 Id),再加抗鼠的标记抗体,为了克服非特异性鼠抗人 IgM 同种型 Ig 造成的假阳性,同时用非特异性人 IgM 包被微板作为对照(图 9 -9)。当试验孔为阳性、对照孔为阴性时可基本确定为抗 Id 抗体。

图 9 -9 用 ELISA 间接法检测鼠源性单克隆抗 Id 示意图
二、抗独特型抗体在医学中的应用
抗独特型抗体不仅对于免疫应答调节的理论研究具有重要意义,而且在传染性疾病的预防、自身免疫性疾病发病机理研究和恶性肿瘤的治疗等应用研究中也具有重要的价值。
(一)抗独特型抗体与疫苗
抗独特型抗体中 Ab2β 作为抗原的模拟物,可代替病原体的抗原,诱导机体产生抗病原体的特异性免疫应答,即所谓抗独特型疫苗(anti-idiotype vaccine)。目前,抗独特型疫苗研究仍处于动物实验研究阶段,疫苗的范围主要有病毒、细菌和原虫等引起的传染病(表 9 -2)。
1. 抗病毒的抗独特型疫苗 针对病毒感染的抗独特型疫苗是近年来较活跃的研究领域。Reagan 将狂犬病毒糖蛋白特异的单克隆抗体免疫动物,制备出抗 Id 抗体,将这些抗体注射小鼠后,可诱导出具有病毒特异性中和活性的抗体应答。Kennedy 等用抗 HBsAg 抗体制备出抗独特型抗体,经亲和层析纯化后注射于 BALB/ c 小鼠,诱导产生针对 HBsAg 的体液免疫应答。
Uytdehaag 等用对Ⅱ型脊随灰质炎病毒特异的保护性单克隆抗体(Ab1)免疫 BALB/ c 小鼠, 制备出单克隆 Ab2,用 Ab2 免疫 BALB/ c 小鼠后,可诱导出 Ab3,产生抗脊髓灰质炎病毒的保护性免疫,这种单克隆 Ab2 可用于预防Ⅱ型脊髓灰质炎病毒的感染。Tanaka 等在 BALB/ c 小鼠中用抗新城疫病毒(NDV)血凝素的抗体诱导出抗 Id 抗体,在无病毒抗原存在的情况下,这种抗 Id 抗体可刺激小鼠产生抗 NDV 抗体。Lathey 用单纯疱疹病毒(HSV)糖蛋白 D 特异的 McAb 制备了抗 Id 抗体,并在小鼠中诱发对 HSV 的免疫应答。用人工合成 HIV 包膜抗耕牛的 735-752 氨基酸段的多肽免疫黑猩猩制得 Ab1,再用 Ab1 免疫家兔制备 Ab2,将 Ab2 免疫小鼠获得 Ab3,实验表明,Ab3 能与 HIV 多肽抗原发生特异性结合。
图 9 -10 HBsAg 抗 Id 的实验研究(Kennedy,1984)
2. 抗细胞菌和原虫的抗独特型疫苗 抗 Id 抗体也可用于诱导针对细菌和原虫的保护性免疫应答。例如,用 Ab2 诱导动物针对肺炎球菌、大肠杆菌(K13)、血吸虫和罗德西亚锥虫等病原体的保护性免疫。其 Ab2 的制备和研究方法与病毒性抗 Id 疫苗研究类似。
抗 Id 作为疫苗有以下优点:(1)不含有传染性物质;(2)可大量制备抗 Id 的 McAb;(3)某些保护性抗原决定簇为碳水化合物,不能用 DNA 重组技术获得,而某些抗 Id 可模拟碳水化合物抗原决定簇;(4)能诱导比灭活病毒更为有效的 T 细胞应答;(5)诱导抗原决定簇特异性的抗 Id 疫苗。应该看到,抗 Id 疫苗的免疫应答水平一般较低,大剂量鼠源性免疫球蛋白可能刺激机体产生抗异种蛋白的免疫反应以及过敏反应。因此,在临床实际应用中,制备人源性抗 Id 疫苗,应该看到,抗 Id 疫苗的免疫应答水平一般较低,大剂量鼠源性免疫球蛋白可能刺激机体产生抗异种蛋白的免疫反应以及过敏反应。因此,在临床实际应用中,制备人源性抗 Id 疫苗,提高抗 Id 疫苗的免疫原性,以及细胞工程和基因工程相结合等方面有待进一步深入研究。
(二)抗独特型抗体与自身免疫性疾病
自身免疫病是机体产生对自身成份的免疫应答并造成病理损害而引起的一系列疾病,常与自身隐蔽抗原的释放、自身反应的 T 细胞克隆激活以及由于具有与自身交叉反应抗原的病原体感染有关。随着免疫网络学说和抗独特型抗体研究的发展,进一步提示了抗独特型抗体与某些自身免疫性疾病的发生有关。
表 9 -2 抗独特型疫苗的研究
| 抗独特型疫苗种类 | 作者 |
| 病毒 | |
| 狂犬病毒糖蛋白 | Reagan 等(1983) |
| 呼肠孤病毒 | Sharpe 等(1984) |
| HBsAg | Kennedy 等(1984,1986) |
| Ⅱ型脊髓灰质炎病毒 | Uytdehaag 等(1985) |
| 新城疫病毒血凝素 | Tanaka 等(1986) |
| HSV- 1 糖蛋白 D | Lathey 等(1986) |
| 肾综合征出血热病毒 | 米力等(1993) |
| 细菌 | |
| 肺炎球菌 | McNamara 等(1984) |
| 大肠杆菌(K13) | Stein 等(1984) |
| 肺炎球菌 | Ward 等(1987) |
| 原虫 | |
| 疟原虫 | Naussenzweig 等(1980) |
| 非洲锥虫 | Sack 等(1982) |
| 血吸虫 | Grzych 等(1985) |
1. 抗独特型抗体与重症肌无力 1971 年,Bartels 等合成了称之为 Bis-Q(trans-3,3`-bis[(α-trimethylammonio methyl)azobenzene]的化合物,发现 Bis- Q 可模拟乙酰胆硷(acetylcholine,Ach)与乙酰胆硷受体(acetylcholinereceptor,AchR)结合。继而,Erlanger 将 Bis- Q 与蛋白载体交联,制备了 Bis- Q 特异性抗体。1982 年 Wassermann 等用抗 Bis- Q 抗体免疫家兔,由于抗 Bis- Q 能模拟 AchR,免疫后产生的抗独特型抗体可模拟抗 AchR,结果在接受抗 Bis- Q 免疫的 5 只家兔中,在第 1 次加强免疫后就有 4 只产生了实验性重症肌无力(myasthenia gravis,MG)的症状,但第 2 次加强免疫后 MG 症状又有所减轻。他们认为,第 1 次免疫后产生了抗 AchR,阻断了运动终板处 Ach 与 AchR 的结合,与 MG 的症状产生有关。而第 2 次免疫后,由于注入的抗 Bis- Q 对血清中抗 AchR 抗体有中和作用,抑制了抗 AchR 的作用,使 MG 症状缓解。重症肌无力患者血清中,除了发现有抗 AchR 的自身抗体外,还可能存在针对 Ach 抗体的抗 Id 抗体,Ach 可刺激抗 Ach 抗体的产生,Ab1 可变区的 Id 又可刺激抗 Id 抗体产生,Ab2 作为 Ach 的模拟和换封闭了神经肌肉接头的 AchR,从而导致神经 - 肌肉接头功能障碍,发生 MG 症状。
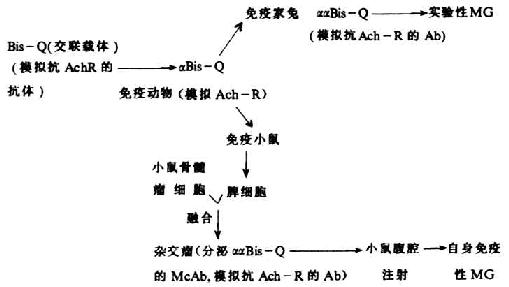
图 9 -11 Bis-Q、αBisQ 和 ααBis- Q 与实验性 MG 发生的关系
1984 年,Erlanger 等又进一步以 α -Bis- Q 为抗原免疫小鼠,制备了分泌 ααBis-QId McAb 的杂交瘤细胞株,将此杂交瘤细胞注入到小鼠腹腔,小鼠发生自身免疫性 MG,这是由于杂交瘤所分泌的 αα-Bis-QId McAb 可模拟抗 AchR 抗体的作用,与 Bis- Q 的封闭作用相似。
2. 抗独特型抗体与促甲状腺受体病 甲状腺机能亢进(简称甲亢)的病因尚不十分清楚。以往认为,病人血清中存在着抗促甲状腺素受体(thyroid stimulating lormone receptor,TSHR)的抗体,由于该抗体与 TSHR 的结合可模拟 TSH 的配体作用,因而刺激产生甲状腺素,导致患都产生甲亢的症状,并将抗 TSHR 称为长效甲状腺刺激素(long acting thyroidstimulator,LATS)。以后研究发现针对抗 TSH 的独特型抗体中有一部分应能模拟 TSH 的作用,能与 TSHR 结合而刺激甲状腺素的分泌。
进一步研究证实:(1)来自甲亢患者血清中 TSHαId 可促进甲状腺上皮细胞对碘的摄取;(2)αId 作为 TSHR 的配体,检测到 TSHR 的分子量为 197kDa;(3)αId 的 Fab 段可直接与 TSh McAb 结合并 TSH 与 TSH McAb 的结合,TSH 也可抑制 αId 与 TSHR 的结合。
3. 抗独特型抗体与类风湿关节炎 类风湿关节炎患者血清中存在类风湿因子(rheumatoid tacfor,RF), 在来自不同个体的类风湿因子之间存在着不同程度的交叉反应,表明这些 RF 存在着交叉反应独特型(IdX)。Bona 等在研究针对人 IgM 型 RF 的 IdX 时,发现一种特殊的抗独特型抗体,称为 epidody,这种抗体不仅能与 IgM 类风湿因子可变区结合,同时也可与 IgG 的 Fc 段结合。Chen 等合成了与该种 Igm RF 可变区 IdX 中氨基酸序列相同的一段多肽作为抗原,免疫家兔制备抗体,结果该抗体可与 Igm RF 的轻链和 IgG 结合,提示 IgMRF 的轻链和 IgG 上具有交叉反应性抗原决定簇。以上述实验为依据,似乎存在这样的可能:由 RF 刺激机体产生的 epibody 可广泛地与人 Igg Fc 段结合,所形成的免疫复合物沉积于关节滑膜等部位,导致类风湿性关节炎等自身免疫损伤。此外,有人认为许多自身抗体上具有交叉反应 Id,这些 IdX 与外界微生物感染时诱发产生抗体的 Id 有交叉反应。当相应的微生物感染机体时,刺激产生特异性抗体以及相应的抗 Id 抗体,后者可通过与自身抗体可变区上 IdX 的相互作用,诱发自身免疫应答,从而导致免疫损伤。
(三)抗独特型抗体与肿瘤免疫
表达于肿瘤细胞的肿瘤相关抗原刺激小鼠产生相应的抗体(Ab1), 用这种 Ab1 免疫另一小鼠可诱导产生针对 Ab1 的抗独型抗体, 其中 Ab2β(模拟肿瘤相关抗原)注入荷肿瘤的动物或病人可诱导出称之为抗 - 抗 - 独特型抗体的 Ab3,由于这种 Ab3 与最初肿瘤相关抗原所诱导的 Ab1 具有相同的抗原特异性,因此又称为 Ab1`。
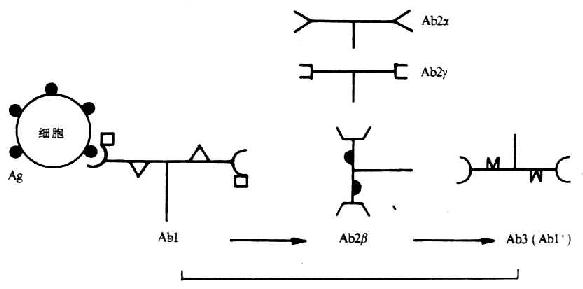
图 9 -12 模拟肿瘤相关抗原的 Ab2β 诱导出 Ab3(Ab1`)
采用模拟肿瘤相关抗原的 Ab2β 刺激机体的抗肿瘤免疫应答,已在许多动物实验中得到证实,包括 B 淋巴细胞肿瘤、T 细胞性白血病、乳腺癌、黑素瘤、小鼠肉疚、结肠癌、胰腺癌等(表 9 -3)。目前,有几种肿瘤相关抗原抗 Id 已开始临床 I 期验证,有些病例显示出一定的疗效。
Lery 等(1982、1985)应用淋巴细胞杂交瘤技术,制备了针对病人结节性淋巴瘤 B 细胞表面免疫球蛋白的 αId(4D6),获得一定的疗效(图 9 -13)。
在实验研究中发现,有的肿瘤相关抗原如黑素瘤相关蛋白聚糖(MPG)难于在动物体内诱导出 MPG 特异性抗体,但是模拟 MPG 抗原的 Ab2β 可诱导出肿瘤相关抗原的特异性抗原,提示 Ab2β 可能通过打破机体对某些肿瘤相关抗原的天然免疫耐受,从而诱导相体产生抗肿瘤相关抗原的免疫应答。
需要注意的是抗 Id 在一定条件下可抑制机体的免疫应答。Flood 等(1980)报道了由抗 IdT 细胞所诱导的免疫抑制作用。小鼠纤维肉瘤 1591 和 1316 都有很强的免疫原性,在正常情况下移植到小鼠体内后 100% 被排斥。如先用纤维肉瘤 1591 效应 T 淋巴母细胞(含 TCr Id)免疫正常同类系小鼠,然后分为两组,分别移植 1591 和 1316 肉瘤,结果发现,移植 1591 组约有 2 / 3 小鼠丧失排斥肉瘤的能力,而移植 1316 组仍 100% 被排斥,说明 TCr Id T 淋巴母细胞所诱导的免疫抑制作用是特异性的,其机理可能是 αIdT 细胞杀伤或抑制了肉瘤特异性 T 效应细胞。
表 9 -3 肿瘤相关抗原抗 Id 临床前研究和临床 I 期验证(举例)
| 肿瘤相关抗原 | Ab1 | Ab2 | 治疗肿瘤 | 应 用 情 况 |
| T 细胞肿瘤抗原 gp37(SN2 肿瘤相关抗原) | SN2(McAb) | 4DC6(McAb) | 皮肤性 T 淋巴瘤(CTCL) | 在家兔和小鼠体内诱导出 Ab3,与绝大多数 CTCL 发生结合反应,已开始 I 期临床验证 |
| 高分子量癌胚抗原(HMW-CEA) | 116NS-3d(3019)(McAb) | 3H1(McAb) | 人结肠癌、胰腺癌 | 在小鼠体内诱导出 Ab3,特异性结合 CEA 和结肠癌细胞株 LS174T |
| 黑素瘤相关蛋白聚糖(MPG) | 在猴子体内诱导出 Ab3,与大多数人黑素瘤细胞结合,抑制黑素瘤细胞侵入基底膜基质;免疫沉淀出 MPG | |||
| 乳腺癌粘蛋白样蛋白(400kDa) | MC-10 | 11D2 | 乳腺癌 | 在不同种动物诱导出 Ab3,与 MC-10 阳性抗原发生结合反应 |
| 小鼠肉瘤 MCA-1490 | 4.72(McAb) | MCA-1490 | 抑制小鼠肉瘤生长,诱发 MCA1490 肉瘤特异性迟发型超敏反应 | |
| 结节性淋巴瘤 | 4D6 | B 细胞瘤 | 对肿瘤病人本身有作用,约 50% 病人病性缓解 | |
| 结肠直肠癌相关抗原 | 17-1A GA733 | 多克隆抗体(羊) | 结肠直肠癌 | Ab2 注入晚期病人能产生 Ab3,能与结肠肿瘤细胞发生结合反应,约 43% 病人有改善 |
| 人高分子量黑素瘤抗原(high-MrMAA) | MK2-23(McAb) | 黑素瘤 | 部分病人产生的病人疗效优于不产生 Ab3 病人,近 20% 病人转移肿瘤缩小 |
注:CTLC:cutaneousT cell lymphoma
CEA:carcinoembryonic antigen
MPG:melanoma-associatedproteoglycan
high-MrMAA:human high molecularmass melanoma associated antigen
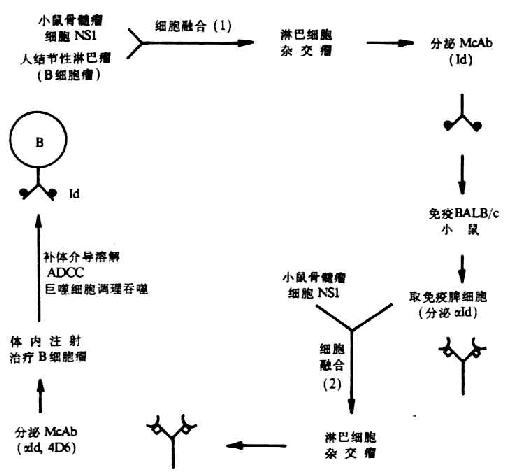
图 9 -13 抗 Id(4D6)治 B 细胞瘤示意图
(金伯泉 许辉)
参考文献
1.Bhattacharya-Chatterjee M,etal.Idiotype vaccines against human T cell leukemi-a.II. Generation andcharacterizization of a monoclonal idiotype cascade (Ab1,Ab2 and Ab3).JImmunol,1988;141:1398
2.Bhattacharya-Chatterjee M,etal.Idiotype vaccines against human T cell acute lymphoblasticleukemia(T-ALL).I. Generation and characterization of biologically activemonoclonal anti-idiotypes.j Immunol,1987;139:1354
3.Bhattachary-Chatterjee M,etal.Murine monoclonal anti-idiotype antibody as a potential network antigen forhuman carcino-embryonic antigen.j Immunol,1990;140:2758
4.Bhattacharya-Catterjee MB etal.Idiotypic antibody immunotherapy of cancer.Cancer Immunol Immunother1994;38:75
5.Chattopadhyay P,et al.Murinemonoclonal anti-idiotype antibody breaks unresponsiveness and induces aspecific antibody response to human melanoma-associated proteoglycan antigen incynomolgus.Proc Natl Acal Sci USA,1992;89:2684
6.Davie JM,et al.Structrualcorrelates of idiotopes.Ann.Ren.Immunol.1986:4:147
7.Grzych JM,et al.Ananti-idiotype vaccine against experimental schistosomiasis.Nature,1985;316:74
8.Herlyn D,et al.Anti-idiotypeimmunization of cancer patients:modulation of the immune response.Proc NatlAcad Sci USA,1987;84:8055
9.Herlyn D,et al.Anti-idiotypeantibodies bear the internal image of a human tumor antigen.Science,1986;232:101
10.Jerne NK,et al.Recurrentidiotypes and internal image.EMBO j 1982;1:243
11.Jerme NK.Towards a networktheory of the immune systim .Ann Immunol(Paris),1974;125C:373
12.Kennedy RC,etal.Anti-idiotypic antibody vaccine for type B viral hepatitis inchimpanzees.Science,1986;232:220
13.McNamara MK,et al.Monoclonalidiotype vaccine against Strcptococcus pneumoniaeinfection.Scicnce,1984;226:1325
14.Mittelman A,et al.Human highmolecular weight melanoma-associated antigen(HMW-MAA)mimicry by mouseanti-idiotypic monoclonal antibody MK2-23:induc-tion of humoral anti-HMW-MAAimmunity and prolongation of survival in patients with stage IV melanoma.ProcNatl Acad Sci USA,1992;89:466
15.Nisonoff A and LamoyiE.Impllications of the presence of an internal image of the antigenanti-idiotypic antibodies:possible application to vaccine production.ClinImmunol Immunopathol,1981;21:397
16.Rodkey LS.Autoregulation ofimmune response via idiotype network interactions .Microbiol Rev 1980;44:631
17.Roitt IM.Encyclopedia ofImmunology.lst ed .San Diego:Academic Press ine .1992:723
18.Roitt IM.EssentialImmunology.6th ed.Oxford:Blackwell Scientific publications.1988;P35-37,P121-125
19.Roitt IM.et al.Idiotypicnetworks and their possiblse exploitation for manipulation of the immuneresponse.Lancet,1981;I:1041
20.Sacks DL.et al.Immunization ofmice against African trypanosomiasis using antiidiotypic antibobies.J ExpMed,1982;155:1108
21.Sharpe AH,et al.Syngeneicmonoclonal anti-idiotype can induce cellular immunity to reovirus.J ExpMed,1984;160:1195
22.Stein KE and SderstromJ.Neonatal administration of idiotype or anti-idiotype primes for protectionagainst Escherichia coli K13 infection in mice.J Exp Med,1984;160:1001
23.Uytdehaag IGCM and OsterhausADME.Induction of meutralizing antibody in mice against poliovirus type II withmonoclonal anti-idiotype antibody.J Immunol,1985;134:1225
24.Victor-Kobrin,et al.Structuralcorrelates of a regulatory idiotope.1989;Immunol Rev 110:151
25.Wasserman NH,etal.Anti-idiotypic route to anti-acetyecholine receptor antibodies andexperimental myasthinia gravis.Proc.Natl.Acad Sci USA,1982,79(15):4810
26. 陈敬贤、马宝骊. 抗体的独特型与免疫网络研究进展. 国外医学免疫学分册,1987;5:238
第十章 神经免疫内分泌学引论
生物科学研究在广度和尝试上飞速发展,导致传统的学科界限日趋模糊,并不断衍生和分化出新的学科。神经免疫内分泌学(neuroimmunoendocrinology)的形成和建立即是如此。此学科横跨神经、免疫和内分泌等三大系统,集中探讨系统间的多重往返联系及其生理或病理意义,着重研究系统间的信息交流和影响因素。本章拟简述神经免疫内分泌学的历史发展,神经、免疫和内分泌网络的理论基础和实验依据,神经免疫内分泌相关疾病实例,以及神经免疫内分泌学的发展前景。
第一节 神经免疫内分泌学的发展简史
人类有关神经系统和或内分泌系统影响机体免疫功能的感性认识由来已久。古希腊医生 Galen 曾注意到忧郁的妇女较乐观的女生易罹患癌症。祖国医学对七性(喜、怒、衷、思、悲、恐、惊)致病也早有直觉和经验性的描述,提示情绪因素至少可部分地影响机体的抗病能力特别是免疫力,从而加速或延缓疾病的发生和发展。西方医学的许多早期观察均说明应激性刺激可导致疾病或促进发病。直至 1919 年,Ishigami 的工作才为以上的经验积累提供了直接的实验证据。他发现在慢性结核病患者,情感挫折可明显削弱机体对结核杆菌的咸噬能力,并提出情绪性应激可导致免疫抑制。继后,受巴甫洛夫学说的影响,Metalnikov 等于 1924 年证明,经典式条件反射可改变免疫反应,说明免疫系统亦接受神经系统高级中枢的有力影响。这一事实得到反复证实,并已成为心理神经免疫学(psychoneuroimmunology)重要研究领域。1936 年,Selye 分析了一系列伤害性刺激对机体的影响,发现诸如缺氧、冷冻、感染、失血、中毒和情绪紧张等均可引起肾上腺皮质肥大,胸腺萎缩,外周血中淋巴细胞减少等变化,他将这群征候称为“应激”(sterss),并确定这些变化系由肾上腺皮质激素分泌过多所致,由此证明了内分泌系统对免疫系统的影响。嗣后,不断有报道描述神经精神因素及内分泌因素对免疫功能、免疫性疾病和肿瘤的影响。本世纪五十年代以后,由于中枢毁损方法在神经生理学研究中的应用,发现某些中枢神经核团或区域参与对机体免疫功能的调节,如可改变外周血中单核细胞吞噬能力及循环血中抗体深度等。1972 年苏联学地得 Korneva 等发现机体接受抗原刺激后,脑内某些区域神经元放电发生改变。瑞士学者 Besedovsky 等实验也得到类似结果。与此相近,神经内分泌学也因下丘脑促垂体激素释放或释放抑制激激素如促甲状腺素释放激素(thyrotropin-erleasing hormone,TRH)、促黄体生成素释放激素(luteinzing-hormonereleasing hormone,LHRH)、生长抑素(somatostatin,SS)的分离、纯化和鉴定,进一步证明应激是一典型的神经内分泌反应,而应激对免疫系统的影响自然应是神经内分泌系统的调控结果。然而,这一时期与神经、免疫内分泌系统相关的工作总体处于低潮,因免疫学家们更关注的是免疫系统的内部调节和机制,且许多免疫现象和过程可在离体条件下重现,故主观上忽视了神经和内分泌系统在免疫学中的作用和地位。另一方面,神经生理学家和神经生物学家们也仅关注神经元的结构和功能及突触传递等课题而无暇它顾,同时在客观上也受技术条件及各学科发展深度的限制。
进入八十年代后,由于技术方法的进步和新的学说和理论的问世,神经、内分泌和免疫系统间的关系探讨进入一个新的阶段,神经免疫内分泌学渐趋成形,这主要基于下述事实:
(1)众多的神经递质、神经肽及激素于在体和离体条件下可影响免疫细胞及免疫应答的各环节。
(2)免疫细胞上及胞内有多种神经递质、神经肽或激素的受体的表达。
(3)免疫细胞可合成某引起神经肽或激素。
(4)神经细胞及内分泌细胞均可合成及分泌免疫分子(如细胞因子等),且细胞因子对内分泌影响亦极为广泛。
(5)神经内分泌及免疫系统间存在双向往返的反馈联系。
(6)许多临床疾病的发生和发展与神经免疫和内分泌系统间的交互作用密切相关。
围绕神经免疫内分泌系统间交互影响,还有众多名词术语从不同的角度加以反映,如神经免疫学(neuroimmunology), 心理神经免疫学(psychoneuroimmunology),行为免疫学(behavioral immunology), 免疫精神病学(immunopsychiatry),神经免疫发生(neuroimmunogene-sis), 神经免疫调节(neuroimmunomodulation)等,Blalock 提出的“神经免疫内分泌学”,因精神心理活动是神经系统的高级主功能,精神疾患的发生有深刻的神经内分泌基础,且以上各术语的共同基础是神经免疫内分泌系统间的交互作用,即为“神经免疫内分泌网络”(neuroimmunoendocrine network)。
迄今,已有几部神经免疫内分泌学专著问世,已举办了数届神经免疫内分泌学相关的国际会议,出版了儿种国际性杂志如 Journal of Neuroimmunology,Brain Behav Imm 等,每年有众多论文发表,并散见于各相关领域。此领域的研究工作在美国、加拿大、瑞士、日本、前苏联及东欧一些国家广泛开展,较知名的研究者有 Ader,Blalock,Sharp,Dinarello,Fontana,Besedovsky,Berczi 等。我国的神经免疫内分泌研究工作也有了一定的基础,较有系统性的工作始于八十年代中期,较系统从事此领域研究的北京医科大学、白求恩医科大学等,零散的工作遍及许多省市医学院校和科研单位。相信这门新兴学科在我国能引起文学注意并取得发展。
第二节 神经、免疫及内分泌系统间的关系
一、神经、免疫、内分泌系统的特性和共性比较
高等动物的机体是由诸多系统的机组合而成的结构和功能性整体。这些系统可粗略分为二类:一类主要执行着机体的营养、代谢及生死等基本生功能,包括血液循环、呼吸、消化及泌尿生殖等系统;而广泛分布的神经、免疫及内分泌三大系统则起着调节上述各系统的活动,参与机体防御及控制机体的生长和发育等重要作用,从而构成另一类枢纽性系统。此三大系统除各具有独特而经典的内容外,尚有下述方面可资相互比较。
1. 三大系统与种系发生和个体发育 以种系发生的观点而言,神经、免疫及内分泌系统的区分和定义是局限于多细胞生物的。然而这三大系统共同的基本功能,即信息的传递和感受,却可在原核生物中有雏形体现,例如,Stock 等的工作表明,大肠杆菌细胞膜上有膜受体蛋白质构成的化学感觉系统,经 4 个蛋白质成份而将相关信息传入胞内,并借助这些蛋白的磷酸第过程,完成信息的储存记忆和对其的反应,如细菌的化学趋化等过程。阿米巴滋养体的吞噬活动,既是其摄食方式,亦可视为非特异性免疫的较早范例。此外,单细胞生物如梨形四膜虫,粗糙链孢霉菌及烟曲霉菌中均含有胰岛素样物质,但其功能意义尚不清楚。一般变为,神经元最先在二胚层动物水螅的胚层间出现。这些事实提示,三大系统的种系进化可能是不同步的。自个体发生的角度而论,末受精鸡卵内即含有胰岛素,而爪蟾卵母细胞中除含有胰岛素及其 mRNA 外,尚有 TGF- β 及 FGF 的 mRNA 表达,编码 TGF-α、TGF- β 及 PDGF 的 mRNA 亦可在小鼠胚泡中检测出,且着床前的小鼠胚胎中还有胰岛素受体及 IGF- I 受体的分布。神经系统的个体形成似晚于免疫和内分泌系统。神经免疫内泌间的交互影响也有渊远的进化过程,如曼氏裂体血虫中含 POMC 相关的 mRNA,且 Mytilus edulis 的血细胞可生成脑啡肽并受其影响,这种生物的血淋巴细胞可接受 ACTH 的调控。Cooper 等人比较性地研究了蜗牛、蟾蜍、鱼和许多哺乳动物的免疫功能,发现许多低等动物的免疫细胞均有自分泌现象,并可释放阿片肽,且后者可影响这些细胞的功能。
2. 三大系统分布、作用途径和范围 从分布和作用途径及范围来看,三大系统在体内均系广泛分布,但神经系统有以突触为中介的结构连续性,并可借其分枝支配各种组织和器官,包括内分泌组织和细胞,长期认为垂体前叶无直接神经支配的观点目前已被推翻。免疫组织亦是如此,甚至小肠壁集合淋巴小结也发现有神经末梢分布。所以,广义上讲,内分泌和免疫系统可视为反射弧的传出环节。神经系统的信息传递主要由神经纤维上的动作电位及化学性和电突触来实现,而内分泌及免疫系统的信息传递更多是由体液运输完成的,后者还依赖于免疫细胞的循环而行使其细胞和体液免疫功能。Blalock 还将免疫细胞的经体液转送称为“流动的脑”。近年有人系统地研究了白细胞胞膜上的离子通道和电活动,这较好地体现了神经元、内分泌细胞与免疫细胞间的相似性。
从内外环境条件变动构成的刺激性质分析,理化,生物及心理因素均可以直接或间接的方式影响此三大系统的功能状态,但它们的适宜刺激却明显不同,如角摸刺激仅能直接作用于神经系统。然而此三大系统的反应本质均可视为阻尼性振荡过程,即减少或消除刺激所造成的影响,在某些情况下可为共振性质。
3. 三大系统的某些共性 神经、免疫、内分泌系统在信息分子和细胞表面标志、信息储存和记忆、周期性变化、正负反馈调节性机制以及与性别和衰老的关系等方面都有不同的程度的相似之处。
(1)信息分子和细胞表面标志:愈趋增多的证据表明,这三大系统可共享信息分子及其受体。表现为大多数神经肽、激素及免疫因子可分别在神经、免疫及内分泌组织内合成或释放,这已在转录、翻译、加工、储存和释放等多重水平上得到证实。不仅如此,神经、免疫和内分泌细胞的标志分子也呈重叠分布,如,Thy- 1 糖蛋白是啮齿动物胸腺细胞和神经元细胞的表面标志,嗜铬颗粒蛋白(chromogranins)是神经内分泌系统中一种分泌性蛋白质标记物,而在脾、淋巴结、胸腺等淋巴器官中也有此蛋白的存在;淋巴细胞可结合嗜神经病毒,同样,嗜淋巴病毒亦可攻击中枢神经系统,如人 T 细胞嗜淋巴病毒Ⅲ(AIDS 相关病毒)可选择性伤害辅助 - 诱导 T 细胞,并能引起脑器质性病变,提示神经细胞和免疫细胞膜结构的相近。免疫细胞表面的 MHCI 及Ⅱ类抗原分子也可在神经胶质细胞及垂体前叶滤泡星形细胞膜上表达。另外激活的人 T 细胞也能合成神经细丝(neurofilament)。神经胶质细胞的标志蛋白 S -100 不但存在于垂体滤泡星形细胞中,也出现胸腺的树突状细胞内。
(2)信息储存和记忆:从信息储存记忆的角度考察,神经系统借助感官可存储和记忆外界信息,免疫系统则在抗原识别等方面表现出记忆功能,但神经系统和免疫系统记忆的分子机制有何异同,尚不清楚。内分泌系统似科不具备某种形式的记忆功能。
(3)周期性变化:与其它系统类似,神经和内分泌系统的活动都具有周期性变化,如睡眠、多种神经肽及激素的分泌节律等。在免疫系统,也已证实小鼠的外周血中和脾内淋巴细胞数目有明显的昼夜节律,其变化与小鼠活动规律相一致,表现为白昼降低,夜晚上升。这一变化系由肾上腺糖皮质激素分泌所介导的。因去肾上腺小鼠无此节律,给强的松可压抑此节律性波动。在人类,T 细胞、B 细胞等均具有周其性波动,即昼降夜升,并与血浆中皮质醇水平呈反变趋势。在鱼类等变温动物的外周血中,淋巴细胞数目于冬季最低而在夏季达高峰,淋巴细胞亚群也有类似变化。爬行类动物免疫系统的季节性活动突出体现在免疫细胞存活率、抗体滴度、溶血斑形成细胞(PFC)数目及 E 玫瑰花形成数目。这些周期性现象似起源于机体神经内分泌节律活动,尤其是下丘脑 - 垂体 - 肾上腺皮质轴系以性腺和松果腺的功能活动。起源于免疫反应自身的周期性变化尚较少报道。
(4)正负反馈调节性机制:神经、免疫和内分泌系统各自内部均存在正负反馈性调节机制,由此各系统的功能活动更趋协调、准确而精细。在病理条件下,某些反馈机制可引起机体较严重的损伤,如超敏反应等。
(5)与性别和衰老的关系:性别差异和衰老性变化亦可体现在此三系统的各主要方面。性别差异主要是遗传因素和内分泌系统中的性腺轴系造成的,而对神经系统和免疫系统产生明显的影响。人及各种实验动物的免疫机能均有明显的性别差异,包括体液免疫和细胞免疫的诸方面,如血浆中 Ig 水平、细胞免疫的各种参数,对自身免疫性疾病、感染性疾病及肿瘤发生的易感性等。与雄性小鼠相比,雌性小鼠脾细胞在 ConA 作用下分泌更多的 IL-2,而预先用 Ag 致敏的脾中 APC 细胞(抗原提呈细胞)所诱发的再次免疫应答也以雌鼠为强。雄激素水平变动可影响这一反应。雌性小鼠的胸腺中糖皮质激素受体含量亦高,并可受雄激素的负性调控。久已清楚的是全身性红斑狼疮(SLE)患者约 90% 为女性,且雌激素增多可加重这一自身免疫性疾病。类风湿性关节炎亦有类似情况。另外,男性易产生免疫耐受现象。衰老可引起从多的神经内分泌改变,如 GH 分泌减少,垂体前叶对下丘脑激素的反应性降低,靶腺对垂体激素及外周靶组织对激素的反应性也呈下降趋势。同样,衰老也可涉及免疫系统,突出的是胸腺萎缩,这可能是 GH 及甲状腺激素分泌异常所致。除此,衰老动物对外来抗原的反应能力减弱,而自身免疫反应常出现或加重,也影响到 T 细胞、Mφ 细胞,使其生成 IL- 6 和 TNF- α 能力降低。衰老小鼠某些 T 细胞亚群在激活后表达的 IL-2R 数目较少,这可能与 T 细胞受刺激后信号转导障碍有关。
二、神经、免疫、内分泌系统间的关系
机体内各系统可抽象地以集合概念表明,则神经,免疫和内分泌三系统间的关系可以图 10- 1 中的集合群表示。其中三个集合两两重叠处可分别代表神经(N)与免疫(I),免疫(I)与内分泌(E)及神经(N)与内分泌(E)间的共同范畴,而三重叠部应视为神经、免疫和内分泌的共同内容(NIE)。集合间各有种组合方式可罗列如表 10- 1 和图 10-2。
图 10-1 神经(N)、免疫(I)和内分泌(E)系统的关系
图 10-2 N、I、E 间作用方式
由表 10- 1 可见,神经免疫内分泌学(NIE)与神经内分泌学(NE)、神经免疫学(NI)和免疫内分泌学(IE)相比,涉及更为复杂的系统间影响和作用。内内涵广泛,并以 NE、NI 和 IE 间的联系为基础。系统间作用方式,既有直接和间接之分,亦要同时和先后之别,系统间交互作用的性质可为增强、减弱、修饰、允许或协同,借变频、变时和变力等方式体现。系统间作用的属性,可有生理和病理性之分,是质和量的互变过程。上述关系图示为二维描述,实际应为立体过程,结合时间变量,则三大系统间的交互影响即为四维图象,这难以直观图示。
鉴于目前描述神经,免疫和内分泌系统间关系的术语较多且易混淆,缺乏统一性,故应确定术语的范畴及相互关联系,以决定相应学科内容及领域。下述考虑似有助于澄清此问题。
(1)在现代内分泌学的理论体系中,“内分泌”概念应包括内分泌、神经内分泌、旁分泌和自分泌等方式;而激素的内涵亦大为增加,诸如局部激素、循环激素、神经激素等,而许多免疫因子如淋巴因子和单核因子等均符合激素的标准;严格地讲,神经系统和免疫系统既与内分泌系统有种种区别,又有诸多共性,这也是系统间相互影响的基础。
表 10-1 N、I、E 间的作用和联系方式及相应学科划分

(2)细胞免疫和体液免疫是借助于血液循环、淋巴循环或组织液而进行和实现的生理过程,而神经内分泌调控也最终由循环血液或组织液完成,故在此交汇路途上难免发生交叉性影响和作用。所以神经内分泌或免疫内分泌联系在活体内必将受到免疫或神经源性因素的影响。
(3)已研究的神经免疫学领域和内容,绝大多数发现有内分泌因素或成份的参与。
(4)精神和心理活动以及行为的共同基础是中枢神经系统的高级功能活动,由此可把精神神经免疫学(psychoneuroimmunology)及行为神经免疫心理学 (behaviouralneuroimmunololgy) 划入神经免疫内分泌学(neuroimmunoendocrinology),作为其重要的分支学科。
综上所述,用《神经免疫内分泌学》这一名称可较贴切地包涵三大系统间的交互作用和多重联系,并可将此学科内容进一步划分为数门子学科(如上述)。随着研究的深入,可望将神经内分泌学的大部分内容纳入这一学科。神经免疫内分泌学可直接引用神经科学、免疫学和内分泌学的相关概念和理论,其研究方法应是跨学科的,研究工作应采用多重指标,全面观察,对相关临床问题的考察,更应从多方面入手,分清主次矛盾,并应考虑与其它系统的联系和影响,以期在不同水平上全面而完整地反映机体的真实生理过程。
第三节 神经和内分泌(或神经内分泌)系统对免疫系统的调控
神经免疫内分泌学中一重要方面是神经和内分泌系统(或神经内分泌)对免疫功能的调控。广义上讲,所有的内分泌功能均受神经系统的直接或间接支配,故神经和内分泌系统可以神经内分泌表示。神经内分泌对免疫系统的影响是由激素、神经肽、神经递质的作用所实现,体现于一些典型的生理过程或实验过程中,如应激、妊娠、哺乳或条件性免疫应答的产生等。
一、神经内分泌对免疫功能调控的生物学基础
(一)免疫组织及器官上的神经支配
淋巴组织和淋巴器官具有神经去配是久已周知的事实,这些神经纤维伴随血管穿过被膜而进入淋巴组织,其性质为交感或副交感神经纤维。近年大量工作表明,支配中枢和外周淋巴器官的神经含有众多肽能神经纤维。
1. 髓髓 脊神经中的内脏纤维伴骨动脉经滋养孔进入骨髓,支配骨髓内血管及实质,与细胞关系密切。这些纤维包括有髓和无髓纤维,其中有 P 物质(substance P,SP)肽能神经纤维。
2. 胸腺 作为中枢免疫器官和内分泌器官,胸腺可接受膈神经、交感神经和副交感神经支配,其中交感神经纤维来源于颈胸段交感神经链,而副交感纤维来源于迷走神经。用免疫组织化学逆行追踪法证实,支配胸腺的迷走神经纤维发自延髓的面后核、颖核、迷走神经背核等核团,并接受网状系统的传入冲动,与高级中枢间构成多突触联系。这些迷走神经节前神经元含有高脑啡肽(leucine-enkephalin,L-ENK)和生长抑素(SS)。在发育早期,迷走神经纤维即分布于胸腺,进而形成神经网。这些神经纤维随腺体的发育、成熟和衰退而变化。交感和副交感神经纤维在皮质中成丛分布,游离末梢进入髓质,与各种细胞相比邻。血管活性肠肽(vasoactive intestinal polypeptide,VIP)、降钙素基因相关肽(calcitonin-gene-related polypeptide,CGRP)及神经肽 Y(neuropeptide Y,NPY)阳性的神经分布于大鼠胸腺血管周围,小叶间结缔组织及皮质和髓质的实质内。被膜中有 SP 及 CGRP 阳性纤维和去甲肾上腺素(norepinephrine,NE)能神经纤维分布,并有分支穿插于胸腺实质细胞间,与肥大细胞及巨噬细胞关系密切。已发现 NPY 亦共存于 NE 能神经末梢中。这些事实说明胸腺的结构和机能可受交感和副交感神经活动的影响。一般认为交感神经兴奋可减弱免疫机能,而副交感神经兴奋则作用相反。
3. 脾 来自腹腔神经节的交感神经形成脾神经沿脾门入脾,迷走神经伴动脉入脾,进入脾实质白髓的小动脉树,与淋巴细胞关系密切,尤其在白髓和红髓的交界处。大鼠脾脏白髓中央动脉及其分支上有 NPY,甲硫氨酸脑啡肽(methionine-enkephalin,M-ENK)缩胆囊素(cholecystokinin,CCK)和神经降压素(neurotensin,NT)阳性神经纤维分布,仅少数进入实质。猫脾脏血管中亦含有 NPY、SP 及 VIP 免疫阳性神经纤维。已发现 NPY 与 NE 共存。这种纤维主要见于脾脏被膜和小梁部位的血管。另外酪氨酸羟化酶(tyrosine hydroxylase,TH)阳性神经末梢可与脾淋巴细胞形成突触联系。
4. 淋巴结 在淋巴结的包膜下及包膜内,可见乙酰胆硷(acetylcholine,ACh)能神经纤维,而 NE 能神经进入淋巴结实质中,绕周边血管成丛分布,少许在实质中游离。在淋巴结的门部、被膜下、皮质与髓质交界及髓质和副皮质区有 SP、VIP、NPY、CGRP 等肽能神经纤维的分布。
5. 淋巴管 交感和副交感神经纤维支配淋巴管,并有区域性特点。另外,肠壁粘膜下层的淋巴小结或 Peyer 氏结与粘膜免疫密切相关,并受 SP 肽能神经纤维的支配。SP 肽能神经纤维还存在于肠绒毛中央乳糜管周围,后者还有 ACh 能神经纤维分布。
以下上事实说明,免疫组织和器官受到交感神经、副交感神经和肽能神经纤维的支配,从形态上体现出神经系统对免疫系统的直接影响,这种神经支配可以突触方式和非典型突触两种方式,即“线性传导”和“体积性传导”,后者应视为神经纤维末梢的旁分泌现象。至于整体条件下两种方式何者为主,尚不知晓。神经纤维对淋巴组织和器官的影响至少涉及以下几方面:①血流调控;②淋巴细胞的分化、发育、成熟、移行和再循环;③细胞因子或其它免疫因子的生成和分泌;④免疫应答的强弱及维持的时间等。
(二)免疫细胞上的受体分布
运用药理学方法、放射受体分析、放射自显影、受体生化和受体分子生物学等技术,已在免疫细胞膜上或胞内发现众多激素、神经肽和神经递质的特异性受体。
1. 经典神经递质受体
(1)肾上腺素受体:肾上腺素能受体可分为 α 和 β 两型,并可再分为 α 1、α2和 β 1及 β 2型。已知胸腺和脾接受肾上腺素能纤维的支配,并发现在胸腺细胞和脾细胞膜上有 β 受体的分布。小鼠胸腺细胞 β 受体在胚胎期的亲和力(Kd=2.2nM)高于成年鼠(Kd=8.0nM)。用 β 受体激动剂异丙肾上腺素刺激后,胎鼠胸腺细胞 cAMP 增高也更为明显。小鼠淋巴细胞上 β 受体的 Kd 为 1nM,结合位点数为 500 个 / 细胞。另有报道,用 125 I 标记的受体拮抗剂进行受体分析表明,小鼠淋巴细胞上受体为 β 2 亚型,其 Kd=0.9nM,受体密度为 3000 个 / 细胞。用 24 株近交系小鼠进行的受体分析表明,T 和 B 细胞上 β 2受体动力学参数基本相同,亦不受性别影响。
大鼠腹腔肥大细胞膜上有 β 受本分布,Kd 为 1.58±0.56nM,结合容量为 4000±14000 个 / 细胞,药理学分析表明,这些 β 受体中 83.5% 为 β 2,而 16.5% 为 β 1亚型,且用 IgE 致敏或相关 Ag 刺激肥大细胞均不改变 β 受体的特性。静止的肥大细胞以 β 受体激动剂刺激 15 秒,胞内 cAMP 即有明显的增多,但不影响 IgE 介导的组织胺的释放。年轻大鼠的脾实质细胞有 β 2和 β 2受体的共存。
家兔外周血淋巴细胞的 β 受体密度为 3500 左右 / 细胞,其 Kd 为 0.35±0.18nM。
人外周血淋巴细胞、多形核白细胞、单核细胞、巨噬细胞及血小板上均有肾上腺素能受体。正常人和哮喘患者淋巴细胞上 β 受体密度有异,而受体亲和力不变,服用 β 受体激动剂可降低 β 受体密度,呈下调现象。正常自愿受试者每天服用 terbutaline 6mg,7 天后淋巴细胞上 β 2受体数目减少 42%。T 和 B 淋巴细胞的受体参数无明显差异。血小板上有 α 肾上腺素能受体,刺激其受体可促进血小板聚集。人多形核白细胞及 Mφ 上有 α 2受体的存在。另据新近报道,慢性感染患者外周血中单个核细胞的 β 2受体密度与血清中可溶性 IL- 2 受体的水平有关。
(2)多巴胺受体:小鼠和大鼠淋巴细胞膜有多巴胺受体,其 Kd 分别为 4.8±0.2nM 和 1.9nM。小鼠 B 淋巴细胞上的受体密度为 60000 个 / 细胞,且多种抗多巴胺药物均可抑制放射性配基与多巴胺受体的结合。
(3)ACh 受体:以同位素标记的 M 受体可见于小鼠脾淋巴细胞和非淋巴细胞上,前者是的 Kd 为 1nM,密度为 200 个 / 细胞,后者密度为 400 个 / 细胞。小鼠胸腺和家兔胸腺细胞的胆碱能受体为 N 型,可特异地结合银环索毒素,提示胸腺的部分细胞可能起源于神经嵴或神经外胚层。骨髓干细胞膜上的 ACh 受体参与干细胞的激活。另外,Jurkat 细胞株具有 M3 型的 ACh 受体,M3 受体激活后细胞内 Ca2+浓度上升,这一效应系 PLC 和 IP3 所介导的。Jurkat 细胞膜上 M3 受体的 Kd 为 14.1nM,最大结合为 45370 位点 / 细胞,所制备细胞膜也具有这一结合活性。
(4)5 羟色(5-hydroxytryptamie,5-HT):5-HT 既是神经递质,又是免疫细胞如肥大细胞和嗜碱性粒细胞的活性分泌物。已发现激活的人 T 细胞膜上有 5 -Ht 1a 受体的分布,此受体的激活可增加胞内 cAMP 尝浓度。人 T 淋巴细胞系 Jurkat 也表达 5 -HT1a 受体,其作用可由 IP3 和 Ca2+介导。
(5)组织胺(histamine)受体:人 T 细胞有 Kd 为 0.4nM 及数目为 35000/ 细胞的组织胺受体。CD8+ T 细胞上的组胺受体为 H2 型,其密度约为 6000-7000/ 细胞,并受白细胞介素和 H2 受体拮抗剂西米替丁的调节。B 细胞上的组织胺受体亦以 H2 型居中多。
2. 类固醇激素受体
分子生物学研究工作表明,几种类固醇激素的胞内受体构成一受本超家族,包括糖皮质激素受体(glucocorticoid ,receptor,GR)、雄激素受体(androgenreceptor,AR)、孕激素受体(progesterone receptor,PR)、盐皮质激素受体(mineralocorticoid,receptor,MR)、甲状腺激素受体(thyroidhormone receptor,TP), 视黄酸受体(retinoicacid receptor,RAR)及维生素 D 受体(vitaminD erceptor,VDR)。其中 GR、MR、AR 和 PR 均可识别和结合 DNA 分子中一段基因序列,称之为糖皮质激素反应原件(glucocorticoid response element,GRE), 其序列为 AGAACAnnnTGTTCT 由 GRE 介导可影响靶基因的转录。
(1)GR:GR 广泛分布于多种淋巴组织及器官,存在于免疫细胞的胞浆及核内。GR 在免疫细胞的表达有如下特点:①有较大的性别差异,如雌鼠胸细胞内 GR 浓度低于雄鼠。②抗原刺激及 PHA 均可上调 GR 浓度,而地塞米松则使其下调。③Ca2+参与对 GR 失活速率的调控。④IL- 2 及 IL- 4 联合应用可降低人外周血单个核细胞 GR 对配基的亲和力,并使其增加,此作用可被 IFN- γ 阴断。⑤LPS 可促进 GR 在小鼠 Mφ 的表达。
GR 由 800 多氨基本组成,其序列可分为几个功能区域:①DNA 结合区,由 80 氨基酸残基构成,中心部分为两上锌指结构,可结合 DNA 双螺旋的大沟(major groove)内;②C 端为糖皮质激素(GC)结合区;③N 末端有 Tau1 区,可在 GR 与 DNA 结合后,以反式激活靶基因的转录。此外,在 GC 结合区邻近,也有 Taul 区,参与 GR 在核内转位。无配基存在时,GR 与 300kDa 的蛋白复合物结合而处于无活性状态。此蛋白复合物由 2 个亚意念的 90kDa 热休克蛋白(HSP90),59kDa 的免疫亲和素(immunophilin)及其它抑制性蛋白组成,HSP90 结合于 GR 的 C 末端,参与 GR 的折叠构型并防止其自胞浆向核内转位。免疫亲和素也可结合 CsA、FK506 及 rapmycin 等免疫抑制剂,提示 GC 的免疫效应与其它免疫抑制剂的作用机制可能类同。
(2)AR:已证实在大鼠、小鼠的胸腺及鸡的法氏囊上皮细胞内有睾酮受体存在。
(3)ER 及 PR:雌二醇(F2)受体存在于大鼠、小鼠、牛及人的胸腺中,其 Kd 约为 0.2nM,可能定位于胸腺上皮细胞或网状细胞内。鸡法氏囊也有 E 2受体。PR 则见于大鼠胸腺细胞内。
3. 神经肽及肽类激素受体
(1)ACTH 受体:已知小鼠脾细胞膜上有高亲和力和低亲和力两种 ACTH 受体,其 Kd 分别为 0.1nM 和 4.8nM,受体密度为 3000/ 细胞及 5000/ 细胞。人外周血单个核细胞也有此两种受体,Kd 值分别为 0.04M 和 3.4nM。免疫细胞上的 ACTH 受体与肾上腺皮质细胞膜的 ACTH 受体性质和结构基本相同,其分子量为 225kDa,由 4 条多肽链构成,分子量分别是 83、64、52 和 22kDa。
(2)GH 受体:小鼠及小牛胸腺细胞,人 T 细胞、外周血单个核细胞均有 GH 受体分布。胸腺的 GH 受体密度为 10-20000/ 细胞,而 IM- 9 淋巴母细胞系细胞膜上 GH 受体的 Kd 为 1.3nM,密度为 4000/ 细胞。
(3)PRL 受体:PRL 与 GH 对免疫细胞作用广泛,故其各自受体亦应存在于免疫细胞膜上。人外周血 T 及 B 淋巴细胞 PRL 受体 Kd=1.66nM,密度为 360/ 细胞,由 E 2所致的大鼠淋巴瘤 Nb2 株细胞的 PRL 受体 Kd 为 75pM,每个细胞有 12000 个结合位点。另发现,环孢霉素 A 能增加淋巴样细胞对125I-PRL 的结合。
(4)阿片肽受体:阿片肽受体不同的亚型及非阿片样受体均存在于免疫细胞膜上。人外周血淋巴细胞和血小板可结合 3H- 纳络酮。非阿片肽受体主要与 β - 内啡肽(β-endorphn,β-END) 的 C 端相结合,参与调节淋巴细胞对植物血凝素的反应。
(5)SP 受体:利用放射受体分析、放射自显影及 FACS 等技术已证实 SP 特异性受体分布广泛,如大鼠脾脏富含 B 细胞的边缘区,小鼠脾脏及肠壁 Peyer 氏结中的 T 和 B 细胞,豚鼠腹腔巨噬细胞等(表 10-2)。
表 10-2 SP 受体在免疫细胞上的颁布及特性
| 受体的细胞来源 | 放射性配 基 | 亲和力解离常数(Kd) | 受体密度(个 / 细胞) | 配体特异识别部位 |
| 人外周血 T 淋巴细胞 | 3H-SP | 1.85±0.70*10-7 | 7035±2850 | C- 末端 |
| 人 B 系 IM- 9 淋巴母细胞 | 3H-SP | 0.65±0.19*10-9 | 22641±6143 | C- 末端 |
| 人 B 系 IM- 9 淋巴母细胞 | ||||
| 细胞膜组分 | 125I-SP | 0.87±0.80*10-9 | 21±3*10-15M/mg 蛋白 | C- 末端 |
| 胞膜蛋白质 | 125I-SP | 0.75±0.33*10-9 | 3.7±1.5*10-15M/mg 蛋白 | C- 末端 |
| 小鼠淋巴细胞(混合) | 0.68±0.01*10-9 | N 及 C 末端 | ||
| 脾淋巴细胞 | 125I-SP | 195(T),190(B) | ||
| Peyer 氏结淋巴细胞 | 125I-SP | 647(T),975(B) | ||
| 大鼠脾脏边缘区 | 125I-SP | 2.4*10-9 |
注:在速激肽受体中,SP 受体为 NK- 1 型,系 G 蛋白受体家族成员之一。
(6)其它:CD4+ T 细胞膜上有与腺苷酸环化酶相偶联的 VIP 受体。降钙素受体分布于人外周 B 细胞膜上,提示降钙素不但能调节骨骼生理过程,还可影响免疫功能。同样,LHRH、促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)、CGRP、ANP、心房利钠肽(atrial natriuretic polypeptide,ANP)、血管紧张素Ⅱ(angiotensin Ⅱ,AⅡ)、VIP、SS 等受体也见于免疫组织及免疫细胞上。
4. 褪黑素受体 目前发现,在鸡、鸭等家禽及鹌鹑的胸腺、脾脏、淋巴结和法氏囊等部位可特异性结合褪黑素。褪黑素具有脂溶性,可穿透胞膜而作用于胞浆及核内受体。
(三)免疫细胞合成的神经肽或激素
1.POMC 族肽 前阿黑皮素(proopiomelanocortin,POMC)为促肾上腺皮质激素(adrenocorticotropin,ACTH)的前体分子,也是 β -LPH(促脂激素)、α-MSH(黑素细胞刺激素)及 β -END 的前身。人外周血淋巴细胞及脾细胞在病毒感染及 LPS 作用下,可分泌 ACTH 和 β -END,与垂体分泌的 ACTH 和 β -END 结构一致。小鼠脾脏中部分 Mφ 及大鼠某些淋巴细胞则稳定生成这些激素,POMc mRNA 可表达于 Mφ 及淋巴细胞中。在 PHA 刺激下,人外周血细胞中 POMc mRNA 表达增强。LPS 刺激小鼠脾细胞,亦使其胞浆中 POMC mRNA 增多。小鼠白细胞对不同的刺激反应各异,如以 CRF 或新城病毒加入培养液中,则白细胞分泌的 POMC 肽类以 ACTH(1-39)和 β -END(1-31)为主,而 LPS 引起白细胞主要生成 ACTH(1-25)和 β -END(1-16,1-17)。有人将 β -END 归为细胞因子。
2.TSH已证明人外周血 B 细胞在 SEA 刺激下可分泌 TSH。Molt- 4 是人 T 细胞性白血病细胞株,能稳定生成 TSH,其化学结构与重体中 TSH 相同。
3.GH 及 PRLCon A 可提高淋巴细胞中 GH 及 PRL 的 mRNA 水平。T 及 B 细胞也可稳定生成 GH,其分子量为正常或高分子量。在造血及淋巴组织,IM- 9 淋巴母细胞系及 Jurkat 细胞存在有控制 GH 和 PRL 表达的转录因子 Pit-1/GHF1 , 这些细胞亦含有 GH 及 PRL 的分子及 mRNA,因此,GH 可以旁分泌方式调控淋巴细胞和造血细胞的增殖和分化。GH 在这些细胞中的合成及分泌可能主要受局部生长因子及类固醇激素的调控。
4.SP人嗜酸性粒细胞可合成 SP。血吸虫所致的小鼠肝脏肉芽肽中嗜酸性细胞也能合成 SP。
5.VIP 及 SS在血小板、单个核细胞、肥大细胞及单核细胞中均发现有 VIP 或 SS 的免疫阳性物质分布。
6.LHRH大鼠脾脏及胸腺的淋巴细胞中含 LHRH 及其 mRNA,免疫细胞中 mRNA 的序列与下丘脑中存在的 LHRh mRNA 的的序列相同。Con A 可刺激 LHRH 在 T 淋巴细胞的合成,PHA 亦有类似作用。新近发现,人外周血中 CD4+ 及 CD8+ T 细胞可表达 LHRH 及其 mRNA,表达水平受细胞状态的影响。
7.CRHCRH 及 CRH mRNA 存在于大鼠胸腺和脾脏中,且与下丘脑中 CRH 及其 mRNA 结构及序列相同。胸腺和脾脏中的 CRH 含量与下丘脑相比为 1.7:1:117。CRh mRNA 主要表达于胸腺及脾脏中的淋巴细胞内。这些细胞的 CRH 分泌不受 IL- 1 的影响,但脂氨化酶抑制剂则可加强 CRH 的分泌,这些特征与下丘脑 CRH 的分泌调节不同。人外周血淋巴细胞和中性粒细胞也有 CRH 分子及其 mRNA 的表达。在大鼠炎症组织如风湿性关节囊滑巴细胞和中性粒细胞也有 CRH 分子及其 mRNA 的表达。在大鼠炎症组织如风湿性关节囊滑膜组织中亦检测出 CRH 的分布。以上事实提示 CRH 可以旁分泌或自分泌的方式参与免疫调控。
8. 其它 胸腺上皮细胞还可合成精氨酸血管加压素(arginine vasporessia, AVP)及催产素(oxytocin, OT)。GHRH 在大鼠白细胞中的合成亦得到证实。
二、激素、神经肽及神经递质对免疫功能的影响
激素、神经肽及神经递质等神经内分泌信息分子可借经典内分泌、旁分泌和自分泌途径,影响或调节免疫应答,并能与某些免疫病理过程。
(一)类固醇激素
1. 糖皮质激素(GC)GC 对免疫功能的影响极为广泛。Selye 等于 1936 年首先观察一肾上腺皮质提取物可导致大鼠胸腺萎缩。其后证明 GC 可通过多种途径影响免疫系统,且此效应存在较大的种属差异,如小鼠、大鼠、仓鼠和兔较为敏感,而豚鼠、猴和人相对不敏感,主要差异表现为后者的淋巴细胞不易被 GC 作用反致溶。
(1)GC 影响胚胎期免疫系统的发育:如小鼠胚胎胸腺在 GC 作用下,其淋巴细胞表达 Thy1.2 抗原增加,而高浓度的 GC 可杀伤小淋巴细胞。胸腺的上皮细胞对 GC 尤为敏感。GC 引起胸腺萎缩的机制涉及细胞程序性死亡或凋零(apoptosis),此作用需要核酸内切酶的参与,在 Ca2+及 Mg2+激活核酸内切酶,后导致 DNA 的断裂。GC 明显降低胸腺激素的分泌水平,减少胸腺中胸苷激酶(TK)的活性。离体大鼠胸腺细胞接触 Gc 4 小时后,胞浆中 RNA 降解速率加快。另外,胸腺细胞不同发育阶段对 GC 的反应有所差异,如人胚胎胸腺中,胸腺前体细胞对 GC 的敏感性较成熟细胞为高。
(2)GC 影响淋巴细胞的生成和骨髓造血机能:如减少骨髓中成熟 B 细胞数目,提高髓髓中 Mφ 及粒细胞的集落形成率。
(3)GC 改变细胞的循环和重新分布:小鼠给予 GC 后,血中单个核细胞及嗜酸性粒细胞减少。GC 可降低淋巴细胞自血中进入淋巴结的数量,但促进淋巴细胞空过血管内皮而进入骨髓腔。
(4)GC 对淋巴功能的调节作用:①GC 可降低 PHA 引起的 T 细胞增殖以应,这可能与降低 IL-2R 表达有关。GC 还能减弱 T 细胞的趋化及游走性,抑制脾脏中的 B 细胞对 LPS 及 PPD 的反应,减少 Ig 合成细胞的数目,改变 PWM 诱导的 PFC 形成率。②在 GC 作用下 Mφ 的 APC 功能受抑制,且 IL- 1 分泌减少。GC 也抑制单核细胞转变成 Mφ,抑制皮肤 Langerhans 细胞的功能,削纯收益 Mφ 的吞噬及细胞内杀伤能力。③调节 NK 细胞的功能,如小鼠脾细胞培养中 NK 细胞活性受地塞米松(10-7-10-11M)的抑制。体内药理剂量的 GC 则减少脾脏中 NK 细胞数目,但也有相反的报导。
(5)GC 对肥大细胞功能的影响:GC 抑制 Ag 所致肞大细胞脱颗粒反应,减少组织胺的释放,减少嗜酸性粒细胞数目,抑制其趋化反应,降低粒细胞的渗出和吞噬活动,并能对抗某些细胞因子维持嗜酸性粒细胞的存活作用。
(6)GC 对细胞因子产生及生物活性的影响:GC 在风湿性关节炎患者可抑制 IL- 1 引起的 IL- 6 基因表达;减弱 LPS 诱导的 TNF- α 产生,增加 IL-α、IL-1β 及 IL-6mRNA 的不稳定性,减少 IL- 2 的分泌,与 GM-CSF 联合应用可提高中性粒细胞对 IL- 1 的结合,与造血生长因子协同诱导骨髓细胞表达 IL- 1 受体 GC 通过阻抑 IL-2R 的信号传递。降低免疫细胞对 IL- 2 的反应性。GC 受体拮抗剂 RV38486 能模拟 IL- 1 作用而加强 TNT- α 的致死及诱生 IL- 6 效应。GC 还可对抗 IL-1β 对胰岛素分泌的抑制效应。
(7)GC 对 MHC I 类及Ⅱ类分子表达的抑制作用:MHC 参与 T 细胞识别粘附及 APC 功能,MHC 表达过低或不表达,可引起严重的免疫缺陷,而表达过高则可纠起血身免疫性疾病。现已证明,GC 可抑制小鼠 B 细胞和巨噬细胞 MHc Ⅱ基因 I -Aβ 的激活。GC 的部分免疫抑制效应是由脂皮素(lipocoritin)介导的,脂皮素是由至少 6 种蛋白质构成的家族,其结构与细胞骨架和胞吐相关蛋白(calpactin)类似。在 GC 作用下,大鼠腹腔白细胞、人羊膜细胞、人外周血单个核细胞及人支气管肺泡冲洗液中 Mφ 等的脂皮素生成增加。而摘除肾上腺可减少大鼠几种组织内脂皮肤 mRNA 及蛋白水平。GC 主要影响脂皮素 1 和 2 的含量,使胞浆中及与胞膜相关的脂皮素 1 和 2 浓度升高。脂皮素具有较强的抗炎和免疫抑制效应,如抑制 PAF 及类花生酸等的合成,并模拟 GC 的众多作用。在类风湿性节炎患者,脂皮素 1 自身抗体的存在 GC 的反应性缺损有关。
(8)GC 对粘附分子表达的调节作用:GC 的另一免疫调控机制涉及 ELAM 及 ICAM。GC 可抑制血管内皮细胞表达 ELAM- 1 及 ICAM-1mRNA 和蛋白分子,此作用可被 GR 拮抗剂 RU486 所阻断。GC 可调节白细胞的循环及定缶滪和游走反应,从而发挥其强大的抗炎和免疫抑制效应。
(9)GC 对某些酶合成的调节作用:GC 还较强地抑制成纤维细胞合成胶原酶,抑制多种磷脂酶的合成,影响某些金属蛋白酶的表达,促进血管紧张素转换酶(angiotensin-converting enzyme,ACE)及中性肽链内切酶(neutralendopeptidase,NEP)的生成,ACE 和 NEP 可分别降解缓激肽及速激肽等炎症介质。在哮喘及结肠炎症性疾病时,局部组织的速激肽受体 NK1 表达增高,并可介导 SP 的免疫调节及致炎作用。此受体的表达亦受 GC 的抑制。
(10)GC 对 MO 产生的调节作用:NO 作为细胞内及细胞间信息分子也参与免疫反应,如促进炎症组织的血浆外渗。催化 NO 合成的酶为 NO 合成酶(NOS),其表达受细胞因子的调控。现已证明 GC 可阴抑 NOS 的基因转录,从而减少 NO 的合成和释放。
目前发现,GC 对免疫功能的调控不仅仅是抑制性的,在某些实验条件下,较人氏剂量的 GC 可增强淋巴细胞的增殖反应。
近年来,对 GC 的作用机理已有了分子水平的认识。GC 结合于无活性 GR 后,使 GSP90 及 immunophilin 等蛋白与 GR 解离,有活性的 GR 即可识别糖皮质激素反应元件(GRE)序列,由于 GRE 位于 GC 靶基因的启动子区域,故可诱导或阻抑靶基因的表达。GRE 的数目及相对于转录起始上点的位置可能决定 GC 影响转录的程度,GC 阻抑某些靶基因转录的机制可能和阻抑性 GRE 有关,GR 与此类 GRE 结合后,以空间位阻方式抑制其它转录因子的促转录作用。新近发明,GR 还可直接作用于某些转录因子,从而发挥鞭抗炎效应,如转因子 AP-1(激活蛋白 -1)是由 Fos 蛋白及 Jun 蛋白组成的二聚体。AP- 1 促进胶原酶基因的活化。有活性的 GR 可结合于 AP- 1 从而抑制胶原酶的合成。AP- 1 还参与 T 细胞的活化,促进 IL- 2 及 IL-2R 基因的表达等,GC 则通过 GR 的活化而 AP- 1 的活性以对抗细胞因子的作用。其它转录因子如 NF-κB 及 NF-AT 等也受 GC 的负性调控。此领域的研究将对合理的药物设计及相关的临床实践具有指导意义。
2. 龙激素 一般而言,睾酮等雄激不经对免疫功能有抑制性作用。睾酮可减少人泪腺中 IgA 的产生,这一作用为雄激素所独有。在睾酮的作用下,胸腺的重量和体积均减少。小鼠迟发型皮肤超敏反应及抗体的生成亦受睾酮的抑制,去势可逆转这些变化。睾酮还可降低实验动物对许多细菌、支原体、寄生虫及病毒感染的抵抗力,表现为感染后的致死率及肿瘤发生率明显升高,去势为着能逆转这些改变。
与孕酮及 E2 相反,睾酮阻抑乳腺上皮细胞表达 Ia 分子。此外,IM- 9 系淋巴细胞膜上 SP 受体(NK1 受体)的睾酮的作用下 Kd 值增大,提示睾酮对 SP 这一神经源性炎症介质的作用有一定影响。
3. 雌激素 雌激素可提高体液免疫力而减低细胞免疫机能。
(1)对体液免疫功能的影响:E2 促进子宫分泌 IgG,也使子宫内膜上皮细胞的 IgA 含量增加。C57BL 小鼠接受雌激素后,针对 SRBC 的溶血性抗体滴度上升,面 C3H 小鼠无此反应,提示该作用存在品系差异。
(2)对细胞免疫功能的影响:雌激素制剂能降低胸腺重量,减少胸腺中淋巴细胞数目,但可增加脾脏的重量及脾细胞数。生理条件下,雌性小鼠的脾细胞数目也较雄鼠为多。在去卵巢的雌性大鼠,E2 可引起胸腺萎缩。E2 还能强烈地抑制 PHA 及 ConA 等高层的大鼠胸腺细胞增殖反应。E2 抑制小鼠及人的外周血 T 淋巴细胞 DNA 的合成,E2 还降低 NK 细胞的活性,减弱 poly I- C 及短小棒状杜菌对 NK 细胞的刺激作用,同时增加小鼠实验性或自发性肿瘤的发生率及转移率,延长同种异体皮肤移植物在小鼠的存活时间。去垂体大鼠给予 PRL 可恢复免疫功能,而同时切除卵巢后,PRL 不足以完全恢复免疫功能,必需合用 E2 方可秦效。FE 尚能提高肥大细胞的数目,刺激肥大细胞的功能。
4. 醛固酮 醛固柄借胞膜受体而快速影响人单个核白细胞的 Na+交换,从而改变细胞内的高子尝试及细胞体积,其机制可能与 IP3 的生成有关。
(二)甲状腺激素
甲状腺激素对体液免疫和细胞免疫均有促进作用。新生及年轻大鼠去甲状腺后,将引起外周血淋巴细胞数目降低,抗 SRBC 的抗体反应下降,脾细胞对 PHA 刺激的增殖反应减弱,这些效应有一定的时间依赖性,即新生大鼠去甲状腺后的上述变化发生于断乳后,而年轻大鼠亦需经 40-60 日显类似改变。可见,甲状腺对免疫机能有正性调控作用。遗传性免疫缺损的 Snell-Bagg 小鼠给予生长激素(GH)及 T4 后可重建其免疫功能。T3 可能增加幼龄小鼠胸腺上皮细胞数目,并增大髓质体积。长期给予 T4 可提高外周血淋巴细胞数量,特别是 T 细胞数目。在小鼠及人,甲状腺激素均促进淋巴细胞对丝裂原的增殖反应,并有明显的剂量依赖关系。
(三)蛋白质及肽类激素
1.GH人的 GH 由 191 个氨基酸残基组成,不同种属的 GH 结构和活性有较大的差异。GH 是腺垂体激素中极重要的免疫调节因子。GH 受体是红细胞生成素(EPO)受体超家族的一员,GH 既可借助受体直接影响免疫细胞的功能,也可由胰岛素样生长因子(insulin-like growth factor,IGF)的介导而间接作用于免疫细胞,因 GH 诱导 IGF 的生成,且 IGF- I 受体分布于所有外周血单个核细胞膜上。GH 可影响免疫系统的各个环节,其中胸腺为其主要的靶器官。
(1)小鼠去垂体后胸腺体积和重量减少,淋巴组织萎缩,DNA 合成减少,由抗原诱发的抗体反应减弱,脾脏中 NK 细胞活性下降。大鼠去垂体后素现为胸腺和淋巴结的增殖反应减弱,脾脏中 DNA 代谢速率慢,皮肤移植后排斥反应受抑制,难以诱发佐剂性关节炎,且抗体合成锐减。给予 GH 则可逆转去垂体后的上述变化。
(2)儿单期重体功能低下引起侏儒症,伴有贫血及 EPO 降低。以 GH 治疗则促进生长,增加骨髓中淋巴细胞的数目并加速血,尿中 EPO 含量也增高。
(3)隐生遗传性垂体性侏儒小鼠(Snell-Bagg 小鼠)的免疫机能较差,突出表现为胸腺退化早,外周淋巴组织及骨髓中细胞稀少,免疫反应性降低等。以 GH 及 T4 联合处理此株小鼠,可防止胸腺萎缩,提高淋巴细胞数目,恢复免疫机能。GH 的这一作用可能是由胸腺介导的,因去胸腺后 GH 促进免疫功能的作用消失,现已发现 GH 能促进胸腺激素的释放。
(4)衰老时,GH 分泌减少,免疫功能降低。结予 GH 媃中恢复免疫功能,促进胸腺激素的分泌,可速 T 细胞前体进入胸腺,并处长衰老小鼠的寿命。分泌 GH 的 GH3 垂体瘤细胞移植也可增加胸腺体积和胸腺细胞数目。
(5)GH 促进正常人 T 细胞集落的形成,并刺激淋巴细胞的增殖。GH 可加强 PMA 对单个核细胞释放 H 2O2的刺激效应。GH 还可加强单个核细胞的趋化活性,此作用可被 SS 所拮抗。Mφ 在 GH 刺激下对低密度脂蛋白(LDL)的摄取和降解加速。新近报道证明,重组 GH 可直接刺激 B 细胞增殖及分泌 Ig。
基于上述事实,有人提出可应用 GH 治疗骨髓功能衰竭、免疫功能低下以及抗衰老。
2 .PRLPRL 存在于所有脊椎动物体内。在低等变温动物,PRL 可能主要参与对渗透压、生长、发育和代谢等的调节。而一地哺乳动物及鸟类,PRL 与生殖功能密切相关,如刺激哺乳动物乳腺的发育和分泌乳汁,雄性附性器官的生长和分泌,加速雌体的黄体生成及溶解等。在分子结构上,PRL 与 GH 及胎盘催乳素均二盼相似,且 PRL 与 GH 的各血特异性受体录属于红细胞生成素受体超家族。同 GH 相似,PRL 也对免疫功能珍有正调节作用。
PRL 不仅促进乳腺发育和泌乳,还能提高乳腺中分泌 IgA 的细胞数目,淋巴细胞游走进入乳腺。母乳中 PRL 浓度与婴儿血浆 IgG 及 T 淋巴细胞数目成正相关,说明母乳喂养是重要的免疫刺激作用。去垂体动物于肾囊下埋植同种异体垂体后,可恢复多种免疫功能,如抗 SRBC 的抗体形成,对 DNCB 的接触致每及佐剂性关节炎的发生。已知移植垂体主要分泌大量的 PRL,故 PRL 可能是移植重体恢复免疫力的主要因素,因为单纯给予 PRL 媃中恢复去垂体动物的免疫机能。反之,向去重体动物注射抗 PRL 抗血清,则支物发生贫血甚至死亡。抑制 PRL 分泌的药物也同样抑制动物对 DNCB 的接触性超敏反应。
PRL 的免疫调节作用涉及如下方面:①促进抗体合成;②刺激法氏囊细胞的分裂增殖;③促进胸腺组织的增生,诱导腈胎期胸腺细胞表达 Thy- 1 抗原及 T 细胞抗原;④与 IL- 2 协同刺激 T 细胞的克隆增殖,并诱导其表达 IL-2R,对克隆的 T 细胞 L2 株系,PRL 也与 IL- 2 协同诱导其表达干扰素调节因子(IRF-1),C-myc,ODC(鸟氨酸脱羧酶)、组蛋白及 cyclin B 等分子,促进 T 细胞的增殖;⑤刺激大鼠 Nb2 淋巴瘤的增殖,并抑制 Dex 引起的 DNA 断裂,防止及对抗 Nb2 细胞的 Dex 作用的凋零;⑥激活 Mφ;⑦激活 NK 细胞,并与 IL- 2 协同诱导 LAK 活性。
3.ACTHACTH 为 39 肽,可影响多种免疫细胞。在整体水平,ACTH 的效应至少经由二条途径,其一是刺激 GC 的分泌而间接引起免疫抑制,其二是借助其在免疫细胞膜上的特异受体而直接影响免疫功能。ACTH 纯制剂引起胸腺萎缩及脾萎缩,伴有淋巴细胞数目减少,而去肾上腺后此效应仍然存在。
(1)ACTH 对 B 细胞功能的调节:ACTH 在体外可抑制 T 细胞依赖性抗原(如 SRBC)及非信号依赖性抗原(如 DNP-Ficoll)的抗体反应,减少 PFC 数目。此作用具有明显的 ACTH 分子结构特异性,如 ACTH(1-39)为抑制性的,而 ACTH(1-24)无效。ACTH 还可与 IL- 2 或 DCGF 协同刺激正常的 B 细胞生长和分化。对 BCL1 细胞系而言,ACTH 可能以自分泌方式促进其增殖。
(2)ACTH 对 T 细胞功能的调节:ACTH 抑制 T 细胞产生 IFN-γ,并调节 IL- 2 的生成。新近发现,Jurkat 细胞膜上 CD3 分子的 γ 链磷酸化过程也受 ACTH 的负性调控。ACTH 能增强混合淋巴细胞反应(MLR)中的细胞毒作用。此外,ACTH 能完全阴止 IFN 诱导 Mφ 的杀伤肿瘤活性,并抑制腹腔 Mφ 的 MHCⅡ类分子表达。
4.β-ENDβ-END 与 ACTH 来源于共同的前体 POMC,由于 β -END 既能自重体释放,也可在免疫细胞中合成,且其受体广布于多种免疫细胞,故 β -END 具有广泛的免疫调节作用。
(1)β-END 对 T 细胞的影响:β-END 可促进 T 细胞的增殖反应,但也有相反报道。β-END 还能抑制 T 细胞表达 IL-2R,抑制人外周血 T 细胞(HPBTL)的玫瑰花环形成率,改变 T 细胞膜上 CD3 原的表达,影响 PHA 引起 CD3γ 链的磷酸化以及干扰 CD3-TCR 复合物的内化过程。
(2)β-END 对其它免疫细胞的影响:β-END 以剂量依赖方式促进 NK 细胞的细胞毒作,并可活化 Mφ 促进其吞噬和趋化活性,并可调节 MHC Ⅱ类分子的表达。
除 β -END 外,α-END,γ-END 强啡肽(dynorphin),M-ENK 及 L -ENK 等阿片肽类均可借助各种阿片样受体调节免疫细胞的功能。
5.CRH作为 41 肽的下丘脑激素,CRH 至少经由二条途径影响免疫机能:CRH 可单独或与 AVP 协同刺激 ACTH 的释放而激动 GC 的分泌,后二者均具有广泛的免疫抑制效应;CRH 借助免疫细胞膜上的受体而直接影响免疫细胞。鉴于 CRH 可由胸腺及脾脏等免疫器官合成,故 CRH 可能具有重要的生理性免疫调节作用。CRH 抑制人外周血单个核细胞分泌 IL-1β 及 IL-6,CRH 可能首先抑制 IL-1β 的生成,引起 IL- 6 继发性分泌减少。妊娠时 CRH 及 GC 的血浆中浓度均升高,故可能抑制母体对胎我的免疫反应。
也有文献报道了 CRH 的免疫增强作用,CRH 可刺激人外周血单个核细胞分泌 IL-6,抑制 IFN- γ 的分泌,但不影响此类细胞的增殖及 IL-1β 的分泌。有报道 nM 水平的 CRH 能刺激人外周血单个核细胞分泌 IL- 2 及 IL-1,增强 LPS 及 PHA 分别对 IL- 1 及 IL- 2 的促分泌反应,刺激 β -END 的分泌。CRH 亦能促进淋巴细胞的增殖,IL-2R(Tac)的表达水平,并可调节 NK 细胞介导的杀伤细胞作用。
6.LHRH胸有少脾脏不仅含有 CRH 及其 mRNA,也有 CRH 的受体表达,且此类受体直接分布于大鼠及小鼠的淋巴细胞上。目前认为,胸腺可能是衰老的时钏。老龄大鼠胸腺重量呈进行性减轻,同时伴有 CRH 受体数目的减少,而给予 CRH 强效类似物(LHRHA)可逆转这些改变,并在单用或合用 ConA 时促进胸腺细胞的增殖反应,刺激 IL-2R 的表达。LHRH- A 主要影响 CD4+ 或 CD8+ T 细胞亚群。雄鼠去势也可引起类似变化,如再给予 LHRH- A 则呈协同作用。LHRH 在体内或体外均具有促进免疫功能的作用。
7.SP在从多神经肽中,SP 的免疫调节效应研究最为广泛和深入。SP 可影响所有的免疫细胞。
(1)SP 对人外周血淋巴细胞的作用:SP 有剂量信赖性的促进淋巴细胞增殖效应,并加强 ConA 及 PHA 的刺激反应,SP 受体拮抗剂可抑制此反应。因此 SP 可能是 T 细胞的丝裂原或辅助丝裂原。SP 还可刺激小鼠脾淋巴细胞、肠壁 Peyer 氏结及肠系膜淋巴结淋巴细胞的增殖。SP 及其 N 端片断 SP1- 4 可防止大鼠应激所致的胸腺萎缩,在对镍过敏的个体,SP 加强硫酸镍的促 T 淋巴细胞增殖效应。另有发现,SP 不依赖受体介导亦能升高人 T 细胞内 Ca2+浓度。
(2)SP 对 B 细胞的作用:SP 促进 B 细胞分泌 Ig 的报道较为一致。SP 刺激体外培养小鼠 Peyer 氏结、肠系膜淋巴结及脾脏来源的 B 细胞 IgA 的合成分别增加约 300%、50% 及 70%。体内给予 SP1- 7 日后,上述三种组织的淋巴细胞在培养时 IgA 及 IgM 的合成明显增加,此作用为生理性的,因所用 SP 剂量在生理波动范围内。SP 对 IgA 合成的影响最明显,提示 SP 参与调节憉部免疫。
(3)SP 对单核 - 巨噬细胞的作用:SP 既能促进其吞噬和趋化游走活性,又可刺激其的氨化爆发反应(oxidative burst),促进多种介质的释放,且所需 DP 尝试较低。如小鼠腹腔 Mφ 及人外周单核细胞的 SP 及 SP1- 4 作用下吞噬功能增强,SP 刺激豚腹腔 Mφ 的有氧呼吸,加强花生四烯酸的代谢,生成和放出 O2-、H202、TXB2、PGE、6 酮 PGF1α、LTC4 及溶酶体酶 ADGase(β-D-2- 乙酰氨 -2- 脱氧葡萄糖苷酸酶)等,SP 促进人外周血单核细胞释放 IL-1、IL- 6 及 TNF-α,促进 IFN- γ 的合成与分泌,诱导小鼠 Mφ 细胞系 P388D1 细胞释放 IL-1,SP 可还与 M -CSF 协同刺激小鼠骨髓单核 - 巨噬母细胞系的增殖反应。通过以上作用 SP 间接地调节 Mφ 与 T 细胞间的识别、抗原加工及提呈等过程。
(4)SP 对中性粒细胞及嗜酸性粒细胞作用:SP 在生理浓度即可刺激人多形核白细胞的趋化运动,明显增强 C5a 所致的中性粒细胞趋化、游走运动及吞噬杀菌活性。SP 还能促进中性粒细胞粘附于支气管上皮细胞,故可能参与呼吸道的病理过程。此外,SP 可通过肥大细胞而促进粒细胞的浸润。SP 对嗜酸性粒细胞的影响不甚明了,但 SP 同样由肥大细胞脱颗粒而吸引嗜酸性粒细胞的渗出和游走,缺乏肥大细胞的 WBB6F2-W/Wγ 及 WCB6F2-SL/SL2 系小鼠无此反应,而当这类小刀竕别移植同种骨髓细胞或局部注射小鼠肥大细胞后,皮下给予 SP 即可引起该部位的嗜酸性粒细胞的渗出反应。
(5)SP 对肥大细胞的作用:在人及多种实验动物均证明了 SP 刺激肥大细胞释放组织胺的效应。SP 不促进 5 -HT 自大鼠肥在细胞的分泌。SP 诱发组胺及 5 -HT 释放反应十分迅速,30 秒内释放量可达最大值的 90%,并依赖于糖酵解和氧化磷酸化过程。SP 的这一作用是由 G 蛋白介导的,不需要胞外 Ca2+ 的存在,也不引起 IP3 及 DAG 的含量变化,且 IgE 诱发的组胺释放与 SP 的效应间无交叉脱敏现象。肥大细胞能表达及分泌许多细胞因子,如 TNF-α、IL-1、IL-3、IL-4、IL- 6 和 GM-CSF 等,SP 则选择性地促进肥大细胞系 CFTL12 表达 TNF-αmRNA 及释放 TNT-α。上述作用表明 SP 对肥大细胞的影响与过敏疾病的发生和发展有密切的联系。
(6)SP 对其他细胞的作用:SP 促进成纤维细胞、滑膜细胞等结缔组织细胞的增生,并协同 IL- 1 的致成纤维细胞增殖活性,并可刺激其释放胶原酶及 PGE2。险些,SP 诱发肥大细胞分泌组胺,从而引起血管扩张、血浆外涌及炎性细胞浸润,导致局部充血水肿。在溃疡性结肠炎、十二指肠溃疡、类风湿性关节炎及佐剂引起的实验性关节炎等病变部位,SP 含量明显升高,胸膜腔炎性渗出液中及家兔内毒素休克时血中 SP 浓度也上升,这些事实均提示 SP 作为一种炎性介质参与重要的免疫病理过程。
8. 血管紧张素Ⅱ(AⅡ)对 AⅡ的免疫调节效应了解不多。已证明 AⅡ刺激人外周血单核细胞氧化爆发反应,增强其胞内伤能力,但不影响其化学趋性,低浓度 AⅡ(10-9M)的作用由对百日咳毒素(PTX)敏感的 G 蛋白介导,引起胞浆中 Ca2+ 浓度上升;而高浓度的 AⅡ(Ca-6M)引起 Ca2+内流加速,PLA2 活性增强,刺激花生四烯酸的代谢及促进 PKC 的移位。
9.SSSS 可使大鼠灌流肝脏 Mφ 的胞饮活动增强,并以温度及 Ca2+ 依赖方式刺激大鼠腹腔肥大细胞释放组胺。SS 还能对抗 VIP 引起的大鼠淋巴细胞中腺苷酸环化酶活性增加。
10.FSH(卵泡刺激素 follicle-stimulatinghormone)及 LH(黄体生成素,luteinizing hormone)胸腺外皮质层有 LH 免疫阳性细胞的分布,而在其内层皮质和髓质有 FSH 免疫阳性细胞的分布,提示 LH 和 / 或 FSH 可能参与胸腺细胞的发育和功能。
11. 胰岛素 在小鼠,胰岛素可改变 ConA 引起的淋巴细胞增殖反应,与 LPS 联合应用可增加抗体形成细胞数目,胰岛素在不改变血糖浓度剂量时能加强小鼠过敏性休克的发生,并抑制角叉菜胶所致的足垫的肿胀。在人体,胰岛素可促进 MLR 中的 DNA 合成,抑制 ADCC 功能。生理尝试的胰岛素即可加强单核细胞的纤溶性,促进其对静止颗粒的吞噬,并提高多形核白细胞的趋化活性。
(四)经典神经递质
1. 儿茶本分胺 从支配淋巴器官的神经末梢释放的去甲肾上腺素(NE)及肾上腺髓质释放的肾上腺素(Adr)和 NE,经由 α 及 β 受体影响各种免疫细胞及免疫功能。儿茶酚胺的作用复杂多样,报道不尽相同。异丙肾上腺素可引起小鼠胚胎胸腺细胞表达 Thy- 1 抗原。Adr 可降低人 T 淋巴细胞对丝裂原刺激的增殖反应,降低体液免疫应答,导致抗体合成减少及 I 型超敏反应受抑制。对吞噬细胞影响的研究结果不一致,如 Adr 和 NE 在生理浓度时抑制 Mφ 分泌 IL-1,而另有报道称 α2 受体兴奋促进 Mφ 释放 TNF。Adr 和 NE 抑制吞噬细胞的趋化游走及吞噬活性。儿茶酚胺还降低移植排斥反应,改善 GVHR。新近发现,儿茶本分胺还可作用于脑血管内皮细胞,促进 MHc I 及类Ⅱ类分子表达,但 NE 季节低人星形胶质细胞瘤 MHCⅡ类分子的表达。
2.ACh胆碱能药物如氨甲酰胆碱(carbachol)可升高人外周血 T 细胞的 E 花环形成率,此反应可被阿托品所阻断,说明有 M 受体的参与。Ach 还经由 M 受体提高大鼠 T 淋巴细胞的细胞毒作用,促进 PHA 所致的淋巴细胞转化和蛋白质合成。在离体人肺组织,ACh 刺激组胺的释放,此效应亦受阿托品的拮抗。低剂量的 ACh 直接刺激肥大细胞释放组胺。ACh 参与肠敏反应的发生,如牛乳中含 β - 乳球蛋白,可引起对牛乳的过敏反应。β- 乳球蛋白能诱发迷走末梢释放 ACh,可为肠道内源性免疫介质。
3.5-HT5-HT 即可作为神经递质,亦可由血小板及肥大细胞释放。5-HT 能解除 T 细胞增殖的抑制因素,影响 NK 细胞活性,抑制 Mφ 表达 Ia 分子。
4. 褪黑素 松果体与免疫功能与有密切的联系。以药物阻断松果体的功能、摘除松果体或动物连续光照等措施,均显著减少初次抗体合成反应及抑制混合淋巴细胞反应。而经予褪黑素可逆转这些变化。褪黑素还可促进小鼠脾细胞生成 IFN-γ。
三、应激对免疫系统的影响
(一)经典的应激概念
各种伤害性刺激引起的一系列非特异的定型反应均可称为应激,表现为下丘脑 - 垂体 - 肾上腺皮质轴系(HPa axis)及交感神经 - 肾上腺髓质系统的兴奋,并伴有众多组织和器官的功能变化。应激不仅取决于外界环境因素的变动,还肥个体心理因素的影响。
构成应激性刺激的内外环境因素,可分为躯体性为主的、以心理性为主的及混合型三类(表 10-3)。
表 10-3 应激时血浆中激素水平的变化趋势
| 增多:儿茶酚胺,NE,Adr,dopamine |
| CRH-ACTH-GC |
| β-END,HG,PRL,suppressin |
| ADH,RAA(renin-angiotensin-aldosterone) |
| NPY |
| PGSs,TXs,kinins |
| IL-1,IL-6 |
| 降低 insulin,LH,testosterone,TSH(寒冷时除外) |
注:部分引自徐仁宝(1991)
(二)应激对免疫系统的影响
十余年来,应激对免疫系统的影响倍受重视。动物实验及人体观察证实,应激对免疫的影响主要是抑制性。
(1)以电击作为痛性应激刺激,可降低大鼠淋巴细胞对 PHA 的增殖反应,这一作用有明显的组织差异,如脾脏淋巴细胞较易对电击刺激发生适应。电击还可减弱脾脏中 NK 细胞活性,抑制 Mφ 生成 H 2O2。这些改变主要是由阿片样受体介导的。
(2)以 2 - 脱氨葡萄糖(2DG)抑制细胞对葡萄糖的氧化和利用作为代谢性激模型,也获得类似结果。此应激反应可减少实验性自身免疫性疾病的发生率及其严重程度。
(3)实验动物的饲养条件,特别是每笼饲养动物只数等因素亦明显影响机体的免疫力,如使 T 细胞依赖性抗体生成减少,T 细胞转化率降低。此种影响有种属差异和性别差异,所产生的影响为一过性,的主要影响 Th 细胞,IL- 2 的生成,且不依赖于肾上腺的的存在与完整。
(4)应激降低小鼠对 HSV 感染的免疫力,减少脾脏中细胞毒性淋巴细胞数目,增加小鼠实验性肿瘤的的转移率。
(5)人类外科手朴作为一种典型的应激刺激,可导致血浆中激素和细胞因子浓度的变化,如 GH、T4 及 IL- 2 等降低,而 GC 及 IL- 6 升高,这些变化可被 PG 合成阻断剂消炎痛所阻断,淋巴细胞对 PHA 的反应降低。儿童脑损伤后,血中淋巴细胞减少,以 Th 及 Ts 的减少为最明显,同时白细胞的吞噬能力下降,IgM 降低而 IgA 含量上升。机体缺氧后,首先引起外周血淋巴细胞增多,CD16+ 细胞增加,NK 细胞活性及受刺激后的活性均上升,随后伴有细胞数目的减少。
(6)心理因素对人免疫功能的影响较为显著。如观看外科手术电影构成被动应激,可降低淋巴细胞对 ConA 的反应,减弱 B 细胞对 PWM 刺激的增殖反应,但以进行紧张心算作为主动应激时,仅表现出淋巴细胞对 ConA 所致的增殖反应下降。孤独感强或易激惹等个性心理特征能明显影响分裂原对淋巴细胞的促增殖反应,同时 IL-2R 表达水平下降。考试压力及婚姻不和等情感性应激刺激常伴有血中抗 HSV、抗 EBV 或抗巨细胞病毒的抗体滴度上升,CD4+ 细胞及 NK 细胞的百分比率及活性也相应降低,提示应激可能降低免疫力,使体内潜伏病毒激活。另外,精神疾患伴有免疫功能失调亦是公认的。
(7)心理性应激与许多人类疾病的发生和发展关系密切。如在回顾性或前瞻仰性调查研究中发现,儿童型糖尿病、Crohn’s 病、类风湿性关节炎、眼葡萄膜炎、Graves 病及上呼吸道感染等疾病与各种心理应激事件有不同程度的关联。这些心理应激事件中,突出的有亲人去世、离婚和失业等生活变故。心理性应激也可能提高肿瘤发生率和转移率。
对应激的可控制或预见性能有效地改善或不出现应激反应。短期应激刺激呈现免疫抑制,而较长期应激则常引起免疫增强。如以声音为应激条件时,小鼠 NK 细胞活性、淋巴细胞对 PHA 等的增殖反应即是如此。温和急性的应激训练,可提高淋巴细胞转化水平。
(三)应激影响免疫功能的机理
各种应激引起免疫功能改变的机理较为复杂,举例如下。
(1)CRG-ACTH-GC 轴系统的激活。
(2)交感 - 肾上腺髓质系统的激活。
(3)阿片肽类的参与如,β-END、M-ENK、L-ENK、Dynorphin 等。
(4)GH、PRL、α-MSH 分泌增加,LH、FSH、TSH(冷刺激除外)等分泌减少,α-MSH 可对抗细胞因子激活 HPA 轴系的作用。
(5)IL-1、IL- 6 等的释放。
(6)垂体前叶生成的 suppressin(暂译抑制素),为 63kDa 的蛋白质,具有较强的免疫抑制效应,由 ACTH、GH 及 PRL 等刺激细胞生成,故可推测其为应激性激素,参与对免疫功能的抑制性调控。
(7)应激时血清中出现多种免疫抑制因子。如手术、烧伤、失血等均刺激机体生成多种血清免疫抑制因子,可抑制淋巴细胞生成 IL- 2 与 GC 及 PGE2 等无关。非创作性应激也可引起血清中出现一种免疫抑制因子,其性质为耐热的 6kDa 的多肽,可抑制正常小鼠淋巴结淋巴细胞的增殖,该因子的生成需中枢神经系统的参与,但不涉及肾上腺素及 β -END。
由于应激时众多神经内分泌功能变化,可以多重途径和水平改变机体的免疫力,特别是近年血清免疫抑制因子及腺垂体的 suppressin 的发现,将有助于阐明应激时神经免疫内分泌相互作用的变化规律及生理或病理意义。如应激时的免疫抑制可保护机体免受更严重的损伤,但另一方面却降低机体对病原体的抵抗力和免疫力,容易引起感染或肿瘤的发生。
四、神经系统定位损毁对免疫功能的影响
(一)中枢神经结构损毁的效应
早期有关中枢神经系统影响免疫的工作主要采用于核团及束路损毁技术,如电解损毁、手术切割或化学损毁等方法。在 1958 年即观察到下丘脑结节部的破环可改变过敏等免疫反应的发生和发展。以后研究进一步发现,中枢神经系统中许多部位损伤后均可引起免疫机能变化,如下丘脑内许多核团损毁,常引起抑制效应,提示这些区域为免疫反应增强区。损毁下丘脑前区后,脾细胞及胸腺细胞的数目减少,抗原及丝裂原刺激所致的淋巴细胞增殖反应减弱,不易发生实验性变态反应性脑炎。小鼠下丘脑腹内侧部、背内侧部及弓状核的破坏导致 NK 细胞活性降低。啮齿动物的结节漏斗区损伤可促进肿瘤生长。在边缘系统,核团损毁的结果多为免疫增强效应,如乳头体、海马列及杏仁核的破环均表现为提高淋巴细胞的增殖水平,海马破坏还增加胸腺细胞数目。人大脑皮层受损后的免疫机能变化似有某些特点,即左侧皮层损伤伴有脾细胞数目降低,淋巴细胞增殖反应减弱,NK 细胞活性下降,但右侧皮层受损则无上述改变,提示大脑皮层在免疫机能调控上的分工及侧化。临床观察说明,左利者易患免疫性疾病也支持上述实验结果。由于单侧皮层损伤后的免疫变化于术后 3 周消退,这提示可能有某种代偿性机制的存在。鸡胚脑部分切除或损毁可引起胸腺上皮细胞的减少,提示在胚膙发育期,神经系统与免疫系统间即有功能的联系。
以上工作也存在一些特解难题。其一,从方法学角度考虑,中枢结构损毁难以做到高度局限精确,常殃及许多结构和通路,故引起的免疫状态改变很难认为是部位或区域特异的。其二,这些效应的发生途径及机制绝大多数尚不清楚,仅少数资料表明:中脑导水管及颖核损毁后的免疫增强效应系由副交感神经对胸腺的直接支配所介导的;中枢损毁效应不涉及 GC,但与重体激素有关。
(二)外周神经损毁的效应
脾神经切除后,小鼠对 SRBC 刺激的抗体反应增强,新生及成年动物整体给于 6 - 羟多巴(6-OH-OA)可选择性破坏外周交感神经,结果使 T 细胞非依赖性抗原刺激引起的免疫应答增强。
切除免疫动物单侧的第二颈交感神经节能加强同侧引流区淋巴结的 PFC 数目,用 α - 甲基酷氨酸以抑制肾上腺髓质激素的合成则可进一步加强此反应,说明交感神经去甲肾上腺素能系统对免疫的紧张性抑制效应。外周交感神经的免疫调节作用亦存在种属差异,例如小鼠对交感神经损毁所引起免疫变化较大鼠更明显。
五、条件反射对免疫功能的影响
(一)免疫性条件反射的研究概观
俄国学者的早期研究工作已发现可针对免疫应答建立起经典式条件反射。至 70 年代,采用以免疫抑制药物环磷酰胺为非条件性刺激(unconditionedstimulus, US),以饲饮糖精水的味觉刺激作为条件刺激(conditioned stimulus,CS),同时给大鼠上述两种刺激,经过一段时间后(3 日),再单独给予 CS,可引起明显的免疫抑制,表明为 T 细胞依赖性抗体(抗 SRBC)合成减少,而对照组均无此反应,说明已建立起能改变免疫应答的行为式条件反射。以后的研究表明,同样可建立起对细胞免疫的条件反射,并可用以延长患自身免疫性疾病(红班狼疮)小鼠的寿命。另外,条件反射也可导致免疫增强效应,如提高 NK 细胞活性等。表 10- 4 归纳了行为式条件反射引起的免疫应答改变。
表 10-4 行为式条件反射引起的免疫效应变化
| 条件刺激 | 环磷酰胺 | 免疫变化 |
| 味觉 | 环磷酰胺 | 针对 SRBC 的抗体反应↓ |
| 抗 TNP-LPS 抗体↓ | ||
| 抗流产杆菌抗体↓ | ||
| GVH↓ | ||
| 延长患自身免疫性疾病小鼠的寿命 | ||
| 佐剂性关节炎病变关轻 | ||
| 脾 NK 细胞活性↓ | ||
| 抗淋巴细胞血清、左 | 混合淋巴细胞反应减低 | |
| 旋噗唑 | 血中 CD8+↓ | |
| 嗅 觉 | 抗原(BSA+ 佐剂) | 抗原引起的组织胺释放↑ |
| polyI:C | NK 细胞活性↑ | |
| 对肿瘤抵抗性↓ | ||
| 嗅觉 + 灯光(移植过程) | 同种异体皮肤移植物 | 细胞毒性 T 淋巴细胞前体↑ |
引自:Grossmann,Hervberman 和 Livnat(1992)
(二)免疫性条件反射的发生机理假说
条件刺激引起免疫功能改变的机制尚不清楚,GC 浓度上升并不能完全解释条件反射导致的免疫抑制效应,因为以 US 刺激海豹发 GC 分泌时并不改变免疫应答。目前有两种学说解释条件反射的免疫调节机理。
1. 脑内关联性学习模式(associative brain learning paradigm) 该学说认为 US 引起的免疫信息和 CS 信息作为两个相关信号,可激活两种神经通路,并且在两个中枢神经环路间建立和强化相关的联系(结构的功能性的)。嗣后单独给予 CS 时,这两个环路均被激活,由此引发针对免疫系统的选择性信号,即对免疫应答产生调节作用,以图 10- 3 表示如下。
图 1 -3 脑内关联性学习过程模式
根据 Grossmann,Heberman 和 Livnat 等(1992)修改
注:US: 非条件刺激 CS:条件刺激 IR:免疫应答
2. 免疫系统内部的关联性学习模式(associative learning within the immunesystem)其核心内容是将 CS 的关联性学习过程定位于免疫系统内部。当抗原或药物刺激淋巴细胞时,某些淋巴细胞对由此生成的辅助信号的敏感性增强,同时中枢神经系统对条件刺激发生反应,引起外周激素或递质的释放增多。这样,激活的淋巴细胞可同时对两套信号发生反应,并有定型化免疫应答的记忆功能。当单独用 CS 刺激,CS 引起相应的神经源性输出信号,产生对这些免疫识记细胞的重复刺激信息,导致此类细胞激活,引发定型化免疫应答。如同时给予 CS 和 US,则免疫应答较单独给予 CS 时更为明显。条件反射对免疫功能调节的实质是同时激活的淋巴细胞和辅助细胞获得对 CS 和 US 双重信号发生识记和定型反应的能力,以图 10- 4 表示。
(三)免疫性条件反射发生途径实验分析
目前,许多证据支持前述第一假说,如以樟脑气味为 CS,以 Poly I- C 为 US,在小鼠建立起条件反射,结果引起脾脏中 NK 细胞活性增高。以后单用 CS 亦可观察到 NK 细胞的活性上升。进一步分析了这一条件反射的发生机制及途径,取得下述认识。
(1)由于 Poly I- C 能模拟病毒感染而明显促进 IFN- β 的分泌,因此单用 IFN- β 可取代 Poly I- C 成为 US。
图 10-4 免疫系统内的关联性学习模式
注:CS:条件刺激 US:非条件刺激 IS:免疫信号
NS:神经系号 IR:免反应答
(2)为探讨 IFN- β 是如何参与反射建立的,向枕大孔池注射 100U 的 IFN- β 也引起脾脏中 NK 细胞活性上升,而同剂量的 IFN- β 静注无效;将 IFN- β 抗体注入枕大孔池,可阻断条件反射的建立,但不影响 US 引起的反应。
(3)US 以剂量依赖性方式影响免疫功能,如 PolyI-C 10μg/ 小鼠能增加脾脏的 NK 细胞活性,但所生成的 IFN- β 少,不足以建立条件反应。PolyI-c 20μg/ 小鼠足以升高脾脏中 IFN-β、IFN- α 及其 mRNA。以 IFN- β 注入体内作为 US 时,其剂量需达 10000U 方有效,而向枕大孔池中注入 100U 的 IFN- β 即可生效,因此以 PolyI- C 为 US 的中介信号为 IFN-β,此信号可上传到脑内。
(4)CS 为嗅觉刺激,US 为给予免疫增强剂 OolyI-C,此二种信号整合的部位可能在下丘脑。已发现条件反射的建立受多种因素的影响:预先给予纳屈酮阻断阿片肽的效应也阻断条件反应的出现,但用不透过血脑屏障的阿片受体阻断剂 QNTX 则无效,提示 CS 引起 NK 细胞活性上升的条件反射可能需阿片肽的参与,且可能作用于中枢神经部位。
(5)以药物耗竭中枢儿茶酚胺,可防止条件反应的发生,提示中枢内儿茶酚胺参与条件反射的建立和再现。
上述结果说明,条件反射的建立涉及两种记忆,其一为存贮于嗅觉系统中的 CS 记忆,其二为 CS 和 US 关联记忆,存贮于感觉系统以外的中枢部位,有可能是下丘脑。这与第一个学说相吻合。
第四节 免疫系统对神经内分泌系统的调控
神经免疫内分泌学中另一重要领域地免疫对神经内分泌机能的影响。目前这方面的研究进展较快,突出反映在:(1)免疫应答的发生和发展可影响中枢及外周神经系统功能活动及经典激素的分泌;(2)神经内分泌组织及细胞有多种免疫因子的受体表达;(3)免疫因子如白细胞介素可在神经内分泌组织中稳定合成或诱发产生;(4)免疫因子借助受体发挥其对神经内分泌系统的广泛影响。
一、免疫应答过程中神经及内分泌变化
(一)体液免疫应答必变外周淋巴器官中 NE 的含量
体液免疫应答的主要器官是脾脏和淋巴结。以 T 细胞信赖性抗原 SRBC 免疫 3 - 4 日后大鼠脾脏中 NE 含量显着降低,其降低程度和持续时间与免疫应答的强度成反比,且脾脏中 NE 代谢更新率也减低。以 SRBCA 或福氏完全佐剂等皮下免疫动物,则引起注射区域的淋巴结中 NE 含量减少。这些观察说明,抗原诱发抗体生成反应的同时伴有支配脾脏及淋巴结的交感神经活动改变。不仅如此,脾脏交感神经的基础活动亦受免疫调控。如无菌饲养大鼠和无特定病菌大鼠相比,后者免疫活动基础水平高,其胸腺、脾脏及淋巴结中 NE 含量则较低。已知 NE 及 Adr 等肾上腺素能物质对免疫功能的影响主要是抑制性的,因此在体液免疫过程中淋巴器官内 NE 水平降低,提示可能其合成减少,即交感神经活动减少,从而解除其对淋巴细胞的紧张性抑制作用,或因免疫应答过程中可能促进了 NE 自神经末梢的释放(不伴有相应的合成增加),以局部负反馈的方式由 NE 节制免疫应答的程度及范围。
(二)体液免疫过程对中枢神经系统的影响
在抗原刺激相机体后,下丘脑腹内侧核神经元的放电频率明显增加,其增加程度与免疫应答的强度及不同阶段有关。对抗原刺激不发生免疫应答的大鼠则无此现象。视前区及室旁核神经元亦有类似现象。说明中枢神经系统可感受机体内免疫功能状态,并据此向免疫系统发出调控信号。
免疫高应答动物接受抗原刺激数日后,发现下丘脑内 NE 含量下降,代谢更新率也明显降低,在 PFC 达高峰时,NE 含量及代谢率的降低最为明显。用 ConA 刺激的脾细胞上清液中也含有可降低脑内 NE 含量及代谢率的活性物质(可能为 IL-1)。
(三)体液免疫过程伴有血中神经内分泌激素水平改变
抗原免疫动物血浆中 GC 含量上升,且升高的程度与免疫应答的强度相关联。并发现体液免疫过程中 GC 浓度变化与活化淋巴细胞分泌的活性物质有关,该物质称糖皮质激素诱导因子(glucocorticoid inducing factor,GIF), 通过下丘脑促进 CRH 的释放从而激动 HPA 轴。除哺乳动物外,鸟类受抗原刺激后也有 GIF 生成,提示 GIF 在种系遗传上的保守性。经分析,鸡的 GIF 为 16-18kDa 的碱性蛋白质,并证明其为 IL-1β。由于 GIF 激活 HPA 轴后,HPA 轴中的 ACTH 及 GC 均有强大的免疫抑制效应,故可反馈性地调节体液免疫应答的强度及时程。这一现象可能与“抗原竞争”有关,即第一种抗原刺激引发的反应,伴有 HPA 的激活,而激活的 HPA 轴将抑制机体免疫系统对后继抗原刺激的反应。
肥胖种小鸡是自发性自身免疫性甲状腺炎的动物模型,这种小鸡存在神经免疫内分泌改变,即以抗原刺激后,血中 GC 不升高,可能由于这种动物 HPA 轴系中有功能缺陷,对 GIF 反应性降低,并发现这一缺陷受自体显性基因控制且与肥胖株特的内源性禽类病毒(eV22)有遗传联系。由于此种动物免疫(GIF)→神经内分泌(HPA)反馈通路的受阻,因此对外源或内源性抗原的免疫应答增强。此种小鸡在生后注射皮质醇可防止以后出现自发性自身免疫性甲状腺炎,表明免疫应答发生过程中 GC 的升高对机体内环境的稳定和正常以及对机体的保护均具有重要的生理意义。
以上事实表明,免疫系统可做为中枢神经系统的感受器官,感知机体内环境的化学性和生物性动态变化,神经内分泌系统对此作为精确的调控,保障机体的内环境的稳定和生理活动的正常进行。
二、细胞因子对神经内分泌系统的影响
细胞因子作为免疫递质可影响神经内分泌的各项机能,其作用的生物学基础有以下几方面:(1)循环血中可检测到 IL-1、IL-6、TNF、IL- 2 等细胞因子,且在一定条件下浓度有较大波动;(2)神经细胞及神经内分泌细胞可稳定或受诱导而合成 IL-1、IIL-2、IL-6、LIF、TNF-α、TGF-β、IFN-α、IFN-β、IFN- γ 等细胞因子;(3)神经细胞及神经内分泌细胞膜上有细胞因子的特异性受体分布;(4)脑内一些区域如终纹血管器(OVLT)、最后区、脉络丛及正中隆起等处缺乏血脑屏障,为循环血中的细胞因子影响中枢神经系统提供了直接途径,且在生后早期或某些病理条件下,血脑屏障发育末完善或通透性增加时细胞因子也可到达中枢部位;(5)由于淋巴器官具有神经支配,故由免疫细胞生成的细胞因子也可能作用于支配淋巴器官的内脏感觉性神经末梢,从而发挥其调节神经内分泌功能的效应,如 IL-1、IL- 2 等可不同程度地影响神经元的放电活动。
(一)IL-1
1. 神经内分泌细胞中 IL- 1 的合成 在星形胶质细胞、小胶质细胞、神经元及胶质瘤细胞中均可检测到 IL-1β 及其 mRNA 的存在。垂体前叶 TSH 细胞、肾上腺髓质嗜铬细胞中分别含有 IL-1β 及 IL-1α 的 mRNA。IL- 1 在中枢神经系统中的表达受发育、损伤、去神经传入等因素的影响。因此,有人认为 IL- 1 可能作为神经递质而介电动神经元之间、神经元与胶质细胞之间、胶质细胞与胶质细胞或免疫细胞间的信息传递过程。
2.IL- 1 受体(IL-1R)在神经及内分泌细胞中的分布 海马列的颗粒细胞和锥体细胞层、脉络膜丛、嗅球、皮层及小脑神经元均有高密度的 IL-1R 分布,而下丘脑外密度较低,IL-1r mRNA 的表达也见于海马神经元、脑桥和脊髓的中缝核系统及齿状回的颗粒细胞。但嗅球、大脑皮层及下丘脑未见 IL-1r mRNA 的表达,因此有人认为 IL-1R 主要由含 5 -HT 的中缝核神经元合成,经中缝核的投射纤维借轴浆运输至上述脑区。交感神经节也有 IL-1r mRNA 的表达。垂体前叶细胞及 AtT20 小鼠垂体瘤细胞有 IL-1R 的分布,同样,睾丸的 Leydig 细胞及附睾细胞亦存在 IL-1R。新近发现在卵泡破裂前,IL-1r mRNA 以高水平表达于卵巢的初级及次级卵母细胞和颗粒细胞中。胰岛及 β 细胞也为 IL-1R 免疫阳性。尚未发现肾上腺皮质及甲状腺细胞有 IL-1R 的表达。
3.IL- 1 对神经及内分泌系统的影响
(1)神经系统:IL- 1 对神经系统的影响是多方面的,仅举例于下。
①IL- 1 在许多中枢部位如征髓、中脑网状结构、脑干及外侧下丘脑引起发热反应,此作用极为明显,表现为短暂而迅速发作的双峰热。由于 IL- 1 生效需一潜伏期,且抑制前列腺素合成的药物亦阻止 IL- 1 的作用,故 IL- 1 的发热效应可能由类花生酸产物及 β -END 所介导。
②IL- 1 促进家兔、大鼠和猫非快动眼睡眠(non-rapideye movement sleep,NREMS), 但不影响快动眼睡眠相(rapid eye movement sleep,REmS)。当人处于 NREMS 时,血浆 IL- 1 达高峰。猫 CSF 中 IL- 1 水平也与睡眠时相相关。IL-1β 分子中 208-240 肽段对家兔有致热及催眠作用,但此肽段不能影响胸腺细胞的增殖,提示 IL- 1 可能以活性代谢片段形式调节睡眠。蓝斑内注射 IL- 1 促睡眠作用 6 倍于 IL- 2 及 IL- 3 的效应。
③中枢注入 IL- 1 可抑制摄食行为,抑制胃排空和胃酸及胃蛋白的分泌,并具有较广泛的镇痛效应。
④IL- 1 具有较强的促进星形胶质细胞及小胶质细胞的增殖效应,并促进胶质细胞合成 TGF-β1、M-CSF、IL-6、IL-8、MCAF 和 PGE2,增加脑啡肽原 mRNA 的表达,降低胶质细胞 SP 受体的表达。
⑤IL- 1 能诱发视上核神经元放电,此效应涉及 PG 的合成及 GABA 能抑制性中间神经元。但也有报道 IL-1β 减弱下丘脑内葡萄糖敏感神经元的电话动,并引起大鼠海马列锥体细胞元的突触抑制,垕得可能与 SS 在 IL-1β 作用下分泌增加有关。IL- 1 的电生理效应似可引发 VAP 及 OT 的释放。
⑥IL- 1 增加 GABA 受体功能,可促进 Cl–的运转,增加通透性。IL- 1 作用于神经元,诱发外向慢电流,伴有钠电导导下降。IL- 1 的电生理效应似可引发 AVP 及 OT 的释放。
⑦IL- 1 对各种中枢神经递质的合成及代谢有明显的影响,如降低下丘脑内 NE 的含量,提高其代谢产物 MHPG 的浓度,增加 5 -HT 的代谢产物 5 -HIAA(5 羟吲哚乙酸)在脑脊液及海马中的含量。
⑧IL- 1 可激活 CRH 神经元,促进 CRH 基因的表达,此作用系由 PG 介导的。IL- 1 还抑制下丘脑分泌 LHRH,并影响 GHRH 和 TRH 等的分泌。
⑨脑室内给予 IL- 1 或人为促进脑内 IL- 1 的合成可引起明显的外周免疫抑制效应,如 NK 活性降低、淋巴细胞对丝裂原刺激反应降低、IL- 2 分泌减少等。此效应系由 CRH 及交感神经系统介导的,由此亦形成神经内分泌免疫调节环路。
⑩在外周神经系统,IL- 1 增加交感神经节中 SP 的合成,促进雪旺氏细胞的增殖及 LIF 的 mRNA 表达。IL- 1 还提高胆碱乙酰化酶(choline acetyltransferase,ChAT)的活性而促进 ACh 的合成,诱导神经生长因子(nervegrowth factor,NGF)mRNA 的生成。
(2)内分泌系统:IL- 1 对垂体前叶、肾上腺皮质和髓质、性腺、甲状腺以及胰岛等内分泌系统有广泛的影响。
①IL- 1 对垂体前叶激素的作用研究较多,但尚存争议。在体实验发现,IL- 1 或并用 IL- 6 均能提高血浆中 ACTH 浓度,与 IL- 6 及 TNF- α 协同增加 ACTH 对 LPS 的反应。有报道提示 IL-1β 经儿茶酚胺的介导在正中隆起水平调节 ACTH 的分泌。长期缓慢给予 IL-1β 也观察到 ACTH 及皮质激素的升高。去势雄性大鼠注入 IL- 1 后,其 LH 分泌降低。离体实验中,在小鼠腺垂体瘤细胞系 AtT20、大鼠垂体前叶及 Cushing 病患者手术切除的重体前叶培养细胞,IL- 1 均能促进 ACTH 的分泌,此作用可能由 IL-1Rt I 介导的,并能涉及如下方面:如促进 POMC 的基因表达,提高 ACTH 细胞对 CRH 的敏感性,维持细胞对拟肾上腺素能药物刺激的反应性,减弱受体脱敏现象。IL- 1 还可刺激 GH、TSH 及 LH 的分泌,而抑制 FSH 的释放。IL- 1 对 PRL 分泌的影响报道不一。IL- 1 通过类花生四烯酸产物的介导而刺激 IL- 6 的分泌。IL- 1 对 β -END 分泌的刺激作用可能是 PKC 介导的,但也有报道认为此效应主要与 fos 及 jun 的表达升高有关而不涉及 PKC。
②在肾上腺皮质,IL-1α 及 IL-1β 以时间和剂量依赖形式,通过 PGE 等的介导而促进皮质醇的释放。也可由肾上腺皮质内部的 CRH 及 ACTH 系统介导而促进去垂体大鼠皮质酮的生成。IL-1α 或 TNF- α 要调节肾上腺髓质嗜铬细胞合成 ENK、VIP、NT 及 SP 等神经肽。
③IL- 1 在睾丸可明显抑制 Leydig 细胞合成睾酮,因 IL- 1 可阻抑 17- α 羟化酶 -C17-20 侧链裂解酶(P450C17)的表达,而后者为睾酮合成的关键酶。IL- 1 也具有抑制卵巢鞘膜间质细胞合成类固醇激素的效应,并影响生殖细胞的成熟和发育。由于在关膜囊内发现 IL-1,且其水平在妊娠晚期明显升高,故有人认为 IL- 1 可参与分娩的发动。
④在甲状腺,IL- 1 抑制甲状腺激素的分泌,也促进 FRTL- 5 甲状腺细胞株表达 c -myc,刺激甲状腺细胞的增生。
⑤IL-1β 能降低血浆中胰岛素水平,抑制胰岛细胞释放胰岛素。
(二)IL-2
1. 神经内分泌系统中 IL- 2 的分泌 正中隆起和弓状核等部位的 IL- 2 免疫染色较强。海马列锥体细胞层和齿状核的颗粒细胞层也有较高的 IL- 2 表达。IL- 2 表达还见于尾核、下丘脑、蓝斑及额叶皮层。已在神经元和胶质细胞中发现 IL-2mRNA 的存在。
2.IL-2R 的分布 Tac 抗原在中枢神经系统中的分布与 IL- 2 的免疫阳性区域相吻合。125I-IL- 2 的结合位点仅见海马结构和小脑分子层。受损后海马列中 Tac 表达上升 17 倍。由于 IL- 2 及受体的分布重合,提示二者在局部产生特定效应或相互诱导表达。垂体细胞膜上也有 Tac 的抗原的分布。
3.IL- 2 的作用 IL- 2 对神经内分泌系统有广泛的影响,可能参与某些病理和生理过程,举例如下。
(1)向第三脑室微量输注 IL-2,腹内侧核神经元的放电频率增加,室旁核及视上核的神经元电活动也增强,IL- 2 可能促进 AVP(ADH)的释放,参与调控机体的水平衡。
(2)向脑内不同区域如第三脑室和蓝斑等微量注射 IL-2,可特异性地引起清醒大鼠嗜睡,且皮层脑电图(ECoG)的功率谱亦发生改变,对 IL- 2 催眠作用的最敏感脑区为蓝斑,所需的效应有一定联系。向蓝斑急性输注 IL-2,4- 5 日后慢性睡眠时程明显增强。已知蓝斑参与睡眠调节,故 IL- 2 作用可能有病理生理意义,如感染患者常出现嗜睡反应。
(3)尾状核及黑质内微量输注 IL-2,引起非对称性姿势改变,如大鼠向注射同侧倾斜,偶而呈旋转状态,提示 IL- 2 可能抑制黑质及纹状体的 DA 系统。于背侧海巴及腹内侧下丘脑等外输注微量 IL-2,动物运动增多,探寻行为加强。
(4)IL- 2 还可抑制离体海马列脑片在 K +刺激下所致的 ACh 释放,但 IL- 1 及 IL- 4 均无此效应。IL- 2 尚能减弱海马神经元的长时程增强现象(long-term polentiation,LTP),故 IL- 2 可能以此方式参与海马的学习和记忆过程。
(5)IL- 2 具有较强的神经内分泌效应,与 IL-1、IL- 6 及 TNF 一样,参与免疫反应时对下丘脑 - 垂体 - 肾上腺皮质轴系的激活。已经证实,10-15-10-12 M 水平的 IL- 2 可刺激离体垂体前叶细胞 ACTH 的分泌,但抑制 PRL 及 TSH 的基础分泌,抑制 GH、L/FSH 的释放。以 IL- 2 治疗癌症患时,血中 ACTH,皮质醇及 β -END 均明显上升。
(6)IL- 2 刺激胶质细胞表达髓鞘碱性蛋白(myelin basic protein,MBP)及其 mRNA 的表达,促进大鼠少突胶质细胞的分化,对少突胶质细胞有细胞毒样作用。
(7)IL- 2 还可能参与多发性硬化症(MS)的病理过程,因脑内 MS 斑块中心及边缘区 IL- 2 的免疫阳性染色增强。
以上所述说明 IL- 2 也是重要的神经免疫内分泌介质。IL- 2 及其受体在脑内的不均一分布提示其具备特定的功能,可能参与行为、学习和记忆等生理过程。
(三)IL-6
1.IL- 6 及 IL-6R 在神经及内分泌系统的分布 大鼠脑内星形胶质细胞在刺激下可生成 IL-6mRNA。正常大鼠脑内也有 IL- 6 及 IL-6R 分布,脑外伤后,二者的表达均升高。大鼠正常的垂体前叶培养细胞能稳定生成较多的 IL-6,且主要由滤泡星形细胞(follicolostellate cell)所分泌。各种人垂体腺瘤中均有 IL- 6 及其 mRNA 的表达,某些瘤体中甚至 20% 的瘤细胞为 IL- 6 免疫染色阳性。垂体前叶中的 IL- 6 合成和分泌受许多因素的影响,如 IL-1、TNF-α、垂体腺苷酸环化酶激活肽(PACAP)、GRP、LPS 等都可刺激 IL- 6 的释放,其中 IL- 1 的作用涉及 PLA2 和 PLA1,为类花生酸依赖性的。PACAP 及 CGRP 的效应是由 PKA 介导的。垂体前叶的125I-IL- 6 结合位点 Kd 为 2.7nM,密度为 170 结合点 / 细胞。
2.IL- 6 的细胞内分泌效应 IL- 6 通过 PLA2 介导的方式刺激下丘脑释放 CRH,也可作用于正中隆起促进 CRH 的分泌,但不影响 AVP 的释放。对星形胶质细胞,IL- 6 促进 NGF 合成。IL- 6 可刺激清醒大鼠 ACTH 的释放,促进 FSH、LH 及 PRL 的分泌。
(四)TNF-α
1.TNF- α 的合成及分布 TNF- α 在神经及神经内分泌组织中的合成及颁布上报道较少。在人脑的小胶质细胞中发现 TNF- α 的生成。人 D54-MG 恶性胶质瘤细胞也有 TNF- α 及其受体表达。星形胶质细胞在 LPS、IFN- γ 及 IL-1β 的诱导下也可生成 TNF-α。
2.TNF- α 的中枢神经效应 TNF- α 有中枢致热效应,并促进星形胶质细胞表达脑啡肽原 mDNA,对人胶质瘤细胞有下调 SP 受本的效应。TNF- α 可诱导人胶质瘤细胞合成 IL- 8 及 MCAF,能减少实验性脑肿瘤的体积。新近发现,TNF- α 可降低神经元胞体的 K +电导,从而诱发去极化反应。于脑脊液中输注 TNF-α,观察到血脑屏障的通透性增加,白细胞渗出增多。
3.TNF- α 对内分泌的影响 TNF- α 可影响各种垂体前叶激素的分泌。较一致的报道是整体给予 TNF- α 明显升高血浆中 ACTH 浓度。离体条件下 TNF- α 对 ACTH 分泌的影响报道不一。有文献称 TNF- α 抑制多种下丘脑释放激素对垂体前叶激素分泌的刺激效应,尤其是抑制 ACTH 的分泌,TNF- α 还抑制培养的垂体前叶细胞分泌 GH;也有报道说明 TNF- α 可明显刺激 ACTH、TSH 及 GH 的分泌,并刺激 PRL、LH 及 IL- 6 的释放,TNF- α 降低胞内 cAMP 的含量,PG 可能介导 TNF- α 对 TSH、GH 及 ACTH 分泌的促进作用。TNF- α 刺激 PRL 分泌的效应,涉及 Ca2+动员。在 TNF- α 的作用下有 15% 的垂体前叶细胞内 Ca2+浓度有变化。TNF- α 对垂体前原代培养细胞有剂量依赖性促增殖效应,抗 TNF-αMcAb 可阻断此反应。另外,TNF- α 可促进人胎儿胰岛 β 细胞的增殖,并抑制人类的黄体功能。
(五)IFN
IFN 可明显促进成年大鼠小胶质细胞表达 MHC 抗原及 FcR,并刺激超氧离子的生成。IFN- γ 能减轻实验性变态反应性脑炎的病变程度,影响雪旺氏细胞表达 MHC 抗原。向海马神经元微电泳 IFN-γ,可剂量依赖地刺激其放电活动。离体垂体前叶细胞在 IFN- γ 作用下,分泌 PRL 及 IL-6。但另有报道发现 IFN- γ 通过 FSC 介导而抑制 ACTH、PRL 及 GH 的分泌。IFN-α2 体内给药,可提高人血浆中 ACTH 及皮质醇的浓度。IFN- γ 对甲状腺细胞的作用与上不同,它可抑制培养的人甲状腺细胞表达 HLA-DR 抗原,T3 的释放和甲状腺细胞的作用与上不同,它可抑制培养的人甲状腺细胞表达 HLA-DR 抗原,抑制 T3 的释放和对碘的摄取。
(六)其它细胞因子
IL-4、IL-7、IL- 8 对海马神经元有保护性作用。M-CSF 存在于神经元、小胶质细胞及神经母细胞瘤细胞中,人胎儿小胶质细胞含 M -CSF 较少,但可受 LPS 诱导表达较多的 M -CSF 及其 mRNA。M-CSF 抑制小胶质细胞在基础及诱导条件下表达 MHc Ⅱ类分子,但星形胶质细胞不受 M -CSF 的影响。M-CSF 对小胶质细胞而言可能起着自分泌调控作用。GM-CSF 影响小胶质细胞的分化,诱导其不依赖 IFN- γ 功能。
三、胸腺肽对神经内分泌功能的影响
遗传性无胸腺裸鼠或摘除胸腺的动物,其肾组织结构发生改变,且 HPA 轴系活动减弱。新生小鼠去胸腺后,出现进行性生长迟缓,垂体中 GH 细胞缺乏分泌颗粒。裸鼠垂体前叶内 PRL 细胞的分泌颗粒也大为减少,垂体前叶的 LH 及 FSH 的含量下降,血中 LH、FSH、GH、T3 及 T4 的浓度减少。移植胸腺可纠正这些变化。新生大鼠去胸腺后,血浆中 ACTH 浓度减少,而去胸腺的性未成熟猴也表现出血浆中 ACTH、β-END 及 GC 水平降低。这些事实说明胸腺对神经内分泌系统有明显的效应。
业已证实,胸腺的上述作用主要是由胸腺上皮细胞分泌的胸腺肽类介导的。目前发现的胸腺肽类至少有 9 种(表 10-5)。
表 10-5 胸腺肽的种类及其氨基酸残基数和分子量
| 种类 | 氨基酸 | 分子量 | 种 类 | 氨基酸 | 分子量 |
| 残基数 | (kDa) | 残基数 | (kDa) | ||
| Thymosinα1 | 28 | 3.1 | Thymosin v | >40 | |
| Thymosinβ4 | 43 | 5 | Thymic fator X | ≥4.2 | |
| Thymulin | 9 | 0.85 | Tymolymphotropin | >20 | |
| Thymopoietin Ⅱ | 49 | 5.6 | (部分纯化) | ||
| MB35 | 35 | 3.8 | Thymosin α5 | 2.2 |
注:部分引自 Millington 和 Buckingham(1992)
(1)thymosin V: 促进 ACTH、β-END 及 GC 的分泌,Thymosin V 的效应可能不是直接作用于肾上腺皮质,而是以 Ca2+依赖方式刺激 ACTH 及 β -END 的释放,可强 CRH 促进 ACTH 分泌的活性,增加 GH 及 PRL 的分泌。thymosin V 还可调节大鼠卵巢颗粒合成类固醇激素及分泌 IL-6。
(2)thymolymphotropin:刺激大鼠 PRL 及皮质酮的分泌。
(3)thymulin: 对大鼠皮质酮的基础分沁无刺激作用,同样 thymosin α1,thymosin β4 也不影响 ACTH 的释放。MB35 在离体条件下可有效地刺激 GH 及 PRL 分泌。
(4)thymosin β4: 促进内侧基底部下丘脑释放 GnRH,向脑室内注入 thymosinβ4 后,LH 分泌增加。
(5)胸腺提取物及胸细胞培养液中均含有活性成分,可降低或抑制孕酮、E2 及睾酮的合成,减少 HCG 分泌,降低性腺机能。该活性成分的化海陆空结构尚不清楚。
(6)thymopoietin:可直接结合于神经肌肉接头处的 N 受体,并可与 α 银环蛇毒竞争 N 受体。提示胸腺功能亢进时通过此途径能改变神经肌肉接头的传递,与重症肌无力发生有关。
胸腺肽众多的对神经内分泌调节功能表明,胸腺不仅是中枢淋巴器官,还是一内分泌腺体,胸腺与神经内分泌系统间有双向影响和联系。
四、免疫功能在神经及内分泌组织中的体现
(一)中枢神经系统(CNS)
1. 脑是免疫效应器官 既往认为脑是免疫特许器官,表现为:①脑内移植物存活时间长、存活率较高,且免疫排斥反应较弱;②中枢神经系统损伤后,较少出现中笥粒细胞浸润;③存在血脑屏障及血脑疹液屏障;④脑内无明显的淋巴引流,仅在某些条件下借动静脉血管周围间隙(Virchow-Robin space)完成淋巴引流。然而,近年发现,神经胶质细胞可视为脑内免疫细胞并行使一定的免疫功能。另外,某引起中枢神经部位如终纹血管器(OVLT)、最后区(area postrema)、正中隆起及弓状核等均缺乏血脑屏障,由此免疫系统的信息分子如 IL- 1 等可影响中枢部位,且 Ig 可进入脑脊液中。这些事实表明中枢神经系统也是免疫效应部位。
2. 胶质细胞可视为脑内特化的免疫细胞 对神经胶质细胞免疫学的研究已取得较大进展。脑体积中的一半为神经胶质,胶质细胞的数目为神经元数目的十倍,其中星形细胞是主要的胶质细胞成分。其它的胶质细胞包括少突胶质细胞、小胶质细胞和室管膜细胞。外周神经中的雪旺氏细胞亦属于此类细胞。
(1)星形胶质细胞:星形胶质细胞具有支持、营养神经细胞,维持细胞外液离子平衡,调控神经递质的循环,构成血脑屏障及合成 NGF 和 a Ⅱ等神经活性物质的功能,并且有一定的吞噬能力。已发现星形胶质细胞具有多种生物活性物质的受体。星形胶质细胞的表面标记和功能可受到以下因素的影响:①与 LFA- 1 及 ICAM- 1 等免疫粘附分子有关的细胞接触及粘附;②活化的 T 淋巴细胞、Mφ 及星形胶质细胞释放的多种细胞因子:③抗原抗体复合物刺激。在这些因素作用下,星形细胞表现出如下重要功能:
①分泌众多活性成分:IL-6、IL-1、IL-3、TNF-α、LT、bFGF、TGF-β1、C3、备解素 B、SP、TX2、LTB4、LTC4、PGE2、IL-8、MCAF 等。这些成分为免疫介质或炎症介质,可参与脑内的免疫生理及病理反应。
②表达 MHC- I 类及Ⅱ类分子,从而具有抗原提呈功能。
③表达 ICAM-1、fibronectin、laminin 和 N -CAM 等,参与 T 细胞的激活和抗原递呈。
④星形细胞增殖加速与脑受损后的瘢痕形成及 MS 的硬化斑均有密切的关系。
以上事实说明,星形细胞可视为脑内的免疫辅助细胞,介导中枢神经系统内部的神经、免疫内分泌相互联系。
(2)小胶质细胞:现已证明,脑内的小胶质细胞是由骨髓单核细胞系来源并迁入和定居于中枢神经系统的。与外周组织中的 Mφ 类似,小胶质细胞表面的 CR3 受体和 Fc 受体,并表达低水平的 CD4 抗原、MHc Ⅱ类抗原、转铁蛋白受体和 B 细胞共同抗原。上胶质细胞具有多方面免疫相关功能,参与神经系统的发育和重塑,调节神经递质的合成和分解代谢,促进脂类的代谢,参与炎症及修复以及介导免疫反应。
①分泌细胞因子及其它活性成分,如 IL-6、IL-1β、M-CSF、TNF-α、PG 和载脂蛋白 E 等。
②在 M -CSF、GM-CSF、IFN-γ、IL- 1 等细胞因子作用下,可发生增殖反应或获得 APC 功能,超氧离子和 NO 生成及 IIL- 6 等分泌增加,而 IL- 4 可降低 NO 生成。
③由于小胶质细胞表达 CD4,故与 HIV 的脑内感染有一定联系。
④具有吞噬能力,并在一定条件下引起神经元损伤,其机制与超氧离子及 NO 生成有关。
⑤当 MHC-Ⅱ类分子表达时获得抗原提呈功能。如在巴金森氏病及老年性痴呆症的病灶中有 HLA-DR 阳性小胶质细胞的分布。
3. 脑内免疫反应的特点 脑内不但有星形细胞和小胶质细胞等免疫辅助细胞,还存在内源性抗炎机制。因此,中枢神经系统一方面不是完全的免疫特许部位,另一方面脑内的免疫反应经常受抑制或下行性调节。
(二)外周神经系统
交感神经节中的肾上腺素能神经元在交感神节去传入后或离体培养时,胞体中 SP 及编码 SP 的 PPt mRNA 含量增多,且神经元的表型由肾上腺素能渐转变成胆碱能,即 ChAT 表达增加。IL- 1 对交感神经,雪旺氏细胞等有多方面的调节作用。
(1)IL- 1 引起 SP 及 PPT mRNA 在交感节神经元中表达增加,并促进 ChAT 的合成,此作用可被 IL-1McAb 及 IL-1ra 所特导性阻断。
(2)培养的交感神经节中有 IL- 1 及其 mRNA 的表达,且 LPS 可显着增加 IL- 1 及 mRNA 的含量,IL-1ra 可抑制低水平的 SP 表达。
(3)LIF 可能由神经节中的雪旺氏细胞或成纤维细胞合成,可促进交感神经元表达 SP 及 Ach。IL- 1 可诱导 LIF mRNA 的增加,此过程可被 GC 抑制。LIF 的作用可被去极化刺激(如给予高钾或藜芦素)所阻断。
(4)IL- 1 可刺激雪旺氏细胞的增殖,而此种胶质细胞的增多将影响外周神经受损后的修复。
(三)垂体前叶
垂体前叶既是神经内分泌枢纽腺体,也可视为神经免疫内分泌的中心器官。免疫机能在垂体前叶与免疫功能的联系可涉及如下方面。
(1)垂体前叶分泌的 GH 及 PRL 具有正性免疫调控效应,而 ACTH 及 suppressin 对免疫的影响是抑制性的。
(2)垂体前叶可分泌 IL-6、LIF、TGF-β、IL- 2 等细胞因子,在某些刺激条件下上述细胞因子分泌增加。
(3)垂体前叶中的 FSC 细胞可表达 MHCⅡ类分子,并具有多种免疫标志分子,FSC 是垂体前叶中 IL- 6 的主要来源。另外,IFN- γ 对垂体前叶激素 LH 分泌的抑制作用需由 FSC 细胞介导。
(4)垂体前叶有 SP 肽能神经纤维分布,且腺细胞中也有 SP 的存在。SP 具有多种免疫调节作用,在垂体培养条件下,SP 可刺激 FSC 细胞的增殖,刺激 IL- 6 的释放。
(5)下丘脑促垂体激素释放或释放抑制激素以及垂体的外周靶腺派往素均具有程度、性质不等的免疫调制效应,以下丘脑垂体前叶为中心,形成神经免疫内分泌调控网络。
(6)各种细胞因子及胸腺激素也影响或调控垂体前叶激素的分泌。
(四)胎盘
胎盘可能为一种神经内分泌器官,含有多种神经肽和神经递质,并还可生成许多细胞因子。受精卵的植入及胚胎的顺利发育而不被母体排斥涉及局部的免疫抑制。孕激素具有较强的免疫抑制效应,雌激素可促进具有免疫抑制作用 α2 微球蛋白的合成。孕酮及雌激素的作用为间接性的,有促进蜕膜化并维持滋养层细胞功能的活性,而蜕膜和滋养层细胞间的联系将利于胎盘募集一种非 T 细胞的抑制性小淋巴细胞,进而引起局部免疫抑制,以保护胚胎不被排斥。缺乏此类抑制性细胞将导致小鼠胚胎的吸收和细胞毒性细胞的浸润。
第五节 神经免疫内分泌调节环路
各种生物活性物质对神经、免疫、内分泌三大系统的作用不是独立进行的,整体条件下基本是以较完整的环路为单位,构成复杂的网络。这些环路的工作方式是正反馈和负反馈,有调节精确、放大效应、整合效应、自限性及级联反应等特点。以下例举几种典型的神经内分泌免疫调节环路。
(一)下丘脑 - 垂体前叶 - 肾上腺皮质与 Mo-Mφ 环路(HPA-Mo/Mφ)
此环路的中心成分为 CRH-ACTH-GC-IL-1。具体环节如下:
(1)下丘脑的 CRH 促进垂体前叶释放 ACTH,后者刺激 GC 大量分泌,引起血中 GC 浓度升高。(2)ACTH 及 GC 可分别抑制 Mo-Mφ 的功能,减少 IL- 1 的生成。
(3)受刺激后活化的 Mo-Mφ 生成 IL- 1 增加,而 IL- 1 则作用于下丘脑促进 CRH 释放,作用于垂体前叶诱导 ACTH 的分泌,也有报导 IL- 1 直接刺激肾上腺皮质分泌 GC。
(4)ACTH 有 GC 限制 IL- 1 的进一步生成,且 ACTH 前体 POMC 还可裂解释放 α -MSH,而 α -MSH 可在中枢水平对抗 IL- 1 对 CRH 分泌的刺激效应。见图 10-5。
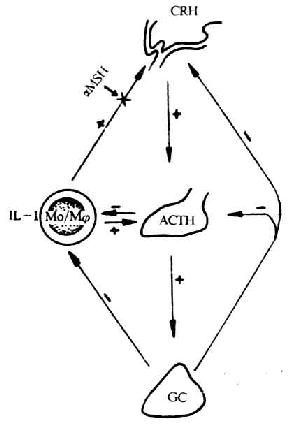
图 10-5 HPA 与 Mo-Mφ 轴系
注:+ 兴奋 - 抑制
(二)下丘脑 - 垂体前叶 - 肾上腺皮质与胸膛环路
此环路有如下环节:
(1)HPA 轴中 ACTH 和 GC 均可抑制胸腺的功能,包括细胞增殖及胸膛激素分泌。
(2)胸腺激素中 thymosin α1 及 thymulin 等都能刺激 ACTH 的分泌。
(3)胸腺中含 CRH 受体并可合成 CRH,而 CRH 对胸腺的某些功能有刺激效应。见图 10-6。
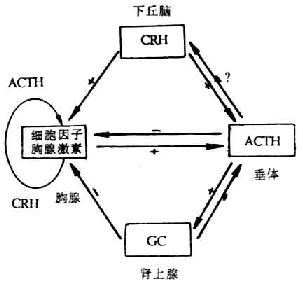
图 10-6 HPA 与胸腺轴系
(三)下丘脑 - 垂体前叶与胸腺环路
(1)下丘脑分泌 GHRH、PRF 和 TRH,作用于垂体前叶,刺激 GH 和 PRL 的分泌。
(2)GH 和 PRL 影响胸腺的发育、细胞的功能及激素的合成,胸腺中可合成 GH、PRL。
(3)胸腺肽可刺激 GH 及 PRL 从垂体前叶释放。
(四)下丘脑 - 垂体前叶 - 性腺轴系与胸腺环路
(1)LHRH 刺激垂体前叶释放 LH/FSH,二者引起性腺分泌雄激素、雌激素及孕激素。
(2)这些类固醇激素对胸腺功能有较强的抑制性效应,如使胸腺体积减少、细胞数目减少、细胞免疫功能障碍等。
(3)胸腺肽中 thymosin β4 可在离体条件下刺激下丘脑释放 LHRH。
(4)胸腺还可分泌一种蛋白成分,强有力地抑制性腺分泌性激素。
(5)LHRH 也可由胸遥小皮细胞合成。
(6)卵巢中有 thymosin 原的存在。
图 10-7 下丘脑 - 垂体前体与胸腺环路
图 10-8 HPG 与胸腺的联系
神经、免疫和内分泌系统间有经常性的信息往返交流,此种联系对各系统的生理功能是必不可少的。由于三大系统均共享各种生物活性物质,如 GH 和 PRL 既是神经内分泌激素,也可视为免疫因子,而 IL- 1 或 IL- 2 也可称做神经介质或神经派往素亦不为过。因此,众多信息分子的原有命名已不足以恰当概括其多重活性。免疫系统可感觉机体内环境的理化和生物性改变,同时还可能具备对感受的信息进行加工、处理、存贮及整合等功能,这引起特点与神经系统有一定的相似性。免疫功能的执行服从于整体需求,如在应激条件下,免疫系统活动减弱,以保证机体充分应付与生存悠关的体内外各种条件改变。再如妊娠时,保持胎盘的免疫抑制状态,有利于胚胎的顺利发育。已在众多疾病的病理及病理生理过程中,找到神经免疫内分泌交互作用的证据。相信随着研究的深入,必将提示更多疾病与神经免疫内分泌网络的联系,从而为临床的诊治提供新的思路、手段和药物。神经免疫内分泌学的研究也将有助于提示脑的奥秘。
(张万会)
参考文献
1.Aird F,etal.Corticotropin-releasing factor mRNA in rat thymus and spleen.Proc Natl AcadSci USA,1993;90:7104
2.Amano Y,et al.Inhibition byglucocorticoids of the formation of interliukinlα,interleukinlβ and interleukin-6:mediation by decreasedmRNa stability.Mol Pharmacol,1993;43:176
3.Araujo DM.et al.Trophic effectsof interleukin-4,7 and 8 on hippocampla cultures:potential involvement ofglia-derived factor.Brain Res,1993;600:49
4.Ban EM,et al.Identification ofsuppressin-producing cells in the rat pituitary.Endocrinology,1993;133:241
5.Berkenbosch F,etal.CRF-producing neurons in the rat activated by interleukin-1.Science,1987;238:524
6.Bernadini R,et al.Rathypothalamic CRH secretion in vitro is stimulated by IL-1 in aneicosanoid-dependent manner.Life Sci,1990;47:1601
7.Berczi I.Pituitary function andImmunity.CRC Press Inc.Boca Raton Florida.1986
8.Buzzetti R,et al.A criticalassessment of the interactions between the immune system and thehypothalamus-pituitary-adrenalaxis.j Endocrinol,1989;120:183
9.Celada A,et al.Repression ofmajor histocompatibility complex I-a expression by glucocorticoids:theglucocorticoid receptor inhibits the DNa binding of the X box DNA bindingprotein.J Exp Med ,1993;177:691
10.Chao CC,et al.Activatedmicroglia mediate nediate neuronal cell injury via a nitric oxide mechanism.JImmunol,1992;149:2736
11.Christ M,et al.Theinositol-1,4,5-trisphosphate system is involved in repid effects of aldosteronein human mononuclear leukocytes.J cLIN eNDOCRINOl mETAB,193;77:1452
12.Cirino G,etal.Anti-inflammatory action of an N-terminal peptide from humanlipocortin-1,Brit J Pharmacol,1990;104:573
13.DuBois CM,et al.Hematopoieticgrowth factors and hlucocorticoids synergize to mimic the effects of IL-1 ongranulocyte differentiation and IL-1 receptor induction on bone marrow cells invi.Exp Hematol,1993;21:303
14.Effros RB,et al.Influence ofage and caloric restriction on macrophage IL-6 and TNF production.Lymphok CytokRes,1991;10:347
15.Flecher-Chiappini SE,etal.Glucocorticoid-prolactin interactions in Nb2lymphomacells:antiproliferative versus anticytolytic effects.Proc Soc Exp BiolMed,1993;202:345
16.Freidin M and KesslerJA.Cytokine regulation of substance Pexpression in sympathetic neurons. ProcNatl Acad Sci UCA,1991;88:3200
17.Garcia I,et al.β-Endorphininhibits IL-2 release and expression of IL-2receptors in Con A-stimulatedsplenic lymphocytes.Lymphok Cytok Res,1992;11:339
18.Guilian D and LachmanL.Interleukin 1 stimulation of astroglial proliferation after graininjury.Science,1984;228:497
19.Haines KA,etal.Chemoattraction of neurtrophils by substance P and transforming growthfactor β1 is inadequately explained by current models of lipid remodelling.JImmunol,1993;151:1491
20.Hart RP,et al.Substance P geneexpression is regulated by interleukin-1 in cultured sympathetic ganglia.JNeurosci Res ,1991;29:282
21.Heagy W,et al.Opioid receptoragonists and Ca2+modulation by interleukin-1 in cultured sympatheticganglia.J Neurosci Res,1991;29:282
22.Hiramoto R,etal.Identification of specific pathways of communication between the CNS and NKcell system.Life Sci,1993;53:527
23.Jonakati GM.Neural immuneinterations in sympathetic ganglia.TINS,1993;16:419
24.Katsuura G,et al.Interleukin-1beta increases prostaglanken E2in rat astrocyte cultrues:modulatoryeffect of neuropeptides.Endocrinology,1989;124:3125
25.Kim KS,et al.Modulation ofbloodbrain barrier permeability by tumor necrosis facto and antibody to tumornecrosis factor in the rat.Lymphok Cytok rES,1992;11:293
26.kIMAALL ES,et al. SubstanceP,neurokinin A,and neurokinin Binduce generation of IL-1 like activity inP388D1 cells.j Immunol,1988;141:356427.
27.Koike K,et al.Tumor necrosisfactor-alpha increases release of arachidonate and prolactin from rat anteriorpituitary cells.Endocrinology,1991;128:2791
28.Kraiem A,et al.Effects ofgamma-interferon on Dr antigen expression,growth,3.5.3′-triidothyroninesecretion ,iodide uptake and cyclic adenosine monophosphate accumulation incultured human thyroid cells.j Clin Endocrin Metab,1990;71:817
29.Kroemer G,et al.Physiology andpathology of an immunoendocrine feedback loop.Immunol Today,1988;9:163
30.Lee SC,etal.Macrophage-colony-stimulating factor in human fetal astrocytes andmicroglia.Differential regulation by cytokines and lipopolysaccharide,andmodulation of class II MHC on microglia.j Immunol,1993;150:594
31.Louis J-C,et al. CNTFprotection of oligodendrocytes against natural and tumor necrosisfactor-induced death.Science,1993;259:689
32.Low KG,et al.Differentialregulation of proenkephalin expression in astrocytes bycytokines.Endocrinology,1992;131:1908
33.Lyson K,et al.Involvement ofarachidonic acid cascade in IL-6 stimulated CRF release invitro.Neuroendocrinol,1992;55:708
34.McGeer PL,et al.Reactivemicroglia are positive for HLA-Dr in the substantia nigra of Parkinson’s andAlzheimer’s disease brains.Neurology,1988;38:1285
35.Milenkovic L,et al.Cachectinalters anterior pituitary hormone release by a direct action in vitro.Proc Natl Acad Sci USA,1989;86:2418
36.Millington G and BuckinghamJC,Thymic peptides and neuroendocrine immunecommunication.JEndocrinol.1992;133:163
37.Muller H,et al.Interfaeronalpha 2-induced stimulation of ACTH and cortisol secretion inman.Neuroendocrinol,1991;54:499
38.Naiboh Y,et al.Interleukin-6stimulates the secretion of corticotropin in conscious freely movingrats.BBRC,1988;155:1459
39.Nistico G.Communications amongceutral nervous system,neuroendocrine and immune systems:interleukin 2.ProgrNeurodiol,1993;10:463
40.Nohava K,et al.Neurons andneuroblastoma as source of macrophage colony stimulating factor.Eur J Immunol.
41.Patterson PH and NawaH.Neuronal differentiation factors/cytokines and synaptic piasticity.Neuron10(suppl)1993;10(suppl):123
42.Perry VH,et al.Macrophages andinflammation in the central nervous system.TINS,1993;16:268
43.Rabin BS,et al.Bidirectionalinteraction between the central nervous system and the immune system.CriticalRev Immunol,1989;9:279.
44.Rogister B,et al.Transforminggrowth factor beta as a neuroglial signal during peripheral nervous systemresponse to injury.J.Neurosci Res,1993;34:32
45.Selmaj KW,et al.Proliferationof astrocytes in vitro in response to cytokines.A primary role for tumornecrosis factor.J Immunol,1990;144:129
46.Shieh JH,et al.Cytokines and dexamethasone modulation ofIL-1receptors on human neutrophils in vitro.J Immunol.1993;150:3515
47.Spangelo BL,et al.Induction ofinterlukin-6 release by interleukin-1 in rat anterior pituitary cells invitro:Evidence for an eicosanoid dependent mehanism.Endocrinology,1991;129:2886
48.Spinedi E,et al.Cytokinestimulates the CRH but not the vasopressin neuronal system:evidence for amedian eminence site of interleukin-6action.Neuroendocrinol.1992;56:46
49.Tsagarakis S,etal.Interleukin-1 directly stimulates the release of corticotropin releasingfactor from rat hypothalamus,Neuroendocrinol,1989;49:98
50.Tsitsiloni OE,et al.Expressionof α-thymosins in human tissues in normal and abnormal growth.Proc Natl AcadSci USA.1993;90:9504
51.Vankelecom H,et al.Evidencethat folliculostillate cells mediate the inhibitory effect of interferon-γ onhormone secretion in rat anterior pituitary cell cultures.Endocrinology,1992;130:3537
52.Yamashita H,et al.Effects ofintekleukin 1β on membrane potentials of hypothalamic meurons in rats invitro.Amm NY Acad Sci,1993;689:689
53. 徐仁宝. 躯体性和心理性应激. 复量神经生物学讲座.1991;7:85