共计 243428 个字符,预计需要花费 609 分钟才能阅读完成。
《免疫学和免疫学检验》(全本)
绪论
一、免疫的概念
免疫学(immunology)是研究机体自我识别和对抗原性异物排斥反应的一门科学。
传统免疫学起源于抗感染的研究,在 19 世纪末 20 世纪初逐渐形成和发展起来。医学家借用拉丁语 immunis 表示免疫(immunyty),其原意为免除税役,转意为免除瘟疫。在以后长在半个世纪的历史时期内,免疫一直被理解为机体的抗感染能力,被描述为宿主对病原微生物的不同程度的不感受性。
20 世纪中期以后,免疫学的发展逐渐突破了抗感染研究的局限。事实上,机体不仅是对微生物,而是对各种抗原都能够进行识别和排斥,以维持正常的生命内环境。所以,免疫是机体识别和排斥抗原性异物的一种生理功能。
现代免疫学认为:人体内存在一个负责免疫功能的完整的解剖系统棗免疫系统,与神经和内分泌等其他系统一样,这个系统有着自身的运行机制并可与其他系统相互配合、相互制约,共同维持机体在生命过程中总的生理平衡,具体表现为以下几种生理功能。
1.免疫防御(immunologicaldefence)指机体排斥外源性抗原异物的能力。这是动物藉以自净、不受外来物质干扰和保持物种纯洁的生理机制。这种功能一是抗感染,即传统的免疫概念;二是排斥异种或同种异体的细胞和器官,这是器官移植需要克服的主要障碍。这种能力低下时机体易出现免疫缺陷病,而过高时易出现超敏反应性组织损伤。
2.免疫自稳(immunololgicalhomeostasis)指机体识别和清除自身衰老残损的组织、细胞的能力,这是机体藉以维持正常内环境稳定的重要机制。这种自身稳定功能失调时易导致某些生理平衡的紊乱或者自身免疫病。
3.免疫监视 (immunologicalsurveillance) 指机体杀伤和清除异常突变细胞的能力,机体藉以监视和抑制恶性促瘤在体内生长。一旦功能低下,宿主易患恶性肿瘤。
近几十年来,免疫学以其辉煌的成就令人瞩目,免疫学技术的优势有力地推动了医学和生物学各领域的研究,并促进了临床医学的进步。目前,免疫学已经成为医学和生物学领域的带头学科之一。
二、免疫学发展简史
与其他学科一样,免疫学也是随着社会的发展和科学的进步而逐渐发生、发展和成熟的。免疫学的发展可分为原始、传统和现代三个时期。
1.原始免疫学时期免疫学起源于中国。我国古代医师在医治天花的长期临床实践中,发现康复后的天花患者及护理者,或穿过沾染患者痘痂的衣服的人不再患天花,于是就大胆创用了将天花痂粉吹入正常人鼻孔的方法来预防天花,这是世界上最早的原始疫苗。据考证,这种人痘苗在唐代开元年间(公元 713~741 年)就已出现,至 10 世纪时已在民间广为流传,并逐渐传播到国外。
在约在 15 世纪,人痘苗法传到中东。当地人把鼻孔吹入法改良为皮内接种法,免疫效果更加显著。1721 年,英国驻土耳其大使夫人 MaryMontagu 把这种接种法传入英国,并且很快遍及欧洲。但是这种经验性的人痘苗虽然有一定免疫效果,却不十分可靠,而且还有人工感染的危险,所以未能为人们普遍接受。
到了 18 世纪末,英格兰乡村医生 E.Jenner 从挤奶女工多患牛痘(一种轻型的局部痘疹)、但不患天花的现象中得到启示,经过一系列实验后,于 1798 年成功地创制出牛痘苗,并公开推行牛痘苗接种法。这是世界上第一例成功的疫苗,为人类最终战胜天花做出了不朽的贡献。但当时微生物学尚未发展起来,人们尚不认识天花和牛痘的病原体,所以这种孤立的成功并未得到理论上的升华。此后一个世纪内,免疫学一直停留在这种原始的经验状态。
2.传统免疫学时期 19 世纪后期,微生物学的发展为免疫学的形成奠定了基础。1880 年,法国微生物学家 L.Pasteur 偶然发现接种陈旧的鸡霍乱杆菌培养物可使鸡免受毒性株的感染,转而成功地创制了炭疽杆菌减毒疫苗和狂犬病疫苗,并开始了免疫机制的研究。1883 年,俄国动物学家 E.Metchnikoff 发现了白细胞的吞噬作用并提出了细胞免疫(cellularimmunity)学说。1890 年,德国医师 E.vonBehring 和日本学者北里发现了白喉抗毒素。1894 年比利时血清学家 J.Bordet 发现了补体。这此发现支持体液免疫(humoralimmunity)学说。两种学派曾一度论战不休,直到 20 世纪初英国医师 A.Wright 发现了调理素,德国学者 P.Ehrlich 提出侧链学说,才将两种学说统一起来。1901 年,“免疫学”一词首先出现在《IndexMedicus》中,1916 年《JournalofImmunology》创刊。作为一门学科,免疫学至此才正式为人们所承认。
于此同时,研究抗原体反应的学问棗血清学(serology)也逐渐形成和发展起来。1896 年 H.Durham 等人发现了凝集反应,1897 年 R.Kraus 发现了沉淀反应,1900 年 K.Landsteiner 发现了人类 ABO 血型,J.Bordet 发现了补体结合反应。这些实验逐渐在临床检验中得到应用。此后的几十年中,血清学研究代表了免疫学发展的主流。
3.现代免疫学时期 20 世纪中期以后,免疫学众多新发现频频向传统免疫学观念挑战。1945 年 R.Owen 发现同卵双生的两只小牛的不同血型可以互相耐受,1948 年 C.Snell 发现了组织相容性抗原,1953 年 R.Billingham 等人成功地进行了人工耐受试验,1956 年 Witebsky 等人建立了自身免疫病动物模型。这些免疫生物学现象迫使人们必须跳出抗感染的圈子,甚至站在医学领域之外去看待免疫学。
于是一个免疫学的新理论棗克隆选择学说(cloneselectiontheory)于 1958 年由澳大利亚学者 F.Burnet 提出。该学说认为:体内存在识别各种抗原的免疫细胞克隆;抗原通过细胞受体选择相应的克隆重并使之活化和增殖,变成抗体产生细胞和免疫记忆细胞;胚胎时期与抗原接触的免疫细胞可被破坏或抑制,称为禁忌细胞株(forbiddenclone);部分免疫细胞可因突变而与自身抗原起反应。这个理论虽不十分完善,但解释了大部分免疫现象,为多数学者所接受并被后来的实验所证明,可以说是一个划时代的免疫学理论。
嗣后,细胞免疫以一个崭新的面貌再度兴起。1956 年 B.Glick 发现了腔上囊的作用,1961 年 J.Miller 发现了胸腺的功能,1966 年 H.Claman 等人区分出 B 细胞与 T 细胞,并且发现了它们的免疫协同作用,以后又相继发现了 T 细胞中不同的亚群及其鉴定方法,以及免疫细胞间朴素作用的机制和主要组织相容性复合体限制性。
同时,体液免疫继续向纵深发展。自 40 年代初确认抗体是血清丙种球蛋白之后,1950 年 R.Porter 用蛋白酶水解获得了抗体的片段,G.Edelman 用化学断裂法得到了抗体的多肽链,共同证明了抗体的分子结构;60 年代统一了免疫球蛋白的分类和名称;1957 年 G.Kǒhler 和 C.Milstein 等人用 B 细胞杂交瘤技术制备出单克隆抗体;1978 年 S.Tonegawa 发现了免疫球蛋白的基因重排。
80 年代以来,众多的细胞因子相继被发现。对它们的受体、基因及其生物活性的研究促进了分子免疫学的蓬勃发展,有人称之为“分子免疫学时期”,但从理论上并未突破克隆重选择学说,只是从技术手段上把免疫学研究推向一个新水平。
三、免疫学的分支学科
免疫学的发展日新月异,涉及的领域越来越广,学科分支也越来越细,主要可分为基础免疫学和临床免疫学两大类。
(一)基础免疫学
基础免疫学(basicimmunology)是研究免疫系统组织结构、生理功能及其调节的几个学科分支的统称。包括以下几个方面。
1.免疫生物学 (immunobiology) 是研究免疫系统组成、免疫应答发生的机制、类型及其调节的学科。目前已经大体清楚民淋巴样细胞各类群和单核巨噬细胞的发育过程、主要特征、免疫功能与检测方法,以及它们在免疫应答中识别与递呈抗原、相互识别与协作的基本过程及机制。免疫生物学的成果可望能够对免疫应答进行特异性的人工调节,克服超敏应答对机体的损害,抑制器官移植的排斥反应,使自身免疫病患者重近对自身抗原的免疫耐受状态。
2.分子免疫学 (molecularimmunology) 是研究免疫分子及其受体的化学结构、基因表达、生物活性及其检测的学科,免疫化学 (immunochemistry) 的大部分内容可以包涵在这个学科中。免疫蛋白基因的研究、独特型抗体的发现、杂交瘤单克隆抗体技术的创立、基因工和抗体的制备、免疫细胞因子的进展等使得分子免疫学成为整个免疫不中最活跃的一个分支。从微观入手研究整体效应可望取得意想不到的效果,不久将会有更多的免疫分子应用到临床诊断和治疗以及疾病预防中。
3.免疫遗传学 (immunoginetics) 是从遗传学角度研究免疫应答发生及其调控的学科。人类的免疫应答主要受控于人类白细胞抗原(HLA)基因组棗人的主要组织相容性复合体(MHC),机体对某抗原是否产生应答、应答过程中免疫细胞间的相互识别与合作、Tc 细胞的杀伤活性等都受 MHC 的限制。器官移植排斥反应和某些变态反应都与 MHC 有关;MHC 还与多种疾病、与母胎关系和衰老等多种临床和生物学现象关联。免疫遗传学的研究正日益受到重视,许多免疫学上的难题可望从遗传学方面找到答案。
4.免疫病理学 (immunopathology) 是研究免疫相关疾病的发生、发展和转归及其机制的学科,是基础免疫研究通向临床医学的桥梁。目前对免疫炎症的发生机制已经基本了解,过去许多原因不明、机制不清的疾病都已证明是自身免疫病或免疫相关性疾病。这些成果为有关疾病的诊断和治疗提供了理论基础。另外,免疫系统本身的异常,例如免疫缺陷病(包括艾滋病)和免疫增殖病等,也都等到了较为深入的研究。
(二)临床免疫学
临床免疫学 (clinicalimmunology) 是利用免疫学理论与技术研究疾病的机制、诊断、治疗和预防的多个分支学科的总称。
1.感染免疫学(infectionimmunology)是研究病原生物与宿主相互关系从而控制感染的学科,是传统免疫学的核心。现在已经对大多数传染病的诊断和治疗建立了一系列的方法,尤其是在预防传染病方法取得了辉煌的成就。传染与免疫的研究进展将为人类最终战胜传染病做出巨大的贡献。
2.移植免疫学 (transplantationimmunology) 是研究移植物与宿主相互关系从而选择移植物和延长移植物存活的学科。目前已经能够通过检测 HLA 或其基因的办法来选择移植物,并且可以通过一定的免疫学方法延缓排斥反应的发生;移植器官的长期存活最终还要依赖移植免疫的研究。
3.肿瘤免疫学 (oncoimmunology) 是研究肿瘤与宿主的免疫相关性及其实验诊断和生物治疗的学科。免疫系统有免疫监督功能,这种功能的降低与宿主发生肿瘤有很大的相关性,有关这方面的研究尚未取得实用性成果;但肿瘤的免疫诊断方法已经广泛地用于临床,免疫治疗的研究也取得了令人瞩目的进展。
4.免疫性疾病 (immunologicdiseases) 包括变态反应病、自身免疫病、免疫缺陷病和免疫增殖病等,是各种原因引起的机体免疫应答异常所致的疾病。现大已经明确了许多免疫性疾病的发病机制和诊断方法,但对多数这类疾病的治疗和预防尚需进一步深入研究。
此外,尚有免疫药理学 (immunopharmacology)、预防免疫学(prophylacticimmunology)、营养免疫学(nutritionimmunology)、衰老免疫学(agingimmunology) 和生殖免疫学 (reproductiveimmunlolgy) 等免疫学分支学科。所有这此分支学科都从不同角度促进了免疫学的整体发展,已经并仍将为人类健康事业做出积极的贡献。
四、免疫学检验
自 1896 年 G.Widal 和 A.Sicad 应用凝集反应诊断伤寒起,免疫学就与医学检验结下不解之缘,至今已经历了一个世纪。随着免疫学和免疫学技术的发展,免疫学检验已成为医学检验中的一个重要部分。
免疫学检验的检测对象是具有免疫活性的物质,内容包括检测方法和临床意义。免疫学检验可分为细胞免疫检验和体液免疫检验两大类,免疫活性细胞及其功能的检测属于前者,抗原、抗体、补体等的检测属于后者。
近年来免疫学检验飞跃发展,在各种疾病的诊断和防治中起着日益重要的作用(免疫性疾病的检验见本书第三篇)。免疫学检验在传染病的诊断中应用广泛,大部分传染病病原体及其抗体的检测已在实验室中作为常规检验。有关内容参见《微生物学和微生物学检验》及《寄生虫学和寄生虫学检验》。
由于新技术的发展,许多与免疫无关的物质亦可作为免疫原而制备其相应抗体并用于这些物质的测定。利用抗原体反应来测定标本中微量物质的方法称为免疫测定(immunoassay)。免疫测定具有高度的特异性和敏感性,在临床检验中已用于测定各种蛋白质、酶、激素、药物和毒品等。严格地说,这些测定属于临床化学范畴。本书将在第二篇中详细叙述各种免疫学技术。免疫测定在临床化学中的应用及肿瘤标志的测定参见《临床生物化学和生物化学检验》。
免疫学基础
第一章 抗原
抗原 (antigen,Ag) 是指能刺激机体免疫系统诱导免疫应答并能与应答产生如抗体或致敏淋巴细胞发生特异反应的物质。一个完整的抗原应包括两方面的免疫性能:①免疫原性 (immunogenicity) 指诱导宿主产生免疫应答的能力,具有这种能力的物质称为免疫原 (immunogen);②免疫反应性(immunoreactivity) 指抗原与抗体或致敏淋巴细胞发生特异性结合的能力,亦称为反应原性。有些物质在独立存在时只具有反应原性而无免疫原性,称为半抗原(hapten);而免疫原通常同时具有免疫反应能力。
抗原是免疫应答的始动因子,机体免疫应答的类型和效果都与抗原的性质有密切的关系。
第一节 免疫原性基础
免疫原性是抗原最重要的性质,一种抗原能否成功地诱导宿主产生免疫应答取决于三方面的因素:抗原的性质、宿主的反应性和免疫方式。这里重点叙述抗原自身的因素。
(一)异物性
正常成熟机体的免疫系统能够区别宿主自身物质与非自身物质,对自身物质一般不产生免疫应答,只对非自身物质产生免疫应答。抗原通常是非自身的物质。对人,病原微生物及其部分产物、动物血清蛋白及异体组织细胞等都是良好的抗原。这种免疫学识别不以物质的空间位置来判断,而以淋巴细胞是否认识为标准;所以有时自身的物质也可以成为抗原。
不同物质之间的抗原性差别取决于它们化学上的异质性,这是免疫识别的物质基础。一般,物质来源的亲缘关系越远,其化学结构差别越大,抗原性也就越强;而亲缘关系越近,抗原性越弱。最好的例子是器官移植:异种移植物排斥强烈,不能存活;同种移植物排斥较弱,可存活一定期限;而自身移植物不排斥,可长期存活。再如鸭血清蛋白对鸡是弱抗原,而对家兔则是强抗原;许多哺乳动物同源组织的蛋白,例如甲状腺球蛋白、脑、睾丸和胎盘组织等均具有相同的器官特异性,就是由于这些物质在种系进化过程中分化程度低,结构差异较小的缘故。
(二)分子大小
分子大小可影响物质的免疫原性形成,一个有效免疫原的分子量大多在 10kD 以上;分子量越大,免疫原性越强。这可能是因高分子物质在水溶液中易形成胶体,在体内停留的时间较长,与免疫细胞接触的机会较多,有利于刺激机体产生免疫应答。另外,大分子物质的化学结构比较复杂,所含有效抗原基因的种类和数量也相对地多。
蛋白质的分子量较大,一般多在 10kD 之上,有良好的免疫原性。糖类物质分子量较小,多数单糖不具有免疫原性;而聚合成多糖时可以成为抗原。但是分子量 10kD 不是一个绝对的界限,例如明胶的分子量高达 100kD 但免疫原性极弱,而胰岛素的分子量仅仅 5734,却有免疫原性。
(三)化学结构
免疫原性的形成还要求分子的化学结构复杂。直链结构的物质一般缺乏免疫原性,多支链或带状结构的物质容易成为免疫原,球形分子比线形分子的免疫原性强。人工合成的单一氨基酸的线性聚合物(例如多聚 L - 赖氨酸和多聚 L - 谷氨酸)无免疫原性,但多种氨基酸的随机线性共聚物可具有免疫原性,且其免疫原性随共聚物中氨基酸种类的增加而增强,加入芳香族氨基酸的效果更明显。上述大分子明胶就是无分支的直链结构,又缺乏环状基团,所以免疫原性微弱;若在分子中连上 2%的酪氨酸,就会明显增强明胶的免疫原性。
(四)其他因素
1.宿主反应性不同种动物,甚至同种动物的不同个体对同一种抗原的应答性差别很大,这与不同的遗传性(详见第六章)、生理状态(见第七章)及个体发育(见第二十七章)等因素有关。
2.免疫方式包括抗原进入的途径、剂量、次数和间隔时间以及免疫佐剂的使用等因素(详见第十章)也可影响免疫应答。
总之,只有用良好的抗原免疫机体,并且宿主处于较好的生理状态,免疫方式又较合适的情况下,才能引起免疫应答。此时抗才真正具有了免疫原性。
第二节 抗原特异性基础
抗原的最大之一是其免疫效应具有特异性(specificity),这种特异性在其免疫原性和反应原性两方面都表现得非常突出。例如伤寒杆菌诱导的免疫应答只能针对伤寒杆菌;志贺杆菌不能诱导出对伤寒杆菌的免疫力,与抗伤寒杆菌抗体也不发生反应。这就是传统免疫学进行免疫预防和免疫诊断的基本依据。
抗原的特异性与蛋白分子中的氨基酸种类、排列顺序、特殊基因和空间构形等因素有关,甚至与其电荷性质及亲水性也有关系。但是其特异性不是平均地决定于整个分子,而是取决于分子表面几个氨基酸残基组成的特殊序列及其空间结构,称为表位 (epitope) 或抗原决定簇(antigenicdeterminant)。正是这些表位被淋巴细胞识别而诱导免疫应答,被抗体分子识别而发生抗原-抗体反应,这是研究抗原特异性的基础。
一、半抗原与载体
(一)半抗原及其应用
免疫学先驱 Landsteiner 在本世纪初就已发现:某些不具有免疫原性的小分子物质可以与抗体结合,如果将其结合到具有免疫原性的大分子蛋白上就可诱导针对小分子物质的抗体应答。他借用希腊语“haptien”(原意为强加、抓牢)称这种小分子为 hapten,汉语译为半抗原;而将半抗原赖以附着的蛋白质分子称为载体(carrier)。
结合到大分子载体上以后,半抗原可以改变载体原有的表位,也可以形成新的表位。半抗原在表位中是关键性的基团。抗原特异性的研究多是通过着抗原-载体复合物来进行的。
将苯胺、对氨基苯甲酸、对氨基苯磺酸和对氨基苯砷酸等四种已知结构的半抗原分别以偶氮方式结合到大分子蛋白上,然后用这些结合物分别免疫动物,结果所产生的抗体能够精确地将上述结构相似的半抗原区别开来,四种抗体只与相应的抗原发生反应(表 1 -1)。即使应用结构稍有差别的同一种物质,例如对位、邻位和间位的三种氨基苯甲酸作为半抗原,所产生的抗体也能将这些分子分出来。利用这种方法不仅可制备出针对许多小分子物质的抗体,甚至抗金属离子的抗体,而且大大地促进了对抗原性质的研究。
表 1 - 1 不同基团对抗原特异性的影响
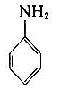 | 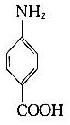 | 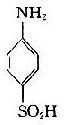 | 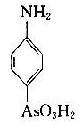 | |
| 抗苯胺 | + | - | - | - |
| 抗对氨基苯甲酸 | - | + | - | - |
| 抗对氨基苯磺酸 | - | - | + | - |
| 抗对氨基苯砷酸 | - | - | - | + |
(二)半抗原-载体效应
在半抗原-载体复合物中,载体分子虽有它本身的特异性,却不干扰半抗原的特异性。但是载体特异性对半抗原诱导抗体应答的效果有明显的影响。
将半抗原 2,4- 二硝基酚(DNP)共价交联于牛血蛋白(BSA)和卵白蛋白(OVA)等大分子载体上,对不同组的动物用不同的抗原进行首次和再次免疫,然后测定各组动物的抗 DNP 抗体,所得结果见表 1 -2。
表 1 - 2 半抗原-载体反应
| 首次免疫 | 再次免疫 | 抗 DNP 抗体 |
| DNP | - | |
| OVA | - | |
| OVA-DNP | + | |
| OVA-DNP | OVA-DNP | ++++ |
| OVA-DNP | BSA-DNP | + |
| OVA | OVA-DNP | ++++ |
| OVA | BSA-DNP | + |
从以上实验可以看出:载体不仅赋于半抗原以免疫原性,还与半抗原免疫应答的记忆性密切相关。进一步的研究证明,半抗原的特异性被 B 细胞识别,而载体特异性被 T 细胞识别;只有 T - B 细胞协作,才能启动对半抗原的抗体应答,才能产生再次应答效应。
二、天然抗原的表位
对天然表位的研究不象半抗原-载体复合物那样简单,但是借助现代科学技术的进步,目前对表位已经有比较深刻的认识。
(一)表位的构成
表位只是抗原分子中几个氨基酸残基组成的特殊结构,在免疫效应中能全方位地与淋巴细胞或抗分子接触。抗体分子的抗原结合点并不很大,所以表位一般只占有大约 3nm×1.5nm×0.7nm 的空间,即 5~7 个氨基酸和单糖残基的大小,至多不超过 20 个氨基酸残基。
表位的构成方式至少有两种:①由某些氨基酸残基按一定顺序连续排列组成的线状序列,称为顺序(sequential)表位或线性 (linear) 表位(图 1 -1)。顺序表位是蛋白分子的一级结构,比较稳定,不受蛋白质加热变性和空间构形改变的影响。②由分子内不连续的 2~3 个氨基酸残基折叠排列所形成的三维结构构成,称为构象 (conformational) 表位(图 1 -1);有时候,呈 α 螺旋式排列的连续肽链序列也可起到构象表位的作用。构象表位的抗体可用来研究蛋白分子在生理或病理过程中三维结构的变化。但是构象表位是蛋白质的二级或三级结构,不太稳定,在蛋白质受热或酶解变性后会彻底破坏,不能恢复。因此分离和研究比较困难。
![]()
图 1 - 1 顺序表位和构象表位示意图
(二)表位的数目和定位
抗原分子上表位的数目可以用饱和情况下能够结合多少个抗体分子来测定,一般情况下表位数目与抗原的分子量呈正相关。例如鸡卵蛋白的分子量为 42kD,有 5 个表位;甲状腺球蛋白的分子量 700kD,有大约 40 个表位。一个表位能结合抗体分子上的一个抗原结合点,所以可将抗原分子表位的数目称为抗原的结合价。例如上述鸡卵蛋白为 5 价,甲状腺球蛋白为 40 价。
虽然一个抗原分子上可以有多个表位,但在诱导宿主免疫应答时可能有一种或一个表位起主要作用,使宿主产生以该特异性为主的免疫应答;这种现象称为免疫显性或免疫优势(immunodominance);起关键作用的表位称为显性表位。这个原则也适用于一个表位中不同的氨基酸残基,在表位中也有所谓的显性基团存在,如被置换会明显改变表位特异性。这种现象可能与表位在抗原分子中的位置或显性基团在表位中的位置有关。上述半抗原就是在表位中起到显性基团的作用。
实验证明,表位只有位于抗原分子的表面才能与淋巴细胞和抗体分子接触而发挥免疫效应。用多聚赖氨酸为骨架,用丙氨酸(A)、谷氨酸(G)和酪氨酸(T)序列为支链进行的研究能清楚地证明这一点:将 G 和 T 连在骨架外部,使可诱导以针对 G 和 T 为优势的抗体产生;将连续的 A 连在骨架外部,便诱导以针对 A 为优势的抗体产生。
(三)共同表位与交叉反应
一个抗原分子上可能只有一种表位,称为单纯抗原;但是天然情况下很少发现单纯抗原,多数抗原分子上都存在多种表位。一般地说,不同的抗原物质具不同的表位,故各具特异性;但有时某一表位也会出现在不同的抗原上,称为共同表位,带有共同表位的抗原互称共同抗原。拥有共同抗原在自然界、尤其在微生物中是很常见的一种现象,存在于同一种属或近缘种属中称为类属抗原,存在于远缘不同种属中则称为异嗜性抗原(heterophileantigen)。
共同表位的例子很多,例如沙门菌可根据其 O 抗原分为 40 多个血清组,含 2000 多个血清型,同一组成员都有共同的 O 表位,是由特定的单糖决定的。再如人类、动物、植物和微生物之间也广泛存在着一种以发现者名字命名的抗原,称为 Forssman 抗原,其共同表位由共价交联于神经酰胺脂上的 N - 乙酰半乳糖胺、半乳糖和葡萄糖联合组成。有些共同表位只是结构相似,所以又称相似表位。
由某一抗原诱导产生的抗体,也可以与其共同抗原结合,这种现象称为交叉反应(crossreaction)。这种交叉反应可用来解释某些免疫病理现象,也可以用来诊断某些传染病。但是交叉反应总不如抗体与其诱导抗原之间的结合那么牢固;在与交叉抗体结合时只能部分地吻合,不能达到整个空间的完全相配。
(四)表位的细胞识别性
抗原免疫原性的体现首先是淋巴细胞对表位的识别。有证据表明,细胞介导免疫和体液免疫是针对同一抗原分子的不同部分,例如用人的高血糖素对小鼠进行免疫,产生的抗体是针对其氨基酸,而细胞介导免疫则是针对其羧基端;结论是 T 细胞和 B 细胞识别的不是同一类表位。这样可以将表位分为两类:B 细胞(识别)表位和 T 细胞(识别)表位。
1.B 细胞表位供 B 细胞识别诱导抗体应答,而 T 细胞不能识别的表位。对这类表位的研究资料较多,以上所述几乎都是应用特异性抗体、针对 B 细胞表位进行研究而得出的,此处不再赘述。
2.T 细胞表位供 T 细胞识别诱导产生细胞介导免疫,而 B 细胞不能识别的表位。T 细胞的抗原受体露出膜外部分较少,不能象抗体分子那样结合游离的抗原,只能识别由抗原递呈细胞(见第四章)递呈的与 MHC 结合的表位。所以被 T 细胞识别的抗原必须事先经过一定的处理,从蛋白质降解为多肽,再与 MHC 分子结合。因为构象表位在蛋白质降解时会遭到破坏,无法被 T 细胞识别,所以 T 细胞表位主要是顺序表位,也不一定位于分子表面。象抗体分子一样,T 细胞也可以由共同抗原引起交叉反应,但总不如与原诱导抗原的结合那么有效。
T 细胞表位可以诱导细胞免疫应答,作为细胞毒性 T 细胞攻击的靶子,同时对诱导抗体应答也是必需的;因为 B 细胞的活化需要活化 T 细胞的辅助,而 T 细胞活化必须由 T 细胞表位来启动。由此看来,每个抗原分子必须至少有一个 T 细胞表位,才能使抗原具有免疫原性。只具有 B 细胞表位的分子可以作为抗体的靶子,但本身不能诱导抗体应答。只有少数分子可能例外。
第三节 抗原的类型
自然界中各种生物、各种组织都有其各自特异性的抗原,所以其数目多得无可胜计。根据任一性状都可对抗原进行分类,因此分类方法也十分复杂。现按其主要性状分类,叙述几种医学上有重要意义的抗原。
一、诱导免疫应答的性能
根据抗原被淋巴细胞识别的特性和诱导免疫应答的性能,可将抗原分成以下三类:
(一)胸腺依赖性抗原
含有 T 细胞表位、需要 T 细胞参与才能诱导免疫应答的抗原称为胸腺依赖性抗原(thymus-dependentantigen,TD-Ag)。TD-Ag 可诱导细胞介导免疫和(或)抗免疫应答,但无一例外地需要 T 细胞的参与。天然抗原的绝大多数都是 TD-Ag。
(二)胸腺非依赖抗原
只含 B 细胞表位、可直接激活 B 细胞的抗原称为胸腺非依赖性抗原(thymus-independentantigen,TI-Ag)。TI-Ag 的分子结构比较简单,往往是单一表位规律而密集地重复排列。这样的结构可使 B 细胞表面受体发生广泛的交联,从而象丝裂原一样直接使 B 细胞活化。但是这种抗原的免疫能力有限,只能诱导 IgM 类抗体,而且不能产生再次应答效应。
近年的研究发现,所谓 TI-Ag 也并非完全不要 T 细胞的帮助,只是对胸腺的依赖性较弱;因此称它们为胸腺增效性(thymusefficient)抗原也许更恰当些。
(三)超抗原
少量分子可使大量 T 细胞活化的高效能抗原称为超抗原(superantigen,SAg)。这类抗原可使宿主 20%的 T 细胞活化,而通常的多肽抗原在初次免疫应答中只能使 0.001%~0.1%的 T 细胞激活。超抗原被 T 细胞识别时虽然要与 MHCⅡ类分子结合,但不受Ⅱ类分子的限制,可以直接活化 T 细胞而且效率特别高(详见第七章)。
近年来对超抗原的研究比较多,已经发现的超抗原有小鼠乳腺瘤病毒编码的次要淋巴细胞刺激(MLS)抗原,狂犬病病毒衣壳蛋白,葡萄球菌肠毒素 A~E(SEA~E),中毒性休克综合征毒素 1(TSST1),表皮剥脱毒素(EXT),链球菌 M 蛋白和致热性外毒素 A、B、C,关节炎支原体丝裂原(MAM),小肠结肠炎耶尔森菌膜蛋白,假单胞菌,HIV 及小鼠 Moloney 白血病病毒编码的某些蛋白质。
超抗原的发现具有许多实际的免疫学意义,为许多疾病的发生机制研究提示了新的线索。超抗原对宿主多有直接的毒性作用,而且还与宿主多方面的免疫机制相关,例如自身免疫病、免疫抑制作用、T 细胞在胸腺发育中的选择作用、某些抗感染和抗肿瘤作用等等。但是迄今为止对超抗原本身的结构及其与 MHCⅡ类分子和 T 细胞受体之间的关系目前还不清楚。对超抗原的研究将有助于解开许多免疫学之谜。
二、与宿主亲缘相关性
(一)异种抗原
与宿主不是同一种属的抗原物质称为异种抗原(xenoantigen)。通常情况下,异种抗原的免疫原性比较强,容易引起较强的免疫应答。与医学有关的异种抗原主要有以下几类:
1.病原微生物如细菌、病毒和其他微生物都是良好的抗原。这些微生物的个体结构虽然简单,但抗原结构却很复杂,是多种抗原的复合体。它们在引起宿主感染的同时,也会诱导宿主产生特异性免疫应答和抗感染能力。因此可用免疫学方法对传染病进行诊断和防治。
2.细菌外毒素和类毒素它们都是很好的抗原,在自然感染和免疫接种后都可产生较强的免疫力。常用于免疫预防的类毒素有白喉类毒素和破伤风类毒素。
3.抗毒素是用类毒素免疫动物(常用马)制备的免疫血清或精制抗体。抗毒素具有免疫二重性:既可中和相应外毒素、具有防治作用,又可引起变态反应。所以在应用前必须做皮肤过敏试验。
4.异嗜性抗原有些微生物与人体某些组织有交叉反应性抗原,可引起宿主发生自身免疫性疾病。例如溶血性链球菌与肾小球基底膜和心肌组织、大肠杆菌某些 O 抗原与结肠粘膜等可存在交叉抗原。在临床上也常借助异嗜性抗原对某些疾病作辅助诊断。例如诊断某些立克次体病的外-斐反应等。
(二)同种异型抗原
同种间不同个体的特异性抗原(alloantigen)。例如人类的 ABO 和 Rh 血型抗原及主要组织相容性抗原等。这种个体间的抗原性差异虽不象异种抗原的免疫原性那么强,但也可在同种间引起一定程度的免疫应答。例如 ABO 和 Rh 血型不符可引起输血反应,而 HLA 除了可引起移植排斥反应之外,还可调节机体的免疫应答(详见第六章)。
(三)自身抗原
能诱导宿主发生自身应答的物质称为自身抗原(autoantigen)。正常情况下免疫系统对自身物质不作为抗原来对待,但当机体受到外伤或感染等刺激时,就会使隐蔽的自身抗原暴露或改变自身的抗原结构,或者免疫系统本身发生异常,这些情况均可使免疫系统将自身物质当作抗原性异物来识别,诱发自身免疫应答,引起自身免疫病(详见第二十五章)。
三、其他分类方法
(一)根据化学性质分类
按照抗原分子的化学性质,可将抗原分成蛋白抗原、多糖抗原和核酸抗原等许多类型。
天然蛋白质的分子组成都比较复杂,且具有二级和三级结构,因此多是良好的抗原。多糖的免疫原性一般较弱,但某些结构复杂的多糖,例如人类 ABO 血型抗原等,也具有较强的免疫原性。核酸和脂类多无免疫原性,与蛋白质结合后形成核蛋白或脂蛋白时可成为良好的抗原;在系统性红斑狼疮等自身免疫病患者体内可发现抗 DNA 或抗 RNA 的抗体,所以核酸也许是一种天然的半抗原。
(二)根据制备方法分类
按照应用抗原的制备方法,可将抗原分成天然抗原、人工抗原和合成抗原三种类型。
天然抗原是不加修饰的天然物质,例如微生物、BSA 和绵羊红细胞等。人工抗原是经人工修饰的天然抗原,例如碘化蛋白、偶氮蛋白等。合成抗原是经化学合成的高分子氨基酸聚合物,例如多聚赖氨酸等。由一种氨基酸组成的聚合物称为同聚物,由两种或两种以上氨基酸合成的聚合物称为共聚物。
(三)根据生物来源和体内定位分类
按照抗原的生物来源和在生物体内存在的位置进行命名是一种自然的方法,可以将抗原分成无数不同的类型;这虽不是一种规范的分类方法,却是一种十分实用的命名方式。例如小鼠 MHC 抗原、病毒表面抗原和细菌鞭毛抗原等。
另外,根据抗原的免疫效果还可以分成完全抗原和半抗原,或免疫原、变应原和耐受原等;根据抗原与宿主的位置关系还可分成内源性抗原和外源性抗原等。
第二章 免疫球蛋白
免疫球蛋白 (immunoglobulin,Ig) 通常是指一组具有抗体活性和(或)抗体样结构的球蛋白。Ig 由浆细胞产生,存在于血液和其他体液(包括组织液和外分泌液)中,约占血浆蛋白总量的 20%;还可分布在 B 细胞表面。Ig 的结构具有不均一性,可分为不同的类型;多数 Ig 具有抗体活性,可以特异性识别和结合抗原,并引发一系列生物学效应。
第一节 免疫球蛋白的化学
免疫球蛋白具有蛋白质的通性,能被多种蛋白水解酶裂解;可以在乙醇、三氯醋酸或中性盐类中沉淀,常用 50%饱和硫酸铵或硫酸钠从免疫血清中提取抗体球蛋白。血清电泳时免疫球蛋白主要分布于 γ 区,因而以往曾称抗体为 γ 球蛋白。其实具抗体活性的球蛋白除存在于 γ 区外,也可延伸到 β 区,甚至 α 2区,这反映了抗体由不同细胞克隆产生的不均一性和结构的多样性。自从发现骨髓瘤患者尿中的本周蛋白是 Ig 的轻链以后,对其氨基酸顺序的研究大大促进了对 Ig 化学性质的了解。
(一)Ig 的基本结构
Ig 分子由 4 条肽链组成,2 条长链称为重链 (heavychain,H),由大约 440 个氨基酸残基组成,分子量约 50~70kD;2 条短链称为轻链(lightchain,L),由大约 220 个氨基酸组成,分子量约 22.5kD。4 条肽链通过链间二硫键(-S·S-) 连在一起。其结构模式见图 2 -1。
Ig 分子肽链的 N 端,在 L 链 1 / 2 和 H 链 1 / 4 处(约在 110 位前)氨基酸的种类和顺序各不相同,称为可变区(variableregion,V 区);肽链 C 端其余部分的氨基酸,在种类和顺序上彼此间差别不大,称为稳定区或恒定区(constantregion,C 区)。
V 区位于 N 端,H 链和 L 链各有 3 个高变区(hypervariableregion),其中的氨基酸残基种类和顺序特别多变。这此都与识别抗原直接有关,为 Ig 分子的抗原结合部位,故亦称为互补决定区(complementaritydeterminingregion,CDR)。
可变区中的其他氨基酸残基称为构架区(frameworkregion,FR),大约占整个 V 区近 75%,其顺序很少变化(约 5%)。FR 的功能为支持 CDR,并维持 V 区三维结构的稳定性。H 和 L 链的 FR 在某些位置上具有相同的氨基酸残基。根据 VH/VL 氨基酸顺序同源程度的差异,可将 Ig 分为群和亚群。
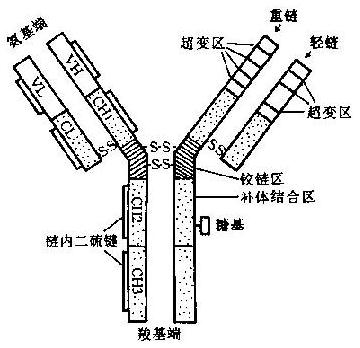
图 2 - 1 免疫球蛋白(IgG)结构模式图
(二)Ig 的三维结构
Ig 分子的每一条肽链,都由链内二硫键将相邻的二级结构单元折叠成球形局部性区域(图 2 -2);每个球形区约由 110 个氨基酸残基组成,不同 Ig 分子对应球形区的氨基酸残基顺序具有高度的相似性,因此称为同源区(domain)。IgG、IgA 和 IgD 分子共有 12 个同源区,其中 Lκ 或 Lλ 各 2 个:VL 和 CL;H 链各 4 个:VH、CH1、CH2 和 CH3。IgM 和 IgE 分子各有 14 个同源区,因为其 H 链上多一个 CH4。虽然 H 链和 C 区的不同区域彼此同源,并且与 L 链的 CL 同源,但它们与 V 区的氨基酸排列顺序极少相同,说明 V 区和 C 区是由不同的基因(V 基因和 C 基因)分别编码的。每个同源区担负着一定的免疫功能,因而也称为功能区(fumctionalregion)。可变区中的氨基酸排列顺序呈高度变异性,其高变区对应的 VL 和 VH 形成袋状,随氨基酸残基的不同形状各异,以能与多种多样的抗原决定簇相适应,构成抗体特异性的分子基础。同时 CH 和 CL 区的氨基酸排列顺序相对稳定,又适应其发挥许多特定的生物学效应,如固定补体和调节 Ig 分解代谢率等功能位于 CH2,而亲和细胞的功能则在 CH3 或 CH4。
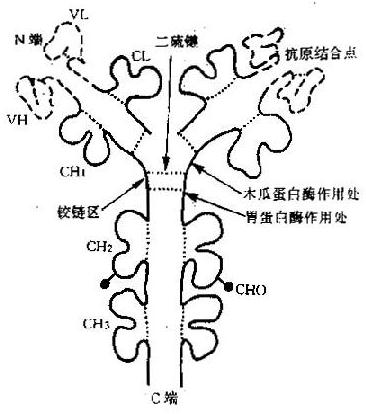
图 2 - 2 免疫球蛋白(IgG)的功能区示意图
在重链 CH1 和 CH2 之间的区域富含脯氨酸和半胱氨酸和半胱氨酸,这两类氨基酸的游离基团少,几乎不与邻近的区域形成固定的二级或三级结构。这一自由柔曲的肽段称为铰链区(hingeregion)。该区结构的柔韧性允许抗体分子的抗原结合部位随意改变方向,使抗体分子结合抗原的能力大大增强。同时也因 Ig 变构而使补体结合点暴露出来。
(三)Ig 的水解片段
Ig 分子可被许多蛋白酶水解,产生不同的片段;免疫学研究中常用的酶是木瓜蛋白酶 (papain) 和胃蛋白酶(pepsin)。
木瓜蛋白酶在生理 pH 下将 IgG 分子从 H 链二硫键 N 端 219 位置上断裂,生成两个相同的 Fab 片段和一个 Fc 片段(图 2 -3)。Fab 段即抗原结合片段 (antigenbindingfragment),含 1 条完整的 L 链和 H 链的一部分(Fd) 段,分子量为 45kD;Fab 段仍具有抗原结合活性,但结合能力较弱,只有一价。Fc 段即可结晶片段(crystallizablefragment),为 2 条 H 链 C 端剩余的部分,分子量 55Kd,在一定条件下可形成结晶。Fc 段不能与抗原结合,但具有许多其他生物学活性,如固定补体、亲和细胞(巨噬细胞、NK 细胞和粒细胞等)、通过胎盘、介导与细菌蛋白(如蛋白 A 和 G)的结合,以及与类风湿因子反应等。
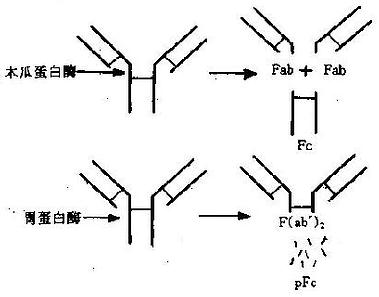
图 2 -3IgG 分子的水解片段模式图
胃蛋白酶于于低 pH 下可将 IgG 分子从 H 链间二硫键 C 端 232 位置切断,形成含 2 个 Fab 段的 F(ab')2片段和 1 个较小的 pFc'片段。F(ab')2段即双价抗体活性片段,经还原后可得 2 个 Fab'。Fab'的分子量略大于 Fab,而生物活性与 Fab 相同。pFc'比 Fc 分子量小,虽然仍保持亲和巨噬细胞及与某些类风湿因子结合的能力,但失 Fc 片段原有的固定补体等活性。
(四)Ig 的辅助成分
1.连接链除了 H 链和 L 链外,多聚体形式的 Ig 分子如 IgA 和 IgM 尚含 1 分子连接链(joiningchain,J 链);但单体 IgA 或 IgM 单体均无 J 链。J 链在连接单体形成多聚体 Ig 分子中并非必要,但可能与保持已形成的多聚体的稳定性有关。人类 J 链的分子量约 15kD,与其他物种的 J 链有高度同源性。J 链基因并不是 Ig 基因簇的一部分,它定位于 15 号染色体。J 链有仅产生于合成 IgA 和 IgM 的浆细胞,而且也产生于合成 IgG 的未成熟浆细胞,但它并不与 IgG 分子结合。
2.分泌片在分泌型 IgA 分子中还含有 1 个分泌成分 (secretorycomponent,SC),或称分泌片(secretorypiece,SP), 是上皮细胞上的多免疫球蛋白受体(polyimmunoglobulinreceptor,poly-IgR) 的一部分,Poly-IgR 为免疫球蛋白超族)Igsuper-family)的一个成员。此受体由上皮细胞产生后,与多聚体 IgA 牢固结合;IgA-poly-IgR 复合物由上皮细胞内输出的过程中,受体分子被蛋白酶裂解,仍附着于 Ig 的剩余部分即为分泌片。游离分泌片的分子量为 80Kd,借二硫键与 SigA 共价结合。分泌片的功能是保护 SigA 分子不被分泌液片内的蛋白酶降解,从而使 SigA 在粘膜表面保持稳定和有利于其发挥生物活性。
第二节 免疫球蛋白的血清型
免疫蛋白为大分子蛋白质,具备抗原的各种性质,对异种、同种异体,甚至宿主自身都是良好的抗原,而且是一个抗原复合体,带有多种抗原决定簇。Ig 分子的这种异质性反映了抗体形成细胞的遗传性差异,代表抗体分子在不同水平上的遗传变异性;通常可用血清学方法检测出来,并据此将 Ig 及其肽链(H 和 L 链)分成不同的血清学类型。
需要指出的是,在正常状态下,1 个 Ig 分子的 2 条 H 链是均一的,2 条 L 链也是均一的,在任何层次上都不会出现 2 条链不同类或不同型的情况。
(一)同种型
同种间所有正常个体都具有的 Ig 抗原特异性,称同种型(isotype)。包括 IgH 链的类和亚类及 L 链的型和亚型,以及 VH/VL 的群和亚群的抗原;亦即同种生物所有正常个体都有各类、亚类及不同型别、群和亚群等多种 Ig 的变异体。这种同种型变异体并不具有个体特异性。
1.类和亚类依 H 链 C 区的结构和抗原性的不同,可将 H 链分为 α、γ、δ、ε 和 μ5 类,相应 Ig 分子也分为 5 类,分别为 IgA、IgG、IgD、IgE 和 IgM。有的同类 H 链 C 区之间的氨基酸顺序仍有一些差别,再分成若干亚类;例如 IgG 可以分为 4 个亚类:IgG1、IgG2、IgG3 和 IgG4;IgA 可分成 2 个亚类:IgA1 和 IgA2(表 2 -1)。
表 2 -1Ig 的类型及其理化特点
| 性状 | IgG | IgA | IgM | IgD | IgE |
| 分子量(kD) | 150 | 160,400 | 900 | 180 | 190 |
| 沉降系数(S) | 7 | 7,11 | 19 | 7 | 8 |
| 电泳位置 | γ | γ~β | γ~β | γ | γ |
| 含糖量(%) | 3 | 8 | 10 | 10 | 12 |
| 重链类别 | γ | α | μ | δ | ε |
| 重链亚类 | γ1~4 | α1,α2 | - | - | - |
| 重链同种异型 | Gm(>20) | Am(2) | - | - | Em(1) |
2.型和亚型根据 L 链和 C 区的结构和抗原性的不同,可将 L 链分为 κ 和 λ 两型。λ 类 κ 链只有 1 个同种异型;但 λ 链至少有 4 种非等位(同种型)基因的产生,为 λ 链上一定位置的 1 个氨基酸置换而形成的变异体。例如 Kern(+)指链上第 150 位是甘氨酸,而 Kern(-)则为丝氨酸;Oz(+)为第 190 位上是赖氨酸,Oz(-)为精氨酸。
(二)同种异型
同种不同个体间 Ig 结构和抗原性的差异称同种异型(allotype)。与同种型的区别在于,同种异型的特异性只存在于同种的某些个体中,而同种型的特异性则普遍存在同一物种的所有个体。同种异型表位在 C 区,由同一基因位点上几个等位基因控制,反映在 CH 和 CL 上只有 1~2 个氨基酸的差异。这此关键氨基酸构成的同种异型抗原称为遗传标志。它包括与 H 链相关的 Gm、Am、Em 系统和与 L 链相关的 Km 系统。Gm 是 γ 链(γ4 除外)上的同种异型标志,由许多种不同抗原决定簇组成,用字母或数字命名。Am 为 IgA2 亚类 α2 链标志,有 2 种 Am 特异性。Km 有 Km1、Km2、Km3 三种,是 κ 链 C 区 153 和 191 位氨基酸残基置换的结果。在入 λ 链中尚未发现同种异链标志。
(三)独特型
同一种属某一个体产生的抗体分子具有独特的抗原决定簇,不但与其他个体受同一抗原刺激产生的特异性抗体不同,而且与自身其他特异性抗体也有区别,称为独特型(idiotype)。独特型是单克隆的,其抗原决定簇位于 V 区,与高变区决定簇的互补空间相关联,反映 Ig 分子高变区抗原决定簇的差异。
独特型抗原可用抗独特型抗体直接特异性检出。抗独特型抗体有两型,一为直接与抗体分子的抗原结合部位决定簇反应,从而能阻断抗原结合,成为抗原内影像,可作为抗独特型抗体疫苗;另一针对抗原结合部位以外的 V 区其他决定簇。虽然 Ig 分子 V 区球形构象提示抗体高变区、抗体的抗原结合部位和抗体的独特型决定簇三者关系密切,但不完全重合。一些独特型抗原与抗体活性无关。抗独特型抗体可因单独的 H 和 L 链或肽链的 V 而产生,亦即独特型决定簇或称独特位(idiotope),可完全位于 H 和 L 链的结合体。
Ig 分子的独特型抗原具有自身免疫原性,在正常免疫应答过程中产生抗独特型抗体(Ab2),这种抗抗体再生引发另一 B 细胞产生抗 Ab2 抗体(Ab3),如此继续下去,独特型和抗独特型将整个抗体产生系统联成一个网络,称为独特型网络(idiotypicnetwork)。独特型网络在免疫应答的调控中起重要作用。
第三节 免疫球蛋白的生物学活性
免疫球蛋白的重要生物学活性为特异性结合抗原,并通过重链 C 区介导一系列生物学效应(表 2 -2),包括激活补体、亲和细胞而导致吞噬、胞外杀伤及免疫炎症,最终达到排除外来抗原的目的。
(一)抗原结合作用
抗体分子在结合抗原时,其 Fab 片段的 V 区与抗原决定簇的立体结构(构象)必须吻合,特别与高变区的氨基酸残基直接有关,所以抗原-抗体的结合具有高度特异性。
尽管某些氨基酸残基在肽链的氨基酸顺序上相距很远,但由于肽链沿功能区长轴平行方向往返折叠,使他们能紧紧接近,形成一双层排布的凹形或袋状包围抗原的活性部位,双层间存在许多硫水氨基酸侧链。抗体分子与抗原的相互作用靠各种非共价力,如氢键、静电引力和 VanderWaal 力等,是一种可逆性反应。抗体与抗原结合后才能激活效应功能,天然 Ig 分子不能起这种作用。但在无抗原存在时,某些物理处理(例如加热、凝聚等)也可模拟 Ig 分子构象的变化而起激活效应机制的作用。
(二)补体活化作用
补体 C1q 与游离 Ig 分子结合非常微弱,而与免疫复合物中的 IgG 或 IgM(经典途径)或凝集 Ig(替代途径)结合则很强。C1q 与 IgGFc 段的 CH2 功能区起反应,其结合位点在 3 个氨基酸侧链上。所有 IgG 亚类的单独 Fc 片段对 C1q 具同样的亲和性;但完整蛋白则主要是 IgG1 和 IgG3 才能结合 C1q 结合的影响有关。
IgM 激活补体能力最强。IgG 至少需两紧密并列的分子才能有效地激活 C1q,而 IgM 单个分子在结合抗原后即可激活补体。循环 IgM 仅显示低亲和性的单个 C1q 结合点,与 IgG 的效能相近似;但当 IgM 分子与大分子抗原的多个决定簇结合后,改变其构象呈钩环状,以致暴露了原来被相近亚单位隐蔽的 C1q 结合点而增强了激活补体的能力。
IgG4、IgA1 和 IgA2 虽不能通过经典途径激活补体,但其 Ig 聚合物均可激活 C3 旁路。
(三)亲细胞作用
IgG 分子能与细胞表面的 Fc 受体结合。这些受体均属 Ig 超族成员,主要有 FcγRⅠ(CD64)、FcγRⅡ(CD32)和 FcγRⅢ(CD16)。FcγRⅠ在单核细胞表面很丰富,中性粒细胞受适当细胞因子调节以后也可表达此受体;FcR 为一高亲和性受体,与 IgG1 和 IgG3 有很强的结合性,与 IgG4 也可作用,但与 IgG2 则不能结合。FcγRⅡ和 FcγRⅢ受体在很多细胞上都存在,包括中性粒细胞、嗜酸性粒细胞和血小板,与 IgG1 和 IgG3 有低亲和相互作用。活化 B 细胞表面有一个 IgM 结合蛋白(FcμR),但在 T 细胞、单核细胞或粒细胞都没有。在单核细胞和中性粒细胞表面有 FcαR,因而 IgA 亦有调理素作用。近年有 T 细胞上存在 IgD 受体的报道,但其意义仍不基清楚。FcεRⅠ受体存在于肥大细胞和嗜碱性粒细胞上;在 B 细胞、巨噬细胞、嗜酸性粒细胞和血小板上有 FcεRⅡ,它们的相互作用与调节 IgE 应答有关。
细胞通过表面 Fc 受体与相应 Ig 结合后,可诱发一系例的生物效应,不同细胞的效应不同。例如在单核-巨噬细胞和中性粒细胞可促进其吞噬功能,称为调理作用(opsonization);在 NK 细胞和巨噬细胞或诱导抗体依赖性细胞介导的细胞毒作用(ADCC);在肥大细胞和嗜碱性粒细胞可诱导Ⅰ型变态反应等等。
(四)其他生物活性
1.结合 A 蛋白和 G 蛋白人类 IgG1、IgG2 和 IgG4 的 Fc 段可结合葡萄球菌 A 蛋白,其结合位点在 IgG 的 CH2~CH3 之间;黄种人的 IgG3 也可结合 A 蛋白,而在白种人则不能,可能因为其 IgG3 的组氨酸被精氨酸置换。链球菌 G 蛋白可与人 IgG 的个亚类结合,也可与几乎所有哺乳动物的 IgG 结合,其结合能力远比葡萄球菌 A 蛋白强。但是这两种蛋白对其他类的 Ig 均无亲和力。
2.透过细胞膜人的 IgG 可通过胎盘传递至胎儿的血液循环,这不是被动的扩散,而是由 IgG 的 Fc 段选择性地与胎盘微血管发生可逆结合透过;这种特性仅为 γ 链所特有,其他类 Ig 不具备这种能力。IgA 通过与分泌成分的结合可以从粘膜下转运至外分泌液中,例如转运至肠道和乳汁中。
第四节 各类免疫球蛋白的特点
五类免疫球蛋白都有结合抗原的共性,但它们在分子结构、体内分布、血清水平及生物活性等方面又各具特点(表 2 -2)。
表 2 - 2 五类 Ig 的代谢、分布及生物活性
| 性状 | IgG | IgA | IgM | IgD | IgE |
| 血清含量(mg/dL) | 1200 | 200 | 120 | 3 | 0.04 |
| 相对含量(%) | 75~85 | 10~15 | 5~10 | 0.05 | 0.03 |
| 合成率(mg/kg·d) | 33 | 24 | 7 | 0.4 | 0.02 |
| 分解率(%/d) | 7 | 25 | 8 | 37 | 71 |
| 半衰期(d) | 23 | 6 | 5 | 3 | 2 |
| 血管内分布(%) | 50 | 50 | 80 | 75 | 50 |
| 外分泌液中 | - | + | ± | - | + |
| 结合补体 | + | - | + | - | - |
| 透过胎盘 | + | - | - | - | - |
| 与肥大细胞结合 | (IgG4) | - | - | - | + |
| 与 Mφ 和 B - C 结合 | + | - | - | - | + |
(一)IgG
IgG 为标准的单体 Ig 分子,含 1 个或更多的低聚糖基团,电泳速度在所有血清蛋白中最慢。IgG 是再次免疫应答的主要抗体,具有吞噬调理作用、中和毒素作用、中和病毒作用、介导 ADCC、激活补体经典途径、并可透过胎盘传输给胎儿;IgGFc 片段可结合类风湿因子及其他抗 γ 球蛋白抗体,致敏异种(豚鼠)皮肤;还有抗核抗体、抗 Rh 抗体、肿瘤封闭抗体等均属 IgG;因而 IgG 有多能免疫球蛋白之称。
IgG 合成速度快、分解慢、半衰期长,在血内含量最高,约占整个 Ig 的 75%;各亚类所占比例大约为:IgG160%~70%,IgG215%~20%,IgG35%~10%,IgG41%~7%,各亚类的比例随年龄及遗传背景而有变化;同时各亚类的生物学和免疫学性质也不尽相同(表 2 -3)。
表 2 -3IgG 各亚类的生物活性
| 性状 | IgG1 | IgG2 | IgG3 | IgG4 |
| 激活补体 | ++ | + | +++ | - |
| 透过胎盘 | +++ | +++ | +++ | +++ |
| 结合 FcγRⅠ | +++ | - | +++ | ++ |
| 结合 FcγRⅡ | +++ | + | +++ | - |
| 结合 FcγRⅢ | +++ | - | +++ | - |
| 结合 A 蛋白 | +++ | +++ | ± | +++ |
| 结合 G 蛋白 | +++ | +++ | +++ | +++ |
| 结合类风湿因子 | ++ | ++ | ++ | ++ |
| 致敏异种皮肤 | ++ | - | ++ | ++ |
| 中和毒素 | +++ | + | + | ++ |
| 抗 Rh 抗体 | +++ | - | +++ | - |
(二)IgM
IgM 为五聚体,是 Ig 中分子最大者。分子结构呈环形,含一个 J 链,各单位通过 μ 链倒数第二位的二硫键与 J 链互相连接。结构模式见图 2 -4。μ 链含有 5 个同源区,其 CH3 和 CH4 相当于 IgG 的 CH2 和 CH3,无铰链区。
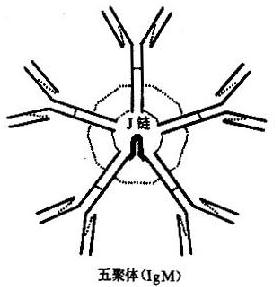
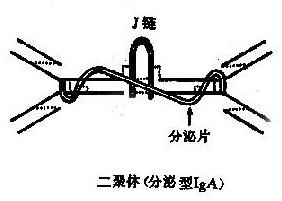
图 2 - 4 免疫球蛋白多聚体结构
从化学结构上看,IgM 结合抗原的能力可达 10 价,但实际上常为 5 价,这可能是因立体空间位阻效应所致。当 IgM 分子与大颗粒抗原反应时,5 个单体协同作用,效应明显增大。IgM 凝集抗原的能力比 IgM 大得多,激活补体的能力超过 IgG1000 倍;由于吞噬细胞缺乏 IgM 的特异受体,因而 IgM 没有独立的吞噬调理作用;但当补体存在时,它能通过 C3b 与巨噬细胞结合以促进吞噬。虽然 IgM 单个分子的杀菌和调理作用均明显高于 IgG 抗体,但因其血内含量低、半衰期短、出现早、消失快、组织穿透力弱,故其保护作用实际上常不如 IgG。
血型同种凝集素和冷凝集素的抗体类型是 IgM,不能通过胎盘,新生儿脐血中若 IgM 增高,提示有宫内感染存在。在感染或疫苗接种以后,最先出现的抗体是 IgM;在抗原的反复刺激下,可通过 Ig 基因的类转换而转向 IgG 合成。当分泌物中 IgA 缺陷时,IgM 也和 IgA 一样可结合分泌片而替代 IgA。IgM 也是 B 细胞中的主要表面膜 Ig,作为抗原受体而引发抗体应答。
(三)IgA
IgA 分为血清型和分泌型两种类型。
大部分血清 IgA 为单体,大约 10%~15%为双聚体,也发现少量多聚体。IgA 功能区的分布与 IgG 十分相似,两个亚类(IgA1 和 IgA2)的最大差异在铰链区。IgA2 缺少 H - L 链间二硫键区域,容易被解离分开。从含量、稳定性和半衰期看,血清型 IgA 虽不如 IgG,但高于其他类 Ig。IgA 可以结合抗原,但不能激活补体的经典途径,因此不能象 IgG 那样发挥许多的生物效应,所以过去曾误以为血清型 IgA 的意义不大;近年的研究发现,循环免疫复合的抗体中有相当比例的 IgA,因而认为:血清型 IgA 以无炎症形式清除大量的抗原,这是对维持机体内环境稳定的非常有益的免疫效应。
分泌型 IgA(SigA)为双聚体,沉降系数 11S,分子量 400kD。每一 SigA 分子含一个 J 链和一个分泌片(图 2 -4)。α 链、L 链和 J 链均由浆细胞产生,而分泌片由上皮细胞合成。J 链通过倒数第二位二硫键将 2 个 IgA 单体互相连接;结合分泌片后 SIgA 的结构更为紧密而不被酶解,有助于 SIgA 在粘在粘膜表面及外分泌液中保持抗体活性。外分泌液中的高浓度 IgA 主要为局部合成,特别是在肠相关淋巴样组织(GALT)内。
分泌型 IgA 性能稳定,在局部浓度大,能抑制病原体和有害抗原粘附在粘膜上,阻挡其进入体内;同时也因其调理吞噬和溶解作用,构成了粘膜第一线防御机制;母乳中的分泌型 IgA 提供了婴儿出生后 4~6 月内的局部免疫屏障;因此常称分泌型 IgA 为局部抗体。有关 SIgA 的免疫作用参见第七章。
(四)IgD
IgD 的分子结构与 IgG 非常相似,有明显的铰链区,其蛋白质高度糖基化。IgD 性能不稳定,在分离过程中易于聚合,又极易被酶裂解。虽然有些免疫应答可能与特异性 IgD 抗体有关,但它并不能激活任何效应系统。某些自身免疫病及过敏反应病患者血中存在 IgD 类抗核抗体或抗青霉素 IgD 抗体。正常人血清内 IgD 浓度很低,但在血循环内 B 细胞膜表层可检出 IgD,其功能主要是作为 B 细胞表面的抗原受体。在 B 细胞发育的某些阶段,膜 IgD 的合成增强。大部分慢性淋巴细胞白血病病人 B 细胞表面带膜 IgD,并常同时有膜 IgM。
(五)IgE
IgE 为单体结构,分子量大于 IgG 和单体 IgA,含糖量较高,ε 链有 6 个低聚糖侧链。象 IgM 一样,IgE 也有 5 个同源区,CH2 功能区置换了其他类重链的铰链区。正常人血清中 IgE 水平在 5 类 Ig 中最低,分布于呼吸道和肠道粘膜上的 IgE 稍多,可能与 IgE 在粘膜下淋巴组织内局部合成有关。IgE 水平与个体遗传性和抗原质量密切相关,因而其血清含量在人群中波动很大,在特应性过敏症和寄生虫感染者血清中 IgE 水平可升高。IgE 不能激活补体及穿过胎盘,但它的 Fc 段能与肥大细胞和嗜碱性粒细胞表面的受体结合,介导Ⅰ型变态反应的发生,因此又称亲细胞抗体。
第五节 免疫球蛋白的基因及抗体形成
免疫球蛋白反应的特异性和分子的多样性是受基因支配;一条肽链的 C 区和 V 区分别由 C 基因和 V 基因编码。任何一个 B 细胞都有 3 个独立的 Ig 基因簇:1 个 H 链基因簇和 2 个 L 链基因簇(κ 和 λ),构成 Ig 的结构基因;在 B 细胞分化成熟过程中进行基因重排,进而转录与翻译,形成抗体。
(一)Ig 基因的结构
1.重链基因人类重链基因位于第 14 号染色体上,基因结构非常复杂,分为 4 个不连续的基因节段,从着丝点 5'末端起依次为:可变区(VH)基因、多样性区(diversityregion,DH)基因、接合区(JH)基因和稳定区(CH)基因(图 2 -5)。
V 区基因分成 6 个亚群,在 2500kD 的区域内排列有 100~200 个基因。某些大亚群如 VHⅢ含有约 25~30 个基因,而某些小亚群如 VHⅤ或 VHⅥ仅含一个或几个基因。每个 V 基因由一个大的外显子和一个位于前导顺序后的内含子(约 100~150bp)组成,前导顺序编码一种疏水肽,指引 Ig 肽链的转膜作用,V 基因 3 末端是重组酶信号。在 VH 座内还有一些不具表达功能的假基因。
C 基因结构约 200kb,含有 11 个基因。第一个 CH 为 Cμ,以后依次为:Cδ、Cγ3、Cγ1、φε1、Cα1、φγ、Cγ2、Cγ4、Cε、Cα2。其中 φε1(φε2 不在第 14 号染色体上)和 φγ 是两个假基因。除 Cδ 基因外,其他 CH 基因上游都有一个转换(S)顺序,负责 H 链的类转换。临床正常个体的 CH 座位内可有大片缺失,这种无免疫缺陷症状的个体可能是通过细胞选择在免疫应答中补偿这种基因缺失。
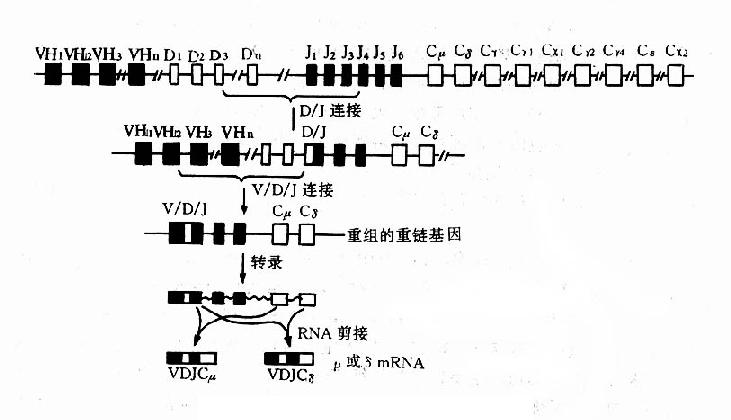
图 2 -5Ig 重链基因及重组示意图
每个 CH 基因的外显子分别编码相应 H 链的功能区,由内含子将其隔开。如 Cμ 基因有 4 个外显子各自编码链 C 区上的 Cμ1、Cμ2、Cμ3 和 Cμ4 四个功能区。除上述主要的 CH 基因外,还有其他编码不同形式 Ig 分子的基因,例如分别编码分泌 IgM 和膜 IgM 的 μs 和 μm 基因;前者是 Cμ45'端的外加部分,编码 μs 链 C 端 20 个氨基酸;后者位于 Cμ 基因下游,含 2 个外显子,共同编码 μm 链 C 端 41 个氨基酸。
V 和 C 基因被中间的另两个基因节段分开,即 D 基因和 J 基因。J 区有 6 个功能基因和 3 个假基因;D 区的基因数目尚未确定,但至少不下 20 个。D 和 J 基因参与重链 V 区的编码,负责其羧基端的一段氨基酸顺序。
2.轻链基因轻链的基因比重链的基因结构简单,仅有 V 区和 J 区而无 D 基因节段。κ 链和 λ 链的基因互不相同(图 2 -6)。
人类 κ 链基因位于第 2 号染色体上。Cκ 基因只有一个,邻近上游的 J 区座位内有 5 个 Jκ 基因,Vκ 基因节段大约有 80 个 Vκ 基因,约一半以上可能是假基因。
λ 链基因位于第 22 号染色体上。Cλ 基因簇比 Cκ 基因复杂得多,至少有 6 个非等位基因,其中 2 个为假基因;每个功能 Cλ 基因前均有一个(或更多)相关的 Jκ 基因;对 Vλ 基因库目前所知甚少,其基因数目尚不清楚。
轻链的 J 基因参与 V 区肽链的编码,大约负责十几个氨基酸的顺序。
(二)Ig 基因的重排
胚系状态的 Ig 基因,无论是重链基因还是轻链基因,都不能作为一个独立的单位进行表达,只有经过重排以后才能成为具有表达功能的基因。在成熟 Ig 基因的产生过程中,Ig 基因的重排需遵循一定的顺序,先由 V - J 连接或 V -D- J 连接,然后由 VJ 或 VDJ 与 C 区基因连接(图 2 -5)。在重链,还可以发生类转换。
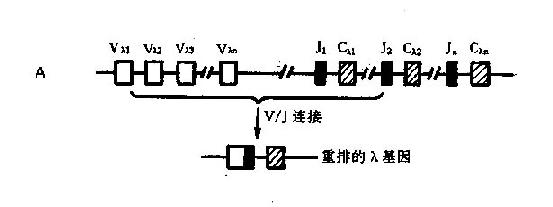
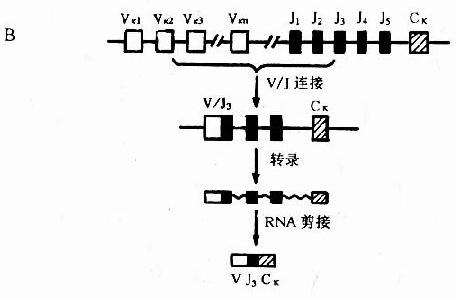
图 2 -6Ig 轻链基因及其重组
A:λ 基因;B:κ 基因
1.V- J 或 V -D- J 连接轻链的 V - J 连接和重链的 V -J- D 连接都是在 DNA 水平发生,均由重组酶介导。V- J 或 V -D- J 的组合都是随机的;重组后的 V - J 编码轻链的 V 区,V-D- J 编码重链的 V 区。
V- J 基因重排是通过 V 区 3'端和 J 区 5'端旁的特殊顺序使 V - J 靠扰并提供酶切信息,实现 V 基因和 J 基因结合成为 V - J 基因单位。这种 V - J 重排是随机性的。V 基因节段中任何一个 V 基因可与任何一个 J 基因重排结合。被结合的 J 基因上游的 J 基因丢失,下游的 J 基因保留。
V-D- J 重排中,除 V3'端和 J5'端旁侧外,D 两侧亦有上述特殊识别顺序在起作用。V-D- J 连接中往往是 DJ 结合先于 VD 结合。与 V - J 连接一样,V-D- J 重排也具有不精确性。还有严重排为功能性连接的 VH 被其中游胚系状态(未重排)的 VH 所替换。这可能是扩大基因容量和保证胚系状态的 VH 基因能全部利用的一种机制。
在 B 细胞成熟过程中,Ig 基因存在重排的等级(hierarchy)现象。在多能造血干细胞分化发育成为幼稚 B 细胞(又称前 B 细胞)时,就发生 V -D- J 重排,开始表达 H 链,邻近 J 基因的 Cμ 自然随之表达,这是顺序优先的结果。由于 Cμ 基因和 Cδ 基因间的距离很短,两者可以同时得以转录;V-D- J 在 RNA 水平既可与 C 结合,也可与 Cδ 结合,使 IgM 和 IgD 在单个 B 细胞上协同表达,而并非缺失性类转换。以后 κ 基因开始 Vκ 和 Jκ 重排,产生 κ 链。
2.重链类转换类转换是在 DNA 水平上 V -D- J 与 CH 基因连接由 Cμ 和 Cδ 转换成其他 CH 基因的过程,是其他 CH 基因上游的 S 顺序间发生重组的结果。S- S 重组导致重组 S 顺序间的所有 DNA 基因丢失,例如 Sμ 与 Sγ1 间发生转换,则 Cμ、Cδ 和 Cγ3 基因及其侧面的顺序均一起丢失,使 V -D- J 连接由一个 CH 重新定位于另一个 CH。类转换只变换 Ig 的类别,不改变抗体的特异性。
(三)Ig 基因的表达及 Ig 分子的分泌
Ig 的合成过程与一般蛋白质合成相似。在细胞内有表达功能的 V - J 或 V -D- J 基因单位重组完成后,与 C 基因簇一起被转录成初级 RNA,经过加工剪接,去除内含子,生成 mRNA,最后分别翻译成各种肽链,装配成 Ig 分子,分泌出体外。
Ig 基因在表达时存在等位排斥(allelicexclusion)和同型排斥(isotypicexclusion)现象,可能是 V -D- J 连接或 V - J 连接的不精确性所造成的结果,以致许多重排无转录产物。一个 B 细胞不会同时表达 κ 链和 λ 链,称同型排斥。κ 基因重排总发生在 λ 基因重排之前,当 Vκ-Jκ 重排形成有表达功能的基因后,λ 基因重排即被抑制;在 λ 链产生细胞内,常有 κ 基因缺失。象其他的基因一样,Ig 基因的表达过程中也有启动子与增强子来启动和调节基因的转录。
B 细胞在接受抗原刺激后迅速分化增殖,除一部分分化记忆细胞外,其余分化为浆细胞。浆细胞在内质网和多聚糖体均显著增加,大量合成 Ig 分子。合成 L 与 H 链的粗面内质网多聚核糖体是不同的。L 链在 190~200S 的多聚核糖体(含 4~5 个核糖体)上合成,H 链在 270~300S 的多聚核糖体(含 11~18 个核糖体)上合成。作为一条完整的多肽链,它们从一个起始点(N 端)开始(向 C 端)依次合成。游离的 L 和 H 链少数在多聚核糖体上就有非共价结合或共价结合,大部分转移至内质网的贮池中,并装配成完整的 Ig 分子,然后依赖 N 端疏水性前导顺序进入高尔基复合体,再分泌至细胞外。在此移动过程中糖残基通过结合在膜上的糖转化酶按一定顺序逐步加到 Ig 分子上。
(四)抗体分子的多样性
一个机体何以能产生多达 106~108种具有不同抗体特异性的 Ig 分子,其机制至今虽未完全清楚,但从基因的结构组成及重排中可找到一些答案。众多 V 区基因和一个或少数几个 C 区基因不连续地排列在染色体上,它们在 DNA 水平随机地结合是 Ig 分子多样性的基础,而体细胞突变又可增大 V 区的库容。
多样性程度可以通过 Ig 基因在染色体内重组时 V - J 与 V -D- J 的乘积来计算:当 100 个 Vκ 和 5 个 Jκ 重组时所产生的多样性至少是 100×5=5×102个;V-D- J 重排时 100 个 VH 与 10 个 DH 和 6 个 JH 连接所的生的多样性至少有 100×10×6=6×103。同时连接这些基因时还会发生不精确性而使多样性增加,因而由 κ 链和 H 链组成的抗体分子的多样性最少有 5×102×6×103=3×106之多。另外,在 V -J、V-D- J 连接过程中发生的碱基缺失和插入又扩大了多样性的程度。
第三章 补体系统
第一节 补体系统的组成和性质
补体(complement,C)是存在于人和脊椎动物血清及组织液中的一组具有酶样活性的球蛋白,加上其调节因子和相关膜蛋白共同组成一个反应系统枣补体系统。补体系统参与机体的抗感染及免疫调节,也可介导病理性反应,是体内重要的免疫效应系统和放大系统。
(一)补体系统的组分及命名
补体系统包括 30 余种活性成分,按其性质和功能可以分为三大类:①在体液中参与补体活化级联反应的各种固有成分;②以可溶性形式或膜结合形式存在的各种补体调节蛋白;③结合补体片段或调节补体生物效应的各种受体。
1968 年 WHO 命名委员会对补体系统进行了统一命名。参与补体激活经典途径的固有成分按其被发现的先后顺序分别称为 C1、C2、……C9,C1 由 C1q、C1r、C1s 三种亚单位组成;补体系统的其他成分以英文大写字母表示,如 B 因子、D 因子、P 因子、H 因子等;补体调节成分多以其功能进行命名,如 C1 抑制物、C4 结合蛋白、衰变加速因子等;补体活化后的裂解片段以该成分的符号后面加小写英文字母表示,如 C3a、C3b 等;具有酶活性成分或复合物在其符号上划一横线表示,如 C1、C3bBb 等;灭活的补体片段在其符号前面加英文字母 i 表示,如 iC3b 等。
(二)补体组分的理化性质
补体的大多数组分都是糖蛋白,且多属于 β 球蛋白;C1q、C8 等为 γ 球蛋白,C1s、C9 为 α 球蛋白。正常血清中各组成分的含量相差较大,C3 含量最多,C2 最低。各种属动物间血中补体含量也不相同,豚鼠血情中含有丰富的补体,故实验室多采用豚鼠血作为补体来源。
补体性质不稳定,易受各种理化因素影响,例如加热 65℃30min 即被灭活。另外紫外线照射、机械振荡或某些添加剂等理化因素均可能破坏补体。所以补体活性检测标本应尽快地进行测定,以免补体失活。补体系统各组成分的主要理化性质见表 3 -1。
表 3 -1 补体成分及其主要理化性质
| 分子量(kD) | 血清浓度(μg/ml) | 电泳位置 | 肽链数目 | |
| 经典途径成分 | ||||
| C1q | 410 | 75 | γ | 18 |
| C1r | 85 | 50 | β | 1 |
| C1s | 85 | 50 | α2 | 1 |
| C4 | 210 | 200~500 | β1 | 3 |
| C2 | 110 | 20 | β1 | 1 |
| C3 | 195 | 550~1200 | β1 | 2 |
| C5 | 19 | 70 | β1 | 2 |
| C6 | 128 | 60 | β2 | 2 |
| C7 | 121 | 60 | β2 | 1 |
| C8 | 155 | 60 | γ | 1 |
| C9 | 79 | 60 | α | 1 |
| 替代途径成分 | ||||
| B 因子 | 93 | 200 | β1 | 1 |
| D 因子 | 25 | 1~2 | α | 1 |
| 备解素 | 220 | 25 | γ | 1 |
| 可溶性调节蛋白 | ||||
| C1 抑制物 | 104 | 200 | α2 | 1 |
| I 因子 | 88 | 35 | β | 2 |
| H 因子 | 150 | 480 | β | 1 |
| S 蛋白 | 8.3 | 505 | β | 1 |
| Sp40/40 | 0.08 | 50 | α | 2 |
| C4 结合蛋白(C4Bp) | 550 | 250 | γ | 8 或 10 |
| 过敏毒素灭活因子 | 300 | α | ||
| 膜结合调节蛋白 | ||||
| 促衰变因子(DAF) | 70 | 1 | ||
| 膜辅助蛋白(MCP) | 45~70 | 1 | ||
| 同种限制因子 | 65 | |||
| 膜反应溶解抑制因子 | 18 |
(三)补体成分的分子结构
1.C1 是由 C1q、C1r、C1s 三个糖蛋白亚单位组成,有 Ca2+存在时形成巨分子复合体,病理状态下可有单体形式存在。C1q 是补体成分中最大的分子,分子量为 410kD,化学组成为胶原蛋白,由 18 条多肽链组成,肽链间借二硫键相连接,多肽链的末端呈球形,每 3 条不同的多肽链(α,β,γ)组合在一起形成 6 个亚单位,可与 6 个 IgG 分子结合,其结合部位在球状的头部(图 3 -1)。
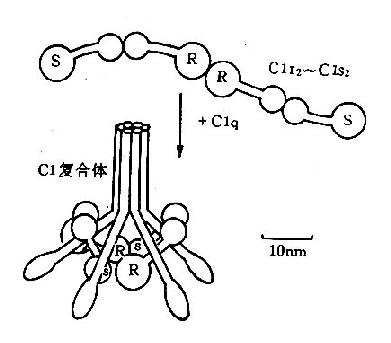
图 3 -1 C1 分子模式图
C1r 是一种 β 球蛋白,正常时以无活性的酶原样形式存在,有二条相同的非共价键连接的多肽链,C1r 常与 C1s 紧密相联在一起,同时 C1r 还是 C1q 和 C1s 的联桥。C1s 是一种 α2 球蛋白,单链,可被 C1r 激活,C1s 具有酶样活性,在 Mg2+存在时激活 C4 和 C2。
2.C4 是一种 β 球蛋白,由 3 条多肽链组成(α,β,γ),分子量分别是 95kD、78kD 和 33kD。C1s 可将 3 条链中最大的 α 链裂解,释放出一较小的多肽 C4a,余下的大部分结合在靶细胞上,进行补体的下一步活化程序。
3.C2 是一种 β 球蛋白,单链,是血清中含量最少的补体成分。激活的 C2 极不稳定,易衰变,形成补体系统中的一种自身调节机制,以控制补体的激活过程。
4.C3 是一种 β 球蛋白,由 α 和 β 两条多肽链组成(图 3 -2),分子量分别是 110kD 和 75kD。α 链有 998 个氨基酸残基,β 链有 669 个氨基酸残基;两链间以氢键、疏水键及二硫键相连,相互平行。α 链参与 C3 活化,链的第 77 位精氨酸和 78 位丝氨酸之间的肽键是 C3 裂解酶的作用部位。C3 裂解后产生小片段 C3a 和大片段 C3b;C3b 受 H 因子、I 因子和 CR1 的协同作用降解为无活性的 iC3b;iC3b 可以被水解为 C3c 和 C3dg,C3dg 还可被进一步降解成 C3d 和 C3g。
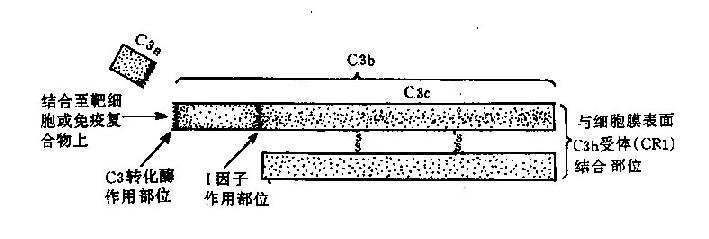
图 3 -2 C3 分子及其裂解产物示意图
C3 呈多样性,有 30 多种异构型。完整的 C3 分子含糖约 2.2%,主要是甘露糖和岩藻糖。C3 在血清中含量甚高,可达 550~120μg/ml。C3 是补体系统中起关键作用的一种成分,所有的补体激活途径均需 C3 的参与。
5.C5 是一种 β 球蛋白,由 2 条多肽链组成,与 C3 相似。α 链被裂解后游离出一小分子具有特殊生物活性的 C3a,其余大部分片段 C5b 参与后续的补体活化。
(四)补体的细胞受体
补体受体(complement receptor,CR)是细胞膜上能与补体成分或补体片段特异性结合的一种表面糖蛋白。许多类型的细胞膜上都具有补体受体,而且在同一细胞膜上可含有不同的受体。现将已发现的几种主要补体受体作简单介绍。
1.C1q 受体 在中性粒细胞、单核细胞、多数 B 细胞等一些细胞的表面发现有 C1q 受体,该受体不与完整 C1 分子中的 C1q 相互作用,但 C1 被 C1NH 解离后则可结合 C1q。受体在结合 C1q 后可活化各种细胞的相应功能,例如氧化代谢、吞噬功能及某些抗体非依赖性的细胞毒作用等。
2.C3 受体 研究最多的是 C3 系列片段受体,最先命名的 CR1~CR4 都是 C3 片段的受体(表 3 -2)。这些受体不能识别循环中的 C3 分子,只选择性地结合 C3 裂解后的片段;而且这种结合作用不能被正常血浆蛋白所封闭。不同片段的受体分布于不同类型的细胞,以 CR1(C3b 受体)的分布较广,可发现在人类红细胞、中性粒细胞、单核-巨噬细胞和 B 细胞上;CR2(C3d 受体)只表达在淋巴母细胞及淋巴细胞上;而 CR3(iC3b 受体)只表达在吞噬细胞上。
如果 C3 片段结合在抗原抗体复合物上,则 C3 受体就是抗原与细胞结合的桥梁;如果结合到吞噬细胞表面,则将促进吞噬细胞对抗原的吞噬,故 CR1 和 CR3 均是吞噬过程中的重要物质。同时,CR1 和 CR2 均是血清酶 I 因子裂解 C3 片段的协同因子;CR3 和 CR4 还是整合素(integrin)家族的成员,在细胞吸附过程中具有重要作用;CR3 缺乏患者血中的吞噬细胞的吸附和吞噬功能明显异常,经常性软组织及皮肤感染,特别是链球菌和铜绿假单胞菌感染。
表 3 -2 C3 片段的细胞受体
| 受体 | 蛋白结构 | 结合片段 | 分布细胞 | 主要功能 |
| CR1 | 单链 15~40kD | C4b/C3b iC3b | 红细胞, 吞噬细胞, 嗜酸性粒细胞等 | 促吞噬作用, 辅助裂解 C3b 成 C3dg |
| CR2 | 单链 140kD | C3d | B 细胞, 少数其他淋巴细胞 | B 细胞分化,EB 病毒受体 |
| CR3 | 双链 265kD | iC3d | 吞噬细胞 | 促吞噬, 辅助 C3bi 降解 |
| CR4 | 双链 254kD | iC3b,C3d | 枯否细胞, 其他吞噬细胞 | 不详 |
| C3aR | ? | C3a,C4a | MN,T-C, 平骨肌, 肥大细胞单核细胞等 | 免疫调节, 过敏毒素 |
| C3eR | ? | C3e | 中性粒细胞 | 引起骨髓中 PMNS 释放 |
补体的可溶性调节蛋白和细胞膜相关蛋白是补体系统的重要组成部分,其主要成分的理化性质见表 3 -1;对补体活化的调节作用见表 3 -3。
第二节 补体系统的活化与调控
补体系统的各组分在体液中通常以非活性状态、类似酶原的形式存在,当受到一定因素激活,才表现出生物活性。补体的激活途径主要有两种,即经典途径(claasicalpathway)和替代途径(alternativepathway)。
(一)经典途径
经典途径是以结合抗原后的 IgG 或 IgM 类抗体为主要激活剂,补体 C1~C9 共 11 种成分全部参与的激活途径。现发现除抗原抗体复合物外,还有许多因子可激活此途径,如非特异性凝集的 Ig、细菌脂多糖、一些 RNA 肿瘤病毒、双链 DNA、胰蛋白酶、纤溶酶、尿酸盐结晶、C- 反应蛋白等。经典活化途径可人为地分成识别、活化和膜攻击 3 个阶段。
1.识别阶段在抗体结合抗原形成复合物后,与 C1q 结合。IgG1、IgG2、IgG3 的补体结合位点在 CH2 区内,而 IgM 补体结合位点在 CH3 区内,IgG4、IgA、IgD 和 IgE 不能结合补体。电镜下观察发现,C1q 的球形结构与抗体结合后,进一步激活 C1r 和 C1s,C1s 具有酯酶活性,继之进入下一步的连续反应(图 3 -3)。研究还发现激活 C1q 的球形分子必须具有 2 个以上紧密相邻的 IgG 分子,IgM 只需 1 分子即可,故单分子 IgM 比 IgG 激活补体的能力大得多,在补体介导的抗体溶细胞反应中,同量的 IgM 比 IgG 更有效。
2.活化阶段此阶段主要形成 2 种重要的转化酶:C3 转化酶 C4b3b 和 C5 转化酶 C4b2b3b。C4 和 C2 均为 C1 酯酶的天然底物,C1 使 C4 裂解成 C4b 和游离的 C4a 两个片段。C4bα 链断端上暴露的硫酯键高度不稳定,可与细胞表面的蛋白质或糖形成共价酰胺键或酯键,在 Mg2+存在时 C1 和 C4b 一起将 C2 裂解成大片段 C2b 和游离的小片段 C2a。C2b 和 C4b 结合可形成 C4b2b(C3 转化酶),将 C3 裂解成大片段 C3b 和游离的小片段 C3a。继而 C3b 结合至 C4b2b 附着的邻近细胞膜上,形成 C4b2b3b 三分子复合物,即 C5 转化酶。
3.膜攻击阶段此期形成膜攻击复合物(membraneattackcomplex,MAC)使靶细胞溶解。C5 转化酶将 C5 裂解为 C5b 和游离的小分子 C5a,C5b 与细胞膜结合,继而结合 C6 和 C7 形成 C5b67 三分子复合物,C5b67 吸附 C8,C8 是 C9 的吸附部位,可以与 1~18 个 C9 分子结合,并催化 C9,使之聚合成内壁亲水的管状跨膜通道,使胞内物质释放出来,水进入细胞,细胞破裂。补体经典途径激活过程见图 3 -3。
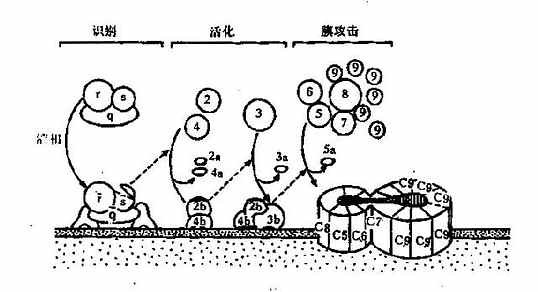
图 3 - 3 补体经典激活途径
(二)替代途径
替代途径或称旁路途径,与经典途径的不同之处主要是越过 C1、C4 和 C2,直接激活补体 C3,然后完成 C5~C9 的激活过程;参与此途径的血清成分尚有 B、D、P、H、I 等因子。替代途径的激活物主要是细胞壁成分,如脂多糖、肽糖苷及酵母多糖等。
1.旁路 C3 转化酶的形成在生理条件下,血中的 C3 可受蛋白酶的作用水解少量的 C3b,C3b 可与邻近的细胞膜结合。如结合的物质是细胞壁上的脂多糖,则 C3b 的半衰期延长,足以使其与 B 因子结合形成 C3bB 复合物。B 因子为 C3 激活剂前体(C3proactivator,C3PA),与结合在膜上的 C3b 构成 C3PA 复合物后,使其对 D 因子的作用更为敏感。D 因子为 C3PA 转化酶原,炎症时增多,在 Mg2+存在时转化为活性形式,能使 C3bB 中的 B 因子裂解出无活性的小碎片 Ba,剩余的 C3bBb 即旁路 C3 转化酶。C3bBb 与正常血清中活化的 P 因子(properdin,P)结合成 C3bBbP,而使其趋于稳定,减慢衰变。生理条件下 C3bBb 和 C3bBbP 使补体系统处于准激活状态,对补体的全面激活具有重要意义。
2.C5 激活替代途径的激活物如细菌脂多糖或酵母脂多糖出现时, 为 C3b 和 C3bBb 提供了可结合的表面,并保护它们不受 I 因子和 H 因子的迅速灭活,这时 C3 激活即由准备状态进入激活状态。C3bBb 裂解 C3 产生 C3a 和 C3b,C3b 可与上述的 C3bBb,C3bBbP 形成多分子的复合物,C3bnBb 或 C3bnBbP,此即 C5 转化酶,其作用类似经典途径中的 C4b2b3b,可使 C5 裂解为 C5a 和 C5b,至此以后的补体激活过程与经典途径相同(图 3 -4)。
3.C3 正反馈循环补体活化过程中形成的 C3 转化酶不断使 C3 裂解,生成大量的 C3b;新产生的 C3b 又可与 B 因子结合,扩大进一步的活化,构成了一个正反馈的循环圈,放大了补体的激活作用。不论是经典途径,还是替代途径,只要有 C3 活化,就可以进入 C3 正反馈循环,产生放大效应。
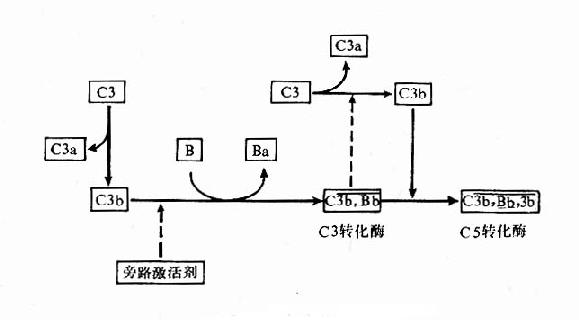
图 3 - 4 旁路激活途径
(三)补体活化的调控
补体系统被激活后,进行系统有序的级联反应,从而发挥广泛的生物学效应,参与机体的防御功能。但如果补体系统活化失控,可形成过多的膜攻击复合物面产生自身损伤,或过多的炎症介质也会造成病理效应。正常机体的补体活化处于严密的调控之下,从而维持机体的自身稳定。
1.补体的自身调控补体激活过程中生成的某些中间产生非常不稳定,成为补体级联反应的重要自限因素。如 C3 转化酶 C4b2b 和 C3bBb 均易衰变,从而限制了 C3 的裂解及其后的酶促反应,与细胞膜结合的 C4b、C3b 及 C5b 也易衰变,可阻断级联反应。此外,只有细胞表面形成的抗原抗体复合物才能触发经典途径,而旁路途径的 C3 转化酶则仅在特定的物质表面才具有稳定性,故正常机体内一般不会发生过强的自发性补体激活反应。
2.调节因子的作用体内的存在多种可溶性膜结合的补体调节因子,它们以特定方式与不同的补体成分相互作用,使补体的激活与抑制处于精细的平衡状态,调节蛋白的缺失有时是造成某些疾病发生的原因。目前发现的补体调节蛋白有十余种,按其作用特点可分为三类:①防止或限制补体在液相中自发激活的抑制剂;②抑制或增强补体对底物正常作用的调节剂;③保护机体组织、细胞免遭补体破坏作用的抑制剂。主要的补体调节因子及其功能见表 3 -3。
表 3 - 3 主要补体调节蛋白及其活性
| 分布 | 靶分子 | 功能 | |
| C1 抑制物 | 血清 | C1r,C1s | 丝氨酸蛋白酶抑制剂,C1r,C1s 与无活性 C1 结合, 抑制激肽释放酶、纤溶酶和凝血因子 XIa,XIIa |
| C4 结合蛋白 | 血清 | C4b | 加速 C4b2b 衰变, 辅助 I 因子介导的 C4b 裂解 |
| H 因子 | 血清 | C3b | 加速 C3bBb 衰变, 辅助 I 因子介导的 C3b 裂解 |
| I 因子 | 血清 | C4b,C3b | 裂解 C3 和灭活 C3b,C4b |
| 过敏毒素灭活 | 血清 | C3a,C4b,C5a | 水解末端精氨酸残基, 灭活过敏毒素因子 |
| S 蛋白 | 血清 | C5b67 | 防止 MAC 插入细胞膜 |
| SP40,40 | 血清 | C5b~9 | 调节 MAC 形成膜结合蛋白 |
| CR1(CD35) | 多数血细胞肥大细胞 | C3b,C4b,iC3b | 加速 C3 转化, 辅助 I 因子介导 C3b 和 C4b 降解 |
| 膜辅助蛋白(MCP、CD46) | 血细胞, 上皮细胞等 | C3b,C4b | 辅助 I 因子介导 C3b 和 C4B 降解 |
| 促衰变因子(DAF) | 多数血细胞 | C4b2b,C3bBb | 加速 C3 转化酶降解 |
| 同源限制因子(HRF,C8bp) | 多数血细胞 | C8,C9 | 抑制旁观细胞溶解, 防止 C9 与 C8 结合, 防止 MAC 引起自身细胞溶解 |
| 膜反应溶解抑制因子(MIRL) | 多数血细胞 | C7,C8 | 抑制旁观细胞溶解, 防止 C7,C9 与 C5b,C6 结合, 防止 MAC 形成及其溶细胞作用 |
第三节 补体系统的生物活性
补体是机体重要的免疫效应系统之一。补体系统活化可以溶解细胞,在活化过程中产生的中间复合物及某些片段也具有多种多样的生物活性;所以补体系统结机体的作用是多方面的,既可参与机体的防御效应和自身稳定,亦可引起免疫损伤。
(一)溶细胞作用
不论何种途径活化,补体系统都能对其粘附的细胞产生溶解作用。在经典活化途径中,抗体的作用只是特异性地定位靶细胞和活化补体,而靶细胞的溶解则是补体系统的作用结果。对不同种类的靶细胞,补体的溶解效果亦不相同;例如革兰阴性杆菌、支原体、异体红细胞和血小板对补体很敏感;革兰阳性菌对补体不敏感。
补体的溶细胞反应不仅可以抗菌,也可抵抗其它微生物及寄生虫的感染。病毒在与相应的抗体结合后,补体的参与可显著增强抗体结病毒的灭活作用,其机制可能是直接溶解有包膜的病毒,防止病毒对易感细胞的吸附和穿入,或干扰病毒在细胞内的增殖。补体缺陷的病人,机体易受病原微生物的侵害。另一方面,补体也常常引起病理性反应,例如异型输血时的溶血反应,自身免疫病时的细胞损伤等都可由补体系统引起。
(二)免疫复合物清除作用
补体在活化过程中生成的中间产物,例如 C3b 和 C4b 等,对抗原抗体复合物有很强的亲和力,可共价结合到免疫复合物上,然后通过补体的其他效应对免疫复合物产生抑制或清除作用。
1.吞噬调理作用人及哺乳类动物的单核-巨噬细胞和中性粒细胞表面都在 C3b 和 C4b 受体,能与带有补体成分的免疫复合物相结合,将两者连接起来,促进吞噬细胞对免疫复合物的吞噬作用。在这种意义上,补体也可称为非特异性调理素(opsonin)。补体成分 C3b、C4b、iC3b 均有调理作用,这种调理作用在机体的抗感染过程中具有重要意义。
2.免疫粘附作用带有补体成分的免疫复合物还可通过 C3b 受体结合到红细胞和血小板的表面(免疫粘附作用)。被粘附的免疫复合物在肝中得到处理,或者通过吞噬作用促进其清除。
3.免疫复合物抑制作用 C3 和 C4 对免疫复合物的共价结合可导致如下结果:①阻碍免疫复合物相互结合形成大的网格而易于在组织中沉积;②阻止免疫复合物激活补体而诱发一系列的病理损伤;③可破坏免疫复合物的空间结构而使其溶解。上述作用对免疫复合物病有抑制效果,在补体活性降低或补体缺乏时,易发生免疫复合物病或使病情加重。
(三)炎症介质作用
补体是机体重要的炎症介质之一,可通过许多途径引起不同的炎症。
1.过敏毒素作用 C5a 和 C3a 可以作用到肥大细胞和嗜碱性粒细胞的细胞膜上,使细胞脱颗粒,释放组胺、白三烯及前列腺素等活性介质,引起类似过敏反应的病理变化(见第八章),所以将 C5a 和 C3a 称为过敏毒素(anaphylatoxin);现已发现 C4a 亦有较弱的过敏毒素作用。这类作用可被抗组胺药物封闭。
2.趋化作用 C4a、C5a、C3a 和 C5b67 是中性粒细胞和单核-巨噬细胞的趋化因子(chemotaxin),可使这些吞噬细胞向炎症部位聚集,加强对病原体的吞噬和消除,同时引起炎症反应。
3.激肽样作用 C2a、C4a 等具有激肽样活性,能增强血管的通透性,引起炎性充血。
补体各成分及其片段的生物活性总结在表 3 -4。
表 3 - 4 补体成分的生物学活性
| 补体成分 | 生物活性 |
| C1~C9 | 溶菌,杀菌和溶细胞作用 |
| C3b,C4b | 吞噬调理作用 |
| C3b | 免疫粘附作用 |
| C1q,C4 | 中和与溶解病毒作用 |
| C2a,C4a | 激肽样作用 |
| C3a,C5a,C4a | 过敏毒素作用 |
| C3a,C5a,C5b67 | 趋化因子 |
| C3,C4,CR1 | 溶解和清除免疫复合物 |
第四节 补体的合成及代谢
(一)补体的编码基因
补体系统的成分非常复杂,各成分的编码基因也分散在不同的染色体上,其中的大多数基因已被成功地克降出来,其产物的氨基酸顺序也得到测定。补体成分的许多蛋白质分子具有同种异构现象,显示其具有遗传多态性。几乎所有的补体蛋白均为单位点常染色体等显性遗传。
编码人 C4、C2 及 B 因子的基因在第 6 对染色体短臂上,与 MHC 系统的基因相邻,被命名为Ⅲ类组织兼容性基因,此种排列的意义尚不清楚。但有趣的是,第 6 对染色体上各有 2 个 C4 基因位点,分别编码 C4A 和 C4B,两者具有不同的生物活性。现已清楚 C4 基因中至少有 1 个无效等位基因(nullallele)可能与自身免疫的发病有关。
与 C4 和 C3 反应的许多调节蛋白的基因被组合在一起,在第一对染色体上形成 1 个超基因家族(superfamily)。此超基因家族编码的蛋白现已知的有:H 因子、C4bp、DAF、CR1、CR2 等;这些产物都有 1 个 60 个氨基酸残基组成的反复重复排列的同源区,可能来自同 1 个基因前体。
(二)补体合成的器官和细胞
人类 2 周龄胚胎已具有补体溶血活性,出生时其脐血中的补体溶血活性已达成人的一半,出生后 1 周时即接近其母体水平。由于补体的产生比抗体产生早,故补体对机体的早期抗微生物感染具有重要意义。
肝是产生补体的主要器官,大部分补体可在肝细胞内合成。其他的一些器官和组织也能产生不同的补体成分,主要细胞是巨噬细胞(表 3 -5)。
表 3 - 5 补体的产生部位
| 补体成分 | 产生部位 |
| C1 | 小肠上皮细胞、脾、巨噬细胞 |
| C2 | 巨噬细胞、肝、脾、肺、骨髓 |
| C3 | 肝、淋巴组织、巨噬细胞、骨髓 |
| C4 | 巨噬细胞、肝、脾、肺 |
| C5 | 骨髓、肝、肾、肺、脾 |
| C6 | 肝、巨噬细胞 |
| C7 | ? |
| C8 | 肝、脾、肺、小肠、肾 |
| C9 | 肝 |
(三)补体的代谢平衡
和其他血蛋白一样,补体在机体内受各种因素的调节,维持其含量的相对平衡。补体成分可被血中的蛋白酶直接降解,在病理情况下补体的代谢速率反映补体的激活程度。补体活化后的酶解片段迅速在体液中失活,并很快地从循环中清除,沉着于细胞表面及组织中会被消耗或分解,例如 C3 在 C3 转化酶的作用下,生成有活性的 C3a 和 C3b,C3b 降解为无活性的 iC3b,再裂解为 C3c 和 C3dg,最后降解为 C3d 和 C3g。血中的其他补体成分也有相似的代谢方式。
在不同疾病的进展过程中,补体的代谢速度变化非常大。临床观察补体含量时应取不同时期的标本进行动态观察,才能了解补体的动态变化。另外,补体的正常水平存在很大的个体差异,补体成分的更新也较快,故单凭测定补体成分含量,有时很难反映补体系统的激活情况,现主张应用测定补体单个成分及其相应裂解产物的方式,例如测定血清 C3a、C5c、C3d 等。补体碎片的连续测定,对预报有关疾病活动情况是很有价值的。
补体血清水平的变化对有关疾病的诊断具有重要意义,例如系统性红斑狼疮和肾小球肾炎时,由于补体系统被免疫复合物过度激活,导致 C3 接近耗竭,其他补体成分也减少;临床症状改善后,其含量又回升。遗传性血管神经性水肿时由于 C1INH 缺陷导致 C4 过度消耗,造成补体含量下降;肝病患者由于肝功能障碍导致蛋白合成能力下降,出现低补体血症。这些患者均有不同程度的对传染病和化脓性细菌的易感性增高;另一方面在发生感染时,常出现代偿性的血液补体含量升高,以抵抗外来微生物的侵入。
第四章 免疫系统
免疫系统(immunesystem)是由具有免疫功能的器官、组织、细胞和分子组成,是机体免疫机制发生的物质基础。免疫系统内的各种淋巴样器官和细胞在机体的整体免疫功能中分别担负着不同的角色,根据其功能不同可将整个系统分成 3 个组织层次:①中枢免疫器官;②外周免疫器官;③免疫细胞。各层次不同类型的组织与细胞又有着不同的作用,通过淋巴细胞再循环和各种免疫分子将各部分的功能协调统一起来。与机体的其它系统一样,免疫系统虽有着一系列的内部调节机制,但不是完全独立运行,而是与其它系统互相协调,尤其是受神经体液调节,又可进行反馈影响,共同维持机体的生理平衡。
免疫系统是伴随着生物种系发生和发展过程中逐步进化而建立起来的。无脊椎动物仅有吞噬作用和炎症反应,到了脊椎动物才开始有腔上囊,出现特异性抗体,至哺乳动物才逐渐产生较多种类的免疫球蛋白。进化程序不同的动物中免疫球蛋白类型出现的多少不一。免疫系统各成分的系统发生顺序为吞噬细胞、细胞介导免疫、体液免疫;在体液免疫中抗体产生的顺序是 IgM、IgG、IgA、IgD 和 IgE(图 4 -1)。
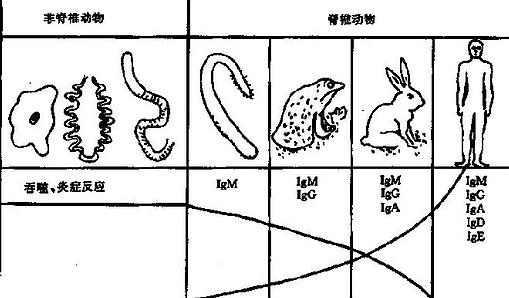
图 4 - 1 免疫应答的种系进化示意图
第一节 免疫器官
免疫器官(immuneorgan)是指实现免疫功能的器官或组织。根据发生的时间顺序和功能差异,可分为中枢神经免疫器官(centralimmuneorgan)和外周免疫器官(peripheralimmuneorgan)两部分。
一、中枢免疫器官
中枢免疫器官又称一级免疫器官,包括骨髓、胸腺、鸟类法氏囊或其同功器官。中枢器官主导免疫活性细胞的产生、增殖和分化成熟,对外周淋巴器官发育和全身免疫功能起调节作用。
(一)胸腺
1.胸腺的组织结构胸腺位于前纵隔、胸骨后。胸腺分为左右两叶,外包结缔组织被膜;被膜伸入胸腺实质内形成隔膜,将胸腺分成许多小叶;小叶的外周部分称为皮质,中央部分称为髓质;相邻的小叶髓质彼此相连(图 4 -2)。
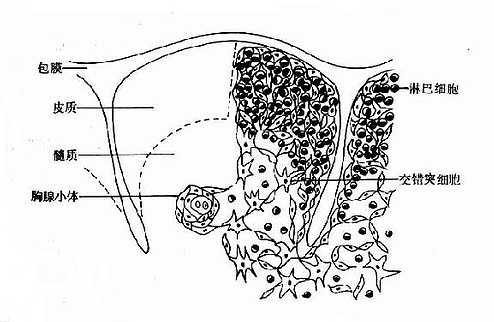
图 4 - 2 胸腺结构示意图
胸腺的细胞分为淋巴样细胞和非淋巴细胞两类。淋巴细胞包括原始 T 细胞向成熟 T 细胞分化过程中各种不同阶段的细胞,统称为胸腺细胞;胸腺细胞是胸腺内的主体细胞,其分布从皮质到髓质逐渐减少。非淋巴细胞包括上皮细胞、巨噬细胞、树突状细胞、抚育细胞、皮纤维细胞和网状细胞等。这些细胞一方面构成胸腺组织的支架,另一方面构成胸腺细胞营养和分化的微环境,统称为基质细胞。
胸腺皮质的毛细血管内皮细胞连接紧密,与网状细胞共同形成血液-胸腺屏障,使循环中的抗原物质不能进入胸腺。血液-胸腺屏障是体内为数不多的几个生理屏障之一,其意义目前尚不清楚。胸腺髓质的毛细血管内皮细胞之间有间隙,抗原性物质可进入髓质,在髓质内还可见多层扁平上皮细胞呈同心圆状排列成的 Hassall 小体,或称胸腺小体。直径约 25~50μm,其功能尚不清楚。
2.胸腺的免疫功能长期以来对胸腺的功能不甚了解,直到 60 年代初 Miller 和 Good 分别用切除新生小鼠和家兔胸腺的办法证明了胸腺的免疫功能。
(1)训化 T 细胞:在骨髓初步发育的淋巴细胞经由血液循环迁移至胸腺,定位于胸腺的皮质外层;这些形体较大的细胞为双阴性(CD4-/CD8-)细胞,约占胸腺细胞总数的 10%。外层细胞在胸腺微环境中迅速增殖,并推动细胞不断向内层迁移,个体形态逐渐变小;内层细胞为双阳性(CD4+/CD8+)细胞,约占胸腺细胞总数的 75%。双阳性细胞为过渡态细胞,其中 90%以上在皮质内凋亡或被巨噬细胞吞噬;据认为,死亡细胞可能是针对自身抗原进行应答的细胞。少数胸腺细胞继续发育并迁移至髓质,成为单阳性(CD4+或 CD8+)细胞,约占胸腺细胞总数的 15%。只有这些单阳性细胞才是成熟的 T 细胞,通过髓质小静脉进入血循环。
(2)分泌胸腺激素:胸腺上皮细胞能产生多种激素,如胸腺素、胸腺生成素和胸腺体液因子等。这些激素可以诱导活化未成熟胸腺细胞的末端脱氧核苷转移酶,促进 T 细胞的分化成熟;不同的激素作用于不同的细胞发育阶段,有选择地发挥免疫调节功能。胸腺激素的作用没有种属特异性,所以目前临床应用的胸腺素都是从动物胸腺中提取出来的。
(3)其他:胸腺还可促进肥大细胞发育,调节机体的免疫平衡,维持自身的免疫稳定性。新生动物摘除胸腺,可引起严重的细胞免疫缺陷和总体免疫功能降低。由此可见胸腺在免疫系统中的地位。
3.胸腺的发育过程胸腺于胚胎第 6 周时就在第三对咽囊的腹侧面形成胚基,至第 7 周形成胸腺雏形,至第 20 周时便已发育成熟。出生时胸腺重量仅约为 20g,青春期达顶峰,约 40g;以后随年龄增长而逐渐萎缩,至老年时仅剩 10g 左右,且多为脂肪组织替代。机体的免疫功能与胸腺的生长周期相关。
(二)腔上囊
腔上囊又称法氏囊(bursaofFabricius),是鸟类动物特有的淋巴器官,位于胃肠道末端泄殖腔的后上方。与胸腺不同,腔上囊训化 B 细胞成熟,主导机体的体液免疫功能。将孵出的雏鸡去掉腔上囊,会使血中 γ 球蛋白缺乏,且没有浆细胞,注射疫苗亦不能产生抗体。
人类和哺乳动物没有腔上囊,其功能由相似的组织器官代替,称为腔上囊同功器官;曾一度认为同功器官是阑尾、扁桃体和肠集结淋巴结,现在已证明是骨髓。
(三)骨髓
骨髓是成年人和动物所有血细胞的唯一来源,各种免疫细胞也是从骨髓的多能干细胞发育而来。
骨髓的主要功能是产生血细胞,近来证明骨髓还是腔上囊同功器官。在骨髓异常时,累及的不单是体液免疫,其他免疫功能也发生障碍。
二、外周免疫器官
外周免疫器官包括淋巴结、脾和粘膜相关淋巴组织(mucosaassociatedlymphoidtissue,MALT)等,是免疫细胞聚集和免疫应答发生的场所。
(一)淋巴结
1.淋巴结的结构淋巴结为近乎圆形的网状结构,表面有一层结缔组织被膜,略凹陷处为门,有输出淋巴管和血管出入。被膜向外延伸有许多输入淋巴管;向内伸入实质形成许多小梁,将淋巴结分成许多小叶。淋巴结的外周部分为皮质,中央部分为髓质(图 4 -3)。
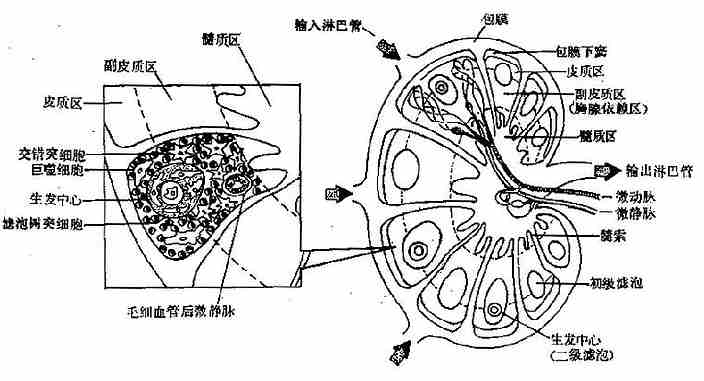
图 4 - 3 淋巴结结构示意图
皮质区有淋巴小结,又称淋巴滤泡;受抗原刺激后出现生发中心;此区内富含 B 细胞和滤泡树突状细胞(follicledendritic,FDCs),所以又称非胸腺依赖区。皮质深层和滤泡间隙为副皮质区,因富含 T 细胞又称胸腺依赖区;此区是淋巴细胞再循环的门户,有大量 T 细胞和巨噬细胞分布在滤泡周围,是传递免疫信息的场所。髓质区的 B 细胞、浆细胞和网状细胞集结成索状,称髓索;在髓索这间为髓窦;此区是滤过淋巴液的场所。
2.淋巴结的功能
(1)滤过和净化作用:淋巴结是淋巴液的有效滤器,通过淋巴窦内吞噬细胞的吞噬作用以及体液抗体等免疫分子的作用,可以杀伤病原微生物,清除异物,从而起到净化淋巴液,防止病原体扩散的作用。
(2)免疫应答场所:淋巴结中富含各种类型的免疫细胞,利于捕捉抗原、传递抗原信息和细胞活化增殖。FDCs 表面有丰富的 Fc 受体,具有很强的捕获抗原体复合物的能力,通过这种方式可将抗原长期保留在滤泡内,这对形成和维持 B 记忆细胞、诱导再次免疫应答很有意义。B 细胞受刺激活化后,高速分化增殖,生成大量的浆细胞形成生发中心;T 细胞也可在淋巴结内分化增殖为致敏淋巴细胞。不管发生哪类免疫应答,都会引起局部淋巴结肿大。
(3)淋巴细胞再循环基地:正常情况下,只有少数淋巴细胞在淋巴结内分裂增殖,大部分细胞是再循环的淋巴细胞。血中的淋巴细胞通过毛细血管后静脉进入淋巴结副皮质,然后再经淋巴窦汇入输出淋巴管。众多的淋巴结是再循环细胞的重要补充来源。
(二)脾
1.脾的组织结构脾是体内形体最大的淋巴器官,结构类似淋巴结。脾的表面有结缔组织被膜,实质比较柔脆,分为白髓和红髓。白髓是淋巴细胞聚集之处,沿中央小动脉呈鞘状分布,富含 T 细胞,相当于淋巴结的副质区。白髓中还有淋巴小结,是 B 细胞居留之处,受抗原刺激后可出现生发中心。脾中 T 细胞约占总淋巴细胞数 35%~50%,B 细胞约占 50%~65%。红髓位于白髓周围,可分为脾索和血窦。脾索为网状结缔组织形成的条索状分支结构;血窦为迂曲的血管,其分支吻合成网。红髓与白髓之间的区域称为边缘区,中央小动脉分支由此进入,是再循环淋巴细胞入脾之处。与淋巴结不同,脾没有输入淋巴管,只有一条平时关闭的输出淋巴管与中央动脉并行,发生免疫应答时淋巴细胞由此进入再循环池。
2.脾的功能脾在胚胎期是重要的造血器官;出生后造血功能停止,但仍然是血细胞尤其是淋巴细胞再循环池的最大储库和强有力的过滤器;①与淋巴结相似,脾还是发生免疫应答的重要基地。此外,脾还有两个显著的特点:产生抗体,脾富含 B 细胞和浆细胞,因此是全身最大的抗体产生器官,尤其是产生 IgM 和 IgG,其数量对调节血清抗体水平起很大作用。所以当自身抗体产生过多导致严重疾病时,曾用切除脾的办法进行缓冲治疗;但脾切除后机体的抗感染能力显著降低。②分泌体液因子,脾可以合成补体(C5 和 C8 等)和备解素等重要的免疫效应分子;还能产生一种白细胞激肽,促进粒细胞的吞噬作用。
(三)粘膜相关淋巴组织
在各种腔道粘膜下有大量的淋巴组织聚集,称为粘膜相关淋巴组织(MALT);其中最重要的是胃肠道粘膜相关淋巴组织(GALT)和呼吸道粘膜相关淋巴组织(BALT)。GALT 包括阑尾、肠集合淋巴结和大量的弥散淋巴组织;BALT 包括咽部的扁桃体和弥散的淋巴组织,构成呼吸道和消化道入口处的防御机构,称为 Waldeyer 环。除了消化道和呼吸道外,乳腺、泪腺、唾液腺以及泌尿生殖道等粘膜也存在弥散的 MALT。
与淋巴结和脾不同,粘膜相关淋巴组织没有包膜,不构成独立的器官,通过广泛的直接表面接触和体液因子与外界联系;MALT 中的 B 细胞多为 IgA 产生细胞,受抗原刺激后直接将 SigA 分泌到附近粘膜,发挥局部免疫作用;粘膜靠一种特殊的机制吸引循环中的淋巴细胞,MALT 中的淋巴细胞也可输入到淋巴细胞再循环池,某一局部的免疫应答效果可以普及到全身的粘膜(详见第七章)。
三、淋巴细胞再循环
各种免疫器官中的淋巴细胞并不是定居不动的群体,而是通过血液和淋巴液的循环进行有规律的迁移,这种规律性的迁移为淋巴细胞再循环(lymphocyterecirculation)。通过再循环,可以增加淋巴细胞与抗原接触的机会,更有效地激发免疫应答;并不断更新和补充循环池的淋巴细胞。
1.再循环的细胞淋巴干细胞从骨髓迁移至胸腺和腔上囊或其功能器官,分化成熟后进入血液循环的定向移动过程不属于再循环范围。再循环是成熟淋巴细胞通过循环途径实现淋细胞不断重新分布的过程。再循环中的细胞多是静止期细胞和记忆细胞,其中 80%以上是 T 细胞。这些细胞最初来源于胸腺和骨髓;成年以后,再循环池手细胞主要靠外周免疫器官进行补充。受抗原刺激而活化的淋巴细胞很快定居于外周免疫器官,不再参加再循环。
2.再循环的途径血液中的淋巴细胞在流经外周免疫器官(以淋巴结为例)时,在副皮质区与皮质区的连接处穿过高内皮毛细血管后静脉(HEV)进入淋巴结;T 细胞定位于副皮质,B 细胞主要定位于皮质区;以后均通过淋巴结髓窦迁移至输出淋巴管,进入高一级淋巴结;经过类似的路径,所有外周免疫器官输出的细胞最后都汇集于淋巴导管;身体下部和左上部的汇集到胸导管,从左锁骨下静脉角返回血循环;右侧上部的汇集到右淋巴管,从右锁骨下静脉返回血循环(图 4 -4)。再循环一周约需 24~48 小时。
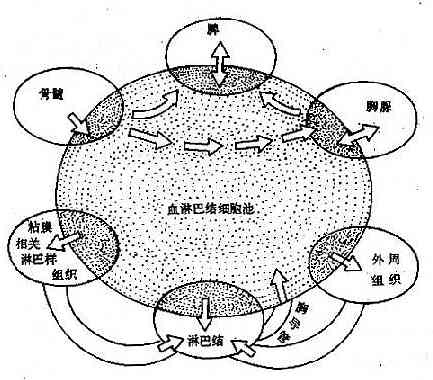
图 4 - 4 体内淋巴细胞迁移路线示意图
3.细胞定居选择淋巴细胞从血循环进入淋巴组织具有高度的选择性,这是因为淋巴细胞上具有特殊的受体分子,称为归巢受体(homingreceptor)。现已发现的归巢受体包括 CD44、LFA-1、VLA- 4 和 Mel-14/LAM- 1 等;其中 Mel-14/LAM- 1 是定居淋巴结的受体,识别淋巴结内的高内皮细胞;VLA- 4 的 α 亚单位是定居 MALT 的受体,识别粘膜表面的配体。
第二节 淋巴细胞
参与应答的细胞(免疫细胞)可以分为三大类:第一类是指在免疫应答过程中起核心作用的免疫活性细胞,即淋巴细胞;第二类是指在免疫应答过程中起辅佐作用的单核-巨噬细胞;第三类是指单纯参与免疫效应的其他免疫细胞。由于免疫细胞的种类较多。为便于初学者掌握,将常用的细胞简称和略语列于表 4 -3。
淋巴细胞(lymphocyte)是受免疫系统的主要细胞,按其形成大小可分为大(11~18μm)、中(7~11μm)、小(4~7μm)三类;按其性质和功能可分为 T 细胞、B 细胞和 NK 细胞。不同类型的淋巴细胞很难从形态学上分辨,只能通过其不同的表面标志和不同的反应性进行区分。
一、T 细胞
T 细胞是在胸腺中成熟的淋巴细胞,故称胸腺依赖性淋巴细胞(thymus-dependentlymphocyte),简称 T 淋巴细胞或 T 细胞,是血液和再循环中的主要淋巴细胞。
(一)T 细胞的表面标志
在 T 细胞发育的不同阶段,细胞表面可表达不同种类的分子,这些分子与细胞功能有关,也可作为签别 T 细胞甩其活化状态的表面标志。
1.T 细胞受体(Tcellreceptor,TCR)又称 T 细胞抗原受体,可表达于所有成熟 T 细胞表面,是 T 细胞识别外来抗原并与之结合的特异受体。TCR 由 α 和 β 两个肽链组成,两肽链之间由二硫键连接,其结构和功能均类似 IgG 分子的一个 Fab 段。α 链与 IgG 的轻链相似,由 V、J 和 C 区 3 个基因片段重组的基因进行编码;β 链类似于 IgG 重链的 V 区和 CH1 区,由 V、D、J 和 C 区 4 个基因片段重组的基因进行编码。在 T 细胞发育过程中,编码 α 及 β 链的基因经历突变和重排,因此 TCR 具有高度的多态性,以适应千变万化的抗原分子。
与 B 细胞表面的 Ig 分子一样,TCR 能特异性地与抗原结合。与 Ig 分子不同的是,TCR 一般只结合与 MHC 分子连接的抗原,这是由于 TCR 与抗原的结合力较弱,并且常常只有 α 链或 β 链单独表达的缘故。TCR 识别抗原的这种特点构成了 MHC 限制性的基础。TCR 与抗原结合后不能直接活化 T 细胞,而是依赖与其邻接的 CD3 分子向细胞内部传递活化信息;CD4 和 CD8 分子能够协同和加强这种作用。
一小部分成熟 T 细胞的表面 TCR 不是由 α / β 链组成,而是由 γ / δ 链组成;γ/ δ 链与 α / β 链有高度同源性,而且 δ 基因正好位于 α 基因的位点上,其意义仍然不甚明确。
2.簇分化抗原(clusterofdifferentiation,CD)T 细胞在分化成熟过程中,不同的发育阶段和不同亚类的淋巴细胞可表达不同的分化抗原,这是区分淋巴细胞的重要标志。所以 1986 年世界卫生组织命名委员会建议应用 CD 系列来统一命名白细胞分化抗原,包括淋巴细胞和其它白细胞。目前已经鉴定出 CD 抗原 70 余种,部分重要 CD 抗原列在表 4 -1。
表 4 - 1 部分 CD 抗原及其分布和性质
| 抗原 | 别名 | 分布细胞 | 主要性质和功能 |
| CD2 | T1,E 受体 | T,NK | 结合 CD58, 转递信号 |
| CD3 | T3,Leu4 | T | T 系标志, 转导信号 |
| CD4 | T4,Leu3a | TH,Mφ 等 EBV 转化的 B | MHCⅡ类分子受体,HIV 受体传递信号,TH标志 |
| CD5 | T1 | T, 部分 B | 结合 CD72, 部分 B 标志 |
| CD7 | Leu9 | T,NK 及前体 | 传递信号 |
| CD8 | T8,Leu2a | Tc | I 类分子受体,Tc 标志 |
| CD10 | CALLA | B 前体 | 内肽酶, 急性淋巴细胞白血病的标志 |
| CD11a | LFA-1α | T,B,NK,M | 整全素, 介导细胞粘附 |
| CD16 | FcγRⅢ | NK,Mφ,N | 低亲和 IgGFc 受体,NK 标志 |
| CD19 | B4 | B | 传递信号 |
| CD21 | CR2,B2 | B | C3d、CD23 和 EBV 受体 |
| CD22 | B | 结合 CD45RO, 传递信号 | |
| CD23 | FcεRⅡ | 活化 B,Mφ 等 | 低亲和 IgEFc 受体,CD21 配体 |
| CD25 | IL-2Rα | 活化 T,B;M | 低亲和 IL-2R,L- C 活化标志 |
| CD28 | 活化 T H | 结合 B7, 介导协同刺激信号 | |
| CD32 | FcγRⅡ | B,Mφ,N,Eo | 中亲和 IgGFc 受体, 传递信号 |
| CD35 | CR1 | B,M,N,NK | C3b 受体 |
| CD40 | B | 结合 CD40, 传递 T H辅助信号 | |
| CD45 | WBC-Ag | 全部 WBC | PTP, 传递 TCR 信号 |
| CD54 | ICAM-1 | 活化 L -c | 结合 LFA- 1 或 CD23 |
| CD56 | N-CAM | NK | NK 标志,NK 粘附作用 |
| CD64 | FcγRⅠ | M,Mφ | 高亲和性 IgGFc 受体 |
T 细胞主要的 CD 抗原有以下几类。
(1)CD2:分子量约 49kD 的糖蛋白,表达于全部人 T 细胞和 NK 细胞表面;由 3 种抗原性不同的分子(CD2-1,CD2-2,CD2-3)组成。CD2- 1 及 CD2- 2 表达于静止细胞表面,CD2- 3 表达于活化的 T 细胞表面。应用抗 CD2- 2 及抗 CD2- 3 可直接活化静止的 T 细胞,这是成熟 T 细胞活化的旁路途径。CD2 是粘附分子之一, 顺抗原递呈过程中起辅助作用。CD2 分子还可与绵羊红细胞(SRBC)结合,又称绵羊红细胞受体。在一定条件下,将外周血淋巴细胞与 SRBC 混合,则血 T 细胞能结合若干 SRBC,染色后在显微镜下观察呈玫瑰花环状,故称 E 花环形成试验;临床上可用于测定外周血 T 细胞总数。
(2)CD3:为 6 肽复合分子,表达在全部 T 细胞表面,是 T 细胞共同的表面标志。CD3 分子与 TCR 分子紧密连接,但 CD3 分子的肽链伸入胞浆的部分比 TCR 长得多,所以 CD3 可将 TCR 与抗原结合所产生的活化信号传递到细胞内部并激活细胞;因此应用抗 CD3 单克隆抗体也可直接活化 T 细胞。CD3 与 TCR 的关系见图 4 -5。
(3)CD4/CD8:是相互关联、但意义不同的 2 个分子,是 T 细胞亚群的表面标志。表达 CD4 的主要是辅助性 T 细胞,表达 CD8 的主要是细胞毒性 T 细胞。CD4 和 CD8 分子可增强 CD3-TCR 对 MHC 抗原的亲和力,CD4 分子增强对 MHCⅡ类抗原的结合,CD8 分子则增强对 MHCⅠ类抗原的结合。在再次免疫应答中,由于 TCR-CD3 与外来抗原 -MHC 复合分子结合的亲和力提高,即使细胞表面的 CD4 或 CD8 分子丢失,亦可发生免疫应答。
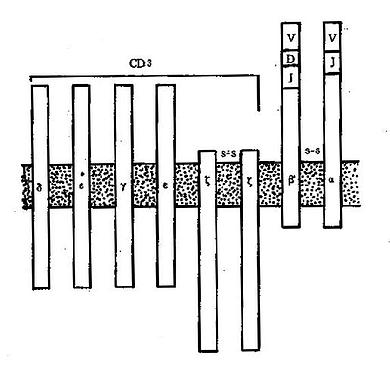
图 4 -5TCR 与 CD3 结构及相关性示意图
(4)其他 CD 分子:CD7 也是 T 细胞的共同标志,而且较早地出现在细胞表面,还可发现在 NK 细胞和少数其他淋巴样细胞前体上。某些 T 细胞亚群(TH)表达 CD28,该分子可传递同刺激信号,与细胞活化相关。
3.其他表面标志主要包括以下几类:
(1)组织相容性抗原:T 细胞主要表达 MHCⅠ类抗原,个别活化的 T 细胞可表达 MHCⅡ类抗原;MHC 及其意义见第六章。
(2)致有丝分裂原受体:致有丝分裂原(mitogen)简称丝裂原,可通过相应受体刺激静止期淋巴细胞转化为淋巴母细胞,发生有丝分裂而增殖。丝裂原种类很多,常见的有植物血凝素(phytohemagglutinin,PHA)、刀豆素 A(concanavalinA,ConA)等。因此可利用 PHA 和 ConA 等活化 T 细胞,也可借此进行淋巴细胞转化试验,判断细胞免疫的功能状态。
(3)病毒受体:淋巴细胞表面还存在病毒受体,例如麻疹病毒受体和人类免疫缺陷病毒(HIV)受体等,通过这类受体,病毒可以选择性地感染某个 T 细胞亚群;例如 HIV 可以通过 CD4 感染辅助性 T 细胞引起艾滋病。
另外,T 细胞表面尚有多种白细胞介素受体(见第五章)、绵羊红细胞受体(CD2)、整合素(integrin)受体、转铁蛋白(transferrin)受体等;还有多种粘附分子,例如 LFA- 1 和 CD2 等;这些均与 T 细胞活化有一定的相关性。
(二)T 细胞的亚群及其功能
虽然 T 细胞有表达 TCR 和 CD2、CD3、CD7 等共性,但这是一个非均一性的复杂群体;可以分化为表达不同 CD 分子、具有不同免疫活性的亚群(subset),其中较为明确的两个亚群是辅助性 T 细胞和细胞毒性 T 细胞。T 细胞的这种分化是不可逆的。
1.辅助性 T 细胞(helpTcell,TH)是能够帮助 B 细胞分化成抗体产生细胞和放大细胞免疫应答的一个细胞群,表达 CD4 但不表达 CD8。TH活化后可释放细胞因子,可以调节 T 细胞、B 细胞、单核-巨噬细胞和其他免疫细胞的活性。TH表面的 CD4 分子主要是与 MHCⅡ类分子相关,而不是与辅助功能相关;因此部分 CD4+细胞有细胞毒活性,而某些 CD8+细胞有辅助作用。
根据产生细胞因子的不同,TH可被分成 3 型:TH1,TH2和 T H0。TH1产生 IL- 2 和 IFNγ,可以增强细胞免疫应答,促进 B 细胞合成 IgM 和 IgG2,活化巨噬细胞;TH2产生 IL- 4 和 IL-5,增强 IgG1 和 IgE 的合成,增加局部和循环中嗜酸性粒细胞的数量;TH0产生中述 4 类细胞因子,兼具 T H1和 T H2的生物活性。不同的抗原诱导的免疫应答可以由不同类型的 T H控制,例如蠕虫感染的免疫应答由 T H2控制,导致 IgE 血清水平升高和嗜酸性粒细胞数量增加;而原虫(如利什曼原虫)感染的免疫应答则由 T H1控制,产生细胞免疫应答和清除原虫的感染。
免疫应答的控制选择和 T H类型分化的机制目前尚不清楚,但细胞发育过程中的局部环境可影响细胞的分化,例如已经证明 IL- 4 可促进 T H2应答,而 IFNγ 可抑制 T H2型应答。
2.细胞毒性 T 细胞(cytotoxicTcell,Tc 或 CTL)能特异性溶解靶细胞的一个细胞亚群,表达 CD8 但不表达 CD4。Tc 能够杀伤所有表达 MHCⅠ类分子并向其递呈抗原的靶细胞;这种杀伤是抗原特异性的、NHCⅠ类分子限制性的和卓有成效的。Tc 细胞在杀伤一个细胞后,可以转向另一个靶细胞,反复行使这种杀伤功能。因此 Tc 细胞在抗病毒感染、抗肿瘤免疫、移植排斥反应和某些自身免疫病中起重要作用。
3.其他 T 细胞亚群以往的免疫学文献曾描写过其他重要的 T 细胞亚群,但随着免疫学技术的进步,这些亚群很难得到证实或者已证明是别的亚群。
(1)抑制性 T 细胞(suppressorTcell,Ts):被描述为专门行使免疫抑制作用的 T 细胞亚群。当 1960 年首次报道某些淋巴细胞有免疫抑制作用以后,30 多年来有大量的文献描述了 Ts 的活性,但至今没有人分离出只有免疫抑制作用的特征性 T 细胞群。所以目前认为:所谓抑制性 T 细胞,可能就是 T H1,因为 T H1除了能引起细胞免疫应答外,它分泌的 IFNγ 还可抑制 IgG1 的产生。
(2)迟发型超敏反应性 T 细胞(delayed-typehypersensitivityTcell,TDTH):被描述为可引起迟发型超敏反应的 T 细胞。有关喧个亚群的文献资料相对少些,更无人证明存在专门诱导迟发型超敏反应的 T 细胞群。实际上,迟发型超敏反应就是由 T H和 Tc 所引起的。
(3)γ/δT 细胞:表面 TCR 由 γ 和 δ 链组成、而非通常 α / β 链的细胞群。这群细胞数量很少,不超过 T 细胞总数的 5%;它们可以是 CD4-/CD8-,也可以是 CD4-/CD8+;具有细胞毒活性,也能释放细胞因子;在皮肤中存在较多,其意义有待进一步证明。
(三)T 细胞的发育与分布
T 细胞来源于骨髓干细胞,在胸腺内发育成熟。迁移至胸腺的初期,这些胸腺细胞只表达 T 细胞系的早期特征 CD2 和 CD7,不表达 CD4 或 CD8,称为双阴性胸腺细胞。在此期间,TCR 基因开始重排;当重排的结果产生了 α 和 β 链时,TCR 和 CD3 便开始低水平地协同表达在细胞表面。这时 CD4 和 CD8 也开始表达,并且同时出现在细胞膜上,这样的细胞称为双阳性胸腺细胞。
因双阳性胸腺细胞已经表达 TCR 和 CD3,故能够识别与自身 MHC 连接的抗原;但是这时的 TCR 刺激不是诱导细胞增殖,而是诱导细胞凋亡(见第七章)。由于在此期间能遇到的抗原通常都是自身物质,所以死亡的细胞基本上都是自身反应细胞。这种现象称为阴性选择(negativeselection)。另一方面,能识别非自身抗原的双阳性细胞得以继续发育,其 TCR 和 CD3 分子的表达增强,并且丢失 CD4 或 CD8 分子中的一个,分化为只表达 CD4 或 CD8 的单阳性胸腺细胞,即成熟的 T 细胞。这种选择称为阳性选择(positiveselection)。T 细胞在胸腺内的主要发育特点见图 4 -6。难以理解的是,阳性选择时并没有外来抗原与 TCR 结合,而且所选择的非自身反应性细胞却也能识别自身的 MHC。
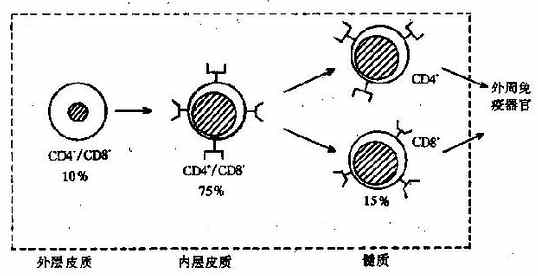
图 4 -6T 细胞在胸腺内的发育过程
成熟的 T 细胞离开胸腺进入血循环,分布于外周免疫器官的胸腺依赖区,例如淋巴结的副皮质区等,受抗原刺激后参与免疫应答。T 细胞是淋巴细胞再循环的主要细胞,在血液中约占 60%~70%,在淋巴结约占 65%~85%,在胸导管中占 90%以上。当胸腺发育不全时,T 细胞发育受阻,外周血淋巴细胞显著减少,外周淋巴器官的胸腺依赖区萎缩。
二、B 细胞
B 细胞是在鸟类法氏囊或其同功器官(骨髓)内发育成熟的细胞,因此称为法氏囊或骨髓依赖的淋巴细胞(bursaorbonemarrowdependentlymphocyte),简称 B 淋巴细胞或 B 细胞。B 细胞受抗原刺激后可产生抗体的浆细胞。
(一)B 细胞的表面标志
1.表面免疫球蛋白(surfaceimmunoglobulin,SLg)是 B 细胞最具特征性的表面标志。成熟 B 细胞膜表面表达 SIgM 和 SigD,早期 B 细胞只表达 SIgM 分子;SIg 的肽链结构与 Ig 相同,但 SIgM 是单体分子。一个 B 细胞表面可有上万个 SIg 分子,其特异性都与细胞分泌的 Ig 分子相同。由于细胞在分化过程中基因突变和 Ig 基因重排的结果,一个正常人体内至少有 3×106个可产生不同抗体分子的细胞克隆。SIg 的功能是为 B 细胞表面的抗原受体,可与相应抗原特异性结合,并将抗原作内摄处理。这种受体介导的结合是 B 细胞捕获抗原的主要方式。
SIgM 或 SIgD 分子的羧基端插入细胞膜,但只有几个氨基酸的深度;所以象 TCR 一样,SIg 自身不能独立地向细胞内传递刺激信号,必须依赖与其紧密相关的其他两种跨膜糖蛋白棗 Ig- α 和 Ig-β。这两种蛋白靠二硫键连在一起,各有一个大的肽段伸入细胞浆,因此可以象 T 细胞表面的 CD3 协同 TCR 一样辅助 SIg 向细胞内传递刺激信号。
2.MHC 和 CD 抗原成熟的 B 细胞表面表达 MHCⅡ类分子,这可使 B 细胞作为抗原递呈细胞,与其免疫活性相关(详见第七章)。
B 细胞在分化成熟过程中可表达不同的 CD 分子,其中某些可作为 B 细胞的标志,某些还与细胞功能相关。CD10 只出现在 B 前体细胞,CD19 从原始至成熟的 B 细胞都存在,而 CD22 只在成熟 B 细胞表达,都是经常检测的标志;CD21 和 CD35 是补体受体;CD23 和 CD32 则是 Ig 的 Fc 受体;CD40 可与 T H细胞上的配体相结合,从而接受 T H的辅助作用。
3.其他标志及作用
(1)Fc 受体:B 细胞表面有 IgG 的 Fc 受体(CD32),与 B 细胞活性有关。Fc 受体还可与抗体包被的红细胞相结合形成 EAC 玫瑰花环,是鉴别 B 细胞的传统方法之一。
(2)补体受体:CR 表达于成熟 B 细胞的表面,CR1 可与 C3b 和 C4b 结合,促进 B 细胞活化或抑制补体活化;CR2 受体(CD21)可与 C3d 结合,同时也是 EB 病毒的受体。
(3)丝裂受体:B 细胞的致有丝分裂原主要是脂多糖(LPS),受丝裂原活化后 B 细胞也可以分化增殖。
另外,B 细胞表面还有多种细胞因子(如 IL-1,IL-2,IL-4,和 IFNγ 等)的受体,与不同细胞因子的结合可使 B 细胞产生相应的生物活性。B 细胞与 T 细胞的比较见表 4 -2。
表 4 -2T 细胞、B 细胞与 NK 细胞的性状比较
| 性状 | T 细胞 | B 细胞 | NK 细胞 |
| 分化成熟部位 | 胸腺 | 骨髓 | ? |
| 表面标志 | |||
| 表面膜 Ig | - | + | - |
| TCR | + | - | - |
| HLAⅡ类抗原 | 极少数 | + | - |
| CD2 | + | - | + |
| CD3 | + | - | - |
| CD19,CD20 | - | + | - |
| CD16,CD56 | - | - | + |
| CR | - | + | 部分 |
| FCγR | - | + | + |
| 细胞分布(%) | |||
| 外周血 | 60~70 | 20~30 | 10~15 |
| 骨髓 | <5 | >95 | 极少 |
| 胸导管 | 90 | 10 | 少见 |
| 脾 | 30~50 | 50~60 | 少见 |
| 淋巴结 | 65~85 | 15~35 | 少见 |
(二)B 细胞的分化成熟
人和哺乳动物 B 细胞的产生、发育和成熟均在骨髓中完成,这个过程伴随着一系列的胞内基因和表面标志的变化(图 4 -7)。
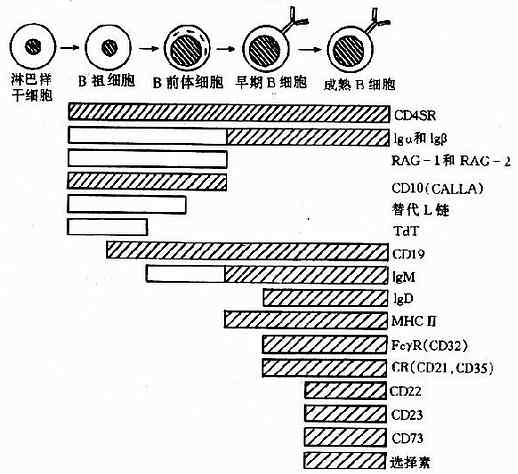
图 4 -7B 细胞发育过程及表面特征
B 祖细胞(pro-Bcell)只表达 CD10、CD19 的末端脱氧核苷转移酶(TdT),这个时期的主要变化是重链基因重排;重排的失败率占 50%,不成功的重排导致细胞死亡。成功的重排可导致产生重链 μm,存放于粗面内质网中;重链 μm 可与未重排轻链基因产物化替轻链(surrogatelightchains)相结合,所形成的临时复合物能转移到细胞膜上;这种转移产生的信号使重链基因重排停止,表面临时复合物消失,细胞发育进入下一阶段。
B 前体细胞(pre-Bcell)在进入成熟前不再分裂增殖,这时期的主要变化是轻链基因重排。重排的基因产生 κ 或 λ 链,与已有的重链结合形成 4 肽的 IgM 单体,并转移到细胞膜上。这一信号使细胞进入成熟期,永久性地失去 Ig 基因重排的能力;因此受抗原刺激后增殖的所有分子代细胞均产生与 SIg 同样特异性的抗体分子。成熟 B 细胞还表达其他表面标志。例如 IgD、归巢受体、MHCⅡ类分子、CD22、CD23 和 CD40 等。
(三)B 细胞的亚群和分布
不同克隆的成熟 B 细胞表达不同特异性的抗原受体,自然地体现了它们之间的差别,但是很难找到其他的显著标志(例如象 T 细胞的 CD4 和 CD8 那样)将 B 细胞分成几个亚群。近年来发现一小部分成熟 B 细胞表达 CD5,这些细胞多与自身反应(产生自身抗体)相关;CD5 还发现在几乎所有慢性淋巴性白血病细胞上。
未成熟 B 细胞都在骨髓内,成熟初期仍留在骨髓 2~3 天,待表面标志表达完全后便离开骨髓进入血循环,分布到外周免疫器官的非胸腺依赖区。B 细胞在血液中约占 20%~30%,在胸导管中不超过 10%,在淋巴结中约占 15%~35%,在脾中数量最多,可达 60%。B 细胞受抗原刺激后可在外周免疫器官中继续增殖分化为浆细胞,分泌抗体(详见第七章)。
三、自然杀伤细胞
自然杀伤细胞(naturalkiller,NK)可非特异性杀伤肿瘤细胞和病毒感染细胞的淋巴样细胞。目前对 NK 细胞的了解尚不甚清楚,但其免疫学潜能值得进一步探讨。
(一)NK 细胞的一般特征
NK 细胞形体较大,含有胞浆颗粒,在形态上独具特色。NK 细胞表面没有 TCR 和 CD3 等 T 细胞标志,也没有 SIg 和 CD40 等 B 细胞标志,因此曾被称为无标志细胞或裸细胞(nullcell)。NK 细胞表达 CD56,可作为细胞的系统标志;与单核-巨噬细胞一样表达 CD16 等分子,与其杀伤功能相关。
NK 细胞也来源于骨髓前体细胞,其发育地点和分化过程尚不明确;但其发育环境和分化显然不同于 T 细胞和 B 细胞,因为 T 和 B 细胞联合免疫缺陷时 NK 细胞可正常;而 T 和 B 细胞正常时可有 NK 细胞缺陷。
NK 细胞的数量较少,在外周血中约占淋巴细胞总数的 15%,在脾中约 3%~4%,也可发现在肺、肝和肠粘膜;但在胸腺、淋巴结和胸导管中罕见。
(二)NK 细胞的活性和功能
1.自然杀伤活性 NK 细胞的主要活性是杀伤肿瘤细胞和病毒感染细胞;与 Tc 细胞不同,这种杀伤不需要 TCR 识别靶细胞上的抗原,也不需要识别靶细胞上的 MHC 分子,因此可以在靶细胞暴露的早期行使杀伤功能,不需要事先的抗原致敏,所以称为自然杀伤。
自然杀伤的识别机制尚不清楚。一种重要的观点是 NK 细胞表面可表达两型受体:一为刺激型,可传递信号使细胞释放 IFNγ 和 THFα 等细胞因子,从而杀伤细胞;另一为相反作用的抑制型。当 NK 细胞只表达刺激型受体时才有杀伤作用。现已知抑制型受体是一种称为 Ly-49 的膜表面分子,它的配体是 MHCⅠ类分子;当细胞表达Ⅰ类分子旺盛时,NK 细胞便失去自然杀伤的能力。
2.细胞因子活化的杀伤作用 NK 细胞的杀伤活性可通过某些细胞因子(例如 IL-2)的诱导而显著增强,这样的细胞称为淋巴因子活化的杀伤细胞(lymphokine-activatedkiller,LAK)。外周血单个核细胞在含 IL- 2 的培养基中孵育便可得到 LAK 细胞,NK 细胞是其主要成分。用 LAK 细胞治疗肿瘤是颇有潜力的一种生物疗法。
3.抗体依赖的杀伤作用 NK 细胞表面有 IgG 的 Fc 受体(CD16),因此亦可通过抗体的媒介活化 NK 细胞,杀伤抗体包被的靶细胞,这种特殊的活性称为抗体依赖性细胞介导的细胞毒作用(antibody-dependentcell-mediatedcytotoxicity,ADCC)。在这种情况下,对靶细胞的识别选择取决于特异性抗体。
第三节 免疫辅佐细胞
在免疫应答过程中,淋巴细胞,尤其是 T 细胞的活化需要非淋巴细胞的参与;能够通过一系列作用帮助淋巴细胞活化的细胞称为辅佐细胞(accessorycell,AC)。
一、辅佐细胞的共性及作用
1.表达 MHCⅡ类分子所有辅佐细胞表面都表达 MHCⅡ类分子,这是辅佐细胞递呈抗原所必需的物质,是辅佐细胞的标志分子,抗原递呈的能力与表达 MHCⅡ类分子的数量相关。
2.具有吞噬作用这是辅佐细胞处理抗原的基本前提,首先它将抗原通过特定的方式吞入细胞内,进行初步消化处理,然后与 MHCⅡ类分子结合,递呈给 T 细胞。
(二)辅佐细胞的免疫活性
1.抗原递呈作用辅佐细胞能够以容易识别的方式将抗原递呈给 T 细胞,从而使 T 细胞活化;具有这项功能的细胞统称为抗递呈细胞(antigen-presentingcell,APC)。APC 通常指那些表达 MHCⅡ类分子、可向 T H细胞递呈抗原的细胞,一般情况下用作辅佐细胞的代名词。
还有一类细胞可将表面抗原与 MHCⅠ类分子结合,递呈给 Tc 细胞,结果是使 Tc 细胞活化,将递呈细胞自身杀灭,这类细胞通常称为靶细胞(targetcell)。能够表达 MHCⅠ类分子的细胞都可成为靶细胞,但一般不算作抗原递呈细胞。
2.协同刺激作用单独的抗原递呈一般不能使 T H活化,其活化还需额外的生理刺激,称为协同刺激信号(costimulatorysignal)。这种信号在 T H在跨膜蛋白 CD28 与 APC 表面的配体 B7 结合时产生。
二、辅佐细胞的类型及特点
免疫辅佐细胞包括单核吞噬细胞系统的细胞、树突状细胞和 B 细胞。以数量和功能而论,当以单核吞噬细胞为主。
(一)单核吞噬细胞系统
单核吞噬细胞系统(mononuclearphagocytesystem)包括血液中的单核细胞和组织中的巨噬细胞。这些细胞在形态上和功能上相似,并且具有同源性。单核细胞从血管内移出并分布到全身各组织中,成为巨噬细胞。巨噬细胞在不同器官有不同的名称,例如肝中的 Kupffer 细胞、肺中的尘细胞、结缔组织中的组织细胞、神经组织中的小胶质细胞、脾和淋巴结中固定和游走的巨噬细胞等。
1.单核-巨噬细胞的表面标志这些标志与其功能相关。
(1)MHCⅡ类分子:所有的单核-巨噬细胞都可表达 MHCⅡ类分子,但在吞噬功能活跃时表达旺盛。
(2)FcR 和 CR:这两种受体通过与 IgG 及补体 C3b、C4b 等的结合活性,增强单核吞噬细胞系统细胞的吞噬功能。
(3)趋化因子受体:可以感受趋化因子(chemotacticfactor)的作用而促进单核吞噬细胞系统向炎症区移动。
(4)其他受体:单核-巨噬细胞的活性可以接受许多物质的调节,例如 GM-CSF 和 M -CSF 等造血生长因子,Ils 和 IFN 等细胞因子,胰岛素和甲状旁腺素等激素都可通过相应的表面受体作用于单核-巨噬细胞。
2.单核-巨噬细胞的免疫功能
(1)吞噬作用:当病原微生物或其他外来抗原进入机体后,可首先被单核-巨噬细胞吞噬清除(只有少数病原体可在其细胞内繁殖)。这种吞噬作用通过 IgG 或补体产物而增强。
(2)产生免疫分子:单核吞噬细胞系数细胞可以分泌 IL-1,IL-6,IL-8,IL-10,IL-12 等白细胞介素,生成 α 和 β 干扰素,产生 C1~C9、B、D、H 和 I 因子站体系统分子,生成溶菌酶和胶原酶等一些胞内酶类,还可产生前列腺素和白三烯等炎症介质。
(3)向 T H细胞递呈抗原和提供协同刺激。
(二)树突状细胞
树突状细胞(dendriticcell,DC)是一类形状不规则的非单核吞噬系统细胞,特点是胞浆有许多长突起呈触须状,使整个细胞的形态象一个蜘蛛。树突状细胞分散于全身的上皮组织和实质性器官,其细胞数量不超过局部细胞总数的 1%;也可迁移到血液和淋巴,其数量不超过血液有核细胞总数的 0.1%。在不同组织中,树突状细胞有不同名称,例如血液中的树突状细胞、皮肤中的 Langerhans 细胞、淋巴液中的帆状细胞(veiledcell)、外周淋巴器官中胸腺依赖区的并指状细胞(interdigitaitngcell)等。树突状细胞来源于骨髓的前体细胞,与单核吞噬细胞系统有不同的祖细胞,但是对其发育过程目前尚了解不多。
树突状细胞的吞噬能力较弱,但细胞表面积大,且有丰富的 MHCⅡ类分子,所以捕获抗原和递呈抗原的能力很强。树突状细胞有运动能力,所以能在体内搜寻罕见的特异性 T 细胞经递呈抗原,因此树突状细胞在启动免疫应答方面有重要的意义。
另外,淋巴结皮质区内含有较多的滤泡树突状细胞(follicledendritic,FDC),这类细胞不表达 MHCⅡ类分子,不能向 T H递呈抗原;但富含 Fc 受体,能够通过结合抗体以免疫复合物的方式捕获抗原。所以 FDC 与 B 细胞的活化和再次抗体应答相关。
(三)其他辅佐细胞
B 细胞是产生抗体、主导体液免疫的中心细胞,但它表达 MHCⅡ类分子,在一定条件下可递呈抗原。B 细胞通过其 SIg(抗原受体)结合对应的抗原后,自身不能活化,必须首先处理抗原,并将有效的抗原与表面 MHCⅡ类分子连接,递呈给 T H细胞,并发放同刺激,在 T H细胞活化的同时,B 细胞自身也得到活化。但因 B 细胞的吞噬能力很弱,有能处理颗粒性抗原,所以这种抗原递呈作用受到很大的限制。
另外,还有许多细胞通常不表达 MHCⅡ类分子,但在一定的条件下受某些细胞因子诱导也可临时性地表达。例如一些上皮细胞和内皮细胞受 IFNγ 的诱导可表达 MHCⅡ类分子,临时性地起到抗原递呈细胞的作用。
除淋巴细胞和单核细胞外,血液中的其他细胞(例如中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞等)及组织中的肥大细胞也不同程度地参与免疫应答,但只作为效应细胞;它们的免疫作用将在炎症反应和超敏反应中叙述。
表 4 - 3 常用免疫细胞的简称和略语一览表
| 简称或略语 | 全称 |
| AC | 辅佐细胞 |
| APC | 抗原递呈细胞 |
| DC | 树突状细胞 |
| FDC | 滤泡树突状细胞 |
| CTL | 细胞毒性 T 细胞 |
| Mφ | 巨噬细胞 |
| B 细胞 | 骨髓(或腔上囊)依赖性淋巴细胞 |
| T 细胞 | 胸腺依赖性淋巴细胞 |
| Tc 细胞 | 细胞毒性 T 细胞 |
| TH细胞 | 辅佐性 T 细胞 |
| TS细胞 | 抑制性 T 细胞 |
| NK 细胞 | 自然杀伤细胞 |
| LAK 细胞 | 淋巴因子活化的杀伤细胞 |
第五章 细胞因子
第一节 概述
细胞因子(cytokines)是一大类能在细胞间传递信息、具有免疫调节和效应功能的蛋白质或小分子多肽。这些因子主要是由免疫细胞产生,也可由非免疫细胞如血管内皮细胞产生。细胞因子的生物活性可表现在多个方面:调节免疫应答、诱导炎症反应、影响造血功能、抗增殖作用、神经-内分泌样效应等。从广义上讲,细胞因子是免疫系统的一个组成部分,是免疫功能中不可缺少的一类活性介质。
一、细胞因子的类型
细胞因子来源广泛,靶细胞众多,生物活性复杂,因此分类方法也不统一。例如可根据其产生细胞分类:将淋巴细胞产生的称为淋巴因子(lymphokines),单核-巨噬细胞分泌的称为单核因子(autocrine)细胞因子,作用于邻近细胞的称为旁分泌性(paracrine)细胞因子,进入循环发挥作用的称为内分泌性(enkocrine)细胞因子;还可根据其功能分类:有免疫调节作用的称为调节因子(regulator),直接参与炎症反应的称为效应因子(effector)等等。
目前普遍使用的分类方法还是根据细胞因子的基本理化性状和主要生物学活性进行综合分类。主要的细胞因子有以下几种:
1.白细胞介素(interleukins,IL)为在白细胞之间传递免疫调节信息的生物分子,目前已认定了至少 15 种 IL(IL-1~15),成为免疫学中最庞大、也是最重要的一类细胞因子。
2.干扰素(interferons,IFN)为能干扰病毒在宿主细胞内复制的一类蛋白质;现已知 IFN 可分成不同的类型,有广泛的抗病毒、抗肿瘤和免疫调节作用。
3.造血生长因子(himopoieticfactors,TNF)能使造血前体细胞分化增殖的生物分子;主要作用是调节机体的造血功能,包括各种集落刺激因子和红细胞生成素等。
4.肿瘤坏死因子(tumornecrosisfactor,TNF)能使肿瘤组织坏死并能杀伤肿瘤培养细胞的一类细胞因子,其中由巨噬细胞产生的称为 TNF、由淋巴细胞产生的称为 TNF。
5.其他细胞因子除了上述几类主要的细胞因子之外,还有一些细胞因子与免疫学相关。如转化生长因子(transforminggrowthfactor,TGF)、白细胞病抑制因子(leukemiainhibitoryfactor,LIF)、癌抑制素 M(omcosatinM,OncoM)、单核细胞趋化蛋白 1(monocytechemoattractantprotein1,MCP-1)等。有些细胞因子虽然与免疫学也有关联,但其主要生物学活性不是影响免疫系统,如神经生长因子(nervegrowthfactor,NGF)、表皮生长因子(epidermalgrowthfactor,DGF)、血小板来源的生长因子(platelet-derivedgrowthfactor,PDGF)、胰岛素样生长因子(insulin-likegrowthfactor,IGF)等等。
二、细胞因子的共同特征
尽管细胞因子种类繁多,但它们具有许多共同特性,有别于免疫球蛋白和其他生物分子。其特点可概括如下:
1.多源性一种细胞因子可由多种细胞产生,几乎没有一种细胞因子是由单一类型细胞产生的。而且诱导细胞因子产生的因素也多种多样。
2.多效性每种细胞因子的生物学活性都不是单一的。各种细胞因子都是通过其特异性受体而发挥作用,但同样的受体可分布在不同类型的细胞上,因此可介导不同的生物活性。
3.高效性细胞因子多具有微量强效的特点,一般在浓度为 10-15~10-10mol/ L 时即可刺激靶细胞,表现很强遥生物学活性;与内分泌激素的效果相似,是免疫球蛋白等分子远不能及的。
4.速效性对激发因素的反应迅速是细胞因子的又一特性。虽然细胞因子一般不是预先合成储存于细胞内,但其基因的转录和分子的合成与释放极其快捷。
5.短效性一般,细胞因子基因的转录时间不象其他基因那么长,其 mRNA 分子不稳定、易分解,而且细胞因子的半衰期又很短,所以细胞因子作用的时间都很短暂。
6.局效性由于细胞因子具有短效性而且微量,所以在进入循环前多被稀释和灭活,只能靠其高效性和高速性在分泌局部发挥作用,即自分泌效应和旁分泌效应;只有少数因子在大量分泌时可进入循环发挥作用。
7.网络性各种细胞因子的生物学活性常常相互关联,一种细胞因子可以诱导另一种可子的产生,或者抑制其它因子的分泌,这种连锁的生物学效应形成了一个复杂的、开放式的细胞因子网络,共同调节机体的免疫功能及生理平衡。
8.难检性细胞因子的检测极其困难,即使用目前最敏感的免疫学方法,也难以从血清等标本中直接对细胞因子进行定量检测(详见第二十三章)。
第二节 白细胞介素
在对免疫应答的研究过程中,在丝裂原刺激的细胞培养上清中发现了许多具有生物活性的分子,研究者各以自己测得的活性进行命名,十几年报道了近百种因子。后来借助分子生物学技术进行比较研究发现,以往许多以生物活性命名的因子实际上是具有多效性的同一物质。为了避免命名的混乱,1979 年第二届国际淋巴因子专题会议将免疫应答过程中白细胞间相互作用的细胞因子统一命名为白细胞介素(interleukin,IL),在名称后加阿拉伯数字编号以示区别,例如 IL-1、IL-2……,新确定的因子依次命名。只有取行克隆化的基因、明确产物的性质和活性才能得到国际会议的认可。
白细胞介素是非常重要的细胞因子家族,现在得到承认的成员已达 15 个;它们在免疫细胞的成熟、活化、增殖和免疫调节等一系列过程中均发挥重要作用,此外它们还参与机体的多种生理及病理反应。
一、白细胞介素 1
(一)IL- 1 的一般性质
1.IL- 1 的产生细胞 IL- 1 主要由巨噬细胞产生;此外几乎所有的有核细胞,如 B 细胞、NK 细胞、体外培养的 T 细胞、角质细胞、树突状细胞、星形细胞、成纤维细胞、中性粒细胞、内皮细胞以及平滑肌细胞均可产生 IL-1。正常情况下只有皮肤、汗液和尿液中含有一定量的 IL-1,绝大多数细胞在受到外来抗原或丝裂原刺激后才能合成和分泌 IL-1。
2.IL- 1 分子 IL- 1 有两种不同的分子形式,一种称 IL-1α,由 159 个氨基酸组成;另一种称为 IL-1β,含 153 个氨基酸;两者由不同的基因分别编码。虽其氨基酸顺序仅有 26%的同源性,然而 IL-1α 和 IL-1β 以同样的亲和力结合于相同的细胞表面受体,发挥相同的生物学作用。
3.IL- 1 受体(IL-1R)IL-1R 几乎存在于所有有核细胞表面,每个细胞的 IL-1R 数目不等,少则几十个(如 T 细胞),多则数千个(如成纤维细胞)。IL-1R 主要有两种类型:一种为 IL-1R1,其分子伸入胞浆内的肽链部分较长,起着传递活化信号的作用;另一种为 IL-1R2,胞内部分的肽段较短,不能有效地传递信号,而是将胞外部分的肽链释放到细胞外液中,以游离形式与 IL- 1 结合,发挥反馈抑制作用。GM-CSF、G-CSF 及 IL- 1 自身均可提高细胞 IL-1R 的表达水平,而 TGF 及皮质类固醇能降低 IL-1R 的表达。
(二)IL- 1 的生物学活性
1.局部作用局部低浓度的 IL- 1 主要发挥免疫调节作用。①与抗原协同作用,可使 CD4+ T 细胞活化,IL-2R 表达;②促进 B 细胞生长和分化,可使脾细胞的溶血空斑数(PFC)增加 100 倍,这说明 IL- 1 也促进抗体的形成;③促进单核-巨噬细胞等 APC 的抗原递呈能力;④与 IL- 2 或干扰素协同可以增强 NK 细胞活性;⑤吸引中性粒细胞,引起炎症介质释放;⑥可刺激多种不同的间质细胞释放蛋白分解酶并产生一些效应;例如类风湿关节炎的滑膜病变(胶原破坏、骨质重吸收等)就是由于关节囊内 Mφ 受刺激后活化并分泌 IL-1,使局部组织间质细胞分泌大量的前列腺素和胶原酶,分解坏滑膜所致;⑦IL- 1 对软骨细胞、成纤维细胞和骨代谢也均有一定影响。
2.全身性作用动物实验证明,IL- 1 的大量分泌或注射可以通过血循环引起全身反应。①作用于下丘脑可引起发热,具有较强的致热作用。这种作用与细菌内素明显不同:IL- 1 致热曲线为单向、潜伏期 200min 左右,而内毒素致热曲线为双向,潜伏期至少为 1h;IL- 1 对热敏感、易破坏,而内毒素耐热;给家兔反复注射内毒素可出现耐受,但对 IL- 1 不会耐受。②刺激下丘脑释放促肾上腺皮质素释放激素,使垂体释放促肾上腺素,促进肾上腺素释放糖皮质激素,对 IL- 1 有反馈调节作用。③作用于肝细胞使其摄取氨基酸的能力增强,进而合成和分泌大量急性期蛋白,如 α2 球蛋白、纤维蛋白原、C- 反应蛋白等。④使骨髓细胞库的中性粒细胞释放到血液,并使之活化;增强其杀伤病原微生物的能力和游走能力。⑤与 CSF 协同可促进骨髓造血祖细胞增殖能力,使之形成巨大的集落;还可诱导骨髓基质细胞产生多种 CSF 并表达相应受体,从而促使造血细胞定向分化。
IL- 1 虽未广泛用于人体研究,但其对免疫系统的特殊作用使它在临床应用方面具有诱人的前景。另外,由于 IL- 1 也参与机体的多种病理过程,所以研究 IL- 1 抑制物可能也具有实际意义。现已克隆出 IL- 1 受体拮抗剂(IL-1receptorantagonist,IL-1ra),该物质可在体内外封闭 IL- 1 的活性,是一种较理想的 IL- 1 封闭因子。
二、白细胞介素 1
(一)IL- 2 的一般性质
1.IL- 2 的产生细胞 IL- 2 主要由 T 细胞(特别是 CD4+ T 细胞)有受抗原或丝裂原刺激后合成;B 细胞、NK 细胞及单核-巨噬细胞亦能产生 IL-2。
2.IL- 2 分子 IL- 2 分子量为 15kD,是含有 113 个氨基酸残基的糖蛋白,在人类由第 4 号染色体上的一个基因编码。IL- 2 具有一定的种属特异性,人类细胞只对灵长类来源的 IL- 2 起反应,而几乎所有种属动物的细胞均对人的 IL- 2 敏感。
3.IL- 2 受体(IL-2R)IL- 2 的靶细胞包括 T 细胞、NK 细胞、B 细胞及单核-巨噬细胞等。这些细胞表面均可表达 IL-2R。IL-2R 包含 3 条多肽链:1 条为 α 链,分子量 55kD;1 条为 β 链,分子量 75kD;另 1 条为 γ 链,分子量 64kD。α 链的胞内区较短,不能向细胞内传递信号,而 β 链和 γ 链的胞内区较长,具有传递信号的能力。3 种肽链单独与 IL- 2 结合亲和力较低,只有同时表达才能产生高度亲和力。
(二)IL- 2 的生物活性
1.刺激 T 细胞生长各种刺激物活化的 T 细胞一般不能在体外培养中长期存活,加入 IL- 2 则能其长期持续增殖,因此 IL- 2 曾被命名为 T 细胞生长因子(Tcellgrowthfactor,TCGF)。静止的 T 细胞表面不表达 IL-2R,对 IL- 2 没有反应;受丝裂原或其它刺激活化后 T 细胞才能表达 IL-2R,成为 IL- 2 的靶细胞;而 IL- 2 又可诱导靶细胞增加 IL-2R 的表达。在活体内,IL- 2 对 CD4+ T 细胞的作用是通过自分泌途径实现的,因为活化的 CD4+ T 细胞能够产生大量的 IL-2;而 CD8+ T 细胞则通过旁分泌途径来维持细胞的生长。IL-2R 在 T 细胞上的表达是一过性的,一般在活化后 2~3 天达到高峰,6~10 天左右消失。随着 IL-2R 的消失,T 细胞即失去对 IL- 2 的反应能力。因此若要维持正常 T 细胞在体外长期生长,必须不断地用丝裂原或其它刺激物去刺激 T 细胞,以维持 IL-2R 的表达。
2.诱导细胞毒作用①接受了预刺激信号的 CD8+ T 细胞可以受 IL- 2 的作用活化为 CTL,发挥细胞毒作用;在一定条件下,CD4+ T 细胞也可受 IL- 2 的诱导而具有杀伤作用。②NK 细胞是唯一正常情况下表达 IL-2R 的淋巴样细胞,因此始终对 IL- 2 保持反应性。然而静止的 NK 细胞上只表达 IL-2R 的 β 链和 γ 链,对 IL- 2 的亲和力低,只能对高浓度的 IL- 2 发生反应。一旦 NK 细胞活化,就表达 IL-2R 的 α 链,成为高亲和力的受体;大剂量的 IL- 2 诱导的 LAK 活性主要 NK 细胞。③使 T 细胞作 NK 细胞产生 IFNγ、TNFβ 和 TGFβ 等因子,促进非特异性细胞毒素;还可诱导产生某些 B 细胞生长因子以及造血生长因子等,从而发挥相应的生物学作用。
3.对 B 细胞的作用 IL- 2 对 B 细胞的生长及分化均有一定的促进作用。活化的或恶变的 B 细胞表面表达高亲和力 IL-2R,但是密度较低;较高密度的 IL- 2 可诱导 B 细胞生长繁殖,促进抗体分泌,并诱使 B 细胞由分泌 IgM 向着分泌 IgG2 转换。
4.对巨噬细胞的作用人类单核-巨噬细胞表面在正常时兴有少量 IL-2Rβ 链的表达,但是受到 IL-2、IFNγ 或其它活化因子作用后,可表达高亲和力 IL-2R。单核-巨噬细胞受到 IL- 2 的持续作用后,其抗原递呈能力、杀菌力、细胞毒性均明显增强,分泌某些细胞因子的能力也得到加强。
(三)IL- 2 的应用研究
由于 IL- 2 能诱导和增强细胞毒活性,目前应用 IL- 2 治疗某些疾病、特别是对肿瘤治疗的研究得到了广泛开展,单独使用 IL- 2 或与 LAK 细胞等(详见第四章)联合使用治疗肿瘤取得了一定的疗效;还可望用于病毒感染、免疫缺陷病及自身免疫病的治疗。
但 IL- 2 的副作用也日益引起人们的注意:IL- 2 可引起发热、呕吐等一般症状,还可导致水盐代谢紊乱和肾、肝、心、肺等功能异常;最常见、最严重的是毛细血管渗漏综合征,使患者不得不中止治疗。IL- 2 的副作用常与 IL- 2 的剂量及用药时间呈相关,停止用药后症状多迅速减轻或消失。IL- 2 引起副作用的机制是多方面的,但主要是间接性的,即 IL- 2 诱导产生的某些因子或杀伤性细胞起着重要作用;现已知 LAK 细胞可通过溶解血管内组织而导致多种副作用。给予适当药物(如吲哚美辛、哌替啶、对乙酰基氨酚等)、采取联合用药、改进给药方式(如少量多次短时间输注)和给药途径(如改全身用药为肿瘤局部用药)等将有效地减轻不良反应。
三、其他白细胞介素
(一)IL-3
IL- 3 又称为多能集落刺激因子(multi-CSF),主要由活化的 CD4+ T 细胞产生。其主要作用为促进骨髓中多能造血干细胞的定向分化与增殖,产生各种类型的血细胞。此外 IL- 3 还可调节多种成熟细胞的生长、分化及相关的基因表达,如 c -myc、IL-2Rα 基因等。IL- 3 分子量约为 15kD,其化学本质为糖蛋白。人类的 IL- 3 基因位于第 5 号染色体长臂区,1987 年人 IL- 3 克隆成功,并产生重组 IL-3。由于 IL- 3 对早期阶段造血细胞的作用较广,可望用于放疗或化疗后患者的骨髓重键。
(二)IL-4
IL- 4 由抗原或丝裂原刺激的 CD4+ T 细胞产年,活化的肥大细胞亦可产生 IL-4。人和小鼠的 IL-4cDNA 均已克隆成功,并获得了相应的重组产品。人 IL- 4 基因与 IL-3、IL- 5 一样,位于第 5 号染色体上。成熟 IL- 4 分子量为 18~19kD 的糖蛋白。
IL- 4 的生物学活性包括以下几个方面:①促使抗原或丝裂原活化的 B 细胞分裂增殖,但其作用远弱于 IL-2;然而 IL- 4 能促使静止的 B 细胞表达 MHCⅡ类分子,增强 B 细胞的抗原递呈能力,因此曾称为 B 细胞刺激因子。IL- 4 是 Ig 重链基因类转换的主要调节因子,能促使 B 细胞表达和分泌 IgE。此外,IL- 4 还能诱导 B 细胞表达低亲和力 Fc 受体。②象 IL- 2 一样,IL- 4 也是 CD4+ T 细胞的自分泌性生长因子;此外,IL- 4 还能促进 Tc 细胞的活性。③IL- 4 不能刺激巨噬细胞增殖,但可增强巨噬细胞的功能;巨噬细胞受刺激后Ⅱ类抗原和 FcγR 的表达量均明显增加;同时巨噬细胞递呈抗原的能力及对肿瘤细胞的细胞毒素作用也显著增强。④IL- 4 与 IL- 3 协同可维持和促进肥大细胞的增殖,在某些起敏反应性疾病发生中具有一定的意义;可与 CSF 协同作用,促进骨髓造血前体细胞的增殖,诱导髓样细胞定向分化;诱导内皮细胞表达血管细胞粘附分子 -1(VCAM-1),对淋巴细胞的迁移具有一定意义。
(三)IL-5
与 IL- 4 一样,IL- 5 也由抗原活化的 CD4+ T 细胞产生;肥大细胞也能产生 IL-5。天然 IL- 5 的分子量为 40~50kD,是由二硫键连接的二聚体糖蛋白,但是单体 IL- 5 也有 IL- 5 活性。
IL- 5 曾补称为 T 细胞替代因子(Tcellreplacingfactor,TRF),后来发现人类的 IL- 5 对 B 细胞没有明显的刺激作用;其主要功能是刺激嗜酸性粒细胞增殖、分化及活化。IL- 5 不仅使嗜酸性粒细胞的数量增加,而且能增强其功能。在蠕虫感染和过敏性疾病时出现的嗜酸性粒细胞增多主要是由 IL- 5 引起的。人类 IL- 5 还能促进嗜碱性粒细胞释放组胺和白三烯等炎症介质,从而提高嗜碱性粒细胞的活性。
(四)IL-6
IL- 6 可由多种细胞合成,包括活化的 T 细胞和 B 细胞、单核-巨噬细胞、内皮细胞、上皮细胞以及成纤维细胞等。人类 IL- 6 基因位于第 7 号染色体上;IL- 6 分子量在 21~30kD 之间,其差异是由于肽链的糖基化和磷酸程度不同所致。IL- 6 由 2 条糖蛋白链组成;1 条为 α 链,分子量 80kD;另 1 条为 β 链,分子量 130kD。α 链缺少胞内区,只能以低亲合性与 IL- 6 结合,所形成的复合物迅即与高亲和性的 β 链结合,通过 β 链向细胞内传递信息。
IL- 6 作用的靶细胞很多,包括巨噬细胞、肝细胞、静止的 T 细胞、活化的 B 细胞和浆细胞等;其生物效应也十分复杂,曾称为 B 细胞刺激因子 2(BSF-2)、26kD 蛋白、B 细胞分化因子(BCDF)、肝细胞刺激因子(HSF)等。①促进 T 细胞表面 IL-2R 的表达,增强 IL- 1 和 TNF 对 T H细胞的致有丝分裂作用。②作为肝细胞刺激因子,在感染或外伤引起的急性炎症反应中诱导急性期反应中诱导急性期反应蛋白的合成,其中以淀粉状蛋白 A 和 C - 反应蛋白增加尤为明显。③促进 B 细胞增殖、分化并产生抗体;多发性骨髓瘤的恶变 B 细胞既能产生 IL-6,又能对 IL- 6 发生应答,提示 IL- 6 可能作为这些细胞的自分泌性生长因子。④IL- 6 还能有效地促进 TNF 和 IL- 1 诱导的恶病质;促进糖皮质激素合成;刺激破骨细胞活性和角质细胞生长;还能促进骨髓造血的功能。IL- 6 不能刺激相应细胞分泌其它细胞因子,在生理浓度下对免疫细胞的自分泌作用亦比较弱,提示其主要免疫学功能是加强其它细胞因子的效果。
(五)IL-7
IL- 7 是由骨髓基质细胞分泌的糖蛋白,分子量为 25kD;其基因位于第 8 号染色体。现多采用基因工程手段,从转染含 IL-7cDNA 表达性质粒的哺乳类细胞培养上清中获取 IL-7。
IL- 7 的靶细胞主要为淋巴细胞,对来自人或小鼠骨髓的 B 祖细胞、胸腺细胞及外周成熟的 T 细胞等均有促生长活性。①与干细胞生长因子(SCF)协同能够刺激 B 前体发生有丝分裂,这一效应可被 TGF 和所抑制;但对 B 祖细胞(pro-B)的生长没有明显作用。②促进双阴性胸腺细胞的成熟,提供胚胎胸腺细胞发育过程中 TCR 基因重组的始动信号;但对成熟 T 细胞无明显作用。③诱导胸腺细胞或外周血淋巴细胞产生 LAK 细胞活性,其效应细胞主要为 CD8+亚群;但 IL- 7 诱导的 LAK 细胞不具有 NK 活性。④IL- 7 能刺激髓样前体细胞和巨核细胞产生集落形成单位和血小板,使机体从环磷酰胺的免疫抑制作用中恢复过来;在较高浓度时,IL- 7 还能增强巨噬细胞的细胞毒活性,诱导单核细胞分泌细胞因子。
(六)IL-8
IL- 8 主要由单核-巨噬细胞产生;其他如成纤维细胞、上皮细胞、内皮细胞、肝细胞等亦可在适宜的刺激条件下产生 IL-8。IL- 8 的分子量约 8kD,主要活性形式为 72 个氨基酸。IL- 8 的氨基酸顺序与许多炎症因子有较高的同源性,属于同一个家族;现初步证实 IL- 8 家族(亦称 PF4 家族)至少有 12 个成员。IL- 8 可以分成 α 和 β 亚群,α 亚群的基因位于第 4 号染色体上,β 亚群的基因位于第 17 号染色体上。IL- 8 的受体也有两型:一种只能与 IL- 8 结合,而另一种还能结合其它的趋化因子;中性粒细胞和嗜碱性粒细胞表面均表达丰富的 IL- 8 受体。
IL- 8 的主要生物学活性是吸引和激活中性粒细胞,曾被命名为中性粒细胞激活肽(NAF)、粒细胞趋化肽(GCP)、中性粒细胞激活因子(NAF)等。中性粒细胞与 IL- 8 接触后发生形态变化,定向游走到反应部位并释放一系列活性产物;这些作用可导致机体局部的炎症反应,达到杀菌和细胞损伤的目的。此外 IL- 8 对嗜酸性粒细胞、嗜碱性粒细胞和淋巴细胞也有一定作用。
(七)IL-9
IL- 9 主要是由 T H细胞产生,成熟分子含 126 个氨基酸,包括 10 个半胱氨酸;由于糖基化不同,分子量为 30~40kD;经过 N - 聚糖酶处理后,分子量降到 15kD。2- 巯基乙醇可使 IL- 9 失活,表明分子间二硫键在维持分子生物学活性方面十分重要。
IL- 9 可在无 IL- 2 和 IL- 4 的情况下维持 T H细胞长期生长;IL- 9 还可促进某些骨髓样白血病细胞系(如 MOTE)的生长,提示其可能还参与造血过程的调控。IL- 9 与其它白细胞介素的关系尚不清楚,但与 IL- 2 明显的不同是不能诱导 CTL 和 LAK 等细胞毒活性,但能维持非抗原依赖性 T H细胞的长期生长。此外,IL- 9 还促进肥大细胞的生长及活性。
(八)IL-10
IL-10 的分子量为 35~40kD,通常为二聚体;主要由 T H 2 细胞产生,也可由单核细胞、角质细胞及活化的 B 细胞产生。
IL-10 能够抑制活化的 T 细胞产生细胞因子,因此曾称为细胞因子合成抑制因子(CSIF),特别是抑制 T H1细胞产生 IL-2、IFNγ 和 LT 等细胞因子,从而抑制细胞免疫应答。IL-10 可降低单核-巨噬细胞表面 MHCⅡ类分子的表达水平,损害了 APC 的抗原递呈能力,实际上这可能是其抑制细胞介导免疫的原因。此外,IL-10 还能抑制 NK 细胞活性,干扰 NK 细胞和巨噬细胞产生细胞因子;但可刺激 B 细胞分化增殖,促进抗体生成。
(九)IL-11
IL-11 由骨髓基质细胞产生,分子量约为 23kD,是造血微环境中一个多功能的调节因子。
IL-11 可刺激浆细胞增殖及 T 细胞依赖的 B 细胞发育;促进巨核细胞的形成及成熟,提高外周血血小板数目;与 IL- 3 和 IL- 4 协同作用刺激休止期造血干细胞的增殖;影响红细胞的生成及分化;调节肝细胞血浆蛋白基因的表达,诱导急性期蛋白生成。
(十)IL-12
IL-12 主要由 B 细胞和巨噬细胞产生;其分子是一种异型二聚体,40kD(P40)和 35kD(P35)的 2 个亚基通过二硫键相连接。
IL-12 主要作用于 T 细胞和 NK 细胞,曾被命名为细胞毒性淋巴细胞成熟因子(CLMF)和 NK 细胞刺激因子(NKSF)。IL-12 可刺激活化型 T 细胞增殖,促进 T H 0 细胞细胞向 T H 1 细胞分化;诱导 CTL 和 NK 细胞的细胞毒活性并促进其分泌 IFNγ、TNFα、GMCSF 等细胞因子;促进 NK 细胞和 IL-2Rα、TNF 受体及 CD56 分子的表达,增强对肿瘤细胞的 ADCC 效应。
由于 IL-12 在抗肿瘤免疫及抗感染免疫中的重要作用,人们对其临床应用寄予厚望;特别是 IL-12 可协同 IL- 2 促进 CTL 和 LAK 细胞的产生表明,IL-12 与 IL- 2 联用可望构成一种更有效的肿瘤免疫治疗方法。
(十一)IL-13
IL-13 由 T H 2 细胞产生,分子量约 10kD;其基因位于第 5 号染色体上,与 IL- 4 基因紧密连接。IL-13 分子的氨基酸顺序与 IL- 4 有 20%~25%的同源性,在功能上也与 IL- 4 有许多相似之处。
IL-13 可诱导单核细胞分化,增强其 MHCⅡ类分子的表达;抑制 LPS 诱导的单核因子分泌,控制炎症反应;诱导 B 细胞增殖及合成 IgE 类抗体,增强 B 细胞表面 MHCⅡ类分子、CD23 及 CD72 的表达;协同 IL- 2 刺激 NK 细胞产生 IFN,从而促进单核-巨噬细胞活化和 T H 1 型细胞免疫反应。最近还发现,IL-13 还具有抑制 HIV- 1 在巨噬细胞内复制,诱导中性粒细胞中 IL-1ra 基因表达和蛋白质合成等多种功能。
(十二)IL-14
IL-14 由 T 细胞分泌,其成熟形式含 468 个氨基酸残基,可刺激活化的 B 细胞增殖,抑制丝裂原诱导的 B 细胞分泌免疫球蛋白。
(十三)IL-15
IL-15 是新近发现的一种因子,可由活化的单核-巨噬细胞、表皮细胞和成纤维细胞等多种细胞产生。IL-15 的分子结构与 IL- 2 有许多相似之外,因此可以利用 IL- 2 受体的 β 链和 γ 链与靶细胞结合,发挥类似 IL- 2 的生物学活性。
IL-15 可诱导 B 细胞增殖和分化,是唯一能部分取代 IL- 2 诱导初期抗体产生的细胞因子;IL-15 能够刺激 T 细胞和 NK 细胞增殖,诱导 LAK 细胞活性,还能与 IL-12 协同刺激 NK 细胞产生 IFNγ。
第三节 干扰素
一、干扰素的性质及类型
干扰素是由多种细胞产生的具有广泛的抗病毒、抗肿瘤和免疫调节作用的可溶性糖蛋白。干扰素在整体上不是均一的分子,可根据产生细胞分为 3 种类型:白细胞产生的为 α 型;成纤维细胞产生的为 β 型;T 细胞产生的为型。根据干扰素的产生细胞、受体和活性等综合因素将其分为 2 种类型:Ⅰ型和Ⅱ型。
1.Ⅰ型干扰素又称为抗病毒干扰素,其生物活性以抗病毒为主。Ⅰ型干扰素有 3 种形式:IFNα、IFNβ 和 IFNω。IFN 主要由白细胞产生,含有至少 14 种不同基因编码的蛋白质,各成分之间氨基酸顺序的同源性约为 90%,成熟的 IFNα 的分子量约 1820kD。IFNβ 是单一基因的产物,主要由成纤维细胞和白细胞以外的其他细胞产生;分子量 20kD,与 IFNα 的同源性在氨基酸水平上仅为 30%,在核苷酸水平上约 45%。IFNω 的基因有 6 个,但其中只有 1 个是有功能的;IFNω 与 IFNα 的基因相近,而且其主要产生细胞也为白细胞。IFNα、β 和 ω 的受体为同一种分子,其基因位于第 21 号染色体上,表达在几乎所有类型的有核细胞表面,因此其作用范围十分广泛。多数Ⅰ型干扰素对酸稳定,在 pH2.0 时不被破坏。
2.Ⅱ型干扰素又称免疫干扰素或 IFN,主工由 T 细胞产生;主要活性是参与免疫调节,是体内重要的免疫调节因子。IFNγ 与Ⅰ型干扰素几乎在所有方向均有不同:IFNγ 只有一种活性形式的蛋白质,由一条分子量为 18kD 的多肽链进行不同程度的糖基化修饰而成;IFNγ 的基因只有一个,位于人类第 12 号染色体上;IFNγ 的受体与Ⅰ型干扰素的受体无关,其基因位于第 6 号染色体上,但也同样表达在多数有核细胞表面;IFNγ 对酸不稳定,在 pH2.0 时极易破坏,利用此特性可以很容易地将其与Ⅰ型干扰素区分开来。
二、干扰素的诱导及产生
正常情况下组织或血清中不含干扰素,只有在某些特定因素的作用下才能诱使细胞产生干扰素。Ⅰ型干扰素的主要诱生剂是病毒及人工合成的双链 RNA,此外某些细菌和原虫感染及某些细胞因子也能诱导Ⅰ型干扰素的产生。IFNα 和 ω 的表达细胞非常局限,以白细胞为主;但 IFNβ 则可由几乎所有的有核细胞产生。IFNγ 由 CD8+ T 细胞和某些 CD4+ T 细胞(特别是 T H 1 细胞)产生,NK 细胞亦可合成少量的 IFNγ;这些细胞只有在免疫应答中受到抗原或丝裂原活化后才能分泌 IFNγ。
三、干扰素的生物活性
干扰素的生物活性有较严格的种属特异性,即某一种属细胞产生的干扰素,只能作用于相同种属的细胞。Ⅰ型干扰素的抗病毒作用较强,而Ⅱ型干扰素则具有较强的抑制肿瘤细胞增殖和免疫调节作用。目前,国内外均已利用基因工程技术批量生产重组人 IFNα、IFNβ、IFNγ,并投入抗病毒和肿瘤治疗的临床研究。
1.抗病毒作用Ⅰ型干扰素具有广谱的抗病毒活性,对多种病毒如 DNA 病毒和 RNA 病毒均有抑制作用;但这种效应不是直接的,而是通过对宿主细胞的作用引起的。①对干扰素敏感的细胞表面存在于干扰素受体,核内有“抗病毒蛋白”基因,受干扰素作用后该基因活化,产生的抗病毒蛋白可阻止病毒 mRNA 翻译,并促进病毒 mRNA 降解。②干扰素能提高细胞表面 MHCⅠ类分子的表达水平,受到病毒感染的细胞表面 MHCⅠ类分子的增加有助于向 Tc 细胞递呈抗原,引起靶细胞的溶解。③干扰素可增强 NK 细胞对病毒感染的杀伤能力。
2.抗肿瘤作用Ⅰ型干扰素能抑制细胞的 DNA 合成,减慢细胞的有丝分裂速度;这种抑制作用有明显的选择性,对肿瘤细胞的作用比对正常细胞的作用强 500~1000 倍。另外,Ⅱ型干扰素也可通过增强机体免疫机制、加强免疫监督功能来实现其抗肿瘤效应。
3.免疫调节作用干扰素的免疫调节作用表现在对宿主免疫细胞活性的影响,如对巨噬细胞、T 细胞、B 细胞和 NK 细胞等均有一定作用。
(1)对巨噬细胞的作用:IFNγ 可使巨噬细胞表面 MHCⅡ类分子的表达增加,增强其抗原递呈能力;此外还能增强巨噬细胞表面表达 Fc 受体,促进巨噬细胞吞噬免疫复合物、抗体包被的病原体和肿瘤细胞。
(2)对淋巴细胞的作用:干扰素对淋巴细胞的作用较为复杂,可受剂量和时间等因素的影响而产生不同的效应。在抗原致敏之前使用大剂量干扰素或将干扰素与抗原同时投入会产生明显的免疫抑制作用;而低剂量干扰素或在抗原致敏之后加入干扰素则能产生免疫增强的效果。在适宜的条件下,IFNγ 对 B 细胞和 CD8+ T 细胞的分化有促进作用,但不能促进其增殖。IFNγ 能增强 T H 1 细胞的活性,增强细胞免疫功能;但对 T H 2 细胞的增殖有抑制作用,因此抑制体液免疫功能。IFNγ 不仅抑制 T H 2 细胞产生 IL-4,而且抑制 IL- 4 对 B 细胞的作用,特别是抑制 B 细胞生成 IgE。
(3)对其它细胞的作用:IFNγ 对其他细胞也有广泛影响:①刺激中性粒细胞,增强其吞噬能力;②活化 NK 细胞,增强其细胞毒作用;③使某些正常不表达 MHCⅡ类分子的细胞(如血管内皮细胞、某些上皮细胞和结缔组织细胞)表达 MHCⅡ类分子,发挥抗原递呈作用;④使静脉内皮细胞对中性粒细胞的粘附能力更强,且可分化为高内皮静脉,吸引循环的淋巴细胞。
第四节 肿瘤坏死因子
一、肿瘤坏死因子的性质及类型
人 TNF 有两种分子形式,一种称为 TNFα,另一种称为 TNFβ。TNFα 由细菌脂多糖活化的单核-巨噬细胞产生,可引起肿瘤组织出血坏死,也称恶病质素(cachectin);TNFβ 由抗原或丝裂原刺激的淋巴细胞产生,具有肿瘤杀伤及免疫调节功能,又称淋巴毒素(lymphotoxin,LT)。尽管两型 TNF 有不同的细胞来源,DNA 水平上也仅有 28%的核苷酸序列同源,但两者结合于相同的膜受体,并且具有非常相似的生物学功能。
人 TNFα 和 β 的基因均位于第 6 号染色体。成熟 TNFα 的分子量约 17kD,而 TNFβ 略呈异质性,为 2025kD。TNF 受体存在于几乎所有的有核细胞表面,目前已发现两种 TNF 受体(TNFRⅠ和 TNFRⅡ)。TNFRⅡ的亲和力比较强,TNFRⅠ的亲和力相对弱一些。两者与 TNF 结合后产生的效应有所不同,TNFRⅠ主要增强细胞毒细胞的活性和促进成纤维细胞生长,击 TNFRⅡ主要是增进 T 细胞增殖。
二、肿瘤坏死因子的生物效应
最初对 TNF 功能的认识仅限于对肿瘤的特异性杀伤作用,后来发现 TNF 也具有免疫调节作用,而且参与某些炎症反应的过程。TNF 的生物活性与 IL- 1 十分相似,只是 TNF 的毒性较大,更易引起血管阻塞,抗肿瘤作用更强。低浓度的 TNFα 主要在局部发挥作用,高浓度的 TNFα 可以进入血流,引起全身性反应。近来的研究表明人和小鼠 TNFα 和 β 的基因都与 MHC 基因紧密连锁,暗示其可能参与免疫调节基因的表达调控。
1.抗肿瘤及抑瘤作用 TNF 对多种肿瘤细胞均有杀伤或抑制作用,敏感性因肿瘤细胞类型而异。TNF 抗瘤机制尚不完全清楚,可能包括①通过 TNF 受体介导的直接效应;②诱导组织内凝血活性,导致病理性凝血,阻断进入瘤区的血流;③诱导肿瘤局部的炎症反应及血管改变;④介导多种细胞的杀瘤性效应,如自然细胞毒细胞(NC)、杀瘤性单核-巨噬细胞等。
2.抗病毒作用 TNF 呈剂量依赖性地抑制病毒介导的细胞病变的发展,对 RNA 病毒和 DNA 病毒均有抑制作用。TNF 的抗病毒活性与抗瘤活性一样没有明显的种属特异性,抗病毒的机制不是通过诱导干扰素的间接作用,与 TNF 的细胞毒性也无直接关系。除诱导未感染细胞有抗病毒能力之外,TNF 也可选择性杀伤病毒感染的细胞。现还证实,多种病毒、polyⅠ:C 等也可刺激 TNF 的产生。
3.免疫调节作用 TNF 能够增强 T 细胞产生以 IL- 2 为主的淋巴因子,提高 IL-2R 的表达水平,从而促进 T 细胞的增殖;还能促进 B 细胞增殖、分化和产生抗体。
此外,TNF 能诱导单核-巨噬细胞系统的前体细胞分化,增加其吞噬能力和氧化代谢水平,扩大单核-巨噬细胞对肿瘤的 ADCC 效应,提高巨噬细胞的抗原递呈能力;TNF 可增加某些细胞的 MHCⅠ类分子的表达,协同 IFNγ 诱导 MHCⅡ类分子的表达;近来还发现 TNF 可促进骨髓基质细胞和巨噬细胞产生 CSF,特别是 GM-CSF,可促使骨髓释放中性粒细胞和巨噬细胞。
4.诱发炎症反应 TNF 有中性粒细胞和单核细胞趋化作用,并使之活化和脱颗粒,释放炎症介质。TNF 作用于血管内皮细胞,一方面提高粘附分子的表达水平,促进对中性粒细胞的粘附作用;一方面诱使血管内细胞产生其它炎症介质,如 PG、IL- 6 和 IL- 8 等,与白细胞产生的介质共同引起局部的炎症反应;活化的血管内皮细胞还可释放凝血第三因子,启动凝血过程,引起小血管阻塞,造成局部组织(如肿瘤组织)血液供给中断和出血坏死,这是 TNF 得以被发现的主要特征。细菌内毒素休克时发生的弥漫性血管凝血(DIC)即是由于大量的 TNF 产生和释放人血所致。此外,TNF 还可诱导肝细胞合成急性期反应蛋白,是 IL- 1 之外又一个急性期反应的强力诱导剂。
5.对结缔组织的作用 TNF 可刺激成骨细胞内的碱性磷酸酶活性,诱导成骨细胞吸收骨质、促进软骨细胞进行软骨更新,抑制新骨形成。TNF 还能刺激成纤维细胞和滑膜细胞的增生,引起关节组织的纤维化和增厚。
三、肿瘤坏死因子的应用研究
由于 TNF 的抗肿瘤作用和多种免疫调节功能,TNF 疗法的临床研究已在许多国家开展。动物实验和临床实验均表明,TNF 对某些肿瘤具有明显的抑制作用;但是由于副作用较大,为 TNF 的临床应用造成困难。TNF 的副作用包括发热、头痛、恶心、呕吐、全身倦怠、肌肉酸痛等;高剂量时可导致休克、肾功能不全和 DIC 形成等。建立合理的用药方案及治疗措施,可望降低用量,减轻副作用,达到最佳治疗效果。
静脉注射 rhTNF 可使部分肿瘤缩小,但是副作用大,人体很难耐受。瘤内注射可在局部出现坏死,且副作用较轻,对某些肿瘤的治疗效果优于静脉注射。已报告的有效病例包括肾癌、胃癌、肝癌等,并使转移性大肠癌腹水减少。鉴于 TNF 可直接杀伤瘤细胞而有损伤正常细胞,比化疗药物毒性小,rhTNF 可望较其他细胞因子更快地大量应用于临床。
单独使用 TNF 用量大,不容易获得好的效果,患者常因不能耐受其副作用而中止用药。将其它具有肿瘤抑制作用的细胞因子(如 IL-2、IFN 等)或某些抗肿瘤药物与 TNF 联合应用,既可减少各种药物的用量、降低毒副作用,又可提高疗效,不失为肿瘤治疗的一种可行方法。此外,由于 TNF 对肺癌的杀伤能力有明显的温度依赖性,在 40℃条件下杀瘤活性最强,因此结合温热疗法可能有助于降低 TNF 用量,增加疗效。
第五节 造血生长因子
造血生长因子是促进骨髓造血细胞分化增殖和定向成熟的一系列活性蛋白;可分成两大组:第一组是集落刺激因子(colonystimulatingfactor,CSF),能刺激体外培养的造血前体细胞形成定向分化的细胞克隆,但不能直接作用于淋巴细胞;第二组是白细胞介素(IL-1、2、3、4、5、6、7、8、9、10、11),可直接作用于淋巴细胞,亦能作用于造血前体细胞,促进其分化成熟,其中 IL- 3 又称多能集落刺激因子。
(一)红细胞生成素
红细胞生成素(erythropoitin,EPO)是一种糖蛋白,分子量约 30~39kD,主要由肾小管内皮细胞合成,也可由肝细胞和巨噬细胞产生。EPO 是一种强效的造血生成因子,在 0.05~1U/ml 时即呈剂量依赖效应。EPO 活性单一,只作用于骨髓巨核前体细胞,可刺激红祖细胞及早幼红细胞形成成熟的红细胞集落;对红细胞造血过程的调节需其他细胞因子(如 IL-3、GM-CSF 和 IL- 1 等)的协同作用才能完成。EPO 的产生受机体内血容量和氧分压的调节,在失血或低氧的刺激下,EPO 水平迅速上升。在某些肿瘤患者,可也现 EPO 异常增高;骨髓造血反应不良的贫血患者,其 EPO 也升高。
EPO 是最早应用于临床的细胞因子,是迄今所知作用最单一、且安全可靠的升血红蛋白制剂。对于肾贫血、再生障碍性贫血、多发性骨髓瘤及阵发性夜间血尿等均有一定疗效;此外,应用 EPO 还可减少手术中的输血量,并能在一定程度上纠正由恶性肿瘤、化疗及类风湿性关节炎引起的贫血。由于 EPO 主要由肾小管内皮细胞产生,肾性疾患引起的贫血是 EPO 的首选适应证;EPO 纠正肾性贫血的疗效几乎是 100%,但并不能改善肾功能。另外,EPO 使用的有效性与机体的铁储备也有一定关系,在应用 EPO 后,造血增强,铁利用增强;因此应适当补给一定量的铁。
(二)粒细胞-巨噬细胞集落刺激因子
粒细胞-巨噬细胞集落刺激因子(GM-CSF)是分子量为 22kD 的糖蛋白,主要来源于活化的 T 细胞、B 细胞、单核-巨噬细胞、成纤维细胞和血管内皮细胞。GM-CSF 可以作用于造血干细胞,促进其分化增殖,而所形成的细胞不限于中性粒细胞和单核-吞噬细胞系统。体外实验研究发现,随着 GM-CSF 浓度的增加,首先刺激单核-巨噬细胞增殖,随后是中性粒细胞,最后是嗜酸性粒细胞和巨核细胞。此外 GM-CSF 还能刺激多能干细胞和早期红细胞的增殖和分化。
(三)粒细胞集落刺激因子
粒细胞集落刺激因子(G-CSF)是由单核-巨噬细胞、血管内皮细胞和成纤维细胞全成的多肽,分子量为 19kD。G-CSF 能刺激骨髓粒细胞前体,使之分化增殖为成熟粒细胞的集落。G-CSF 还能作用于完全成熟的终末粒细胞,提高中性粒细胞的吞噬能力,促进超氧化物的产生。
临床上 G -CSF 可用于各种中性粒细胞减少症的治疗。G-CSF 作为肿瘤化疗的辅助制剂,在化疗前的适当时机给予,可使髓性白细胞进入细胞周期,对大剂量化疗药物的治疗更敏感;在化疗中或化疗结束后给予,可以缩短骨髓抑制期。
(四)单核-巨噬细胞集落刺激因子
单核-巨噬细胞集落刺激因子(M-CSF)是一种 40kD 的多肽,主要来源于单核-巨噬细胞、血管内皮细胞和成纤维细胞。其功能主要是刺激骨髓单核-巨噬细胞的前体细胞,使之分化成熟,形成单核细胞集落。M-CSF 可刺激骨髓内单核-巨噬细胞集落的形成,后者又能分泌 G -CSF 和 GM-CSF 等,形成一个逐渐放大的细胞因子网络;同时可促进骨髓生成中性粒细胞,使细胞数量增加的同时,细胞功能也增强。M-CSF 亦能作用于终末细胞,增强厉熟单核-巨噬细胞的功能。
M-CSF 具有较强的造血作用,已试用于肿瘤化疗后多种血细胞减少症,可以加速化疗所致的中性粒和血小板减少的恢复,而且副作用减轻。M-CSF 还能增加单核细胞对多中白血病细胞株的反应性,因此已试用于治疗前白血病状态的骨髓异型性征候群。
第六节 细胞因子受体
随着细胞因子受体及基因的确认,人们发现多数细胞因子受体属于几个较大的多基因家族(multigenefamilies)(表 5 -1)。每个家族的成员具有独特的结构特征,相互之间在进化上可能有一定关系。如 IL-1、M-CSF、G-CSF 和 IL- 6 受体的细胞外段均含有一个 Ig 样的功能区,因此属于 Ig 基因超族(immunoglobulingenesuperfaamily)。而 TNF 受体家族的特点是在细胞外段含有 4 个富含半胱氨酸的区域;属于此家族的还有神经生长因子和 fas 抗原受体及 CD27、CD30 和 CD40 的配体。造血生长因子受体家族包括 IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-9、GM-CSF、EPO、LIF 及生长因子的受体,其特点是每个受体的细胞外段均含有 4 个富含半胱氨酸的区域及靠近细胞外膜的 trp-ser-X-trp-ser(即色氨酸 - 丝氨酸 - 任棸被? 色氨酸 - 丝氨酸)的保守顺序功能段。
表 5 - 1 细胞因子受体家族
| 受体 | 特点 | 配体 |
| 造血生长因子家族 | Trp-Ser-X-Trp-Ser 功能段;4 个细胞外半胱氨酸残基 | IL-2,IL-3,IL-4,IL5,IL-6,IL-7,IL-9,G-CSF,GM-CSF,EPO,ILF, 生长因子, 催乳素 |
| Ig 超家族 | Ig 样的细胞外功能区 | IL-1,IL-6,M-CSF,G-CSF,SCF |
| TNF 家族 | 4 个富含半胱氨酸的细胞外区 | TNF,CD27,CD30,CD40fas 抗原,神经生长因子 |
| IL- 3 家族 | 共同的 β 亚单位 | IL-3,IL-5,GM-CSF |
| IL- 6 家族 | 共同的 β 亚单位 | IL-6,IL-11,ILF,OSM |
| IL- 8 家族 | 具有 7 个穿膜区的嗜紫红质样蛋白质 | IL-8,GRO,PF4,TG,C3a,IP-10,MIP-1α,MIP-1β,MCP-1, 血管活性肠肽,P 物质,PAF |
| 酪氨酸激酶家族 | 细胞内功能区具有独特的酪氨酸激酶活性 | M-CSF,SCF,PKGF, 成纤维细胞生长因子 |
| TGFβ 家族 | 细胞内功能区具有独特的苏氨酸 / 色氨酸激酶活性 | TGFβ,Muller 抑制物质, 骨形态发生蛋白, 抑制素, 活化素 |
| IFN 家族 | Ⅰ型和Ⅱ型 IFN | IENα,β,ω,γ,IL-10 |
细胞因子受体家族的划分不是绝对的,有些受体可归于多个家族。例如,IL- 6 受体既属于造血生长因子受体家族,又属于免疫球蛋白超族,而且还是 IL- 6 受体家族的原型。
细胞因子受体除了镶嵌于细胞膜表面的形式外,还有分泌游离的形式,即可溶性细胞因子受体。IL-1、IL-2、IL-4、IL-5、IL-6、IL-7、IL-8、G-CSF、GM-CSF、IFNγ 及 TNF 的受体均有其可溶性形式。可溶性细胞因子受体可作为相应细胞因子的载体,也可与相应的膜受体竞争配体而起到抑制作用。
第六章 主要组织兼容性复合体
第一节 概述
组织兼容性(histocompatibility)是指器官或组织移植时供者与受者相互接受的程度;如兼容则不互相排斥,不兼容就会出现排斥反应枣一种免疫应答效应;诱导排斥反应的抗原称为组织兼容性抗原,也称为移植抗原(详见第二十九章)。人和各种哺乳动物的组织兼容性抗原都十分复杂,但有一组抗原起决定性作用,称为主要组织兼容性抗原(majorhistocompatibilityantigen,MHA),其余的称为次要组织兼容性抗原。编码 MHA 的基因是一组呈高度多态性的基因群,集中分布于各种动物某对染色体上的特定区域,称为主要组织相容性复合体(majorhistocompatibilitycomplex,MHC)。MHC 编码的产物称为 MHC 分子,可分布于不同类型的细胞表面,不但决定着宿主的组织相容性,而且与宿主的免疫应答和免疫调节密切相关,其意义已远远超出了移植免疫的范畴。
MHC 的发现主要得益于对近交系小鼠(inbredmice)及同类系小鼠(congenicmice)的研究。近交系小鼠又称纯系小鼠,是通过连续 20 代以上同胞兄弟姊妹交配而育成,同一系内各个体的遗传背景完全相同,同源染色体都是纯体型。同类系小鼠是应用两纯系小鼠不断杂交和回交筛选而育成,同一系内各个体的 MHC 结构有所不同,其他遗传背景完全一致;这种动物对研究 MHC 非常重要。另外还可用不同的同类系小鼠杂交进一步产生重组体小鼠。
1936 年,R.Gorer 利用近交系小鼠研究发现:小鼠的自发肿瘤移植到同系小鼠体内能够生长,但在不同系小鼠则遭排斥;这种排斥作用不仅针对肿瘤,也针对供者正常的组织、细胞;还发现决定移植物排斥的基因与红细胞抗原 2 的基因一致,故将其称为 H - 2 系统。1948 年 C.Snell 用同类系小鼠证明了 H - 2 基因复合体(图 6 -1),并陆续发现了其他动物的 MHC。1954 年,J.Dausset 利用多产妇血清发现了人类的 MHC 棗 HLA 系统。于 1963 年,B.Benacerraf 发现了免疫应答(Ir)基因,并发现 Ir 基因与 MHC 紧密连锁。因此,Benacerraf、Dausset 和 Snell 分享了 1980 年度的诺贝尔生理学奖。
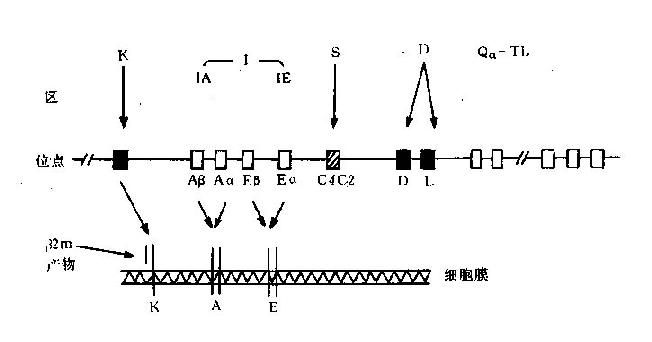
图 6 - 1 小鼠 H - 2 基因结构示意图
除了人和哺乳动物之外,很多脊椎动物及两栖动物均有各自独特的 MHC。在迄今为止所研究过的哺乳动物中,除小鼠的 MHC 称为 H - 2 外,其他种属多以白细胞抗原(leukocyteantigen,LA)命名,例如人的 MHC 是 HLA(humanleudocyteantigen),恒河猴的为 RhLA,狗的为 DLA,家兔的为 RLA,豚鼠的为 GPLA 等。MHC 的研究开创了免疫遗传学的新领域,许多免疫学的重要问题可望从 MHC 研究中找到答案。
第二节 HLA 基因复合体
一、HLA 的基因组成
人类的 MHC 称为 HLA 复合体,位于第 6 对染色体的短臂上,长度为 4 分摩(centimorgan,cM),约为 4000kb。整个复合体上有近 60 个基因座,已正式命名的等位基因 278 个。根据编码分子的特性不同,可将整个复合体的基因分成三类:Ⅰ类、Ⅱ类和Ⅲ类基因(图 6 -2)。
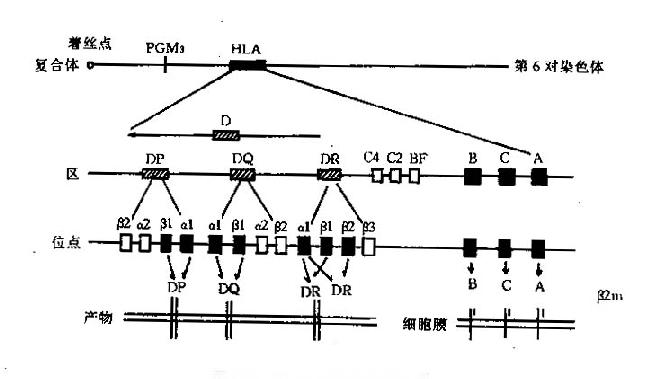
图 6 -2HLA 基因结构示意图
1.类基因区位于着丝点的远端,主要包括 HLA-A、B、C 三个位点;新近又提出 E、F、G、H、K 和 L 位点。
2.类基因区位于着丝点的近端,是结构最为复杂的一个区,主要由 DR、DQ、DP 三个亚区构成,每个亚区又有若干个位点。新近又鉴定了 DO、DZ、DX 三个亚区。
3.类基因区含有编码补体成分 C2、C4、B 因子及 TNF、热休克蛋白和 21 羟化酶的基因。
4.非 HLA 基因这些基因位于 HLA 区域内,其功能与 HLA 相关;目前已经命名的有两类:LMP(largemultifunctionalprotease,或 lowmolicularweightpolypeptides)和 TAP(transporterassociatedwithantigenprocessing,或 transporterofantigenpeptides)。LMP 为蛋白酶体相关基因,由 LMP2 和 LMP7 组成;TAP 为 ABC 转运蛋白基因,包括 TAP1 和 TAP2;它们的功能可能与抗原的处理和递呈有关。
二、HLA 的多态性
HLA 复合体是人体最复杂的基因系统,呈高度的多态性,主要原因之一是由于 HLA 复合体的复等位基因所致。
遗传学上将某一个体同源染色体上对应位置的一对基因称为等位基因(alleles);当群体中位于同一位点的等位基因多于两种时,称为复等位基因(muotiplealleles)。HLA 复合体Ⅰ类和Ⅱ类基因位点多为复等位基因。1995 年公布的用血清学、MLR 和 PLT 确认的 HLA 特异性见表 6 -1。
表 6 -1HLAⅠ类和Ⅰ类基因特异性总表(1995)
| A | B | C | DR | DQ | DP | D | |
| A1 | B7 | B5102 | Cw1 | DR1 | DQ2 | DPw1 | Dw1 |
| A2 | B703 | B5103 | Cw2 | DR103 | DQ4 | DPw2 | Dw2 |
| A203 | B8 | B52(5) | Cw3 | DR2 | DQ5(1) | DPw3 | Dw3 |
| A210 | B13 | B53 | Cw4 | DR3 | DQ6(1) | DPw4 | Dw4 |
| A3 | B15 | B54(22) | Cw5 | DR4 | DQ793) | DPw5 | Dw5 |
| A11 | B18 | B55(22) | Cw6 | DR7 | DQ8(3) | DPw6 | Dw6 |
| A23(9) | B27 | B56(22) | Cw7 | DR8 | DQ9(3) | Dw7 | |
| A24(9) | B35 | B57(17) | Cw8 | DR9 | Dw8 | ||
| A2403 | B37 | B58(17) | Cw9(w3) | DR10 | Dw9 | ||
| A25(10) | B38(16) | B59 | DR11(5) | Dw10 | |||
| A26(10) | B39(16) | B60(40) | DR12(5) | Dw11(w7) | |||
| A29(19) | B3901 | B61(40) | DR13(6) | Dw12 | |||
| A30(19) | B3902 | B62(15) | DR14(6) | Dw13 | |||
| A31(19) | B40 | B63(15) | DR1403 | Dw14 | |||
| A32(19) | B4005 | B64(14) | DR1404 | Dw15 | |||
| A33(19) | B41 | B65(14) | DR15(2) | Dw16 | |||
| A34(10) | B42 | B67 | DR16(2) | Dw17(w7) | |||
| A36 | B44(12) | B70 | DR17(3) | Dw18(w6) | |||
| A43 | B45(12) | B71(70) | DR18(3) | Dw19(w6) | |||
| A66(10) | B46 | B72(70) | DR51 | Dw20 | |||
| A68(28) | B47 | B73 | DR52 | Dw21 | |||
| A69(28) | B48 | B75(15) | DR53 | Dw22 | |||
| A74(19) | B49(21) | B76(15) | Dw23 | ||||
| B50(21) | B77(15) | Dw24 | |||||
| B51(5) | B7801 | Dw25 | |||||
| Dw26 | |||||||
HLA 抗原的命名由世界卫生组织命名委员会确定,每个特异性抗原均以其基因位点的字头附以适当的数字(按抗原被发现或官方认可的顺序)表示。标有 w(workshop)的为暂用名,得到认可后将其去掉;1991 年决定:新特异性的申报要有明确的 DNA 顺序,并根据 DNA 间关系命名,故取消 w;现在所保留的 w 已非当初实验室暂定名的含义,例如保留 Cw 以示与补体缩写区别,保留 Dw 和 DPw 以示其用细胞学方法检测。后面带括弧的表示该特异性由括弧内的特异性分解而来,括弧内为早期确认的抗原,包含多个特异性。表中 D 抗原不是独立基因位点的编码产物,而是与 DR 和 DQ 广泛相关,是用细胞学方法检测的抗原。
表 6 - 1 所列特异性是用血清学方法和细胞学方法鉴定出来的,几乎每次会议都命名新的特异性。如此复杂的基因及产物,再加上单倍体共显性遗传的特点,可随机组合成一个巨大的数字;以致在人群中除同卵双胎外,难以找到 HLA 完全相同者。这充分体现了 HLA 对免疫调控的个体差异,也为同种器官移植增加了困难。
现在用分子生物学方法可在基因水平上鉴定出更大的 HLA 多态性,例如 HLA-A2 的基因有 12 个变异体(A*0201~A*0212),其差别仅在第 19 密码子一个碱基的置换。1994 年 3 月 WHO 命名委员会公布的Ⅰ类和Ⅱ类等位基因为 440 个,1995 年 1 月又发现了 35 个新的基因序列,并对以前的报告进行了部分修正。
三、HLA 的遗传特点
1.单倍型遗传单倍型(haplotype)是指一条染色体上 HLA 各位点基因紧密连锁组成的基因单位。人体细胞为二倍体型,两个单倍型分别来自父亲和母亲,共同组成个体的基因型(genotype)。由于一条染色体上 HLA 各位点的距离非常近,很少发生同源染色体之间的交换,因此新代的 HLA 以单倍型为单位将遗传信息传给子代。例如父亲的基因型为 ab,母亲的为 cd,则子代可能有 4 种基因型,ac,ad,bc,bd,某一个体获得任一基因型的可能性都是 1 /4。故两个同胞有完全相同或完全不同 HLA 基因型的可能性都是 1 /4;一个单倍型相同的可能性是 1 /2。而子代和亲代总是共有一个相同的单倍型。
2.共显性遗传共显性(co-dominance)是指某位点的等位基因不论是杂合子还是纯合子,均能同等表达,两者的编码产物都可在细胞表面检测到。故每个位点可具有两个抗原,可能相同,也可能不相同;这些抗原组成了个体的表型(phenotype)。多数个体的 HLA 位点都是杂合子,但当父亲和母亲在某位点上具有相同的等位基因时,其子代的这个位点就成为纯合子。
3.连锁不平衡理论上,一个 HLA 位点的等位基因与另一个或几个位点的等位基因在某一单倍型出现的频率应等于各自频率的乘积。然而在很多情况下,预期的单倍型频率往往与实际检测的频率相差很大,在不同的地区或不同的人群,某些基因相伴出现的频率特别高,这种现象称为连锁不平衡(linkagedisequilibrium)。HLA 基因连锁不平衡的发生机制目前尚不清楚,但已经发现某些疾病的发生与 HLA 复合体中某些特定的等位基因密切相关;某些连锁不平衡倾向于出现在某些区域、某些人种和某些民族。深入探讨连锁不平衡的发生机制无疑将有助于对某些疾病的诊断和治疗,亦将为人类学研究增添新的内容。
四、HLA 的分型技术
HLAⅠ类抗原的 DQ、DR 用血清学检测法进行分型,因此在方法学上称为血清学鉴定的抗原(serologicallydefinedantigen,SD 抗原);DP 和 D 特性需用细胞学方法进行检测,因此称为淋巴细胞鉴定的抗原(lymphocytedefinedantigen,LD 抗原)。虽然 HLA 的基因分型技术发展很快,但目前仍不能完全取代血清学分型法和细胞分型法(详见第二十八章)。
第三节 MHC 分子
虽然不同个体、不同种属的 MHC 结构不同,但其编码的分子在化学结构、组织分布及功能上均十分相近,可以分成三类:即Ⅰ类分子,Ⅱ类分子和Ⅲ类分子;其编码基因也相应地分成三类。Ⅰ类和Ⅱ类分子是结构相似的细胞膜表面糖蛋白,除作为移植抗原外,还与抗原递呈及某些疾病相关。Ⅲ类分子包括 C2、C4、B 因子和肿瘤坏死因子等多种可溶性蛋白质,相互间差别很大,与Ⅰ类和Ⅱ类分子在结构和功能上相关性很小,本章不予讨论。
一、MHCⅠ类分子
(一)Ⅰ类分子的结构
人类的类分子由 HLA 的 A、B、C、E、F、G、H、K 和 L 等基因编码;但因后几类基因的性质和作用尚不清楚,所以目前所称的类分子主要指 HLA-A、B、C 位点的抗原。
Ⅰ类分子是由非共价键连接的两条肽链组成的糖蛋白;其中一条称为重链或 α 链,另一条为轻链或称为 β2 微球蛋白(β2m)。α 链的分子量为 44kD,结构呈多态性;其羧基端穿过细胞膜,伸入胞浆之中,氨基端则游离于细胞膜外(图 6 -3)。α 链的膜外区肽段折叠形成三个功能区,分别称为 α1、α2、和 α3 区;每个功能区约含 90 个氨基酸残基,其结构与 Ig 相似;α1 和 α2 区的氨基酸顺序变化较大,决定着Ⅰ类分子的多态性。β2m 不 MHC 基因编码,而是第 15 号染色体上单个基因编码的产物,分子量 12kD。其结构与 Ig 恒定区(CH3)有较大同源性,属于 Ig 超族成员,没有同种异型决定簇,但具有种属特异性。β2m 不穿过细胞膜,也不与细胞膜接触,而是以非共价形式附着于 α3 的功能区上。虽然 β2m 不直接参与Ⅰ类分子的抗原递呈过程,但是它能促进内质网中新合成的Ⅰ类分子向细胞表面运输,并对稳定Ⅰ类分子的结构具有一定作用。
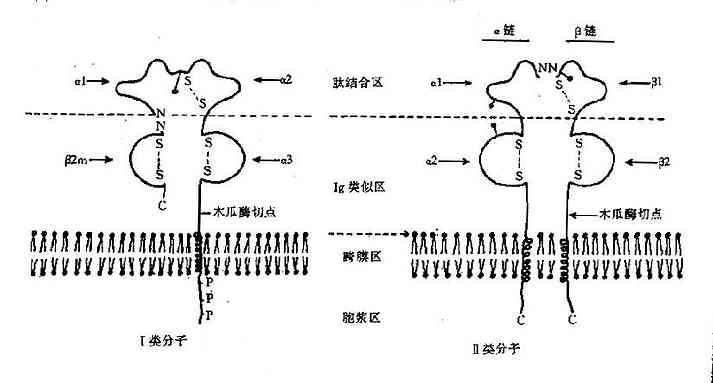
图 6 -3HLA 分子结构示意图
利用 X 线结晶衍射图分析,阐明了Ⅰ类分子的三维结构:α1 和 α2 功能区共同构成了槽形的抗原肽段结合部位,来自 α1 和 α2 的 8 条反向平行的 β 片层结构组成槽的底部;而 α1 和 α2 功能区的其余部分各自形成一个 α - 螺旋,两条螺旋相互毗邻,相互平行,在分子的远端共同构成槽的侧壁;槽的底部和侧壁体现Ⅰ类分子的多肽性,也决定了Ⅰ类分子与抗原结合的特异性;α3 功能区具有与 CD8 分子结合的空间构型(图 6 -4)。
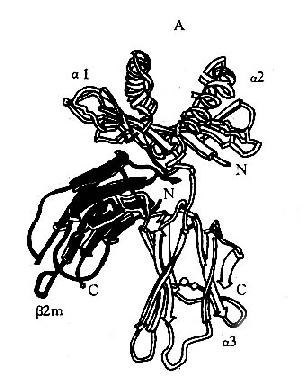
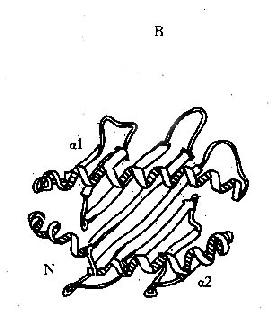
图 6 -4HLAⅠ类分子多肽折迭立体结构示意图
A:侧面观;B:上面观
Ⅰ类分子与抗原的结合有一定的选择性,但是没有抗体和 TCR 与抗原结合的特异性高。Ⅰ类分子的抗原结合槽能够容纳 8~10 个氨基酸长度的抗原片段,其抗原结合点主要与氨基酸顺序相对恒定的抗原肽段的骨干结合,而将抗原肽段上多变的氨基酸侧链处于游离状态;这些侧链却能与 TCR 和抗体结合。每个细胞表面可以表达约 106个Ⅰ类分子,每个Ⅰ类分子都能与相当各类的抗原肽段结合。因此每个细胞都具有同时递呈许多不同抗原的潜力,从而保证一个正常的个体对绝大多数抗原发生Ⅰ类限制性的免疫应答。
(二)Ⅰ类分子的分布和功能
MHCⅠ类分子分布于几乎所有有核细胞表面,但不同组织细胞的表达水平差异很大:淋巴细胞表面Ⅰ类抗原的密度最高,肾、肝、肺、心及皮肤次之,肌肉、神经组织和内分泌细胞上抗原最少,而成熟红细胞、胎盘滋养层细胞上未能检出,血清、尿液中及初乳等体液中也有可溶性形式存在的Ⅰ类抗原。干扰素、肿瘤坏死因子在体内外均可增强各种细胞对Ⅰ类分子的表达。
Ⅰ类分子的重要生理功能是对 CD8+ T 细胞的抗原识别功能起限制性作用,也就是参与向 CD8+ T 细胞递呈抗原的过程。CD8+ T 细胞只能识别与相同Ⅰ类分子结合的抗原(多为内源性的细胞抗原,如病毒感染的细胞和肿瘤细胞等),这种现象称为 MHC 限制性。例如,当病毒感染了某个细胞,病毒抗原可被分解成一些短肽片段,后者与在内质网中合成的Ⅰ类分子结合后表达于细胞表面,才能被 CD8+ T 细胞识别。Ⅰ类分子主要介导 Tc 细胞的细胞毒作用,也是重要的移植抗原。
二、MHCⅡ类分子
(一)Ⅱ类分子的结构
人类的 MHCⅡ类分子由 HLA 复合体中的 D 区基因编码,已经明确的Ⅱ类分子包括 HLA-DR、DP 和 DQ 抗原。Ⅱ类分子亦是由非共价连接的两条多肽链组成,分别称为 α 链和 β 链;与Ⅰ类分子不同的是,两条链均由 HLA 基因编码。α 链的分子量约 34kD,β 链约 29kD;两条肽链均嵌入细胞膜,伸入胞质之中;其膜外区各有两个 Ig 样的功能区(图 6 -3),分别称为 α1、α2、β1 和 β2 功能区。
X 线结晶衍射图显示,Ⅱ类分子的 α1 和 β1 功能区共同形成一个与Ⅰ类分子相似的槽型结构的多肽结合区。1 和 β1 各有一个螺旋,形成槽的两侧壁,其余部分形成片层,构成槽的底部。Ⅱ类分子的多态性也体现在多肽结合槽的侧壁和底部,所以其空间构型依编码基因的不同而异。类分子的抗原结合特性亦与Ⅰ类分子一样,特异性不强,每个分子可能与多种肽片结合;但与Ⅰ类分子不同的是,Ⅱ类分子肽结合槽的两端呈开放状(Ⅰ类分子的结合槽两端呈封闭状),能够容纳较长(10~18 个氨基酸残基)的肽段。
(二)Ⅱ类分子的分布和功能
Ⅱ类分子的分布比较局限,主要表达于 B 细胞、单核-巨噬细胞和树突状细胞等抗原递呈细胞上,精子细胞和某些活化的 T 细胞上也有Ⅱ类分子。一些在正常情况下不表达Ⅱ类分子的细胞,在免疫应答过程中亦可受细胞因子的诱导表达Ⅱ类分子,因此Ⅱ类分子的表达被看成是抗原递呈能力的标志。IL-1、IL- 2 和干扰素在体内外均能增强Ⅱ类分子的表达。有些组织在病理条件下也可表达一些类抗原,如胰岛 β 细胞、甲状腺细胞等。
Ⅱ类分子的功能主要是在免疫应答的始动阶段将经过处理的抗原片段递呈给 CD4+ T 细胞。正如 CD8+ T 细胞只能识别与 MHCⅠ类分子结合的抗原片段一样,CD4+ T 细胞只能识别Ⅱ类分子结合的抗原片段。Ⅱ类分子主要参与外源性抗原的递呈,在一些条件下也可递内源性抗原。在组织或器官移植过程中,Ⅱ类分子是引起移植排斥反应的重要靶抗原,包括引起宿主抗移植物反应(HVGR)和移植物抗宿主反应(GVHR)。在免疫应答中,Ⅱ类抗原主要是协调免疫细胞间的相互作用,调控体液免疫和细胞免疫应答。
第四节 MHC 在医学上的意义
(一)MHC 与器官移植
前已述及,通过移植排斥的研究发现了 MHC,所以 MHC 的意义首先与器官移植相关。Ⅰ类和Ⅱ类分子是引起同种异体移植排斥反应的主要抗原,供者与受者 MHC 的相似程度直接反映两者的兼容性;供-受者间的 MHC 相似性越高,移植成功的可能性越大。同卵双胎或多胎兄弟姊妹之间进行移植时几乎不发生排斥反应;亲子之间有一条 HLA 单倍型相同,移植成功的可能性也较大;而在无任何亲源关系的个体之间进行器官移植时存活率要低得多。为了降低移植排斥反应,延长移植物的存活时间,移植前的重要工作就是通过 HLA 检测的方法进行组织配型,选择 HLA 抗原与受者尽量相同的供者;在移植后发生排斥反应时进行恰当的免疫抑制(详见第二十八章)。
(二)MHC 与免疫应答
1.免疫调控作用动物实验证明,不同品质的小鼠对同一抗原的应答能力大不相同:甲小鼠可产生抗体应答和细胞性应答,乙小鼠完全无应答,两者杂交的 F1 有应答能力。这说明对某抗原的应答能力受遗传调控,Benacerraf 将这种控制基因称免疫应答基因(immuneresponsegene,Ir 基因);Ir 基因的编码产物称为免疫应答抗原(immuneresponseassociatedantigen,Ia 抗原);后来发现实际上就是 MHCⅡ类基因及其抗原。Ⅱ类分子调控免疫应答的机制尚未清楚,可能是不同Ⅱ类分子与抗原结合的部位不同,因此递呈给 T H细胞的抗原表位也不相同。
2.MHC 限定性识别当抗原递呈向免疫活性细胞递呈抗原时,免疫活性细胞在识别特异性抗原的同时,必须识别递呈细胞的 MHC 抗原,这种机制称为 MHC 限定性(MHCrestriction)。CD4+ T 细胞必须识别Ⅱ类分子的特异性,CD8+ T 细胞必须识别Ⅰ类分子的特异性;MHC 分子对抗原识别的机制已如前述,而识别的后果见第七章。
(三)MHC 与疾病
近 20 年来,已发现 50 余种人类疾病与 HLA 的一种或数种抗原相关,例如某些传染病和自身免疫病,强直性脊柱炎就是其中一个典型代表。在美国白人中,90%的强直性脊柱炎患者为 HLA-B27,而正常人 HLA-B27 仅为 9%,表明 HLA-B27 与强直性脊柱炎的发生呈高度相关。需要指出的是,这种“相关性”只是一种统计学的概念,并不表明两者之间有绝对的因果关系,因为除了 HLA 之外,其它基因及许多未知的环境因素都可能影响疾病的发生。HLA 与某疾病的相关程度常用相对危险性(relativerisk,RR)表示,这是带有某种 HLA 抗原的人群发生某种疾病的频率与不带该抗原的人群发生某病频率的比值,其公式为:
RR=患者(Ag+/Ag-)/对照(Ag+/Ag-)
RR 数值越大,表示某病与该抗原的相关性越强。一般地说,RR 值大于 3 就表示相关性较强;但是如果某抗原在患者中出现的频率低于 20%,即使 RR 值很大,也无较大意义。表 6 - 2 列出了几种疾病与 HLA 的 RR 数值。
表 6 -2HLA 与某些疾病的相对危险性
| 疾病 | HLA | RR |
| 霍奇金病 | A1 | 1.4 |
| 特发性血色素沉着症 | A3 | 8.2 |
| 先天性肾上腺皮质增生 | B47 | 15.4 |
| 强直性脊柱炎 | B27 | 87.4 |
| 急性前葡萄腺炎 | B27 | 10.4 |
| 亚急性甲状腺炎 | B35 | 13.7 |
| 银屑病(牛皮癣) | Cw6 | 13.3 |
| 疱疹性皮炎 | DR3 | 15.4 |
| 乳糜泻 | DR3 | 10.3 |
| 特发性阿狄森病 | DR3 | 6.3 |
| 突眼性甲状腺肿 | DR3 | 3.7 |
| 胰岛素依赖型糖尿病 | DR3 | 3.3 |
| DR4 | 6.4 | |
| 重症肌无力 | DR3 | 2.5 |
| D8 | 2.7 | |
| 系统性红斑狼疮 | DR3 | 5.8 |
| 多发性硬化 | DR2 | 4.1 |
| 类风湿性关节炎 | DR4 | 4.2 |
| 天疱疮 | DR4 | 14.4 |
| 慢性甲状腺炎(桥本病) | DR5 | 3.2 |
| 恶性贫血 | DR5 | 5.4 |
MHC 在 HLA 相关疾病中的作用机制目前尚不十分清楚,抗原决定簇选择(determinantselection)学说部分地解释了 MHC 的作用:①某些自身抗原的抗原片段与某个或几个特定 HLA 抗原的结合力比与其它 HLA 分子的结合力高得多,因此带有该特异性 HLA 分子的个体较易针对此抗原产生 MHC 限制性的免疫应答,引起自身免疫病;②某些 HLA 分子与病原体的某些抗原相同(共同抗原),不能有效地产生对该病原体的免疫应答,导致机体对该病原体所致的感染性疾病的易感性增强。虽然决定族选择学说还未得到证实,但是许多动物实验结果均支持这一学说。
(四)MHC 与法医学
HLA 是体内最复杂的多态性基因系统,其表现型数以亿计,两个无血缘关系的个体很难具有完全相同的 HLA,而且 HLA 终身不变。因此 HLA 检测至少具有两方面的意义:①由于 HLA 具有单倍型遗传的特点,每个子代均从其父母各得到一个单倍型,因此可用于亲子关系鉴定。②如用分子生物学方法,尚可对极少量的陈旧性标本进行检测,在法医学上可用于凶犯身份鉴定和死者身份鉴定。
(五)MHC 与人类学研究
不同民族的种族起源等人类学研究可从多方面进行,如历史、文化、语言、体质和基因等,其中唯基因受外界环境的影响最小,故其意义最大。因为 HLA 的基因连锁不平衡,某些基因或单倍型在不同种族或地区人群的频率分布有明显差异,故在人类学研究中可为探讨人类的源流和迁移提供有用的资料。
第七章 免疫应答
第一节 概述
免疫应答(immuneresponse)是机体免疫系统对抗原刺激所产生的以排除抗原为目的的生理过程。这个过程是免疫系统各部分生理功能的综合体现,包括了抗原递呈、淋巴细胞活化、免疫分子形成及免疫效应发生等一系列的生理反应。通过有效的免疫应答,机体得以维护内环境的稳定。
一、免疫应答的基本过程
免疫应答的发生、发展和最终效应是一个相当复杂、但又规律有序的生理过程,这个过程可以人为地分成三个阶段。
1.抗原识别阶段(antigen-recognitingphase)是抗原通过某一途径进入机体,并被免疫细胞识别、递呈和诱导细胞活化的开始时期,又称感应阶段。一般,抗原进入机体后,首先被局部的单核-巨噬细胞或其他辅佐细胞吞噬和处理,然后以有效的方式(与 MHCⅡ类分子结合)递呈给 T H细胞;B 细胞可以利用其表面的免疫球蛋白分子直接与抗原结合,并且可将抗原递呈给 T H细胞。T 细胞与 B 细胞可以识别不同种类的抗原,所以不同的抗原可以选择性地诱导细胞免疫应答或抗体免疫应答,或者同时诱导两种类型的免疫应答。另一方面,一种抗原颗粒或分子片段可能含有多种抗原表位,因此可被不同克隆的细胞所识别,诱导多特异性的免疫应答。
2.淋巴细胞活化阶段(lymphocyte-activatingphase)是接受抗原刺激的淋巴细胞活化和增殖的时期,又可称为活化阶段。仅仅抗原刺激不足以使淋巴细胞活化,还需要另外的信号;TH细胞接受协同刺激后,B 细胞接受辅助因子后才能活化;活化后的淋巴细胞迅速分化增殖,变成较大的细胞克隆。
分化增殖后的 T H细胞可产生 IL-2、IL-4、IL- 5 和 IFN 等细胞因子,促进自身和其他免疫细胞的分化增殖,生成大量的免疫效应细胞。B 细胞分化增殖变为可产生抗体的浆细胞,浆细胞分泌大量的抗体分子进入血循环。这时机体已进入免疫应激状态,也称为致敏状态。
3.抗原清除阶段(antigen-eliminatingphase)是免疫效应细胞和抗体发挥作用将抗原灭活并从体内清除的时期,也称效应阶段。这时如果诱导免疫应答的抗原还没有消失,或者再次进入致敏的机体,效应细胞和抗体就会与抗原发生一系列反应。
抗体与抗原结合形成抗原复合物,将抗原灭活及清除;T 效应细胞与抗原接触释放多种细胞因子,诱发免疫炎症;CTL 直接杀伤靶细胞。通过以上机制,达到清除抗原的目的。
二、免疫应答的定位
抗原经皮肤或粘膜进入机体以后,一般在进入部位即被辅佐细胞捕获处理,并递呈给附近的淋巴细胞;如果附近没有相应特异性的淋巴细胞,辅佐细胞会沿着淋巴细胞再循环的途径去寻找。抗原在入侵部位如未得到处理,至迟不越过附近的淋巴结,在那里会被辅佐细胞捕获,递呈给淋巴细胞。无论在何处得到抗原刺激,淋巴细胞都会迁移到附近淋巴组织,并通过归巢受体定居于各自相应的区域,在那里分裂增殖、产生抗体或细胞因子。所以外周免疫器官是免疫应答发生的部位。
淋巴细胞的大量增殖导致外周淋巴组织发生形态学改变:T 细胞增殖使其胸腺依赖区变厚、细胞密度增大;B 细胞增殖使非胸腺依赖区增大,在滤泡区形成生发中心。所以在发生感染等抗原入侵时,可见附近的淋巴结肿大等现象,便是免疫应答发生的证明。
在局部发生的免疫应答,可循一定的途径扩展到身体的其他部位甚至全身各处。抗体可直接进入血循环,很容易地遍布全身;T 细胞则从增殖区进入淋巴细胞再循环,也可以很快遍及全身。在粘膜诱导的局部免疫应答,分泌型 IgA 不能通过血循环向全身扩散,但淋巴细胞可经由再循环的途径,通过特殊的归巢受体选择性地定居于其他部位的粘膜组织,定向地转移局部免疫性。
三、免疫应答的类型
根据抗原刺激、参与细胞或应答效果等各方面的差异,免疫应答可以分成不同的类型。
1.按参与细胞分类根据主导免疫应答的活性细胞类型,可分为细胞介导免疫(cellmediatedimmunity,CMI)和体液免疫(humoralimmunity)两大类。CMI 是 T 细胞介导的免疫应答,简称为细胞免疫,但与 E.Metchnikoff 描述的细胞免疫(吞噬细胞免疫)已有本质的区别。体液免疫是 B 细胞介导的免疫应答,也可称抗体应答,以血清中出现循环抗体为特征。
2.按抗原刺激顺序分类某抗原初次刺激机体与一定时期内再次或多次刺激机体可产生不同的应答效果,据此可分为初次应答(primaryresponse)和再次应答(secondaryresponse)两类。一般地说,不论是细胞免疫还是体液免疫,初次应答比较缓慢柔和,再次应答则较快速激烈。
3.按应答效果分类一般情况下,免疫应答的结果是产生免疫分子或效应细胞,具有抗感染、抗肿瘤等对机体有利的效果,称为免疫保护(immunoprotection);但在另一些条件下,过度或不适宜的免疫应答也可导致病理损伤,称为超敏反应(hypersensitivity),包括对自身抗原应答产生的自身免疫病。与此相反,特定条件下的免疫应答可不表现出任何明显效应,称为免疫耐受(immunotolerance)。
另外,在免疫系统发育不全时,可表现出某一方面或全面的免疫缺陷(immunodeficiency);而免疫系统的病理性增生而称为免疫增殖病(immunoproliferation)。
第二节 抗原的处理与递呈
一、抗原的捕获与处理
辅佐细胞可通过多种方捕获抗原,例如吞噬作用(对同种细胞或细菌等大型颗粒)和胞饮作用(对病毒等微小颗粒或大分子)等。这种吞噬和吞饮作用无抗原特异性,可能的识别机制在于吞噬细胞与被吞噬颗粒之间的表面亲水性差异。另外还有受体介导的内摄作用,这是弱吞噬力的辅佐细胞捕获抗原的主要方式,例如 B 细胞可借助抗原受体(表面免疫球蛋白)与相应的抗原特异性结合,并将抗原内化处理。这些捕获方式与中性粒细胞的吞噬作用(详见第八章)相似。
抗原处理(antigenprocessing)是指辅佐细胞将天然抗原转变成可被 T H细胞识别形式的过程;这一过程包括抗原变性、降解和修饰等。例如细菌在吞噬体内被溶菌酶消化降解,将有效的抗原肽段加以整理修饰,并将其与 MHCⅡ类分子相连接,然后转运到细胞膜上。
可与 MHCⅡ类分子结合的都是蛋白性抗原;多糖和脂类不易于 MHCⅡ类分子连接,难以被 T H细胞识别,因而多不是良好的免疫原;但有时可以诱导抗体性免疫应答。
二、抗原的递呈
抗原递呈(antigenpresentation)是辅佐细胞向辅助性 T 细胞展示抗原和 MHCⅡ类分子的复合物,并使之与 TCR 结合的过程。这个过程是几乎所有淋巴细胞活化的必需步骤。
抗原递呈之前,经处理后的抗原肽段已经连接在 MHC 分子顶端的槽中,这个复合物便是 TCR 的配体。TCR 与配体结合的精确模式尚未清楚,一个合理的说法是 TCR 中 α 和 β 链的 V 段接触 MHC 分子的 α 螺旋(形成 MHC 分子顶端槽的肽段),使高可变的连接部(V- J 及 V -D-J)与抗原肽段相结合。这样保证了 TCR 识别抗原的特异性。
超抗原(例如细菌毒素等,详见第二章)的递呈有独特的模式,它不需要胞内处理,可以直接与 MHCⅡ类分子结合。超抗原不结合在 MHCⅡ类分子的顶端槽中,而是结合在槽的外侧;与 TCR 结合时,不结合其 α 链,只结合 β 链的 V 节段。超抗原对 TCR 和 MHCⅡ类分子的结合都非常牢固,象一支双向钩子将 T 细胞和辅佐细胞紧紧地连在一起,很容易使 T 细胞活化。另外,任何超抗原都只与含特殊 β 链 V 节段的 TCR 结合,这样的 TCR 约占外周 T 细胞总数的 1%~10%,这一数字远远大于任何普通抗原所能识别的细胞数;所以某些产毒细胞感染时,容易发生急性期素休克综合征,就是超抗原刺激的结果(图 7 -1)。
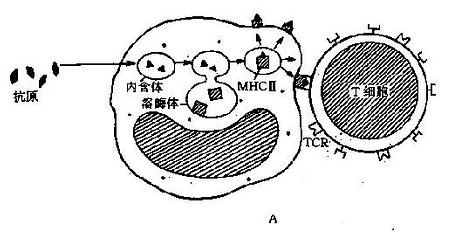
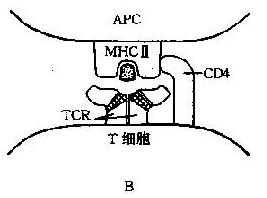
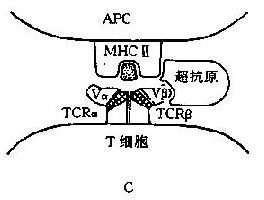
图 7 - 1 抗原递呈示意图
A:APC 的抗原处理和递呈;B:抗原、Ⅱ类分子、TCR 与 CD4 的相互关系
C:超抗原作用示意图
需要强调的是,TCR 只识别自身或与自身相同的 MHC 分子,这就是 MHC 对 TCR 识别的限制性。这种限制性是 T 细胞在胸腺内发育成熟的过程中,由阳性选择作用所规定的。
除了辅佐细胞外,体内表达 MHCⅠ类分子的细胞都可向 Tc 细胞递呈抗原,自身成靶细胞而被 Tc 杀灭。这类递呈作用是重要的免疫效应方式之一。
三、辅佐分子
TCR 虽能与抗原 -MHC 复合物特异性结合,但这种结合力很弱(超抗原除外),不足以将辅佐细胞和 T 细胞连接在一起,还必须有额外的辅助力量使两类细胞密切接触。这些力量来自辅佐受体 (accessoryreceptor) 和协同受体(coreceptor)。
1.辅佐受体 T 细胞表面有多种粘分子(adhesionmoleule),例如 CD2 和 LFA- 1 等。T 细胞与辅佐细胞最初接触的能力来自这些粘附分子与相应配体的相互吸附,例如 T 细胞 CD2 与辅佐细胞 CD58(LFA-3)的吸附。当 TCR 与抗原 -MHC 复合物相互识别以后,会加固粘附分子之间的作用。另外,辅佐细胞上的 FcR、CR 和丝裂原受体等也可以起到辅佐受体的作用。
2.协同受体 T 细胞亚群的标志分子 CD4 和 CD8 邻近 TCR,对 MHC 分子有亲和力,可以分别直接结合 MHCⅡ类和Ⅰ类分子。CD4 和 CD8 之所以称为协同受体,不仅可增加 T 细胞与 APC 的接触,且在 TCR 转导刺激信号方面也起到一定的辅助作用(图 7 -2)。
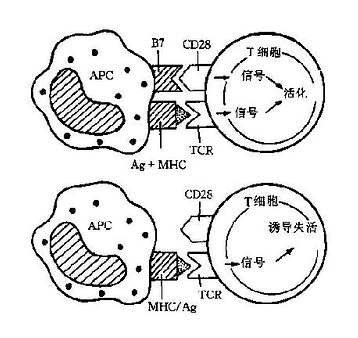
图 7 - 2 辅佐分子作用示意图
第三节 细胞免疫应答
一、辅助性 T 细胞的活化及活性
抗原 -MHCⅡ类分子复合物与 TCR 的结合是使 T H细胞活化的首要信号,但 TCR 本身不能成功地将这个信号传递到细胞内部,也不能激发连锁效应使细胞活化,所以细胞活化需要其他成分和其他过程的协助才能完成。
1.TCR 的信号传递 TCR 插入胞浆的部分太短,不能有效地传递抗原信号;但是可借助邻接的 CD3 和 CD4,在抗原刺激发生的 5 秒钟内将信号导入细胞内部,激活一组蛋白酪氨酸激酶(proteintyrosinekinase,PTK)。有 3 种 PTK 与 TCR 信号相关;p56lck与 CD4 的胞浆部分连接;ZAP70 与 CD3 的两条 ξ 链连接;p59fun与 CD3 的其余 4 条链连接(图 7 -3)。
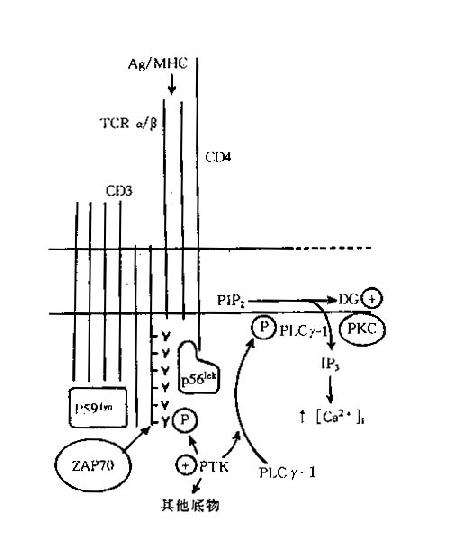
图 7 -3TCR 信号的初期传导示意图
PTK 的活性是使蛋白质中的酪氨酸磷酸化,这种磷酸化可以调节某些关键酶的活性,使细胞更快地转导活化信号。有些抑制这种过程的药物已在临床用来有效地延迟移植排斥反应。
2.CD45 的调节作用 CD45 是分子量约 180~220kD 的跨膜蛋白,可发现在所有的白细胞表面。CD45 缺乏的 T 细胞不能对抗原产生免疫应答。CD45 是一种酪氨酸磷酸酶,它的活性是能够消除抑制信号的磷酸化,作用对象是 p56lck,因为 p56lck的羧基端酪氨酸(tyr-505)磷酸化能降低其激酶活性,tyr-505 的去磷酸化则允许 PTK 在抗原识别期间被激活。CD45 的功能应该是防止细胞无效的活化。
CD45 有几种不同的异构体,其区别在于细胞外部分。例如有些 T 细胞表达 205220kD 的 CD45RA,而另一些则表达 180kD 的 CD45RO。CD45RO 曾一度被认作记忆性 T 细胞的标志,但最近的研究表明,它是细胞新近活化的象征:静止的 T 细胞表达 CD45RA,但活化后立即改为 CD45RO,几周后又恢复表达 CD45RA。
3.协同刺激信号以上全部的复杂过程只是完成了一个抗原识别信号,并不足以使 T H细胞活化;恰恰相反,单一的抗原信号还可能导致细胞进入无能(anergy)状态。这就是说,正常的 T H细胞活化还需要第二个信号棗协同刺激(costimulation)。
协同刺激一直是一个热门的课题。目前已经清楚的是,协同刺激得部分一与 T 细胞表面的 CD28 分子相关。CD28 的配体 B7 家族可表达在所有辅佐细胞上,至少有 8 种蛋白质分子,存在大约 25%的氨基酸顺序同源性。当 T 细胞与辅佐细胞接触时,CD28 与 B7 两种分子的相互作用可产生一个特殊的协同刺激,使 TCR 介导的抗原识别信号导致细胞的活化而不是无能。
4.自身活化与双向活化抗原识别和协同刺激两个信号可使 T H细胞活化,首先的反应是分泌 IL-2,同时表达 IL-2R;TH细胞依赖这种 IL- 2 的自分泌效应诱导自身分裂增殖。TH分泌的 IL- 2 也有旁分泌效应,诱导 Tc 细胞的活化。
两个信号使 T H细胞活化的同时,也能使细胞活化,分泌 IL-1。IL- 1 也有很强的自分泌效应,它能刺激辅佐细胞增加 MHCⅡ类分子的表达,增强抗原递呈作用,进一步促进 T H细胞的增殖。
5.TH的免疫功能①TH细胞是机体免疫应答的启动细胞,没有 T H的活化,机体会处于免疫无能状态;②活化的 T H 1 释放 IFN、IL- 2 和其他免疫效应因子,可以促进 T 细胞应答、抑制产生、诱导迟发型超敏反应;③活化的 T H 2 释放 IL- 4 和 IL- 5 等细胞因子,可使 B 细胞活化、促进抗体产生。所以 T H细胞是免疫应答的中心细胞。
二、细胞介导的细胞毒作用
T 细胞的另一亚群棗细胞毒性 T 细胞可溶解或杀伤靶细胞, 芝种杀伤是抗原特异性的和 MHC 限制性的,并且需要 T H细胞提供的辅助。
1.Tc 细胞的活化 Tc 细胞识别抗原和细胞活化的机制和过程与 T H细胞极为相似,最大的区别在于 Tc 的表面标志是 CD8,因而只能识别与 MHCⅠ类分子结合的抗原,其抗原识别是 MHCⅠ类分子限制性的。因为体内大多数细胞都表达 MHCⅠ类分子,所以都有可能向 Tc 细胞递呈抗原而成为靶细胞。
体内某些细胞遭受病毒感染或发生恶性病变时,会使细胞表面出现新的抗原,这类新抗原与 MHC 类分子连接的复合物可被 Tc 细胞的 TCR 所识别。抗原识别可产生第一个信号,经由与 T H相似的过程将信号转入胞浆内。第一信号能够诱导细胞表面亲和力的 IL-2R,这时便可接受邻近的活化 T H细胞所分泌的 IL- 2 作为第二信号,使 Tc 细胞激活,表现杀伤活性。
2.Tc 细胞的杀伤活性 Tc 细胞杀伤靶细胞的前提条件是与靶细胞密切接触。与 T H细胞相似,Tc 细胞与靶细胞的最初接触依靠粘附分子的作用,Tc 细胞活化后可增强粘附分子的表达,使其与靶细胞的接触更加紧密,接触面积更大,更利于发挥杀伤作用。
Tc 细胞杀伤机制至少有两方面:第一种机制是“谋杀”,向靶细胞施放细胞毒性蛋白,包括穿孔素(perforin)和颗粒酶(granzyme)。穿孔曾被称为溶细胞素,颗粒酶是一组丝氨酸蛋白酶,它们的来源和活性与补体 C9 相关,可在靶细胞膜上打孔使靶细胞溶解。第二种机制是“诱导自杀”,引起靶细胞的程序性死亡或者称为凋亡(apptosis)。细胞凋亡的精确机制尚不清楚。
在杀务一个靶细胞后,Tc 并不失活,可以继续和重复其杀伤功能。Tc 细胞还可增殖,繁衍出许多具有同样杀伤功能的 Tc 细胞。
三、细胞免疫的生理功能
细胞免疫应答的效应方式主要有两类:一是细胞毒作用,一是迟发型超敏反应。这两类效应合在一起,可表面出如下生理功能:
1.抗感染效应细胞免疫在病毒、真菌和胞内寄生性细菌入侵时,起到重要的抗感染作用。上述病原微生物感染的特点是在宿主细胞内寄生,抗体或其他机制不易发挥作用;而细胞免疫可以通过杀伤被感染细胞或引起迟发性炎症等方式,将病原微生物消灭。
2.抗肿瘤效应肿瘤细胞的新生抗原可以诱导免疫应答,其中细胞免疫应答能产生有效的抗肿瘤作用。
3.同种排斥反应 T 细胞对同种异体组织可发生免疫应答,称为同种反应性(alloreactivity),表现为同种器官移植时发生排斥反应(详见第二十八章)。
第四节 体液免疫应答
一、B 细胞的活化
根据诱导抗原类型的不同,B 细胞可呈现不同的活化方式。
1.TD-Ag 诱导的活化自然情况下,多数抗原是 TD-Ag,所以 B 细胞活化多需 T H细胞的辅助。B 细胞吞噬能力较弱,但其表面 Ig 是高亲和力的抗原受体,因此可通过受体介导的细胞内摄作用捕获与处理抗原。这个过程需要 SIg 邻近分子 Ig- α 和 Ig- β 的帮助才能传递抗原信号,就象 CD3 协助 TCR 一样。抗原刺激构成了 B 细胞活化的第一信号,可使 B 细胞初步活化,开始表达粘附分子、MHCⅡ类分子和细胞因子受体等,以便向 T H递呈抗原和接受 T H细胞的帮助。
B 细胞的完全活化产生在抗原递呈的过程中。当 T H与 B 细胞密切接触时,一些对应的协同蛋白可以表现协同刺激作用,例如前述的 B7 和 CD28 分子。B 细胞表面还有一个特殊的分子 CD40,可与 T H细胞上的配体 CD40L 相互作用,所产生的信号足以使 B 细胞完全活化,甚至可活化未结合抗原的 B 细胞;这种现象称旁观者效应(bystandereffect)。当 CD40L 缺乏时,由于 B 细胞跑得不到 T H的帮助而导致一种抗体缺陷病棗超 IgM 综合征。
B 细胞还可通过表面受体(IL-R,FcR,CR 等)接受多种因子的作用而促进活化,例如 Ils、IgG、C3b 和丝裂原等;但是抗原抗体复合物却抑制 B 细胞的活化。
2.TI-Ag 诱导的 B 细胞活化与 TD-Ag 不同,TI-Ag(详见第一章)与 B 细胞上的膜 Ig 结合时,可通过其大量重复排列的相同表位使 B 细胞完全活化(图 7 -4)。但是这种抗原直接的活化作用只能诱导 IgM 类抗体的产生,而且不能形成记忆细胞,即使多次抗原刺激也不产生再次免疫应答。
3.B 细胞的分化与抗体产生 B 细胞完全活化后,可在淋巴结内,也可迁入骨髓内迅速分化增殖,其中一部分细胞分化为浆细胞。浆细胞是 B 细胞的终末成熟形式之一,不能继续增殖,而且其寿命仅为数日。但是浆细胞产生抗体的能力特别强,在高峰期一个浆细胞每分钟可分泌数千个抗体分子。一旦抗原刺激解除,抗体应答也会很快消退。
一个增殖克隆的多数 B 细胞可能不分化成浆细胞,而是返回到静止态变成记忆性 B 细胞。记忆性 B 细胞定居于淋巴滤泡内,能存活数年;再被激活时,可重复以前的变化,一部分分化为效应细胞,一部分仍为记忆细胞。数次活化后的子代细胞仍保持原代 B 细胞的特异性,但中间可能会发生重链的类转换(见第四章)或点突变。这两种变化都不影响 B 细胞抗原识别的特异性,但点突变影响其产物抗体对抗原的亲和力;高亲和性突变的细胞有生长繁殖的优先权,而低亲和性突变的细胞则选择性死亡。这一现象称为亲和性成熟(affinitymaturation),通过这种机制来保持在后继应答中产生高亲和性的抗体。
二、初次应答与再次应答
1.初次应答抗原初次进入机体后,需首先刺激有限的特异性克隆增殖才能达到足够的反应细胞数,表现为经一定时间的潜伏期才能在血液中检出抗体;如抗原刺激不持续,在应答达到一定之前便消退,多数来不及发生重链的类转换。所以初次应答的显著特点是需要的抗原浓度大、诱导潜伏期长、抗体滴度抵、持续时间短、优势抗体为 IgM。
2.再次应答致敏机体受到相同抗原的再次刺激后,在多数情况下会产生再次应答,与初次应答有明显的区别(表 7 -1)。再次应答可直接活化 B 记忆细胞,反应性高、增殖快、容易发生类转换;所以表现为潜伏期短、抗体滴度高、持续时间长、优势抗体为 IgG 和 IgA 等。免疫应答的这一特性已被广泛应用于传染病的预防、例如疫苗接种一般都做加强免疫,其目就是刺激机体产生再次应答,从而获得对某种传染病更强、更持久的免疫力。
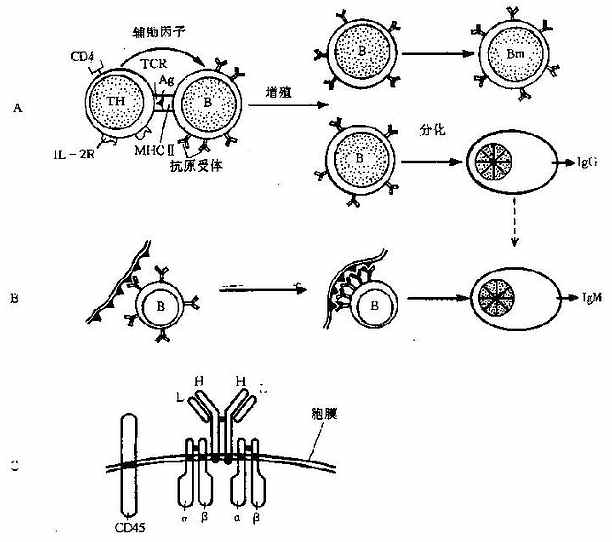
图 7 -4B 细胞的活化
表 7 - 1 初次应答与再次应答的比较
| 初次应答 | 再次应答 | |
| 抗原递呈 | 非 B 细胞为主 | B 细胞为主 |
| 抗原要求 | 较高浓度 | 较低浓度 |
| 滞后期 | 5~10 天 | 2~5 天 |
| 抗体滴度 | 相对低 | 相对高 |
| 抗体类别 | IgM 为主 | IgG 为主 |
| 抗原亲和性 | 相对低 | 相对高 |
| 非特异抗体 | 多见 | 罕见 |
三、抗体的免疫功能
抗体通过与相应抗原的特异性结合发挥生物学效应,最终的生理功能主要是抗感染,其作用机制右归纳为以下几方面:
1.毒素中和作用当抗原为细菌外毒素时,抗原与抗体的结合可中和毒素对宿主的毒性作用。当抗原为激素或酶类时,与抗体结合也可使其活性失活。
2.感染中和作用当病毒与相应抗体结合后,可失去其侵袭细胞的能力,不能进入宿主细胞进行增殖。
3.吞噬调理作用抗菌抗体与细菌结合后,虽不能直接将细胞杀灭,但可作为免疫调理素促进吞噬细胞对细菌的吞噬作用。
4.诱导溶菌作用 IgG 和 IgM 类抗体与细菌结合后,可激活补体的经典活化途径裂解病原菌。
5.介导 ADCCIgG 类抗体还可介导 NK 细胞等产生 ADCC 效应,以杀伤病毒感染的靶细胞和恶变细胞。
在另一条件下,抗原抗体反应也可引起机体的组织损伤,例如引起超敏反应或自身免疫病。
第五节 膜免疫应答
胃肠道、呼吸道、泌尿生殖道及其他外分泌腺的粘膜中存在大量的淋巴组织和散在的淋巴细胞,由于受粘膜部位复杂且特殊的抗原环境影响,形成了一些独特的免疫机制,使得粘膜淋巴系统成为一个相对独立的免疫体系,称膜免疫系统(mucosalimmunesystem,MIS)。
粘膜淋巴系统由大小不等的淋巴小结和散在的淋巴构成,其中的 B 细胞多是 IgA 型;散在细胞中有丰富的 CD4+ T 细胞,而且大约 50%带有 γ / δ 型 TCR。膜免疫系统接受抗原不通过血液和淋巴,而是经由一种具有吞噬功能的扁平上皮细胞(称膜细胞或 M 细胞)从粘膜表面获取。
一、共同膜免疫机制
某一克隆淋巴细胞在某部位粘膜滤泡中受抗原诱导而分化增殖后,很快就会在全身其他粘膜淋巴组织发现同样抗原反应性和相似分布的致敏淋巴细胞。粘膜的这种免疫共享机制称为共同膜免疫机制(commonmucosalimmunemechanism)。
某部位粘膜受抗原刺激后,与无抗原诱导的部位可以分布数目相似的抗原活化细胞,说明这种免疫共享不是由抗原分散刺激引起,而是由淋巴细胞迁移引起的。现已证明在 Peyer 结和其他 MIS 中诱导的淋巴细胞表面有特殊的归巢受体 CD49d(VLA-α4);而在粘膜毛细血管后微静脉的内皮细胞上有相应的配体 VCAM-1,又称定居素(addressin);这样,活化增殖的粘膜淋巴细胞进入再循环池以后,经由受体与配体相互作用的媒介可使淋巴细胞定居在粘膜组织中。实际上,在以前接触过该抗原的部位,免疫应答会比其他部位稍微强一些。
二、SIgA 的转运及功能
IgA 可分为血清型和分泌型(SIgA),两型 IgA 的产生部位与体内分布均不相同。血清型主要由骨髓产生,直接释入血循环;分泌型主要产生于粘膜,连接上一个 SC 分子后转运到粘膜腔(SIgA 和 SC 的分子结构见第二章)。
二聚体的 SIgA 从浆细胞分泌出以后,在上皮细胞的嗜碱性侧以共价键的形式与 SC 结合;上皮细胞以内化的方式将 IgA-SC 摄扩胞内形成吞饮小泡,转运至细胞的顶端,并将 IgA-SC 复合物以胞吐方式释入粘膜腔(图 7 -5)。释放过程中 SC 分子被截去一小段,其余部分成为分泌型 IgA 的分子成分。SC 的合成与 IgA 存在与否无关,当其产生超过转运的需用量时,粘膜分泌物中可见游离的 SC 分子。
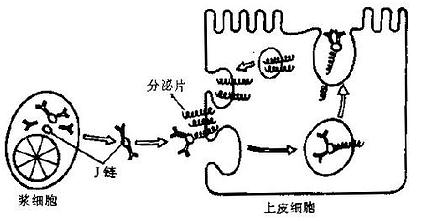
图 7 -5SIgA 的转运示意图
在某些动物,这种转运过程也发生在肝内,结果是将 SIgA 随胆汁排入肠道。但在人类的肝细胞表面未发现 SC 分子,只能通过其他的摄取机制进行补偿,例如 IgA1 可经由 Fc 受体和唾液糖蛋白受体被肝细胞内化。经肝转运 IgA 的活性和代谢都有重要意义,因为 IgA 不激活补体的经典途径,可以通过非炎症方式清除循环中的抗原,再通过肝进行处理并将 SigA 转运至肠粘膜。
在粘膜应答的高峰期,SIgA 的分泌量相当惊人。它们在局部与各种性质的抗原结合,阻止了抗原对机体的损害,增加了抗原降解及排泄的机会,而且不引起任何病理效应,这种功能称为免疫清除作用(immuneexclusion)。免疫清除作用在无害地清除病原微生物、变应原、致癌物等方面起非常重要的作用。在选择性 SIgA 缺乏者,机体循环免疫复合水平比正常人显著增高,易患消化道和呼吸道感染,过敏症和恶性肿瘤的发病率也明显增高。
除 IgA,其他类型 Ig 在膜系统免疫中也起作用。粘膜在存在产生 IgM 的 B 细胞,所分泌的 IgM 也可通过 SC 介导的转运机制释放入粘膜腔,在选择性 IgA 缺陷的个体,这种分泌性 IgM 可替代 SIgA 产生适当的粘膜免疫效应;粘膜组织还可合成 IgG 和 IgE。但这些非 IgA 类抗体在清除抗原时容易激活补体产生病理效应。
三、其他膜免疫机制
1.乳汁免疫乳汁中富含抗体,尤其是初乳,其 IgA 含量可高达成人血清的 20 倍;但随着泌乳增加而不断地稀释,4 日后降至血清水平。乳汁中的 SIgA 由乳房中的 B 细胞产生,合成的 IgA 经 SC 介导的转运过程释放入乳汁中。乳汁中的抗体种类繁多,是新生儿免疫防御的来源之一。曾有报道,母乳喂养的婴儿与非母乳喂养的婴儿相比,前者抗败血症的能力高 18 倍,死于腹泻的危险性为 1:24。另外,母乳抗体在婴儿建立正常菌群及防止大分子吸收方面都起重要作用,非母乳喂养的婴儿常有对牛乳过敏者,其原因可能是缺少母乳源性的 IgA。
乳汁中还含有大量的免疫细胞,多为巨噬细胞和粒细胞,有少量的 B 细胞和 T 细胞。母乳喂养者每日可通过乳汁将 108个细胞转给新生儿。这些巨噬细胞功能活跃,胞内含有大量摄入的 IgA,所以乳汁中的巨噬细胞还可能是将 IgA 运往急需部位的一种输送工具。乳汁中的 T 细胞数目虽然很少,却有证据表明可以有效地转移特异性免疫应答,说明这些细胞能够通过一定的途径进入新生儿的血液循环中。
2.口服无反应性(oralunresponsiveness)指肠粘膜免疫系统对食物中大量抗原及膜环境中正常菌群均不发生免疫应答的现象。这种耐受性可使免疫系统乃至整个机体不受这些抗原的过度干扰。这一现象对 TD 抗原比对 TI 抗原更加明显,这可以解释膜系统对食物抗原维持耐受的同时,却对病原体产生应答的现象。
某些免疫性疾病的发生常是对膜环境中某种抗原的不适当应答所引起,自身抗体常与膜环境中的简单抗原有交叉反应证实了这种可能性。儿童的口服无反应性较差,易对某些经口而入的抗原(如奶类蛋白质)发生过敏反应。
3.粘膜疫苗由于膜免疫系统的相对独立性,对于粘膜系统感染性的预防疫苗也最好经粘膜途径投入。典型的例子是脊髓灰质炎疫苗,最初的疫苗是经皮下注射的型,可以诱导产生高度滴度的血清抗体,但预防感染的效果却不满意;后来改成口服剂型,虽然循环抗体的滴度低,但预防效果却显著提高。
口服疫苗首先要克服的障碍就是口服无反应性,持续存在的可复制性抗原(如活病毒)以及可直接通过粘膜表面的细菌和病毒都可成功地诱导免疫应答。口服疫苗产生的免疫力可以通过共同膜机制遍布全身膜系统,这样就可以发展抗呼吸道、泌尿生殖道等部位感染的口服疫苗。口服疫苗不但能有效地诱导膜系统的特异性免疫力,而且口服给药的途径简单、安全,避免了注射疫苗所需要的严格标准,不需高度专业训练的卫生人员即可同时大群免疫。所以口服疫苗将是一种可普遍接受的疫苗形式。
第六节 免疫应答的调节
免疫应答是机体针对外来抗原产生的一种复杂的排斥过程,与其他生理系统相互配合,共同维持机体内环境的稳定。与其他生理过程一样,免疫应答也受到许多因素的影响和制约。首先,免疫应答受遗传基因的控制;受免疫系统内部各种因素的制约;还要接受宿主整体生理水平的调节。
一、TH细胞的调节作用
TH细胞不是一个均一的群体,活化后可分化成 T H1、TH 2 和 T H 0 三种类型。三个类型细胞免疫功能互有差别,尤其 T H1、TH 2 和 T H 0 三种类型。三个类型细胞的免疫功能互有差别,尤其 T H 1 与 T H 2 之间存在相互或促进的作用。因为 T H是免疫应答的中心细胞,所以它的活性对整个免疫应答具有调节作用。
TH 1 产生 IL-2、IFN 和 TNF,作用于各种免疫细胞。IL- 2 可诱导 T 细胞分裂增殖,增强细胞免疫应答;但 IFN 抑制抗体应答,抑制移植排斥反应和迟发型超敏反应。TH 2 分泌 IL- 4 和 IL- 5 等细胞因子,可诱导 B 细胞的增殖化,促进抗体产生(细胞因子的作用详见第五章)。由此可见,TH细胞在体液和细胞免疫应答中皆有调控作用,被视为免疫应答的中心调节作用途径。
二、抗体分子的调节作用
抗体是 B 细胞应答的效应产物,可反过来对特异性体液免疫应答产生反馈性抑制作用。抗体与相应抗原结合所形成的免疫复合物可结合到 B 细胞的表面 Ig 上,向胞内传入抑制信号,影响 B 细胞的活化和抗体的产生。例如将 Rh 抗体注射给刚分娩 Rh+婴儿的 Rh-母亲,则可阻止母亲产生 Rh 抗体,从而预防下一次妊娠时可能发生的新生儿溶血。
在对肿瘤的免疫应答中,某些抗体分子与肿瘤抗原结合后,不仅能介导任何免疫效应,还能阻止 Tc 对靶细胞的杀伤,实际上是抑制了细胞免疫效应,这类体称为封闭抗体(blockingantibody)。
三、独特型网络的调节作用
与游离的 Ig 分子一样,B 细胞的 SIg 分子高变区也存在着独特型标志。每一 B 细胞克隆的独特型标志能够被另一克隆 B 细胞的 SIg 所识别,构成一个相互识别的独特型网络;被识别的细胞受到抑制,而主动识别的细胞则活化。网络中的细胞可分成以下 4 组:①抗原反应细胞(antigen-rdactivecell,ARC),外来抗原与 ARC 结合,使细胞增殖并产生相应的抗体,构成网络的主体;②ARC 抑制细胞,即抗独特型组(anti-idotypeset),可识别 ARC 的独特型标志,有抑制 ARC 反应的作用;③ARC 激发细胞,为内影像组(internalimageset),该组细胞的独特位与外来抗原表位的结构相似,可模拟外来抗原对 ARC 构成刺激;④与 ARC 独特位相同的细胞,为非特异性平行组(unspecificparallelset),可被 ARC 激活细胞识别,刺激其对 ARC 激活细胞识别,刺激其对 ARC 的抑制作用。后三类细胞也分别抑制细胞和刺激细胞,以构成自己的网络(图 7 -6)。
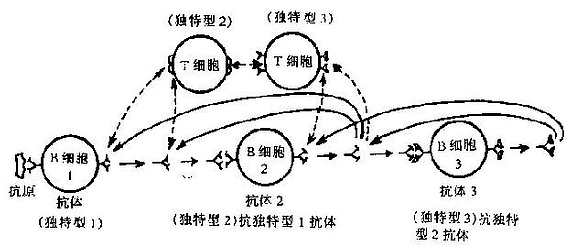
图 7 - 6 独特型网络作用示意图
独特型网络调节的最终效应是抑制抗体的产生,使免疫应答终止。这一学说为免疫调节的研究开辟了新的领域,有关网络的精确机制及操纵方法尚需进一步研究。
四、免疫应答的整体调节
上述的免疫调节并非各自独立存在,而是相互影响,并且在整体上受神经-内分泌的调节,构成更加复杂的神经-内分泌-免疫调节网络。尽管免疫系统与神经系统和内分泌系统没有解剖学上的直接联系,但通过小分子介质可以沟通这三个系统。已有资料表明,免疫细胞可以表达某些神经递质的受体,而某些神经细胞上也发现有细胞因子的受体。虽然这些受体的确切作用尚未得到证实,但无疑这是系统间相互作用的物质基础。
现已证明雌激素、雄激素和皮质醇等可抑制免疫应答,而生长素、甲状腺素和胰岛素等则有免疫促进作用。乙酰胆碱、肾上腺素、去甲肾上腺素、多巴胺等神经递质对淋巴活性的影响都有报道,尤其内啡肽与脑肽对免疫应答的影响已受到重视,并证明它们可促进 T 细胞增殖和 NK 细胞的杀伤活性;而对抗体的产生则表现抑制作用。
大量的临床观察和实验研究表明,精神因素和条件反射对免疫应答也有显著的影响,但其作用途径及机制尚不清楚。
第八章 免疫应答
炎症(inflammation)是各种致病因素引起的局部组织的防御性反应;其基本病理变化为组织的变质、渗出和增生,典型的急性炎症表现为红、肿、热痛和功能障碍。引起炎症的原因很多,如物理因素、化学因素、生物学因素和免疫学因素等。由免疫学因素介导的或免疫应答过程导致的炎症称为免疫炎症或炎症性应答。
免疫炎症是针对有害因子的积极反应,例如血管通透性增加可以促进炎症细胞跑到炎症反应部位,液体渗出有助于稀释有害的抗原,局部血凝可以限制抗原进入血循环而扩散,支气管收缩可加速气流促进变应的原排出。但是上述的变化也同样地干扰了正常的生理环境,表现出一系列的病理改变和病理生理过程,通常称之为变态反应(allergy)或超敏反应(hypersensitivity)。因此,免疫炎症与变态反应是一种过程的两个方面,变态反应是免疫炎症的病理与临床表现。
第一节 炎症细胞
参与炎症应答的细胞都可称作炎症细胞(inflammatorycell);其中有些是组织固定细胞,例如巨噬细胞、肥大细胞和内皮细胞等;有些是循环细胞,例如淋巴细胞、粒细胞和血小板等。淋巴细胞和巨噬细胞虽然是免疫炎症的中心细胞,但已在第四章详细叙述;本节主要介绍其他炎症细胞。
一、中性粒细胞
中性粒细胞(neutrophil)来源于骨髓,形成特征是具有分叶形或杆状的核,胞浆内含有大量既不嗜碱也不嗜酸的中性细颗粒。这些颗粒多是溶酶体,内含髓过氧化酶、溶菌酶、碱性磷酸酶和酸性水解酶等丰富的酶类,与细胞的吞噬和消化功能有关。
中性粒细胞在血液中占白细胞总数的 60%~70%,而在骨髓储库中约 100 倍于血液中的数量;中性粒细胞是短寿的终末细胞,释放骨髓后在血流中仅数小时便移血管外,并在 1~2 天内凋亡;因此骨髓造血能力的 60%左右用来维持中性粒细胞的数量平衡。
中性粒细胞表面表达 IgGFc 受体,多是中亲和力的 FcγRⅡ和低亲和力的 FcγRⅢ,有时受细胞因子的诱导也可表达高亲和力的 FcRⅠ;还表达补体片段 C3b 和 C4b 以及某些特殊因子的受体。表面受体与相应配体作用后,可以活化中性粒细胞某方面的特殊功能。
1.趋化运动活性 中性粒细胞受到某些化学因子的作用以后,可以朝因子源方向移动,这种现象称为趋化作用(chemotaxis),该化学物质称为趋化因子(chemotacticfactor)。中性粒细胞的趋化因子有两类:一是自身组织损伤释放的因子,例如胶原和纤维蛋白片段、补体活化产物及免疫细胞因子等;另一是微生物来源的含有 N - 早酰蛋氨酸残基的多肽。
受趋化因子作用后,中性粒细胞表面的 L - 选择素(selectin)数量增加,血管内皮细胞开始表达 P - 或 E - 选择素;这两类选择素结合可使细胞贴向血管壁,称为着边作用(margination);这时中性粒细胞迅速表达整合素(intergrin),例如 MAC- 1 和 LFA- 1 等,与内皮细胞的配体结合可使中性粒细胞变扁,紧密粘贴内皮细胞;继而中性粒细胞变形移出血管外,以阿米巴运动的方式向趋化源移动。这种过程多发生在毛细血管微静脉血流缓慢处。
2.吞噬杀伤效应 到达损伤感染部位后,中性粒细胞可对细菌、细胞碎片或其他颗粒表现活跃的吞噬作用;但如合识别这些目标尚不明了,可能与被吞噬物表面的亲水性有关。吞入的方式有以下几种:①吞噬作用(phagocytosis),这是捕获大型颗粒抗原的主要方式,例如对同种细胞、细菌等微生物,都可以吞噬,吞噬后在胞浆内形成吞噬体;②胞饮作用(pinocytosis),与吞噬作用相似,只是针对微小颗粒;胞饮后在胞浆内形成吞饮小泡;③受体介导的内摄作用(receptormediatedendocytosis),可借助细胞表面的某些受体连接被吞噬物;例如对那些结合有 IgG 或补体片段的抗原颗粒,中性粒细胞可通过其表面受体增强吞噬活性,这种现象称为吞噬调理作用(opsnization)。
颗粒被吞入后,由细胞膜将其包绕形成一个吞噬体,吞噬体与溶酶体融合形成吞噬溶酶体(phagolysosome),这时溶酶体酶就会活化,通过一系列的代谢机制将吞入的微生物杀死并进行降解。完成这一过程后细胞本身也衰老死亡。
3.抗感染和应用激作用 当机体遭受急性损伤或休脓性细菌感染时,会有大量的中性粒细胞向受体部位集中;同时骨髓的储备库释放和造血功能增强;机体表现为外周血中性粒细胞显著增加;局部死亡的白细胞和受累细胞液化形成脓汁。
中性粒细胞以其庞大的数量和迅速的行动发挥抗感染和创伤修复的作用,当中性粒细胞缺陷时,机体容易发生化脓菌感染和创伤修复缓慢。
图 8 - 1 中性粒细胞趋化作用和吞噬作用示意图
上图:趋化着边作用;下图:吞噬消化作用
二、肥大细胞和嗜碱性粒细胞
肥大细胞(mastcell)和嗜碱性粒细胞(basophil)虽在来源、性质和分布方面都不相同,但它们在表面特征和活性方面非常相似,都是 IgE 介导型炎症的主要效应细胞。
(一)肥大细胞
肥大细胞的形态呈多样性,通常为圆形或者椭圆形,直径大约 10~15μm,表面有许多放射状突起;细胞核呈圆形,位于细胞中央;胞浆内充满很多特异性颗粒,用碱性染料(如甲苯胺蓝)染色时呈紫红色。颗料内含有大量的组胺、肝素、TNFα 和其他炎症介质,还含有超氧化岐化酶、过氧化物酶和许多酸性水解酶等。
肥大细胞来源于骨髓干细胞,在祖细胞时期便迁移至外周组织中,就地发育成熟。肥大细胞在全身各处沿神经和血管附近分布,尤其多见于结缔组织和粘膜中。粘膜中的肥大细胞成熟与胸腺的诱导相关,颗粒中含组胺较少;结缔组织中的肥大细胞是胸腺非依赖性的,颗粒中含有大量的组胺。
肥大细胞的突出特点是表面有大量的高亲和性 IgE 受体(FcεRⅠ)。FcεRⅠ含有 4 条多肽链(α、β、2γ),暴露于细胞外的是链,与 IgE 的 Fc 有较强的结合力;两条链伸向胞浆内部,在结构和功能上都象 CD3 分子的 ζ 链;β 链在细胞膜中将 α 和 γ 连接起来。通过 FcR,肥大细胞可从循环中吸附大量的 IgE 分子在细胞表面,作为相应抗原的特异性受体。
(二)嗜碱性粒细胞
嗜碱性粒细胞是外周血颗粒性白的一个类型。细胞呈圆形,直径约 5~7μm,在粒细胞中形态较小,细胞数也少,约占血中有核细胞总数的 1%。嗜碱性粒细胞在骨髓内发育成熟,成熟细胞存在于血液中,只有在发生炎症时受趋化因子诱导才迁移出血管外。
嗜碱性粒细胞与肥大有许多相同的特性,例如胞浆内含有丰富的嗜碱性颗粒,细胞表面表达 FcRⅠ,与抗原结合后可使细胞活化,释放颗粒和炎症介质等。两种细胞的比较见表 8 -1。
表 8 - 1 肥大细胞与嗜碱性粒细胞特性比较
| 肥大细胞 | 碱性粒细胞 | |
| 细胞直径 | 10~15μm | 5~7μm |
| 细胞核 | 圆形或卵圆形 | 两叶或多叶 |
| 细胞外形 | 光滑有窄突起 | 偶有短宽突起 |
| 主要分布 | 粘膜和结缔组织 | 血液 |
| 细胞寿命 | 数周~数月 | 数日 |
| 增殖能力 | 增殖 | 不增殖 |
| 颗粒颗粒内含物 | 组胺、肝素、硫酸软骨素、中蛋性白酶 | 组胺、硫酸软骨素、中性蛋白酶 |
| 释放介质 | TNFα、PAF、LTC4、PGD2 | LTC4、TNFα |
三、嗜酸性粒细胞
嗜酸性粒细胞(eosinophil)是直径约 10~15μm 的圆形细胞,因其富含嗜酸性颗粒而得名。细胞的嗜酸性颗粒中含有多种酶类,如过氧化物酶、酸性磷酸酶、组胺酶、芳基硫酸酯酶、磷脂酶 D、血纤维蛋白溶酶等;还含有较多的碱性组蛋白,因此使颗粒呈嗜酸性。嗜酸性粒细胞来源于骨髓,爱 GM-CSF、IL- 2 和 IL- 3 的诱导发育成熟。该细胞的寿命很短,在骨髓有 2~6 天的成熟期,在循环中的半寿期约 6~12h,在结缔组织中可存活数日。
血循环中的嗜酸性粒细胞约占白细胞总数的 3%,但这个数字只占嗜酸性粒细胞总数的一小部分。估计在骨髓和其他结缔组织中的成熟嗜酸性粒细胞约 200 倍和 500 倍于循环中的同类细胞。IgE 型超敏反应和寄生虫病时嗜酸性粒细胞数量增多;并且可受趋化因子的作用向局部组织中集聚。
嗜酸性粒细胞表达低亲和性 IgE 受体 FcεRⅡ,在正常血清 IgE 水平时有与 IgE 结合;约 10%~30%的细胞表达 FcγRⅢ或 FcγRⅡ(表 8 -2);约 40%50%的细胞表达补体受体。这些受体与带相应配体的抗原结合可使细胞活化,GM-CSF、IL-1、IL-2、IL- 5 和 TNFα 等细胞因子也可使细胞直接活化。活化的嗜酸性粒细胞主要表现下列生物活性:
表 8 - 2 炎症细胞的免疫球蛋白受体
| 受体 | 中性粒细胞 | 单核细胞 | 肥大细胞 | 嗜碱粒性细胞 | 嗜酸性粒细胞 | 血小板 |
| IgG | ||||||
| IgG1 | + | + | - | ? | + | + |
| IgG2 | + | + | - | - | ? | + |
| IgG3 | + | + | - | - | ? | + |
| IgG4 | + | + | - | - | ? | + |
| IgM | - | - | - | - | - | - |
| IgA | + | + | - | - | ? | - |
| IgD | - | - | - | - | + | - |
| IgE | - | + | + | + | + | + |
| FcRⅠ | - | - | + | + | - | - |
| FcRⅡ | - | + | ? | ? | + | + |
1.趋化与吞噬作用 嗜酸性粒细胞的趋化因子包括过敏反应中产生的 ECF-A、补体活化过程中产生的 ECF- C 和 T 细胞来源的 ECF- L 等;受趋化因子作用后,嗜酸性粒细胞在体外对细菌、真菌和抗原抗体复合物等的吞噬能力已经得到证明,但在体内的吞噬作用尚需更确实的证据。
2.过敏反应调节作用 嗜酸性粒细胞参与 IgE 型超敏反应的调节作用。当肥大细胞或嗜碱性粒细胞的表面 IgE 与相应抗原结合诱发过敏反应时,会产生 ECF- A 吸引嗜酸性粒细胞聚集,并释放组胺酶分解组胺,释放芳基硫酸酯酶分解白三烯,消除过度的炎症反应。这样,嗜酸性粒细胞与肥大细胞和嗜碱性粒细胞之间形成一个反馈的调节机制,在过敏反应强烈时嗜酸性粒细胞的这种调节作用更加明显。
3.对寄生虫感染的应答 机体受寄生虫感染后,可产生相应的抗体,抗体与抗原结合可激活补体,形成 ECF-C;另一方面,寄生虫抗原又使 T 细胞致敏,产生 ECF-L。这些趋化因子可吸引许多嗜酸性粒细胞到寄生虫感染部位,并释放过氧酶等物质,对寄生虫发挥毒性杀伤作用。
4.纤维蛋白溶解作用 嗜酸性粒细胞能释放纤维蛋白溶酶;还可释放磷脂酶 D,分解能引起血栓形成的血小板激活因子;因此,嗜酸性粒细胞参与防止血管内凝血,消除已形成的纤维蛋白。
四、血小板
血小板(platelet)是骨髓内巨核细胞脱离的细胞质片段,形状不规则,内含三种类型的颗粒(致密颗粒、α 颗粒和溶酶体颗粒)。血小板在血液中的平均寿命约 10 天,其主要功能是使血液凝固;也能够生成、储存和释放生物活性介质,如在花生四烯酸代谢产物(PGG2、PGH2 和促血栓素 A2)、生长因子、生物活性胺及中性和酸性水解酶等。
血小板表面有 IgGFc 受体,也有低亲和性 IgEFc 受体(FcεRⅡ)。FcεRⅡ可使血小板与 IgE 包被的寄生虫结合,并释放细胞毒性产物,例如过氧化氢或其他氧化代谢产物;抗原与 IgE 结合也可通过 FcεRⅡ诱导血小板激活因子生成。
五、内皮细胞
内皮细胞(endothelialcell)通过促进和调节循环的炎症细胞而参与炎症应答。内皮细胞可以受细胞因子(如 IL-1、IFNγ、TNF)或其他免疫应答主物的作用而活化,增加对单核细胞、中性粒细胞和其他循环细胞的粘附作用;活化的内皮细胞有时表达 MHCⅡ类分子,表现原递呈功能;也可分泌 IL- 1 和 GM-CSF,调节免疫应答。
第二节 炎症介质
炎症介质是炎症过程中形成或释放、并参与炎症反应的活性物质。通常,具备以下条件可认为是炎症介质:①用适当浓度介质可在相关组织引起相似的炎症反应;②炎症时介质能从组织中释放;③炎症组织中存在该介质生成的酶,当介质增加时有酶活性增强;④体内存在使该介质分解、吸收或脱敏的机制;⑤用药理学方法改变介质的合成、储存、释放或代谢时可影响炎症过程;⑥该介质过多或缺乏对炎症反应有可预见的影响;⑦能证明在靶细胞上存在相应的介质受体,并可触发或调节特异性炎症反应。
炎症介质的种类繁多,许多细胞因子可以是良好的炎症介质,已在第五章叙述;其它的主要介质可分为 4 类,见表 8 -3。
表 8 - 3 主要炎症介质
| 类别 | 主要介质 | 存在形式 |
| 血管活性与平滑肌收缩介质 | 组胺、腺苷、PAF、花生四烯酸产物 | 储存释放临时生成 |
| 酶类介质 | 胰蛋白酶等 | 储存释放 |
| 趋化因子 | 细胞因子、PAF、补体产物、LTB4 | 储存释放临时生成 |
| 蛋白聚糖 | 肝素 | 储存释放 |
一、血管活性与平滑肌收缩介质
(一)组胺
组胺(histamine)是最早发现的一种炎症介质,分子量 111,由左旋组氨酸脱羧后生成。组胺生成后储存于肥大细胞和嗜碱性粒细胞的颗粒中,占颗粒内容物重量的 10%。组胺在颗粒中以肝素结合的形式存在,当通过脱颗粒作用释放到细胞外时,组胺与肝素分离,发挥活性作用。
组胺通过 3 种不同的靶细胞受体发挥生理作用,这些受体分别命名为 H1、H2 和 H3,各自的组织活性见表 8 -4。
表 8 - 4 组胺受体及其活性
| 受体 | 活性及效应 |
| H1 | 后微静脉通透性增加,平滑肌收缩,肺血管收缩,细胞内 cGMP 水平升高,粘液分泌增加,白细胞化学激活作用,肺部前列腺素的产生 |
| H2 | 促进胃酸分泌,促进粘液分泌,提高细胞内 cAMP 水平,白细胞化学激活作用,诱导 T 细胞抑制 |
| H3 | 抑制组胺释放,抑制组胺合成 |
组胺在炎症中的作用主要由 H1 受体介导,且于治疗过敏反应的抗组胺药物也是通过选择性地阻断 H1 受体而发挥作用。H2 受体可被西莫替丁和雷尼替丁阻断,临床上常用来治疗消化性溃疡。H3 受体活化能抑制组胺的合成和释放,使组胺的致炎作用减弱或消失;这是机体生理平衡需要的一种自限方式。
引起组胺释放的因素很多,主要是 IgE 介导的反应;某些理化因素也可诱导组胺释放。组胺的半衰期较短,约为 30~60min;之后便被组胺酶及 N - 甲基转移酶和单胺氧化酶作用,转化为各种无活性的代谢产物随尿排出。
组胺在炎症中的作用如下:
(1)舒血管活性:组胺可引起微动脉舒张,使毛细血管前阻力降低;使毛细血管后微静脉的通透性增强,血中大分子物质渗出;这些变化导致局部充血水肿,严重时发生休克。
(2)非血管平滑肌收缩:组胺可使多种组织的平滑肌收缩,支气管平滑肌对组胺尤为敏感,实验动物可因支气管痉挛而致死。这是引起支气管哮喘的主要机制。
(3)腺体分泌增加:组胺能引起胃酸大量分泌,其机制是与 H2 受体结合激活了腺苷酸环化酶,使细胞内 cAMP 水平升高,因其胃壁细胞分泌增加。组胺对其他消化腺、支气管腺和泪腺也有较弱的作用。
(4)致痒作用:组胺刺激神经末梢可引起皮肤发线和瘙痒,这是过敏反应常见的症状。
(二)花生四烯酸代谢产物
花生四烯酸为二十碳不饱和脂肪酸,它可经磷脂酶 C 和二酰甘油脂酶的作用从膜磷脂释放出来,也可经脂酶 A2 直接作用于膜磷脂而产生。花生四烯酸的代谢产物有多种,主要可分为两类:经环氧化酶作用产生的前列腺素(prostaglandin,PG)类和经脂氧化酶作用产生的白三烯(leukotrienes,LT)类。这类物质不是储存性介质,是在过敏反应发生后才产生的。
1.前列腺素类环氧化酶的产物主要有:PGG2、PGH2、PHI2、PGF2 和 PGD2,另外还有一部分血栓素 TXA2 和 TXB2 等。PG 在炎症中的作用有:①舒张血管作用, 肥 PGI2 作用最强;②对支气管、胃肠和子宫平滑肌的收缩作用;③增强腺体分泌作用;④趋化因子作用;⑤免疫症调节作用:PGE2 低浓度时能抑制腺苷酸环化酶,使 cAMP 水平降低引起炎症;当高浓度时又可使 cAMP 水平升高,产生炎症抑制效应,例如可抑制嗜碱性粒细胞释放组胺、抑制 Tc 细胞的杀伤作用、抑制中性粒细胞趋化运动和溶酶体酶的释放等。
2.白三烯类脂氧化酶产物主要有 LTB4、LTC4、OTD4 和 LTE4。其中 LTB4 是一种趋化因子。LTC4、OTD4 和 LTE4 过去曾统称为过敏反应的慢反应物质(SRS-A);可使平滑肌收缩和粘液分泌,LTs 收缩支气管的能力比组胺强 1001000 倍,持续时间也长,是引起支气管哮喘的主要原因。另外,LTs 还可引起血压下降和心律失常。
(三)血小板激活因子
血小板激活因子(plateletactivaitngfactor,PAF)是一种磷脂类介质,主要由活化的肥大细胞和血小板释放,因有激活血小板的能力而命名。PAF 可凝聚和活化血小板,使其释放活性胺类,引起毛细血管扩张和通透性增强;可激活中性粒细胞和嗜酸性粒细胞,是已知的最强的嗜酸性粒细胞趋化因子;注入皮肤可引起红肿和白细胞浸润;吸入时可引起急性的支气管收缩。PAF 正常情况下以一种非活化形式储存于细胞中,细胞活化时释放出来,经磷脂酶 D 作用后失去活性。
(四)感觉神经肽
感觉神经肽是一组由感觉神经末梢释放的肽类物质,主要包括 P 物质(SP)、神经激肽(neurokinin)A、B(NKA,NKB)及降钙素基因相关肽(CGRP)等。
感觉神经肽具有明显的促炎作用,能通过轴突反射机制引起神经源性炎症和加重炎症反应。CGRP 对人皮肤是一种很强的血管扩张剂,大剂量时引起血管壁通透性增加,形成荨麻疹。而 SP 除能引起血管扩张外,更是一种极强的致水肿因子。体外研究表明,SP 具有收缩人支气管平滑肌的作用,NKA 作用更强。SP 还可刺激呼吸道粘膜分泌。在致炎因子作用下,从感觉神经末梢释放的 SP,能使邻近的肥大细胞释放组胺,而组胺和激肽等炎症介质又可刺激感觉神经末梢释放 SP。
二、其他炎症介质
(一)酶类介质
炎症细胞颗粒中存在多种酶类介质,细胞脱颗粒时释放出来,参与补体活化、血液凝固或激肽(kinin)的生成。
1.激肽原酶(kininogenase)为肥大细胞和嗜碱性粒细胞颗粒中含有的酶类之一,释出后可活化激肽生成系统,将血浆中的激肽原转变为激肽。激肽生成系统是血液中除补体外的第二大介质形成系统,其多种中间产物与补体系统互有联系,终产物主要是缓激肽(bradykinin)。
缓激肽是 9 个氨基酸残基组成的小分子肽,可引起平滑肌收缩和血管通透性增加,刺激神经末梢引起疼痛。缓激肽的作用缓而持久,特别是对支气管的子宫平滑肌的作用更加明显。
2.类胰蛋白酶(trytpase)是肥大细胞颗粒中的另一酶类,能裂解补体成分 C3 产生 C3a,也可作用于多种凝血因子。C3a 是一种过敏毒素,也是一种趋化因子。
(二)趋化性介质
趋化因子是能吸引吞噬细胞作定向运动的化学物质,是一类重要的炎症介质。其中有一部分是细胞因子(第五章已述);一部分是补体裂解产物(第三章已述);另外,PAF 和 LTB4 等对中性粒细胞和嗜酸性粒细胞也有趋化作用。
(三)蛋白聚糖
肥大细胞和嗜碱性粒细胞的颗粒中富含一种蛋白质-多糖复合物,称为蛋白聚糖(proteoglycans)。蛋白聚糖形成了颗粒的结构基质,也作为半抗原和其他介质的结合部位,例如硫酸软骨素主要就是这些功能。还有一些具有不同调节活性的蛋白多糖,如肝素,它除了具有抗凝血活性外,还有调节类胰蛋白酶的活性;每个肥大细胞约含 5pg 的肝素。
第三节 免疫炎症的类型
免疫炎症可由不同的途径引发,因此参与反应的炎症细胞、炎症因子和反应机制各不相同。一个世纪以来已观察到不同免疫炎症间的区别,许多认识是从皮肤试验得到的;因为皮肤易于发生各种类型的反应,且容易发现它们之间的区别。现在仍然经常用皮肤试验来判断患者是否对某种抗原发生超敏反应。免疫介导的炎症应答至少有 4 种类型(表 8 -5)。在人工皮肤试验情况下,单一的纯化抗原在特定的病人身上只能诱发一种类型的炎症应答;但复合抗原可同时涉及多种类型;人类对天然抗原的应答多是复合型反应。
表 8 - 5 免疫炎症的分类
| 炎症类型 | 潜伏期 | 效应细胞 | 主要介质 | 应答机制 |
| IgE 介导型 | ||||
| 速发相 | 10min | 肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞 | 组胺、LTs | 血管和平滑肌反应 |
| 迟发相 | 6h | 肥大细胞、嗜碱性、嗜酸性和中性粒细胞 | PAF、PGD2、TNFα、LTs | 肥大细胞后期介质和效应 |
| 免疫复合物型 | 8h | 中性粒细胞等 | 补体产物 | 吞噬消化效应 |
| 细胞介导型 | 36h | 淋巴细胞、Mφ | 淋巴因子 | T 细胞应答 |
| 皮肤嗜碱细胞型 | 36h | 嗜碱性粒细胞 | 不清 | 不清 |
一、IgE 介导的炎症
IgE 又称反应素(reagin)。它介导的炎症发作迅速、有明显的病理生理效应,但很少有组织破坏,多数在短期内即可恢复正常,亦称为过敏反应(anaphylaxis)。近年的研究发现,过敏反应的速发期过后,间隔数小时还会出现不完全相同的后期反应;分别称为过敏反应的速发相和迟发相,或者早期反应和晚期反应。
(一)早期反应
机体被某类抗原致敏后产生的 IgE 通过 FcεRⅠ结合到肥大细胞和嗜碱性粒细胞上,当相应抗原与 IgE 结合时,会产生一个激动信号使肥大细胞活化,从而使细胞脱颗粒并释放炎症介质。
引发早期反应的抗原是多价的,必须与细胞表面 2 个或 2 个以上的 IgE 结合,形成抗体的桥联作用,才能产生细胞活化信号;这种效应也可由抗 IgE 抗体、丝裂原和过敏毒素引起。活化信号可使蛋白质酪氨酸激酶活化和细胞内钙离子水平升高,致使胞浆颗粒互相融合并与细胞的表面膜融合,将颗粒内容物释放到细胞外。
上述过程在抗原与 IgE 结合后的 2~3min 内就可完成。释放出的组胺等介质快引起毛细血管扩张和通透性强、平滑肌收缩和腺体分泌增加等效应,表现为皮肤红斑、丘疹、水肿和瘙痒,支气管哮喘,严重时可发生休克。这些反应在接触抗原后的 15min 达到高峰。
(二)晚期反应
晚期反应发生在接触抗原大约 6h 后,于反应部位出现嗜酸性粒细胞和中性粒细胞浸润,并可持续 12d 或更长时间,是为过敏反应的迟发相。
晚期反应主要由肥大细胞脱颗粒后形成的各种产物(例如 PAF 和各种花生四烯酸代谢产物)及预先形成的 TNFα 所引起,这些因子吸引粒细胞浸润,进一步加重炎症,表现为受累部位出现红斑、硬结、发热、搔痒和烧灼感。炎症部位可有纤维蛋白沉积,但无免疫球蛋白和补体沉积。TNFα 不仅在短期内有白细胞趋化功能,而且刺激局部血栓形成、成纤维细胞增生和瘢痕形成。
一般情况下,IgE 介导的炎症在抗原进入机体初期的防御中起着有益的作用,因为快速的血管扩张能使可溶性因子和细胞容易进入抗原接触部位。引起的超敏反应疾病主要归咎于后期吸引的白细胞作用而不是肥大细胞。
二、免疫复合物介导的炎症
免疫复合物(immunecomplex,IC)介导的炎症分为两种类型枣局部型 Arthus 反应和全身性血清病(serumsickness),其发生机制都是免疫复合物没积、补体活化和细胞浸润等过程。
(一)免疫复合物形成
抗原进入致敏的机体可与相应的抗体结合形成复合物;但只有含 IgG(IgG4 除外)和 IgM 类抗体的复合物才能活化补体的经典途径而引起炎症。这两类抗体在血清中含量较大,是构成免疫复合物的主要抗体;可溶性抗原与相应抗体形成的较大免疫复合物活化补体的能力较强。
IgG 抗体为双价,可与相应的多价抗原交互结合形成较大的免疫复合物;IgM 分子可形成更大的免疫复合物。抗原-抗体亲和力高时易形成大而稳定的免疫复合物。另外,抗原和抗体的相对比例与复合物的形成也密切相关;当抗原或抗体比例相差悬殊时,只能形成小的可溶性复合物;只有在抗原-抗体比例适当时,才能形成引起炎症的免疫复合物。
(二)免疫复合物沉积
较大网格的抗原抗体复合物容易从液相中沉淀出来,即沉淀素反应(precipitinreaction);免疫复合物的沉积还与局部因素有关,在毛细血管分支多、血流缓慢或富含胶原组织的部位,容易发生免疫复合物沉积。
如果免疫复合物在血流中形成,可通过循环沉积在全身各处,例如在动脉弹力层、血管周围、肾小球基底膜和关节滑漠等部位;所引起的病理现象可统称为血清病。另外,高浓度的抗原抗体复合物可以在某一局部形成,例如在皮肤注射部位,形成的免疫复合物不能进入循环,在局部就地沉积,引起局部型免疫复合物炎症,即 Arthus 反应。
(三)补体激活与炎症效应
当免疫复合物在某部位沉积时,可通过经典途径激活补体,所形成的活性介质 C3a、C4a、C5a 和 C567 等有中性粒细胞趋化作用,使大量中性粒细胞聚集在复合物沉积部位;中性粒细胞在吞噬复合物的过程中释放出溶酶体酶,造成周围组织的, 损伤。还可直接或间接引起弥漫性微血栓、内皮细胞增生及巨噬细胞和淋巴细胞浸润。因为上述补体活性产物还有过敏毒素作用,所以有时还伴随着一定程度的过敏反应现象。
Arthus 反应发生在多次重复注射同一种抗原的个体,在注射相应抗原 1h 后,局部可见水促和红晕,随后在数小时内可发展为出血和坏死,2~3 天后逐渐被吸收愈合。Arthus 反应除了发生在实验动物外,在人也可见到,例如在接种某些疫苗和长时期注射胰岛素者的注射部位;还可发生在昆虫叮咬处。
血清病是全身不同程度的血管炎,常发生在大量注射异种免疫血清或重复遭受某种感染的病人,可引起多咱临床表现,例如血管炎、肾小球炎、肺炎、系统性红斑狼疮、类风湿性关节炎和结节病等等。
三、细胞介导的炎症
细胞介导的炎症是指由巨噬细胞和 T 细胞介导的反应,发展较慢,在接触抗原后 36 小时才发生,所以也称迟发型超敏反应(DTH)。
DTH 由抗原特异性 T H促发,活化的 T H释放细胞因子,进行免疫调节和诱导炎症发生。这些可使 T H自身增殖;吸引其他循环细胞聚集,包括 T 细胞、B 细胞、单核细胞、粒细胞等;促进吞噬、细胞杀伤、杀菌和抗原递呈功能。上述过程使局部血管扩张,进一步促使循环细胞到达反应部位;使得凝血系统和激肽系统被激活,纤维蛋白形成和沉积局部。纤维蛋白在限制炎症扩散和硬结的形成方面有重要意义,这是 DTH 的组织特征。
DTH 的病理变化主要是局部淋巴细胞和巨噬细胞浸润;某些抗原如手术缝合线、硅胶、滑石、矿物油等异物及真菌、寄生虫、分枝杆菌等所引起的 DTH 以巨噬细胞浸润为主,导致肉芽肿形成。临床上常见的接触性皮炎、某些预防接种反应、同种移植排斥反应、肿瘤免疫、某些自身免疫病和对细胞内病原体的抗感染机制等都属于此类炎症反应。细胞介导的炎症对机体有保护作用,但强烈持久者也可导致宿主组织的损伤。
四、皮肤嗜碱性粒细胞超敏反应
皮肤嗜碱性细胞超敏反应常由蛋白质抗原引起,当抗原注入皮肤时,引起局部肿胀等 DTH 反应,但比典型 DTH 的损伤和瘙痒轻;主要病理变化为嗜碱性粒细胞浸润,但无 DTH 的肉芽肿等其他特征。这种类型的损伤似乎是抗体介导的,其形成机制尚不肯定。嗜碱性粒细胞浸润有时在同种肾移植中见到,提示这个过程可能是一种移植排斥现象。
免疫学技术
第九章 抗原抗体反应
抗原抗体反应(antigen-antibodyreaction)是指抗原与相应抗体之间所发生的特异性结合反应。可发生于体内(invivo),也可发生于体外(invitro)。体内反应可介导吞噬、溶菌、杀菌、中和毒素等作用;体外反应则根据抗原的物理性状、抗体的类型及参与反应的介质(例如电解质、补体、固相载体等)不同,可出现凝集反应、沉淀反应、补体参与的反应及中和反应等各种不同的反应类型。因抗体主要存在于血清中,在抗原或抗体的检测中多采用血清作试验,所以体外抗原抗体反应亦称为血清反应(serologicreaction)。
第一节 抗原抗体反应的原理
抗原与抗体能够特异性结合是基于两中分子间的结构互补性与亲和性,这两种特性是由抗原与抗体分子的一级结构决定的。抗原抗体反应可分为两个阶段。第一为抗原与抗体发生特异性结合的阶段,此阶段反应快,仅需几秒至几分钟,但不出现可见反应。第二为可见反应阶段,抗原抗体复合物在环境因素(如电解质、pH、温度、补体)的影响下,进一步交联和聚集,表现为凝集、沉淀、溶解、补体结合介导的生物现象等肉眼可见的反应。此阶段反应慢,往往需要数分钟至数小时。实际上这两个阶段以严格区分,而且两阶段的反应所需时间亦受多种因素和反应条件的影响,若反应开始时抗原抗体浓度较大且两者比较适合,则很快能形成可见反应。
(一)亲水胶体转化为疏水胶体
抗体是球蛋白,大多数抗原亦为蛋白质,它们溶解在水中皆为胶体溶液,不会发生自然沉淀。这种亲水胶体的形成机制是因蛋白质含有大量的氨基和羧基残基,这些残基在溶液中带有电荷,由于静电作用,在蛋白质分子周围出现了带相反电荷的电子云。如在 pH7.4 时,某蛋白质带负电荷,其周围出现极化的水分子和阳离子,这样就形成了水化层,再加上电荷的相斥,就保证了蛋白质不会自行聚合而产生沉淀。
抗原抗体的结合使电荷减少或消失,电子云也消失,蛋白质由亲水胶体转化为疏水胶体。此时,如再加入电解质,如 NaC1,则进一步使疏水胶体物相互靠拢,形成可见的抗原抗体复合物。
(二)抗原抗体结合力
有四种分子间引力参与并促进抗原抗体间的特异性结合。
1.电荷引力(库伦引力或静电引力)这是抗原抗体分子带有相反电荷的氨基和羧基基团之间相互吸引的力。例如,一方在赖氨酸离解层带阳离子化的氨基残基(-NH3+),另一方在天门冬氨酸电离后带有阴离子化的羧基(-COO-)时,即可产生静电引力,两者相互吸引,可促进结合。这种引力和两电荷间的距离的平方成反比。两个电荷越接近,静电引力越强。反之,这种引力便很微弱。
2.范登华引力这是原子与原子、分子与分子互相接近时发生的一种吸引力,实际上也是电荷引起的引力。由于抗原与抗体两个不同大分子外层轨道上电子之间相互作用,使得两者电子云中的偶极摆而产生吸引力,促使抗原抗体相互结合。这种引力的能量小于静电引力。
3.氢键结合力氢键是由分子中的氢原子和电负性大的原子如氮、氧等相互吸引而形成的。当具有亲水基团(例如-OH,-NH2及-COOH)的抗体与相对应的抗原彼此接近时,可形成氢键桥梁,使抗原与抗体相互结合。氢键结合力较范登华引力强,并更具有特异性,因为它需要有供氢体和受氢体才能实现氢键结合。
4.疏水作用抗原抗体分子侧链上的非极性氨基酸(如亮氨酸、缬氨酸和苯丙氨酸)在水溶液中与水分子间不形成氢键。当抗原表位与抗体结合点靠近时,相互间正、负极性消失,由于静电引力形成的亲水层也立即失去,排斥了两者之间的水分子,从而促进抗原与抗体间的相互吸引而结合。这种疏水结合对于抗原抗体的结合是很重要的,提供的作用力最大。
第二节 抗原抗体反应的特点
(一)特异性
抗原抗体的结合实质上是抗原表位与抗体超变区中抗原结合点之间的结合。由于两者在化学结构和空间构型上呈互补关系,所以抗原与抗体的结合具有高度的特异性。这种特异性如同钥匙和锁的关系。例如白喉抗毒素只能与相应的外毒素结合,而不能与破伤风外毒素结合。但较大分子的蛋白质常含有多种抗原表位。如果两种不同的抗原分子上有相同的抗原表位,或抗原、抗体间构型部分相同,皆可出现交叉反应。
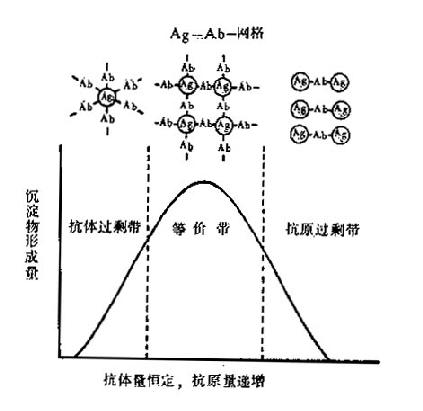
图 9 - 1 沉淀反应中没淀量与抗原抗体的比例关系
Ag:抗原;Ab:抗体
(二)按比例
在抗原抗体特异性反应时,生成结合物的量与反应物的浓度有关。无论在一定量的抗体中加入不同量的抗原或在一定量的抗原中加入不同量的抗体,均可发现只有在两者分子比例合适时才出生现最强的反应。以沉淀反应为例,若向一排试管中中入一定量的抗体,然后依次向各管中加入递增量的相应可溶性抗原,根据所形成的沉淀物及抗原抗体的比例关系可绘制出反应曲线(图 9 -1)。从图中可见,曲线的高峰部分是抗原抗体分子比例合适的范围,称为抗原抗体反应的等价带(zoneofequivalence)。在此范围内,抗原抗体充分结合,沉淀物形成快而多。其中有一管反应最快,沉淀物形成最多,上清液中几乎无游离抗原或抗体存在,表明抗原与抗体浓度的比例最为合适,称为最适比(optimalratio)。在等价带前后分别为抗体过剩则无沉淀物形成,这种现象称为带现象(zonephenomenon)。出现在抗体过量时,称为前带(prezone),出现在抗原过剩时,称为后带(postzone)。
关于抗原抗体结合后如何形成聚合物,曾经有过不少解释。结合现代免疫学的成就呼电镜观察所见,仍可用 Marrack(1934)提出的网格学说(latticetheory)加以说明。因为大多数抗体的巨大网格状聚集体,形成肉眼可见的沉淀物。但当抗原或抗体过量时,由于其结合价不能相互饱和,就只能形成较小的沉淀物或可溶性抗原抗体复合物。
在用沉淀反应对不同来源的抗血清进行比较后,发现抗体可按等价带范围大小分为两种类型,即 R 型抗体和 H 型抗体。R 型抗体以家兔免疫血清为代表,具有较宽的抗原抗体合适比例范围,只在抗原过量时,才易出现溶性免疫复合物,大多数动物的免疫血均属此型。H 型抗体以马免疫血清为代表,其抗原与抗体的合适比例范围较窄,抗原或抗体过量,均可形成可溶性免疫复合物。人和许多大动物的抗血清皆属 H 型。
(三)可逆性
抗原抗体反应遵循生物大分子热动力学反应原则,其反应式为:
[Ab-Ag]/[Ab].[Ag]=k1/k2=k
式中各反应项的单位以 mol 表示,k1 表示反应速度常数,k2 为逆反应速度常数,K 是反应平衡时的速度常数。由上式可知,K 值是反映抗原抗体间结合能力的指示,所以抗体亲和力通常以 K 值表示。
抗原抗体复合物解离取决于两方面的因素,一是抗体对相应抗原的亲和力;二是环境因素对复合物的影响。高亲和性抗体的抗原结合点与抗原表位的空间构型上非常适合,两者结合牢固,不容易解离。反之,低亲和性抗体与抗原形成的复合物较易解离。解离后的抗原结合牢固,不容易解离。反之,低亲和性抗体与抗原形成的复合物较易解离。解离后的抗原或抗体均能保持未结合前的结构、活性及特异性。在环境因素中,凡是减弱或消除抗原抗体亲和力的因素都会使逆向反应加快,复合物解离增加。如 pH 改变,过高或过低的 pH 值均可破坏离子间电引力消失。对亲合力本身较弱的反应体系而言,仅增加离子强度即可解离抗原抗体复合物的目的;增加温度可增加分子间的热动能,加速已结合的复合物的解离,但由于温度变化易致蛋白变性,所以实际工作中极少应用。改变 pH 和离子强度是最常用的促解离方法,免疫技术中的亲和层析就是以此为根据纯化抗原或抗体。
第三节 影响抗原抗体反应的因素
(一)电解质
抗原与抗体发生特异性结合后,虽由亲水胶体变为疏水胶体,若溶液中无电解质参加,仍不出现可见反应。为了促使沉淀物或凝集物的形成,常用 0.85%氯化钠或各种缓冲液作为抗原及抗体的稀释液。由于氯化钠在水溶液中解离成 Na+和 C1-,可分别中和胶体粒子上的电荷,使胶体粒子的电势下降。当电势降至临界电势(12~15mV)以下时,则能促使抗原抗体复合物从溶液中析出,形成可见的沉淀物或凝集物。
(二)酸碱度
抗原抗体反应必须在合适的 pH 环境中进行。蛋白质具有两性电离性质,因此每种蛋白质都有固定的等电点。抗原抗体反应一般在 pH 为 6~8 进行。PH 过高或过低都将影响抗原与抗体的理化性质,例如 pH 达到或接近抗原的等电点时,即使无相应抗体存在,也会引起颗粒性抗原非特异性的凝集,造成假阳性反应。
(三)温度
在一定范围内,温度升高可加速分子运动,抗原与抗体碰撞机会增多,使反应加速。但若温度高于 56℃时,可导致已结合的抗原抗体再解离,甚至变性或破坏;在 40℃时,结合速度慢,但结合牢固,更易于观察。常用的抗原抗体反应温度为 37℃。每种试验都有其独特的最适反应温度,例如冷凝集素在 4 左右与红细胞结合最好,20℃以上反而解离。
此外,适当振荡也可促进抗原抗体分子的接触,加速反应。
第四节 抗原抗体反应的类型
根据抗原和抗体性质的不同和反应条件的差别,抗原抗体反应表现为不同的形式。颗粒性抗原表现为凝集反应;可溶性抗原表现为沉淀反应;补体参与下细菌抗原表现为溶菌反应,红细胞抗原表现为溶血反应;毒素抗原表现为中和反应等。利用这些类型的抗原抗体反应建立了各种免疫学技术,在医学检验中广泛用于抗原和抗体的检测。为了提高反应的敏感性和特异性,便发展了一些新的试验类型,如种种标记的抗原抗体反应等。这些类型各有其特点,将在以下各章中详细叙述。
第十章 免疫原和抗血清的制备
抗原和抗体是免疫学检验的两大重要因素,也是整个免疫反应的基本条件。抗原的纯化是制备特异性抗的先决条件,制得的抗体可用于纯化抗原和检测抗原。抗体有单克隆和多克隆两类。
单克隆抗体用杂交瘤技术制备(详见第十一章),多克隆抗体存在于免疫动物抗血清中。近年来又出现了基因工程抗体(单链抗体)。本章仅叙述抗原纯化和多克隆抗血清制备技术。
第一节 免疫原的制备
免疫原是诱导机体产生抗体、并能与抗体发生反应的物质。能否制得合格的抗体由许多因素决定,而能否制备合格的免疫原则是其前提条件。而且作为诊断试剂的抗原也必须是单一特异性的,即纯化的抗原。自然众多的物质皆可成为免疫原,但绝少是单一成分(除非是合成的基因工程制备的),所以必须将某个抗原从复杂的组分中提取出单一的成分。下面介绍有代表性的免疫原制备方法。
一、颗粒性抗原的制备
颗粒性抗原主要是指细胞抗原或细菌抗原。最常用的细胞抗原为制备溶血素用的绵羊红细胞。这种抗原制备比较简单,采集新鲜绵羊红细胞,以无菌盐水洗涤 3 次(每次离心 2000r/min10min),最后配成 106/ml 浓度的细胞悬液,即可应用。细菌抗原多用液体或固体培养物经集菌后处理。H 抗原用有动力的菌株,菌液用 0.3%~0.5%甲醛处理,而 O 抗原则需要 100℃加温 2~2.5h 后应用。Vi 抗原则应在杀菌后再加 0.5%~1%氯化钙溶液。有时虫卵也可做成抗原,如日本血吸虫卵抗原可制成悬液供免疫用。有些细胞膜成分,如组织细胞膜、血细胞膜经打碎后亦可制成颗粒抗原。颗粒抗原悬液呈乳浊状,多采用静脉内免疫法,较少使用佐剂作皮内注射。
二、可溶性抗原的制备和纯化
蛋白质、糖蛋白、脂蛋白、细菌毒素、酶、补体等皆为良好的可溶抗原。但因这些蛋白质多为复杂的蛋白组分,免疫前需进行纯化。蛋白质纯化方法在生物化学技术中已有详述,本章主要介绍免疫化学纯化方法。
(一)组织和细胞粗抗原的制备
免疫原多来源于只类及动物的组织或细胞,这些材料在取得可溶性蛋白质之前,必须先进行处理,以适合于进一步纯化。
1.组织细胞抗原的制备所用组织必须是新鲜的或低温 (<-40℃)保存的。器官或组织得到后立即去除表面的包膜或结缔组织以及一些大血管。如有条件,脏器应进行灌注,除去血管内残留的血液。处理好的组织用 0.05/NaN3 生理盐水洗去血迹及污染物。将洗净的组织剪成小块,进行粉碎。粉碎的方法有两类:①高速组捣碎机法。操作时,将组织加盐水(约 1 /2)装入捣碎机筒内,用高速(约 1000r/min)间断进行,每次 30~60s,时间过长会产热。②研磨法。可用玻璃匀浆器或乳钵研磨。玻璃匀浆器是由一内壁经过磨砂的玻璃管和一根一端为圆柱状(表面亦经磨砂)的磨杆组成,主要经过旋转、压挤将组织粉粹。研磨法可用于韧性较大听组织,如皮肤、空腔器官等。为了更有效地磨碎组织,有时在研磨时加入淘洗过的海砂。组织匀浆通过 2000~3000r/min 离心 10min 后分成两个部分:沉淀物含有大量的组织细胞和碎片;上清液作为提取可溶性抗原的材料,提取前还要通过 1000~2000r/min20~30min 的高速离心,以除去微小的细胞碎片,此时上清液应澄清。
2.组织细胞或培养细胞可溶性抗原的制备制备抗原用的细胞包括正常细胞、病理细胞(如肿瘤细胞)或传代细胞。组织细胞的制备一般通过上述机械破碎后取得。或通过酶消化,所用的酶大多为胃蛋白酶或胰酶。通过酶解将细胞间质蛋白消化,获得游离的单个细胞。细胞抗原一般分为三个组分:膜蛋白抗原、细胞浆抗原(主要为细胞器)和细胞核及核膜抗原。三种抗原的制备皆需将细胞破碎,方法有如下几种。
(1)反复冻融法:将待破碎的细胞(有时为整块组织)置-20 冰箱内冻结,然后缓慢地融化。如此反复 2 次,大部分组织细胞及细胞内的颗粒可被融破。
(2)冷热交替法:在细菌或病毒中提取蛋白质及核酸时可用此法。操作时,将材料投入沸水浴中,90℃左右维持数分钟,立即置于冰浴中使之迅速冷却,绝大部分细胞被破坏。
(3)超声破碎法:对微生物和组织细胞多用此法。处理效果与样品浓度和使用频率有关。一般组织细胞皆易破碎,而细菌,尤其是真菌的厚膜孢子则较难打破。超声波所使用的频率从 1~20kHz 不等。同样要间歇进行,因长时间超声也会产热,易导致抗原破坏。一次超声 1~2min,总时间为 10~15min。
(4)自溶法:利用组织和微生物的自身酶系,在一定的 pH 和温度下,使其细胞裂解。自溶的温度,对动物组织细胞常选 0~4℃,而对微生物常选室温。自溶时常需加入少量防腐剂,如甲苯或氯仿等,NaN3不宜使用,因其能抑制酶的活力。
(5)溶菌酶处理法:在碱性条件下(pH8.0),溶菌酶可专一破坏细菌细胞壁,适用于多种微生物。除溶菌酶外,蜗牛酶、纤维素酶等也可用于消化细菌和组织细胞。
(6)表面活性剂处理法:常用的有十二烷基吡啶、支氧胆酸钠等。因效果较差,已少应用。
(二)超速离心和梯度密度离心法
超速离心是分离亚细胞及蛋白质大分子的有效手段,往往是进一步纯化的第一次过筛。超速离心又分差速离心和梯度离心。差速离心系指低速与高速离心交替进行,用于分离大小差别较大的颗粒。梯度密度离心是一种区带分离法,通过梯度密度来维持重力的稳定性。通过离心,沉淀的颗粒比液体的比重大,漂浮的颗粒比液体的比重小。通常待分离的悬液中的颗粒比液体重,假如要使之上浮,必须加入第三种成分,使其密度连续或不连续地升高,形成所谓梯度。第三种成分多用甘油、蔗糖、氯化铯或氯化铷等。假如梯度柱的范围所表现的密度同待分离颗粒的密度大致相等时,则经过较长时间离心可得到分离。这种方法称为密度离心或梯度离心。
用超速离心或梯度离心分离和纯化抗原只是一种根据抗原的比重特点分离的方法,除个别成分外,极难将某一抗原成分分离出来。目前仅用于少部分大分子抗原,如 IgM、C1q、甲状腺球蛋白等,以及一些比重较轻的抗原物质如载脂蛋白 A、B 等。对于大量的中、小分子量蛋白质,多不适宜用超速及梯度密度离心作为纯化手段。
(三)选择性沉淀法
选择性沉淀是采用各种沉淀剂或改变某些条件促使抗原成分沉淀,从而达到纯化的目的。
1.核酸去除法从微生物或细胞提取蛋白质抗原时,其中常含有大量核酸成分。除去核酸可用提取沉淀剂,如氯化锰、硫酸鱼精蛋白或链霉素等。核糖核酸降解法较为简便,用 DNA 或 RNA 酶与提取液共同作用 30~60min(4℃),即可有效地除去核酸成分。
2.盐析沉淀法这是最古老而又经典的蛋白质纯化分离动技术。由于方法简便、有效、不损害抗原活性等优点,至今仍被广泛应用。
(1)抗原的粗筛:用不同饱和度的硫酸铵或硫酸钠可将一个复杂的组织液吩成若干组分,也可收集某一饱和度的盐析沉淀物作为进一步纯化的粗筛物。最常用的盐析剂是 33%~50%饱和度的硫酸铵。
(2)提取丙种球蛋白:丙种球蛋白主要为 IgG(95%以上)。将 35%~40%饱和度的硫酸铵沉淀物经去盐后可直接用于某些试验作为抗体试剂。此法简单、稳定、固收率高,已成为免疫化学试验的常规方法。
(3)抗原的浓缩:在液体中含量较少的抗原,如尿中的游离轻链及离子交换层析洗脱液中的抗原,可通过加入硫酸铵,将其沉淀下来,以利进一步纯化。
3.有机溶剂沉淀法有机溶剂以降低溶液的介电常数,从而增加蛋白质分子上不同电荷的引力,导致溶解度降低。另外,有机溶剂与水作用,能破坏蛋白质的水化膜,故蛋白质在一定浓度的有机溶剂中被沉淀析出。使用的有机溶剂多为乙醇和丙酮。高浓度的有机溶剂易引起蛋白质变性、失活、操作必须在低温下进行。Cohn(1942)低温酒精沉淀法可将血浆蛋白分为 5 个组分,IgG 属于 Cohn- 3 组分。
4.水溶性非离子型聚合物沉淀法常用的聚合物为聚乙二醇(PEG)及硫酸葡聚糖。水溶性聚合物沉淀蛋白质的机制尚不清楚,大致有如下解释:①聚合物与蛋白质形成共沉物;①聚合物与蛋白质之间发生水的重分配;①聚合物与蛋白质形成复合物。此法受许多因素影响,主要是 pH、离子强度、蛋白质浓度和 PEG 的分子量等。分子量为 2000~6000 的 PEG 皆适宜于做蛋白沉淀用。如若使用得当,效果甚为满意。一般认为,PEG 浓度在 3%~4%时沉淀免疫复合物,6%~7%可沉淀 IgM,8%~12%可沉淀 IgG,12%~15%可沉淀其他球蛋白,25%可沉淀白蛋白。最突出的应用是用 3%~4%的 PEG 沉淀免疫复合物,未结合的抗原和抗体留在溶液中。按此原理设计了快速测定法和循环免疫复合物测定法。
(四)凝胶过滤和离子交换层析
凝胶过滤又名分子筛层析,利用微孔凝胶,将不同分子量的成分分离。离子交换层析是利用一些带离子基团的纤维素或凝胶,吸附交换带相反电荷的蛋白质抗原,将蛋白质抗原按带电荷不同或量的差异分成不同的组分。这两种层析如能共同应用或者反复应用其中的一种,皆可将某一蛋白质从一复杂的组分中纯化出来。
(五)亲和层析
上面介绍的各种纯方法主要是依赖抗原的物理和化学特性,如分子量、携带电荷等,经过纯化后只能取得相同性质的物质,在免疫特性上是否为同种物质还不能肯定。亲和层析是利用生物大分子的生物学特异性,即生物分子间所具有的专一性亲和力而设计的层析技术。例如抗原和抗体、酶和酶抑制剂(或配体)、酶蛋白和辅酶、激素和受体等之间有一种特殊的亲和力,在一定条件下,它们能紧密地结合成复合物。如果将复合物的一方固定在不溶性载体上,则可从溶液中专一地分离和提纯另一方。与上述其他纯化方法相比,亲和层析能产生相当高的纯化作用。另外,此法的优点是迅速,有时仅一步即可达到纯化的目的。
1.亲和层析支持物的选择作为亲和层析支持物须符合以下要求:①非特异性吸附低;②液体通过时流速要快;③在各种 pH 和高浓度盐溶液中稳定;④必须有合适的、丰富的化学基团,能有效地与蛋白质或其它化合物结合;⑤必须带有丰富的微孔,以增加结合容量。符合以上 5 个条件的支持物有琼脂糖、聚丙烯酰胺和多孔玻璃球,其中常用的是琼脂糖珠(Sepharose2B、4B、6B)。
2.配体的选择所谓配体系指具有亲和性的双方,作为免疫亲和层析专指抗原与抗体。良好的配体必须具备以下 3 个条件。
(1)抗原或抗体必须单一特异性:抗原或抗体的纯化效果决定于固相中配体的纯度。
(2)抗原与抗体之间必须有强的亲和力:这种亲和力决定于抗原决定簇的性质和数量。对抗体来说还决定于抗体来源动物的种类和免疫时间,如马抗血清亲和力较低,免疫血清亲和力较高;免疫时间短的亲和力低。但是,亲和力太强也不利,因为解离抗原抗体复合物所需要的条件就要强烈,从而可造成蛋白质的变性。例如用低 pH(1.5~2.5)或高盐(如 6mol/ L 盐酸胍)可使部分抗原或抗体活性降低或丧失。
(3)配体必须有一个适当的化学基团,这个基团不参与配体和大分子的特异结合,但可用来连接支持物,而且这种连接不应当影响配体与大分子结合的亲和性。
3.抗原或抗体与支持物的结合将抗原或抗体结合到支持物上的方法目前有 20 多种,但可归结为载体结合法、物理吸附法、交联法和网络法 4 类。
结合法的一般步骤是先活化支持物上的功能基团,然后将抗原或抗体连接到这些活化的基团上。用来发生交联的化学反应必须足够温和,不致使抗原或抗体遭到破坏。交联后,要彻底清洗支持物,以除去剩下的未交联的物质。
最常用的支持物是 Separose4B,将此支持物与溴化氰在 pH11 时进行处理,则能使支持物活化。此时溴化氰与支持物上的羟式反应形成氨基甲酸酯基团。加入溴化氰的量取决于支持物的量。如果希望取代程度提高,则加入溴化氰的量也要提高。交联时首先要注意加入抗原或抗体的浓度。通常在交联反应混合物中的交联蛋白质浓度应是亲和分离浓度的 20~30 倍。这样,溴化氰浓度也必须提高到 200mg/ml 凝胶。若希望最终产物含量较少,所加入的溴化氰也应减少。交联时的 pH 也应注意,pH9.5~10 时,活化的琼脂糖珠很不稳定。降低 pH,也就减少了能反应的配体浓度,交联量就会减少。
亲和层析中常用小分子抗原或其它化合物与支持物交联,由于载体空间的位阻而影响了与抗原或其它亲和物的结合,产生了所谓的无效吸附。另外,Sepharose4B 交联时要求有一游离的氨基,如果该抗原有具氨基则难于交联。基于这两个原因,通常在琼脂糖与抗原之间接上不同长度的“手臂”。必要时这些“手臂”末端可接上游离氨基,以与不带氨基的配基偶联。常用的带“手臂”琼脂糖有氨基琼脂糖(二亚胺)、羧基琼脂糖(琥珀酸酐)、溴乙酰琼脂糖(0- 溴乙酰 -N-羧基琥珀酰胺)、重氮盐衍生物琼脂糖和疏基琼脂糖等。这些带“手臂”的琼脂糖有商品供应,使用极为方便。
4.亲和层析条件的选择
(1)支持物与抗原或抗体结合后,还可能有多余的活性基团,为了封闭这些残基团,必须用无关蛋白质或三乙醇胺过一次柱,以封闭活性基团。
(2)去掉未结合及结合不牢固的蛋白质。先用 0.2mol/LNaHCO2(含 0.1mol/LNaC1,pH9.0)洗脱 2~3 个柱体积,再用解脱剂处理一次亲和层析柱。
(3)解脱剂有多种。常用的有 0.2mol/LpH2.8 甘氨酸-HC1 缓冲液、0.1mol/LpH2.4 甘氨酸缓冲液、7mol/ L 脲、5mol/LNaI、3mol/ L 硫氰酸钾(或钠)、1mol/ L 乙酸、6mol/ L 盐酸胍、0.2mol/LKC1 等。作为抗原抗体解脱剂,最多用的是 3mol/ L 硫氰酸钾(或钠)及 0.1mol/LpH2.4 甘氨酸缓冲液。
(六)免疫球蛋白片段的制备
免疫球蛋白具有抗原性,可用以免疫动物制备相应的抗体,而这种抗体常用于免疫球蛋白的检测。五类免疫球蛋白皆可用前面介绍的纯化方法提取出来。如将这些免疫球蛋白分解成片段,如 Fc 段、Fab 段、轻链等作为免疫原制备抗血清,则可制得分辨能力更高的特异性抗体。制备方法如下:
1.温和条件析离亚单位亚单位之间以非共价键、如氢键、静电引力等连接起来,这些键结合力较弱,可经 2 种方法将其断开制备片段。第一种方法是改变 pH,一般将 pH 调至 3~4(羧基滴定范围)和 9~10(赖氨酸-酪氨酸滴定范围),当低于 3 或高于 10 时,亚单位会离解。这个方法是利用强变性剂,如 8mol/ L 盐酸胍等。用此可以将亚单位分开。这个方法也用于载脂蛋白抗原的解离和胶原肽的提取。
2.二硫键的解离二硫键是连接 Ig 肽链的共价键,解离二硫键可将轻链与重链分开。解离的方法多采用氧化法和还原法。氧化法的优点是切开后,肽链不能重新形成二硫键,便于肽链纯化;缺点是甲硫氨酸被氧化成亚砜,色氨酸侧链被破坏。还原法是将二硫键还原成巯基。但这个疏基极不稳定,易再重新结合成二硫键,必须及时用碘乙酸或碘代乙酰胺进行羧甲基化。
3.溴化氰裂解法溴化氰与蛋白质中的甲硫氨酸侧链的硫醚基起反应,生成溴化亚氨内酯。此产物与水反应,将肽链断裂。
4.酶裂解法因为酶解有极好的专一性,不同的片段可用不同的酶裂解。如木瓜酶可将 IgG 裂解成 Fc 和 Fab(×2)3 个片段,胃蛋白酶可将 IgG 解成 F(ab')2和几个小肽段,胰蛋白酶则将其切成不规则的肽链。作为抗原制备常用木瓜酶切断,取得 Fc 段,以制备抗链血清。作为抗体试剂应用,常用胃蛋白酶切断取得 F(ab')2。
(七)纯化抗原的鉴定
纯化抗原的鉴定方法较多,常用的有聚丙烯酰胺凝胶电泳法、结晶法、免疫电泳法、免疫双扩散法等。事实上,仅用一种方法还无法作纯度鉴定,只有几种方法联合应用才较可靠。结晶法不是纯度的标准,因结晶中往往含有其它成分。电泳谱中呈现单一区带也不能排除在这条带中含有其他成分。有时虽出现几条带,也可能是同一物质的聚合体或降解物。
蛋白抗原的定量可用生化分析中的常用方法。根据测试抗原量的多少可用双缩脲法或酚试剂法。如果抗原极为宝贵,可用紫外光吸收法。
三、半抗原免疫原的制备
多肽、甾族激素、药物、脂肪胺、核苷等小分子物质仅能与相应的抗体发生特异性结合反应,而它们自己并不是免疫原,不能诱导抗体产生。只有将这种半抗原与蛋白质或其他高聚物结合后才能刺激机体产生抗体。结合的方法有物理法和化学法。物理吸附的载体有淀粉、聚乙烯吡咯烷酮(PVP),硫酸葡聚糖、羧甲基纤维素等,是通过电荷和微孔吸附半抗原。化学法是利用功能团把半抗原以载体上。
(一)载体选择
1.蛋白质类蛋白质是结构复杂的大分子胶体物质,是一种良好的载体。常用的有人血清白蛋白、牛血清白蛋白、牛甲状腺球蛋白和血蓝蛋白等。其中以牛血清蛋白最为常用,因其溶解度大,免疫活性强,又容易获得。蛋白质和半抗原结合是通过游离氧基、游离羧基、酚基、巯基、咪唑基、吲哚基和胍基等活性基团的缩合。
2.多肽类聚合物是人工合成的多肽聚合物,常用的是多聚赖氨酸(polylysine)。这种多聚合物与半抗原结合后,可诱发动物产生高滴度、高亲和力的抗体。多聚赖氨酸的分子量可达十几万到几十万,是良好的载体。
3.大分子聚合物和某些颗粒 PVP、羧甲基纤维素和活性碳等皆可与半抗原结合,加入福氏完全佐剂可诱发产生良好的抗体。
因半抗原种类、动物类别、载体种类及结合方法的不同,制得的免疫原对动物免疫所产生的效果也不同。实际应用时,应多采用几种载体或方法。
(二)连接方法
半抗原与载体连接要掌握 3 个基本条件:带游离氨基或游离羧基以及二种基团皆有的半抗原,如多肽激素类(脑啡肽、胃泌素、ACTH、前列腺素等),它们有游离的氨基或羧基。羧基可用混合酸酐法和碳化二亚胺法与载体氨基形成稳定的肽键。同样,带氨基的半抗原则可与载体羧基缩合。亦可用双功能试剂如戊二醛、甲苯 2,4- 二异酸盐与载体氨基连接。脂肪胺可用碳化二亚胺缩合剂或对硝基苯酰氯反应,把脂肪胺变为对硝基苯酰胺,通过加氢还原为氨基苯酰衍生物,再用重氮化反应。②带有羟基、酮基、醛基的半抗原,如醇、酚、糖、多糖、核苷以及甾族激素等,它们都不能直接与载体连接,需要用化学方法在半抗原上引起羧基后才能与载体连接。③芳香族半抗原由于环上带有羧基,它邻位上的氢很活泼,极易取代。
半抗原和载体连接的方法在一般实验室皆可完成,但反应条件应严格要求,以防半抗原失活或载体严重变性(一般变性并不妨碍)。
1.碳化二亚胺法碳化二亚胺是一种化学性质非常活泼的双功能试剂,常用的水溶性碳化二亚胺化学名为 1 - 乙基 -3-(3- 二甲氨基)- 碳化二亚胺盐酸盐。它可与半抗原的羧基、也可与其氨基结合,反应如下:+
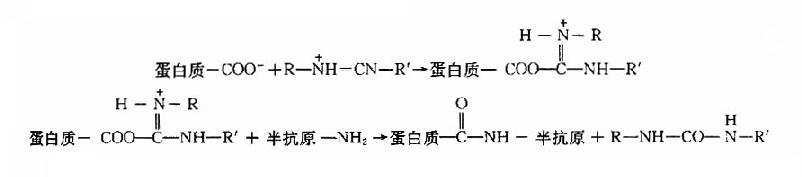
此连接方法十分简便,只需将载体蛋白质和抗原按一定比例混合在适当的溶液中,然后加入水溶性碳化二亚胺,搅拌 1~2h,置室温 24h,再经透析即可。
2.戊二醛法戊二醛也是常用的双功能交联剂,它借两端的醛基与载体和半抗原的氨基以共价键连接,其反应如下:
蛋白质 -NH2+ 半抗原 -NH2+COH-(CH2)3-COH→蛋白质 -N=CH-(CH2)3-CH=N- 半抗原
3.氯甲酸异丁酯法该法又称为混合酸酐法,是利用半抗原上的羧基和载体蛋白上的氨基以肽链相连接,方法简便,多用于类固醇抗原的制备,其反应如下:
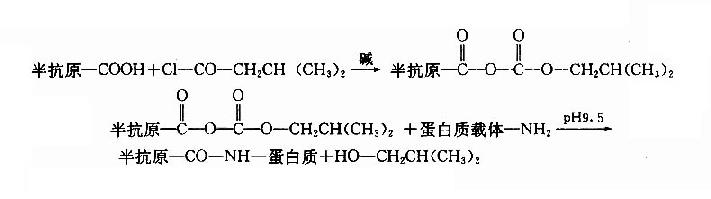
(三)无羧基和氨基半抗原衍生物的制备
某些类固醇和药物,需加以适当的改造,使其转变为带有羧基或氨基的衍生物。依据半抗原的性质有如下 4 种方法。
1.琥珀酸酐法琥珀酸酐是琥珀酸的脱水产物,遇水又可恢复。如果将带有羟基的半抗原化合物和琥珀酸酐在无水的吡淀中反应,就可得到带有羧基的半抗原琥珀酸的衍生物。再经碳化二亚胺可氯甲酸异丁酯法,制备载体半抗原。制备衍生物的反应如下:
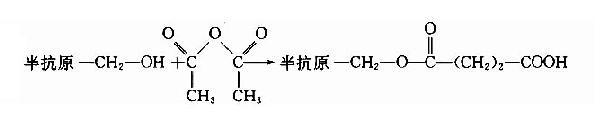
2.O-(羧甲基)羧胺法带有酮基的半抗原与 O -(羧甲基)羟反应,转变为带有羧基的半抗原衍生物。反应式如下:
半抗原 -C=O+H2N-O-CH2COOH→半抗原 -C=N=O=CH2-COOH
3.一氯醋钠法带有酚基的半抗原,可用一氯醋酸钠法,生成带有羧基的半抗原衍生物。其反应式如下:

4.重氮的对氨基苯甲酸法先将对氨基苯甲酸和亚硝酸钠反应,反应产生再作用于带有酚基的半抗原,获得带有羧基的半抗原衍生物。反应式如下:
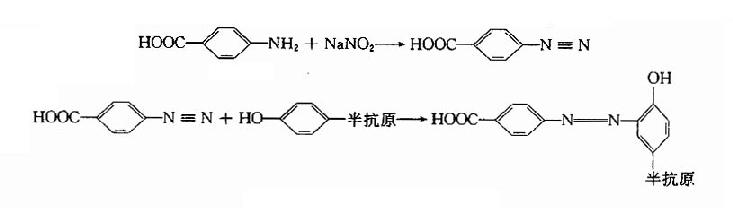
四、佐剂
为了促进抗体产生,可在注射抗原的同时,加入一种辅助剂,这种辅助剂称为佐剂。佐剂本身可以有免疫原性,也可不具备免疫原性。常用的有免疫原性的佐剂有百日咳杆菌、革兰阴性杆菌的内毒素和抗酸杆菌(包括结核分枝杆菌和枯草分枝杆菌)等;非抗原性的佐剂有铝乳、磷酸钙、石蜡油、羊毛脂、表面活性剂、藻酸钙、聚核苷酸、胞壁肽等。应用最多的是福氏(Freund)佐剂,是用石蜡油、羊毛脂和卡介苗混合而成。
佐剂的作用机制极为复杂。在佐剂-抗原的注射部位,可见到细胞浸润,几天后,局部形成肉芽肿(细胞免疫反应)。起初,反应部位以肉芽组织为主,以后则见多量巨噬细胞、浆细胞、巨细胞、类上皮细胞。局部淋巴结和脾中也可见大量浆细胞,提示佐剂可以直接刺激参与免疫反应的细胞并使之增生。有许多佐剂如内毒素、分枝杆菌、小棒状杆菌、聚核苷酸、皂素等对细胞膜有活化作用,它们可增加巨噬细胞和淋巴细胞的细胞通透性,促进了对抗原的有效处理。佐剂一般是乳剂或悬液,当与水溶液抗原混合后形成一种油包水或水包油的乳状颗粒,这种颗粒延缓了抗原的吸引,增加了局部刺激作用。
另有报告,佐剂和抗原混在一起注射可以改变抗原的分布。应用核素标记的合成多肽或沙门氏菌鞭毛抗原与福氏佐剂混合注入大鼠或豚鼠后肢足掌,测定局部引流淋巴结、脾和血清中的抗原含量,发现它可明显地延长抗原从局部吸收的时间。对于低分子量的多肽,这一作用较为短暂,而对于鞭毛抗原,这一作用十分明显。虽然吸收被延缓,但在淋巴结和脾中,抗原的含量都明显高于不用佐剂的动物。这提示,抗原与佐剂同时应用,可促进抗原在淋巴组织中存留。
福氏佐剂分为不完全佐剂(石蜡油+羊毛脂)和完全佐剂(石蜡油+羊毛脂+卡介苗)。佐剂和抗原的比例为 1:1。由于佐剂是油剂,加入抗原后要充分混合成乳剂。混合的方法有 2 种,一为研磨法,二为搅拌混合法。研磨法用一乳钵(玻璃或玛瑙),先将佐剂加热倾入,待冷却后加入卡介苗(2~20mg/ml),再逐滴加入抗原,边滴边加速研磨,直至完全变为乳剂为止。另一种方法是用两个 5ml 注射器,在接针头处用一尼龙管连通,一个注射器内是佐剂,另一注射器内为抗原。装好后来回推注,经多次混合逐渐变为乳剂。本法优点是无菌操作,节省抗原或估剂,用此注射器可直接注射;缺点是不易乳化完全。乳化完全与否的鉴定方法是将一滴乳剂滴入水中,如立即散开,则未乳化好,如不散开漂在水面则为乳化完全。
为了防止感染,有时在佐剂中加入抗生素。但抗生素有免疫抑制作用,如能注意无菌操作,就不必加入。
第二节 抗血清的制备
一、动物的选择
选择合适的动物进行免疫极为重要。选择时应考虑以直几个因素:①抗原与免疫动物的种属差异越远越好;亲缘关系太近不易产生抗体应答(如兔-大鼠之间,鸡-鸭之间)。②抗血清量的需要:大动物如马、骡等可获得大量血清(一头成年马反复采血可获得 10000ml 以上的抗血清);但有时抗体需要是不多,选用家兔或豚鼠即可。③抗血清的要求:抗血清可分为 R 型和 H 型。H 型抗血清用于沉淀反应较难掌握,因而极少应用。④抗原的选择:对蛋白质抗原,大部分动物皆适合常用的是山羊和家兔。但是,在某些动物体内有类似的物质或其它原因,对这些动物免疫原性极差,如 IgE 对绵羊、胰岛素对家兔、多种酶类(如胃蛋白酶原等)对山羊等,免疫时皆不易出现抗体。这些物质有时可以用豚鼠(如胰岛素等)、火鸡、甚至猪、狗、猫等作试验免疫。⑤甾体激素免疫多用家兔;酶类免疫多用豚鼠。
二、免疫剂量、时间和途径
免疫原合适剂量的选定应考虑抗原性强弱、分子量大小和免疫时间。抗原需可量多,时间间隔长,剂量可适当加大。大动物抗原剂量(以蛋白抗原为准)约 0.5~1mg/ 只,小动物约 0.1~0.6mg/ 只。有时主观希望加强免疫效果而不适当地加大剂量,往往会弄巧成拙。因为剂量加大极易造成免疫耐受(免疫抑制)而遭失败。已有证明,几微克的蛋白质也能很好地免疫出抗血清。
免疫注射的途径也很重要。一般采用多点注射,一只动物注射总数约为 8~10 点,包括足掌及肘窝淋巴结周围,背部两侧、颌下、耳后等处皮内或皮下,皮内易引起细胞免疫反应,对提高抗体效价有利。但皮内注射较困难,特别是天冷时更难注入(因佐剂加入后粘度较大)。其他途径还有肌内、腹腔、静脉、脑内等,但较少应用。如抗原极为宝贵可采用淋巴结内微量注射法,抗原只需 10~100μg;方法是先用不完全佐剂在足作基础免疫(预免疫),10~15 天后可见肘窝处有肿大的淋巴结(有时在腹股沟处触及),用两手指固定好淋巴结,消毒后用微量注射器直接注射入抗原(一般不需要佐剂)。
免疫间隔时间也是重要因素,特别是首次与第二次之间更应注意。第一次免疫后,因动物机体正处于识别抗原和 B 细胞增殖阶段,如很快接着第二次注入抗原,极易造成免疫抑制。一般以间隔 10~20 天为好。二次以后每次的间隔一般为 7~10 天,不能太长,以防刺激变弱,抗体效价不高。对于半抗原的免疫间隔则要求较长,有的报告 1 个月,有的长达 40~50 天,这是因为半抗原是小分子,难以刺激机体发生免疫反应之故。免疫的总次数多,多为 5~8 次。如为蛋白质抗原,第八次免疫未获得抗体,可在 30~50 天后再追加免疫一次;如仍不产生抗体,则应更换动物。半抗原需经长时间的免疫才能产生高效价抗体,有时总时间为一年以上。
三、动物采血法
动物免疫 3~5 天后,如抗血清鉴定合格(见下节),应在末次免疫后 5~7 天及时采血,否则抗体将会下降。因故未及时取血,则应补充免疫一次(肌肉、腹腔或静脉内注射,不加佐剂),过 5~7 天取血。
1.颈动脉放血法这是最常用的方法,对家兔、山羊等动物皆可采用。在动物颈外侧做皮肤切口,拉开皮肤后可见斜行的胸锁乳突肌,将此肌钝性分离并推向后方,即可见到淡红色有弹性的总动脉。将此动脉轻轻游离(连同与之同行的迷走神经),用丝线将远心端结扎,近心端用止血钳夹住,另一止血钳夹住动脉迷走神经,用以固定。沿结扎处剪断血管,用固定止血钳将断端放入瓶口,慢慢打开夹持的止血钳,动脉血立即喷射入瓶。如此放血的速度快,动物死亡也快,取血量略少于其他放血法。如在放血大约总量的一半时,暂时将动脉夹住片刻,再继续放血,得血量可以多些。
另外一种慢放血法是在动脉内插入一采血器,用闭式放血。在颈动脉内插入一较粗的玻璃管,将血管与玻璃管用线扎牢,玻璃管接一橡皮管引血入瓶,也极为方便。
2.心脏采血法此法多用于豚鼠、大鼠、鸡等小动物。采血技术应熟练,穿刺不准容易导致动物急性死亡。
3.静脉多次采血法家兔可用耳中央静脉,山羊可用颈静脉。这种放血法可隔日一次,有时可采集多量血液。如用耳静脉切开法,一只家兔可采百余毫升血液(用颈动脉放血最多可获 70~80ml,一般只有 50ml 左右)。用颈静脉采集绵羊血,一次可放 300ml,放血后立即回输 10%葡萄糖盐水,三天后仍可采血 200~300ml。动物休息一周,再加强免疫一次,又可采血二次。如此,一只羊可获 1500~2000ml 血液。小鼠取血往往采取断尾或摘除眼球法,每鼠得血一般不超过 2ml。
抗血清的分离多采用室温自然凝固,然后放置 37℃或 4℃待凝块收缩。前者迅速,但得血清较少;后者时间长,有时还会出现溶血,但获得血清多,而且效价不会下跌。
抗血清分出后是否要经 56℃30min 灭活有两种不同意见。一种认为血清中有许多活性酶,特别是球蛋白的降解酶,如不清除,血清存放过程中将导致抗体效价下降。另外的意见认为,这种自然降解是微不足道的,56 加温后,有些球蛋白会发生热变性或者热聚合。含这种聚合大分子蛋白的抗血清用于免疫浊度试验时,可因沉淀剂(如 PEG)的加入而发生假性混浊。
第三节 抗血清的鉴定和保存
一、抗血清的鉴定
动物血采集后,立即分离出血清,此抗血清在保存或应用前,必须作效价和特异性鉴定。
(一)双向免疫扩散法鉴定抗体的特异性
按双向免疫扩散技术打两排孔,上排放抗原粗提物(如抗原来自动物血清则放相应的混合血清)和纯化抗原,下排加抗血清,进行双扩散 18~24h 后,仔细观察上下两排孔之间出现的沉淀线。若与粗抗原及纯抗原之间皆出现一条沉淀线,且两者互相融合,则证明该动物已产生单价特异性抗体;不出现沉淀线,表明示免疫成功。若与纯化抗原出现一条,而与粗抗原出现多条线,且其中一条沉淀线与纯抗原沉淀线相连接,也是成功的免疫,待取血后将杂抗体吸收去除,可以成为单价特异性抗体。
(二)双向免疫扩散法则定抗血清效价
测定抗血清效价有两种稀释方法:一是稀释抗血清,如 1 /2、1/4、1/8、1/16 对倍稀释,分别与一个浓度的纯抗原反应;另一是稀释抗原,即把抗原作对倍稀释或按浓度(如 mg/ml)进行稀释,分别与不同浓度的抗血清进行双扩散试验(称为棋盘滴定),见表 10-1。
表 10- 1 抗血清效价测定
| 抗原 | 抗血清 | |||||||
| 不稀释 | 1/2 | 1/4 | 1/8 | 1/16 | 1/32 | 1/64 | 1/128 | |
| 不稀释 | +++ | +++ | +++ | ++ | ++ | + | - | - |
| 1/2 | +++ | +++ | +++ | ++ | ++ | + | - | - |
| 1/4 | +++ | +++ | +++ | ++ | ++ | + | - | - |
| 1/8 | +++ | ++ | ++ | ++ | + | + | - | - |
| 1/16 | ++ | ++ | ++ | + | + | + | - | - |
| 1/32 | + | + | + | + | - | - | - | - |
| 1/64 | + | + | + | + | - | - | - | - |
表中+~+++代表出现沉淀线的浓度,如 1:8 抗体出现中等浓度沉淀线,与 1:16、1:32 则出现较弱的沉淀线。按表 10- 1 的互为比例稀释后确定抗血清的效价为 1:32,最佳抗原浓度为 1:16。效价在 1:8 以上即可采用于一般试验。
(三)其他鉴定方法
有时,因抗原特殊,沉淀线不易出现,特别是制备的抗血清将用于某种试验时,则考虑用其它方法(如血凝试验、抑制试验、中和试验、放射免疫技术等)测定其效价。
二、抗血清的保存
抗血清保存有三种方法。第一种是 4℃保存,将抗血清清除菌后,液体状态保存于普通冰箱,可以存放 3 个月到半年,效价高时,一年之内不会影响使用。保存时要加入 0.1%~0.2%NaN3以防腐。如若加入半量的甘油则保存期可延长。第二种方法是低温保存,放在-20~-40,一般保存 5 年效价不会有明显下降,但应防止反复冻融,反复冻融几次则效价明显降低。因此低温保存应用小包装,以备取出后在短期内用完。第三种方法是冰冻干燥,最后制品内水分不应高于 0.2%,封装后可以长期保存,一般在冰箱中 5~10 年内效价不会明显降低。
第四节 抗血清中抗体的纯化
单价特异性是指血清只与其特异性抗原发生反应。有时免疫原不纯,含有微量的杂抗原(性质相近的),制得的抗血清中出现 2~3 种杂抗体。即使用纯抗原,例如用高度纯化的 IgG 免疫动物,出现的抗体总是有抗 γ 重链的抗体,也有抗 κ 轻链和抗 λ 轻链的抗体。还有一种情况,有些蛋白质和其他蛋白质处于一种结合状态,如甲胎蛋白常和白蛋白相结合,因此免疫得到的抗血清总是有抗白蛋白杂抗体存在。
一、除去杂抗体有两种方法:
1.亲和层析法将交叉杂抗原交联到琼脂糖珠 4B 上,如除去抗白蛋白抗体,则交联上白蛋白或不含甲胎蛋白的血清,装柱后,将预吸收的抗体通过亲和层析柱,杂抗体吸附在柱上,流出液则是单价特异性抗体。
2.吸附剂方法用不含特异性抗原的抗原液,即不含用于免疫动物抗原的其他杂抗原液,如血清、组织液或已知的某种杂抗原,用双功能试剂将其交联,做成固相吸附剂。如用不含甲胎蛋白的血清,稀释 1 倍后,加入 0.25%的戊二醛或丙酮醛,放冰箱一夜后,该血清成为胶冻状,用力打碎(或用组织粉碎器),用缓冲液多次洗涤后,则成为颗粒状的凝胶吸附剂。用这种吸附剂直接加到抗血清中(约 1 /10),抗原则与杂抗体结合,上清液则为无杂抗体的单价特异性抗体。有时因杂抗体太多,必须处理吸收两次才能完全去除。吸附过的凝胶,用 3mol/ L 硫氰酸钾(或钠)洗涤,洗脱掉杂抗体,可再继续使用。
有时杂抗原较少,其他蛋白也少,加入戊二醛后不形成胶冻状,此时可加入无关蛋白进行交联,如牛血清蛋白、兔血清、马血清、卵白蛋白等。加入量以达到含总蛋白的 2%~3%为宜。
二、特异性 IgG 抗体的制备
在标记的免疫测定或其他技术中将特异性抗体纯化出来,是极为重要的。例如在 ELISA,用于包被的抗体一定要用特异性 IgG,才能得到良好的效果。这是因为全血清中有大量非抗体蛋白,如白蛋白、α1 和 α2 球蛋白等,如不除去,会干扰包被。再如反相间接血凝,致敏红细胞的抗体也需用特异性 IgG 的 I(ab')2才能使实验满意。特异性 IgG 和 F(ab')2的制备方法有如下几种。
(一)粗提法提取球蛋白
大多用硫酸铵盐析法或硫酸钠盐析法。硫酸铵盐析须经过多次沉淀,第一次用 40%饱和度,第二次用 35%饱和度,第三次用 33%饱和度,经三次提取后的 γ 球蛋白基本是 IgG 成分。硫酸钠法更简便,用 20%即可将 γ 球蛋白沉淀出来。经盐析后的 γ 球蛋白虽大多属于 IgG,但还有 5%其他区带蛋白,如 γ 区的杂蛋白。又因 IgG 组分中还含其他所谓正常的 IgG,产生干扰。因此盐析法粗提的 γ 球蛋白只能用于一般的实验,或者是抗体效价较高的抗血清。
(二)离子交换层析法提取 IgG
常用的离子交换剂有 DEAE 纤维素或 QAE 纤维素,以 QAE-Sephadex 最为理想,DE22、32、52 也可应用。取 QAE-SephadexA25 或 A50 经酸处理并在 0.05mol/LpH7.5~8.6 的磷酸盐缓冲液中平衡,将水分抽干,称湿重 Ig 加于 10ml 血清中,在室温 30min 后,离心或过滤除去离子交换剂。上清液再如此处理一次,即获得较纯的 IgG,甚至不含其他杂蛋白。用该技术纯化 IgG 简便,不损坏抗体,既可小量提取,也可大量制备。
(三)亲和层析法提取特异性 IgG
将纯化抗原或粗制抗原(如是单价特异性则对抗原要求不高)交联 Sepharose4B 制成亲和层析柱,将抗血清过柱后洗去未结合的杂蛋白,再用硫氰酸钾洗脱,流出的是纯的特异性 IgG 抗体。因硫氰酸钾对抗体有破坏作用,应及时透析除去。纯化的 IgG 因含量低,失去保护作用,应及时应用或冻干保存,亦可 20℃保存,但皆不理想;加入三乙醇胺或甘油可起保护作用。
(四)酶解法制备 F(ab')2片段
胃蛋白酶对 IgG 的作用点是在连接两重链的二硫键靠 C 端处(232 氨基酸处),结果两个 Fab 由二硫键连接,保留了抗体的结合点。与 IgG 相比,F(ab')2的特点是去掉了 Fc 段,这样在细胞免疫实验中免除了受体作用;同时也使 IgG 失去主要的抗原特性,不被抗 IgG 抗体结合;在反向间接血凝中,用 F(ab')2致敏羊红细胞比用 IgG 效果好。
第十一章 单克隆抗体的制备
1975 年 Kǒhler 和 Milstein 首先报道用细胞杂交技术使经绵羊红细胞(SRBC)免疫的小鼠脾细胞与骨髓瘤细胞融合, 建立起第一个 B 细胞杂交瘤细胞株, 并成功地制得抗 SRBC 的单克隆抗体(monlclonalantibody,McAb)。迄今世界已研制成数以千计的 McAb。
单克隆抗体的理化性状高度均一,生物活性单一,与抗原结合的特异性强,便于人为处理和质量控制,并且来源容易,所以一问世便受到欢迎和重视。在医学领域中,McAb 在诊断疾病、判断预后、防治疾病以及疾病机制研究等方面起着巨大的促进作用。为此,两位发明者于 1984 年获得诺贝尔医学奖。
第一节 杂交瘤技术的基本原理
杂交瘤抗体技术的基本原理是通过融合两种细胞而同时保持两者的主要特征。这两种细胞分别是经抗原免疫的小鼠细胞作小鼠骨髓瘤细胞。脾淋巴细胞的主要特征是它的抗体分泌功能和能够在选择培养基中生长(选择原理后见),小鼠骨髓瘤细胞则可在培养条件下无限分裂、增殖,即所谓永生性。在选择培养基的作用下,只有 B 细胞与骨髓瘤细胞融合的杂交才具有持续增殖的能力,形成同时具备抗体分泌功能和保持细胞永生性两种特征的细胞克隆。其原理从下列几个主要步骤阐明。
(一)细胞的选择与融合
建立杂交瘤技术的是制备对抗原特异的单克隆抗体,所以融合细胞一方必须选择经过抗原免疫的 B 细胞,通常来源于免疫动物的碑细胞。脾是 B 细胞聚集的重要场所,无论以何种免疫方式刺激,脾内皆会出现明显的抗体应答反应。融合细胞的另一方则是为了保持细胞融合后细胞的不断增殖,只有肿瘤细胞才具备这种特性。选择同一体系的细胞可增加融合的成功率。多发性骨髓瘤是 B 细胞系恶性肿瘤,所以是理想的脾细胞融合伴侣。目前常用的 B 细胞瘤株有:P3-X63-Ag8(KǒhlerandMilstein,1975),P3-NSI/1-Ag4-1(KǒhlerandMilstein,1976),X63-Ag8.563(Kearneyetal,1979),Sp2/0-Ag14(Schulmanetal,1978)等,这些细胞株皆为 HAT 敏感细胞株。
使用细胞融合剂造成细胞膜一定程度的损伤,使细胞易于相互粘连而融合在一起。最佳的融合效果应是最低程度的细胞损伤而又产生最高频率的融合。聚乙二醇(PEG1000~2000)是目前最常用的细胞融合剂,一般应用浓度为 40%(W/V)。
(二)选择培养基的应用
细胞融合是一个随机的物理过程。在小鼠脾细胞和小鼠骨髓瘤细胞混合细胞悬中,经融合后细胞将以多种形式出现。如融合的脾细胞和瘤细胞、融合的脾细胞和脾细胞、融合的瘤细胞和瘤细胞、未融合的脾细胞、未融合的瘤细胞以及细胞的多聚体形式等。正常的脾细胞在培养基中存活仅 5~7 天,无需特别筛选,细胞的多聚体形式也容易死去。而未融合的瘤细胞则需进行特别的筛选去除。
细胞 DNA 合成一般有两条途径。主途径是由糖和氨基酸合成核苷酸,进而合成 DNA,叶酸作为重要的辅酶参与这一合成过程。另一辅助途径是在次黄嘌呤和胸腺嘧啶核苷存在的情况下,经次黄嘌呤磷酸核糖转化酶(HGPRT)和胸腺嘧啶核苷激酶(TK)的催化作用合成 DNA。细胞融合的选择培养基中有三种关键成分:次黄嘌呤(hypoxanthine,H)、氨甲蝶呤(aminopterin,A)和胸腺嘧啶核苷(thymidine,T),所以取三者的字头称为 HAT 培养基。氨甲蝶呤是叶酸的拮抗剂,可阻断瘤细胞利用正常途径合成 DNA,而融合所用的瘤细胞是经毒性培养基选出的 HGPRT-细胞株,所以不能在该培养基中生长。只有融合细胞具有亲代双方的遗传性能,可在 HAT 培养基中长期存活与繁殖(图 11-1)。
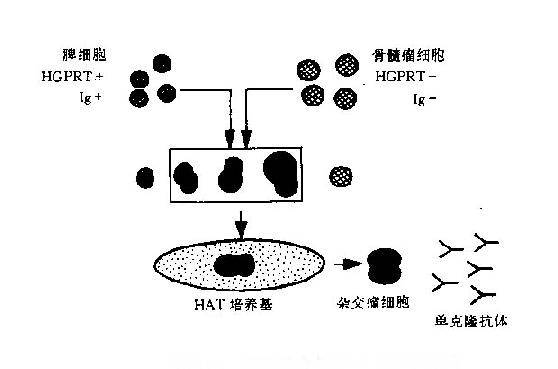
图 11- 1 细胞融合与 HAT 选择示意图
(三)有限稀释与抗原特异性选择
在动物免疫中,应选用高纯度抗原。一种抗原往往有多个决定簇,一个动物体在受到抗原刺激后产生的体液免疫应答,实质是众多 B 细胞群的抗体分泌。而针对目标抗原表位的 B 细胞只占极少部分。由于细胞融合是一个随机的过程,在已经融合的细胞中,有相当比例的无关细胞的融合体,需细筛选去除。筛选过程一般分为两步进行:一是融合细胞的抗体筛选,二是在此基础上进行的特异性抗体筛选。将融合的细胞进行充分稀释,使分配到培养板的每一孔中的细胞数在 0 至数个细胞之间(30%的孔为 0 才能保证每个孔中是单个细胞),培养后取上清以 ELISA 法选出抗体高分泌性的细胞;这一过程常被习惯地称作克隆化。将这些阳性细胞再进行克隆化,应用特异性抗原包被的 ELISA 找出针对目标抗原的抗体阳性细胞株,增殖后进行冻存、体外培养或动物腹腔接种培养。
第二节 制备单克隆抗体的基本技术
制备单克隆抗体是复杂而费时的工作,整个技术流程如图 11-2。
(一)抗原提纯与动物免疫
对抗原的要求是纯度越高越好,尤其是初次免疫所用的抗原。如为细胞抗原,可取 1×107个细胞作腹腔免疫。可溶性抗原需加完全福氏佐剂并经充分乳化,如为聚丙烯酰胺电泳纯化的抗原,可将抗原所在的电泳条带切下,研磨后直接用以动物免疫。
选择与所用骨髓瘤细胞同源的 BALB/ c 健康小鼠,鼠龄在 8~12 周,雌雄不限。为避免小鼠反应而不佳或免疫过程中死亡,可同时免疫 3~4 只小鼠。
免疫过程和方法与多克隆抗血清制备基本相同,因动物、抗原形式、免疫途径不同而异,以获得高效价抗体为最终目的。免疫间隔一般 2~3 周。一般被免疫动物的血清抗体效价越高,融合后细胞产生高效价特异抗体的可能性越大,而且单克隆抗体的质量(如抗体的浓度和亲和力)也与免疫过程中小鼠血清抗体的效价和亲和力密切相关。末次免疫后 3~4 天,分离脾细胞融合。
(二)骨髓瘤细胞及饲养细胞的制备
选择瘤细胞株的最重要的一点是与待融合的 B 细胞同源。如待融合的是脾细胞,各种骨髓瘤细胞株均可应用,但应用最多的是 Sp2/ 0 细胞株。该细胞株生长及融合效率均佳,此外,该细胞株本身不分泌任何免疫球蛋白重链或轻链。细胞的最高生长刻度为 9×105/ml,倍增时间通常为 10~15h。融合细胞应选择处于对数生长期、细胞形态和活性佳的细胞(活性应大于 95%)。骨髓瘤细胞株在融合前应先用含 8 - 氮鸟嘌呤的培养基作适应培养,在细胞融合的前一天用新鲜培养基调细胞浓度为 2105/ml,次日一般即为对数生长期细胞。
图 11- 2 杂交瘤技术制备单克隆抗体的流程
在体外培养条件下,细胞的生长依赖适当的细胞密度,因而,在培养融合细胞或细胞克隆化培养时,还需加入其他饲养细胞(feedercell)。常用的饲养细胞为小鼠的腹腔细胞,制备方法为用冷冻果糖液注入小鼠腹腔,轻揉腹部数次,吸出后的液体中即含小鼠腹腔细胞,其中在巨噬细胞和其他细胞。亦有用小鼠的脾细胞、大鼠或豚鼠的腹腔细胞作为饲养细胞的。
在制备饲养细胞时,切忌针头刺破动物的消化器官,否则所获细胞会有严重污染。饲养细胞调至 1×105/ml,提前一天或当天置板孔中培养。
(三)细胞融合
细胞融合是杂交瘤技术的中心环节,基本步骤是将两种细胞混合后加入 PEG 使细胞彼此融合。其后吧培养液稀释 PEG,消除 PEG 的作用。将融合后的细胞适当稀释,分置培养板孔中培养。融合过程中有几个问题应特别注意。①细胞比例:骨髓瘤细胞与脾细胞的比值可从 1:2 到 1:10 不等,常用 1:4 的比例。应保证两种细胞在融合前都具有较高活性。②反应时间:在两种细胞的混合细胞悬液中,第 1min 滴加 4.5ml 培养液;间隔 2min 滴加 5ml 培养液,尔后加培养液 50ml。③培养液的成分:对融合细胞,良好的培养液尤其重要,其中的小牛血清、各种离子和营养成分均需严格配制。如融合效率降低,应随时核查培养基情况。
(四)有限稀释法
筛选阳性株一般选用的骨髓瘤细胞为 HAT 敏感细胞株,所以只有融合的细胞才能待续存活一周以上。融合细胞呈克隆生长,经有限稀释后(一般稀释至 0.8 个细胞 / 孔),按 Poisson 法计算,应有 36%的孔为 1 个细胞 / 孔。细胞培养至覆盖 0%~20%孔底时,吸取培养上清用 ELISA 检测抗体含量。首先依抗体的分泌情况筛选出高抗体分泌孔,将孔中细胞再行克隆化,尔后进行抗原特异的 ELISA 测定,选高分泌特异性细胞株扩大培养或冻存。
(五)单克隆抗体的制备和冻存
筛选出的阳性细胞株应及早进行抗体制备,因为融合细胞随培养时间延长,发生污染、染包体丢失和细胞死亡的机率增加。抗体制备有两种方法。一是增量培养法,即将杂交瘤细胞在体外培养,在培养液中分离单克隆抗体。该法需用特殊的仪器设备,一般应用无血清培养基,以利于单克隆抗体的浓缩和纯化。最普遍采用的是小鼠腹腔接种法。选用 BALB/ c 小鼠或其亲代小鼠,先用降植烷或液体石蜡行小鼠腹腔注射,一周后将杂交瘤细胞接种到小鼠腹腔中去。通常在接种一周后即有明显的腹水产生,每只小鼠可收集 5~10ml 的腹水,有时甚至超过 40ml。该法制备的腹水抗体含量高,每毫升可达数毫克甚至数十毫克水平。此外,腹水中的杂蛋白也较少,便于抗体的纯化。接种细胞的数量应适当,一般为 5×105/ 鼠,可根据腹水生长情况适当增减。
选出的阳性细胞株应及早冻存。冻存的温度越低越好,冻存于液氮的细胞株活性仅有轻微的降低,而冻存在-70℃冰箱则活性改变较快。细胞不同于菌种,冻存过程中需格外小心。二甲亚砜(DMSO)是普遍应用的冻存保护剂。冻存细胞复苏后的活性多在 50%~95%之间。如果低于 50%,则说明冻存复苏过程有问题。
(六)单克隆抗体的纯化
单克隆抗体的纯化方法同多克隆抗体的纯化,腹水特异性抗体的浓度较抗血清中的多克隆抗体高,纯化效果好。按所要求的纯度不同采用相应的纯化方法。一般采用盐析、凝胶过滤和离子交换层析等步骤达到纯化目的,也有采用较简单的酸沉淀方法。目前最有效的单克隆抗体纯化方法为亲和纯化法,多用葡萄球菌 A 蛋白或抗小鼠球蛋白抗体与载体(最常用 Sepharose)交联,制备亲和层析柱将抗体结合后洗脱,回收率可达 90%以上。蛋白可与 IgG1、IgG2a、IgG2b 和 IgG3 结合,同时还结合少量的 IgM。洗脱液中的抗体浓度可用紫外光吸收法粗测,小鼠 IgG 单克隆抗体溶液在 A280nm 时,1.44(吸光单位)相当于 1mg/ml。经低 pH 洗脱后在收集管内预置中和液或速加中和液对保持纯化抗体的活性至关重要。
第三节 单克隆抗体在医学中的应用
单克隆抗体在生物学和医学研究领域中显示了极大的应用价值,是亲和层析中重要的配体,是免疫组化中主要的抗体,是免疫检验中的新型试剂,是生物治疗的导向武器。
作为医学检验试剂,单克隆抗体可以充分发挥其优势。单克隆抗体的特异性强,可将抗原抗体反应的特异性大大提高,减少了可能的交叉反应,使试验结果可信度更大。单克隆抗体的均一性和生物活性单一性使抗原抗体反应结果便于质量控制,利于标准化和规范化。目前已有许多检验试剂盒用单抗制成,其主要用途如下:
1.诊断各类病原体 这是单克隆抗体应用最多的领域,已有大量的商品诊断试剂供选择。如用于诊断乙肝病毒、疱疹病毒、巨细胞病毒、EB 病毒和各种微生物感染的试剂等。单克隆抗体具有灵敏度高、特异性好的特点。尤其在鉴别菌种型及亚型、病毒的变异株以及寄生虫不同生活周期的抗原性等方面更具独特优势。
2.肿瘤特异性抗原和肿瘤相关抗原的检测 用于肿瘤的诊断、分型及定位。尽管目前尚未制备出肿瘤特异性抗原的单克隆抗体,但对肿瘤相关抗原(例如甲胎蛋白和癌胚抗原)的单克隆抗体早已用于临床检验。
近年来,有人利用单克隆抗体进行肿瘤分型,对制定治疗方案和判断预后也有帮助。用抗肿瘤单抗检查病理标本,可协助确定转移肿瘤的原发部位。以放射性核素标记单克隆抗体主要用于体内诊断,结合 X 线断层扫描技术,可对肿瘤的大小及其转移灶作出定位诊断。
3.检测淋巴细胞的表面标志 用于区分细胞亚群和细胞分化阶段。例如检测 CD 系列标志,有助于了解细胞的分化和 T 细胞亚群的数量和质量变化,对多种疾病诊断具有参考意义。对细胞表面抗原的检查在白血病患者的疾病分期、治疗效果、预后判断等方面也有指导作用。组织相容性抗原是移植免疫学的重要内容,而应用单克隆抗体对 HLA 进行位点检查与配型可得到更可信的结果。
4.机体微量成分的测定 应用单克隆抗体和免疫学技术,可对机体的多种微量成分进行测定,如诸多酶类、激素、维生素、药物等;对受检者健康状态判断、疾病检出、指导诊断和治疗均具有实际意义。
上述应用的单克隆抗体属于鼠源性,作为体外诊断试剂是满意的。鼠源单克隆抗体如作为生物制剂应用于人体,则因是异性蛋白可引起过敏反应甚至危及生命。从临床治疗及预防疾病的要求,希望制备出人源性单克隆抗体。目前虽然已有文献报道,通过人-鼠细胞杂交及人-人细胞杂交进行了一些探索,但对这些细胞株培养很不稳定,融合细胞中人的染色体往往呈选择性丢失,以致细胞株难以维持培养。因此制备人源单克隆抗体是目前急待解决的问题。
第十二章 沉淀反应
沉淀反应(precipetaiton)是可溶性抗原与相应抗体特异性结合所出现的反。早在 1897 年 Kraus 就发现,细菌培养液与相应抗血清混合时可发生沉淀反应。1905 年 Bechhold 把抗体放在明胶中,将抗原加于其中,发现沉淀反应可在凝胶中进行。Oudin(1946)报告了试管免疫扩散技术,Mancini(1965)提出单向免疫扩散技术,使定性免疫试验向定量化发展。另一方面,免疫浊度法的出现,使沉淀反应达到快速、微量、自动化的新阶段。
沉淀反应分两个阶段,第一阶段发生抗原抗体特异性结合,第二阶段形成可见的免疫复合物(参见第九章)。经典的沉淀反应在第二阶段观察或测量沉淀线或沉淀环等来判定结果,称为终点法;而快速免疫浊度法则在第一阶段测定免疫复合物形成的速率,称为速率法。现代免疫技术(如各种标记免疫技术)多是在沉淀反应的基础上建立起来的,因此沉淀反应是免疫学方法的核心技术。
第一节 液体内沉淀试验
一、絮状沉淀试验
絮状沉淀试验为历史较久,又较有用的方法。该法要点是:将抗原与抗体溶液混合在一起,在电解质存在下,抗原与抗体结合,形成絮状沉淀物。这种沉淀试验受到抗原和抗体比例的直接影响,因而产生了两种最适比例的基本测定方法。
(一)抗原稀释法
抗原稀释法(Dean-Webb 法)是将可溶性抗原作一系列稀释,与恒定浓度的抗血清等量混合,置室温或 37℃反应后,产生的沉淀物随抗原的变化而不同。表 12- 1 系以牛血清白蛋白为例的实验结果。
表 12-1Dean-Webb 定量沉淀试验
| 管号 | 抗原 | 抗体 | 总沉淀量 | 反应过剩物 | 抗原沉淀量 | 抗体沉淀量 | 沉淀中 Ab/Ag |
| 1 | 0.003 | 0.68 | 0.093 | Ab | 0.003 | 0.090 | 30.0 |
| 2 | 0.005 | 0.68 | 0.145 | Ab | 0.005 | 0.140 | 28.0 |
| 3 | 0.011 | 0.68 | 0.249 | Ab | 0.011 | 0.238 | 21.7 |
| 4 | 0.021 | 0.68 | 0.422 | Ab | 0.021 | 0.401 | 19.1 |
| 5 | 0.032 | 0.68 | 0.571 | Ab | 0.032 | 0.539 | 16.8 |
| 6 | 0.043 | 0.68 | 0.734 | - | 0.043 | 0.691 | 16.1 |
| 7 | 0.064 | 0.68 | 0.720 | Ab | - | - | - |
| 8 | 0.085 | 0.68 | 0.601 | Ag | - | - | - |
| 9 | 0.171 | 0.68 | 0.464 | Ag | - | - | - |
| 10 | 0.341 | 0.68 | 0.368 | Ag | - | - | - |
单位:mmol/L
从表 12- 1 可以看出,1~5 管为抗体过剩管,7~10 管为抗原过剩管,唯第 6 管沉淀物最多,两者之比为 16:1,即最适比。
(二)抗体稀释法(Ramon)法
本法采用恒定的抗原量与不同程度稀释的抗体反应,计算结果同上法,得出的是抗体结合价和最适比。
现今,为了取得抗原与抗体的最佳比例,已将以上两法相结合,即抗原和抗体同时稀释,称为棋盘格法(亦称方阵法),找出最佳配比。举例见表 12-2。
表 12- 2 方阵最适比测定
| 抗体稀释度 | 抗原稀释度 | ||||||||
| 1/10 | 1/20 | 1/40 | 1/80 | 1/160 | 1/320 | 1/640 | 1/12 | 对照 | |
| 1/5 | + | ++ | +++ | +++ | ++ | + | ± | - | - |
| 1/10 | + | ++ | ++ | ++ | +++ | ++ | + | - | - |
| 1/20 | + | + | ++ | ++ | +++ | ++ | + | - | - |
| 1/40 | - | ± | + | + | ++ | +++ | ++ | + | - |
| 1/80 | - | - | - | - | + | + | + | + | - |
“+”为沉淀物量:为最适比
从表 12- 2 可以看出,方阵法可较正确地找出抗原与抗体的最适比。如抗体用 1:40。抗原则按 1:320 稀释;如抗原是 1:160,抗本则用 1:20 最为恰当。
二、环状沉淀试验
环状沉淀试验是 Ascoli 于 1902 年建立的,其方法是:先将抗血清加入内径 1.5~2mm 小玻管中,约装 1 / 3 高度,再用细长滴管沿管壁叠加抗原溶液。因抗血清蛋白浓度高,比重较抗原大,所以两液交界处可形成清晰的界面。此处抗原抗体反应生成的沉淀在一定时间内不下沉。一般在室温放置 10min 至数小时,在两液交界处呈现白色环状沉淀则为阳性反应。本技术的敏感度为 3~20μg/ml 抗原量。环状试验中抗原、抗体溶液须澄清。该试验主要用于鉴定微量抗原,如法医学中鉴定血迹,流行病学用于检查媒介昆虫体内的微量抗原等,亦可用于鉴定细菌多糖抗原。因该技术敏感度低,且不能作两种以上抗原的分析鉴别,现已少用。
第二节 凝胶内沉淀试验
最常用的凝胶为琼脂糖。由于凝胶内沉淀试验具有高度的敏感性和特异性,且设备简单、操作方便,因而得到广泛应用。
该试验利用可溶性抗原和相应抗体在凝胶中扩散,形成浓度梯度,在抗原与抗体浓度比例恰当的位置形成肉眼可见的沉淀线或沉淀环。适宜浓度的凝胶可视为一种固相的液体,水分占 98%以上,凝胶形成网络,将水分固相化。抗原和抗体蛋白质在此凝胶内扩散,犹如在液体中自由运动。大分子(分子量为 20 万以上)物质在凝胶中扩散较慢,可利用这点识别分子量的差别。另外,由于琼脂网孔有一定的限度,抗原抗体结合后,复合物的分子量至少应在百万以上,这种超大分子则被网络在琼脂中,经盐水浸泡也只能去除游离的抗原或抗体,这对后面的分析带来极大的方便。
凝胶内沉淀试验可根据抗原与抗体反应的方式和特性,分为单向扩散试验和双向扩散试验。
一、单向扩散试验
本试验是在琼脂胶中混入一定量抗体,使待测的抗原溶液从局部向琼脂内自由扩散,在一定区域内形成可见的沉淀环。根据试验形成可分为试管法和平板法两种。
(一)试管法
该方法由 Oudin 于 1946 年报道。将血清或纯化抗体混入约 50℃的 0.7%琼脂糖溶液中,注入小口径试管内,待凝固后,在凝胶中面加入抗原溶液,让抗原自由扩散入凝胶内,在抗原与抗体比例恰当位置形成沉淀环。在黑色背景斜射光处,极易观察这种白色不透明沉淀带。
沉淀环的数目和形态受抗原和抗体性质的影响。溶液内含有多种抗原,在凝胶中含有各自的抗体,扩散后形成相应的抗原抗体复合物,出现多条区带。试管上部的沉淀带表示抗原量少或者抗体量多;反之,下面的沉淀带则是抗原量大,抗体量少。另外,抗体类型也有很大区别,如用兔抗血清(R 型抗体),抗体过量亦可形成复合物,因而沉淀带宽而界线不清;如用马抗血清(H 型抗体),抗原或抗体过量皆不形成复合物,因而只在比例合适处形成界线清晰的沉淀物(图 12-1)。
图 12- 1 两种抗血清形成的沉淀带示意图
(二)平板法
此法由 Mancini 于 1965 年提出,是目前最常用的简易抗原定量技术,其要点是:将抗体或抗血清混入 0.9%琼脂糖内(约 50℃),未凝固前倾注成平板,凝固后在琼脂板上打孔(一般直径约 3~5mm),孔中加入抗原溶液,放室温或 37℃让其向四周扩散,24~48h 后可见周围出现沉淀环(图 12-2)。
图 12- 2 单向辐射状免疫扩散
上排为 5 个不同的参考中、下排为患者血清
下排右 2 为一异常病理血清
由于试验中抗原向四周扩散,故又称单向辐射状免疫扩散(singleradialimmunodeffusion,SRID)。最后,测量沉淀环的直径或计算环的面积。沉淀环直径或面积的大小与抗原量相关,但不是直线相关,而是对数关系。同时,这种沉淀还与分子量和抗散时间有关。抗原含量与环径的关系有两种计算方法:
1.Mancini 曲线适用于大分子抗原和长时间扩散(>48h)的结果处理。使用方格计算纸划线,扩散环直径的平方与抗原浓度呈线性关系(图 12-3)。
利用公式表示:C/d2=K
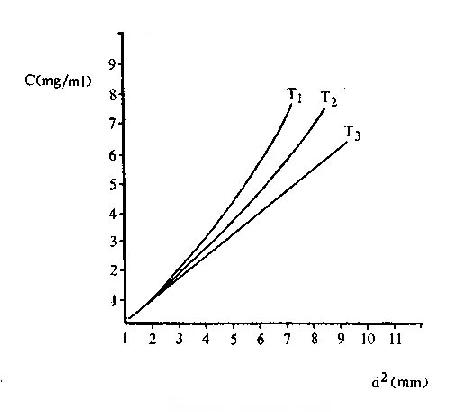
图 12-3Mancini 曲线
T1为 1624h;T2为 24~48h;T3为 48h 以上;可见 T 3为直线,T1为反抛物线
式中 C=抗原浓度,d=沉淀环直径,K=常数。
2.Fahey 曲线这种曲线适用于小分子抗原和较短时间(24h)扩散的结果处理。使用半对数划线,浓度的对数与扩散圈直径之间呈线性关系(图 12-4)。
用公式表示:log/d=K
式中 C=抗原浓度(mg/d),d=沉淀环直径,K=发常数。
各种蛋白质只要符合以下 3 条,几乎皆可用 SRID 定量测定:①备有仅对某待测抗原的单价特异抗血清;②备有已知含量的标准品;③待测品含量在 1.25μg/ml 以上(单向扩散技术的敏感度)。现在最常用于临床检测的项目有 IgG、IgA、IgM、C3、C4、转铁蛋白、抗胰蛋白酶、糖蛋白和前白蛋白等多种血浆蛋白。
在检测标本的同时,用已知含量的标准抗原作 5~7 个稀释度,同时测量圈的大小(见图 12-2)。按扩散时间(Fahey 和 Mancini 法)的不同,取方格纸或对数纸做标准曲线图。
单向琼脂免疫扩散法作为抗原的定量方法,其重复性和线性皆是可信赖的,唯敏感度稍差(不能测 μg/ml 以下含量)。另外,以下影响因素也应注意。
1.抗血清不但要求亲和力强、特异性好、效价高,而且还应注意存放的方法,防止效价下降。
2.标准曲线测定必须同时制作,决不可一次做成,长期应用。
3.测定时必须同时加测质控血清,以保证测量准确性。
4.有时出现扩散圈呈两重沉淀环的双环现象。这是由于出现了不同扩散率、但抗原性相同的两个组分。例如 α 重链病血清中出现的 α 重链和正常 IgA 发生反应,就形成内外两重环(图 12-2)。
图 12-4Fahey 曲线
t1为 1624h;t2为 2448h;t3为 48h 以上可见 t 1为直线,t3为抛物线
5.在单向扩散试验时,有时会出现结果与真实含量不符,这主要出现在 Ig 测定中。如用单向克隆抗体或用骨髓抗原免疫动物获得的抗血清,都存在结合价单一的现象,若用此作为单向扩散试剂测量正常人的多态性抗原,则抗体相对过剩,使沉淀圈直径变小,测量值降低。
6.测得结果的假阳性升高现象与上面相反,如用多克隆抗体测定单克隆病(M 蛋白),则抗原相对过剩(单一抗原决定簇成分),致使沉淀圈呈不相关的扩大,从而造成某一成分的伪性增加。
二、双向扩散试验
在琼脂内抗原和抗体各自向对方扩散,在最恰当的比例处形成抗原抗体沉淀线,观察这种沉淀线的位置、形状以及对比关系,可作出对抗原或抗体的定性分析。双向扩散也可分为试管法和平板法两种方法。
(一)试管法
试管法由 Oakley 首先报道。先在试管中加入含抗体的琼脂,凝固后在中间加一层普通琼脂,冷却后将抗原液体加到上层。放置后,下层的抗体和上层的抗原向中间琼脂层内自由扩散,在抗原与抗体浓度比例恰当处形成沉淀线。此法分析效果与 Oudin 法相似,在临床检验中罕用。
(二)平板法
平板法由 Ouchterlony 首先报道,是抗原抗体鉴定的最基本方法之一。该法的基本步骤是:在琼脂板上相距 3~5mm 打一对孔,或者打梅花孔、双排孔、三角孔等(图 12-5)。在相对的孔中加入抗原或抗体,置室温或 37℃18~24h 后,凝胶中各自扩散的抗原和抗体可在浓度比例适当处形成可见的沉淀线。根据沉淀线的形态和位置等可作如下 3 种分析。
1.抗原或抗体的存在与否及其相对含量的估计沉淀线的形成是根据抗原抗体两者比例所致。沉淀线如靠近抗原孔,则指示抗体含量较大;如靠近抗体孔,则指示着抗原含量较多。不出现沉淀线则表明抗体或抗原过剩。另外,如出现多条沉淀线,则说明抗原和抗体皆不是单一的成分。因此,可用于鉴定抗原或抗体的纯度。
图 12- 5 双扩散各种孔型图
2.抗原或抗体相对分子量的分析抗原或抗体在琼脂内自由扩散,其速度受分子量的影响。分子量小者扩散快,反之则较慢。由于慢者扩散圈小,局部浓度较大,形成的沉淀线弯向分子量大的一方。如若两者分子量相等,则形成。图 12-6 显示左侧沉淀线抗原分子量大于抗体,右侧沉淀线则抗体大于抗原,中间一条线则为两者相等。抗体多为 IgG,分子量约 15kD,未知抗原的分子量可做粗略估计。
图 12- 6 抗原抗体相对分子量示意图
3.用于抗原性质的分析两种受检抗原的性质完全相同、部分相同或完全不同。三种情况在双向扩散中表现的基本图形见图 12-7。
从图 12- 7 可以分析出,左图中两种受检抗原(Ag-a)完全相同,形成一个完全融合的沉淀线;右图中抗体为双价,两种抗原完全不同(Ag- a 和 Ag-c);中图的抗体为双价,两种抗原(Ag-ab 和 Ag-ac)皆有相同的 a 表位,又有不同的 b 和 c 表位,所以沉淀线呈部分融合的形状。这种技术作为抗原的分析,是目前免疫化学中最常用的鉴定技术之一。
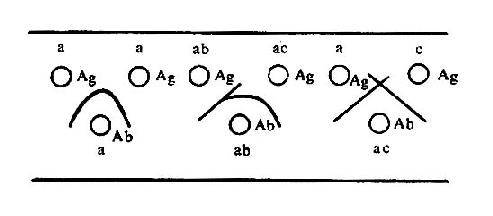
图 12- 7 三种扩散基本图型
4.用于抗体效价的滴定双向扩散技术是抗血清抗体效价滴定的常规方法。固定抗原的浓度,稀释抗体;或者抗原、抗体双方皆作不同的稀释,经过自由扩散,形成沉淀线。出现沉淀线的最高抗体稀释度为该抗体的效价。
第三节 免疫电泳技术
免疫电泳技术是电泳分析与沉淀反应的结合产物。这种技术有两大优点,一是加快了沉淀反应的速度,二是将某些蛋白组分利用其带电荷的不同而将其分开,再分别与抗体反应,以此作更细微的分析。免疫电泳技术的种类很多,这里仅将常用的技术介绍如下。
一、免疫电泳
免疫电泳为区带电泳与免疫双向扩散的结合,是由 Grabar 和 Williams(1953)首先报道的。方法是先利用区带电泳技术将不同电荷和分子量的蛋白抗原在琼脂内分离开,然后与电泳方向平行在两侧开槽,加入抗血清。置室温或 37℃使两者扩散,各区带蛋白在相应位置与抗体反应形成弧形沉淀线(图 12-8)。根据各蛋白所处的电泳位置,可分为白蛋白区、球蛋白 α1 区、α2 区、β 区和 γ 区。各区带常见血浆蛋白见表 12- 3 和图 12-9。
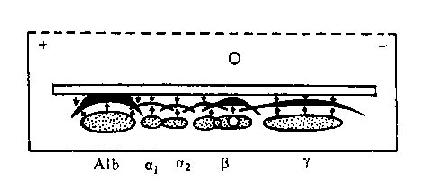
图 12- 8 免疫电泳扩散模式图 A1b:白蛋白
表 12- 3 血浆免疫电泳各区带所含蛋白成分
| ALB | α1 | α2 | β | γ |
| 白蛋白 | α1- 抗胰蛋白酶 | 触珠蛋白 | 转铁蛋白 | IgG |
| 前白蛋白 | α1- 酸糖蛋白 | 铜蓝蛋白 | C3a、C3b | CRP |
| α1 脂蛋白 | 抗糜蛋白酶 | 2- 巨球蛋白 | IgA、IgM、IgD、纤维蛋白原、β1 脂蛋白、血凝素 |
图 12- 9 血浆蛋白各区带位置示意图
PreALB:前白蛋白;HP:触珠蛋白;α1脂蛋白;ALB:白蛋白;TRF:转铁蛋白
βLIP:β 脂蛋白;AAT:抗胰蛋白酶;AAG:酸糖蛋白;α2M:α2巨球蛋白
免疫电泳沉淀线的数目和分辨率受许多因素影响。首先是抗原与抗体的比例,同其它沉淀反应一样,要预测抗体与抗原的最适比;其次是抗血清的抗体谱,一只动物的抗血清往往缺乏某些抗体,如将几只动物或几种动物的抗血清混合使用,则效果更好;电泳条件,如缓冲液、琼脂和电泳等皆可直接影响沉淀线的分辨率。对于免疫电泳的分析,更重要的是经验的积累,只有多看,多对比分析,才能作出恰当的结论。
免疫电泳目前大量应用于纯化抗原和抗体成分的分析及正常和异常体液蛋白的识别等方面。
二、对流免疫电泳
对流免疫电泳实质上是定向加速度的免疫双扩散技术,其基本原理是:在琼脂板上打两排孔,左侧各孔加入待测抗原,右侧孔内放入相应抗体,抗原在阴极侧,抗体在阳极侧。通电后,带负电荷的抗原泳向阳极抗体侧,而抗体藉电渗作用流向阴极抗原侧,在两者之间或抗体的另一侧(抗原过量时)形成沉淀线(图 12-10).

图 12-10 对流电泳结果示意图
①Ag 为阳性;②Ag 为弱阳性;③Ag 为强阳性;④Ag 为强阳性
IgG 作为蛋白质在电泳中比较特殊,4 个亚型有不同的表现。G3 和 G4 与一般蛋白无异,泳向阳极;而 G1 和 G2 则因其带电荷少,受电渗的作用力大于电泳,所以被水分子携裹向阴极移动。这就形成了 IgG 的特殊电泳形式:一部分泳向阳极,另一部分泳向阴极,在抗体孔两侧皆有抗体存在。因此,所谓对流只是部分 IgG 的电渗作用造成。
三、火箭免疫电泳
火箭免疫电泳技术又称作单向电泳扩散免疫沉淀试验,它是由单向扩散发展起来的一项定量技术,实质上是加速度的单向扩散。在含抗体的琼脂板一端打一排抗原孔;加入待测标本后,将抗原置阴极端,用横距 2~3mA/cm 的电流强度进行电泳。抗原泳向阳极,在抗原抗体比例恰当处发生结合沉淀。随着泳动抗原的减少,沉淀逐渐减少,形成峰状的沉淀区,状似火箭(图 12-11)。抗体浓度保持不变,峰的高度与抗原量呈正比,用标本中的抗原含量。

图 12-11 火箭电泳图
①②③为标本;④⑤⑥为标准抗原
火箭电泳操作时应注意以下几点:
1.所用琼脂可选择无电渗或电渗很小的,否则火箭形状不规则。
2.注意电泳终点时间,如火箭电泳顶部呈不清晰的云雾状或圆形皆提示未达终点。
3.标本数量多时,电泳板应先置电泳槽上,搭桥并开启电源(电流要小)后再加样。否则易形成宽底峰形,使定量不准。
4.作 IgG 定量时,由于抗原和抗体的性质相同,火箭峰因电渗呈纺缍状。为了纠正这种现象,可用甲醛与 IgG 上的氨基结合(甲酰化),使本来带两性电荷的 IgG 变为只带电荷,加快了电泳速度,抵消了电渗作用,而出现伸向阳极的火箭峰。
火箭电泳作为抗原定量只能测定 μg/ml 以上的含量,如低于此水平则难于形成可见的沉淀峰。加入少量125 I 标记的标准抗原共同电泳,则可在含抗体的琼脂中形成不可见的放射自显影技术。根据自显影火箭峰降低的程度(竞争法)可计算出抗原的浓度。放射免疫自显影技术可测出 ng/ml 的抗原浓度。
四、免疫固定电泳
免疫固定电泳(immunofixationelectrophoresis,IFE)是 Alper 和 Johnson(1969)推荐的一项有实用价值的电泳加沉淀反应技术。可用于各种蛋白质的鉴定。该法原理类似免疫电泳,不同之处是将血清直接加于电泳后蛋白质区带表面,或将浸有抗血清的滤纸贴于其上,抗原与对应抗体直接发生沉淀反应,形成的复合物嵌于固相支持物中。将未结合的游离抗原或抗体洗去,则出现被结合固定的某种蛋白。区带电泳支持物选用滤纸、醋纤膜、琼脂或聚丙烯酰胺皆可。
免疫固定电泳最常用于 M 蛋白的鉴定。方法是:先将患者血清或血浆在醋纤膜上或琼脂上作区带电泳(一般作 6 条标本),达到预定时间后取下,加抗血清,由上而下依次加抗人全血清、抗 IgG、抗 IgA、抗 IgM、抗 κ 轻链和抗 λ 轻链。必要时还可加抗 Fab、抗 Fc 等特殊抗血清。作用 30min 后洗去游离蛋白质,染色后则可被固定的相应 M 蛋白成分。
第四节 免疫浊度法
经典的沉淀试验有 4 个缺点无法克服,即操作繁琐、敏感度低(10~100μg/ml)、时间长和难以自动化。根据抗原与抗体能在液体内快速结合的原理,70 年代出现了微量免疫沉淀测定法,即免疫透射浊度测定、免疫胶乳浊度测定和免疫散射浊度测定法。这 3 种技术皆已常规用于临床体液蛋白的检测,并已创造出了多种自动化仪器。
免疫浊度测定的基本原理是:抗原抗体在特殊缓冲液中快速形成抗原抗体复合物,使反应液出现浊度。当反应液中保持抗体过量时,形成的复合物随抗原量增加而增加,反应液的浊度亦随之增加,与一系列的标准品对照,即可计算出受检物的含量。
免疫浊度测定法按照仪器设计的不同可以分为两种,即比浊仪测定(turbidimetermeasure)和散射比浊仪测定(nephelomitermeasure)。比浊仪测定是测量由于反射、吸收或散射引起的入射光衰减,其读数以吸光度 A 表示。A 什反映了入射光与透射光的比率(A=2-log10T,T 代表浊度百分比)。散射比浊仪测定是测量入射光遇到质点(复合物)后呈一定角度散射的光量,该散射光经放大后以散射值表示。两者的比较见图 12-12。
图 12-12 透射光和散射光测定比较
由于免疫复合物的形成有时限变化,当抗原抗体相遇后立即结合成小复合物(<19S),几分种到几小时才形成可见的复合物(>19S)。作为快速比浊测定,这种速度太慢,加入聚合剂(或促聚剂)可中速大的免疫复合物形成。目前促聚剂多用聚乙二醇(MW6000~8000),浓度约为 4%。
浊度测定亦有其弱点。其一是抗原或抗体量大大过剩时易出现可溶性复合物,造成测定误差,测定单克隆蛋白时这种更易出现。其二是应维持反应管中抗体蛋白量始终过剩,这个值要预先测定,使仪器的测定范围在低于生理范围到高于正常范围之间;其三是受血脂的影响,尤其是低稀释度时,脂蛋白的小颗粒可形成浊度,使测定值假性升高。
二、免疫胶乳浊度测定法
在上述比浊法中,少量的小的抗原抗体复合物极难形成浊度,除非放置较长时间;如形成较大的复合物,则抗原和抗体用量也较大,显然不符合微量化的要求。于是发展了免疫胶乳浊度测定,其基本原理是:将抗体吸附在大小适中、均匀一致的胶乳颗粒上,当遇到相应抗原时,则使胶乳颗粒发生凝集。单个胶乳颗粒在入射光波之内不阻碍光线透过,两个或两个以上胶乳颗粒凝聚时则使透过光减少,这种减少的程度与胶乳颗粒凝聚的程度呈正比,当然也与待测抗原量呈正比。见图 12-13。
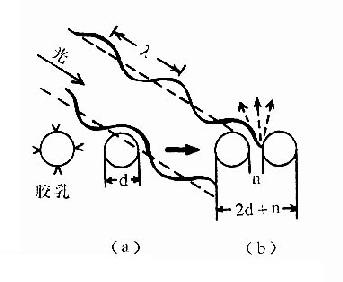
图 12-13 载体胶乳免疫比浊原理
(a)带抗体的胶乳在波长之内可透过光线;(b)结合后,则形成光线衰减
该技术的关键在于两个方面。首先是选择适用的胶乳,其大小(直径)要稍小于波长。用 500nm 波长者,选择 100nm 颗粒较适合;用 585nm 波长者,则选用 100~200nm 颗粒为好。目前多用 200nm 的胶乳颗粒。其次,胶乳与抗体结合时用化学交联虽好,但失活也较严重;一般用吸附法即可。
三、免疫速率散射浊度测定法
速率散射比浊法(ratenephelometry)是 Sternberg(1977)创建的。光沿水平轴照射时,碰到小颗粒的免疫复合物可导致光散射,散射光的强度与复合物的含量成正比,亦即待测抗原越多,形成的复合物也越多,散射光就越强。
速率散射比浊测定是一种抗原抗体结合的动态测定法。经典的沉淀反应皆在抗原抗体结合完成后进行复合物的定性或定量测定(终点法);若在抗原抗体反应的最高峰(约在 1min 内)测定其复合物形成的速率(速率法),则可达到快速、准确的目的。
第十三章 凝集反应
第一节 凝集反应的特点
细菌和红细胞等颗粒性抗原与相应抗体结合后,可出现肉眼可见的凝集(agglutination)现象。早在 1896 年,Widal 就利用伤寒病人的血清与伤寒杆菌发生特异性凝集的现象,有效地诊断伤寒病。至 1900 年 Landsteriner 在特异性血凝现象的基础上发现了人类血型,并于 1930 年获得了诺贝尔奖金。凝集试验灵敏度高,方法简便,迄今已成为通用的免疫学试验,广泛应用于临床检验。
凝集反应的发生分两阶段:①抗原抗体的特异结合;②出现可见的颗粒凝集。通常,细菌和红细胞等颗粒抗原在悬液中带弱负电荷,周围吸引一层与之牢固结合的正离子,外面又排列一层松散的负离子层,构成一个双层离子云。在松散层内界和外界之间的电位差形成 Z 电位。溶液中的离子强度愈大,Z 电位也就愈大。Z 电位使颗粒相互排斥。当特异抗体与相应抗原颗粒互补结合时,抗体的交联作用克服了抗原颗粒表面的 Z 电位,而使颗粒聚集在一起。但当抗体分子太少,不足以克服相当厚度的离子云层时,则不能使颗粒聚集。因此在凝集反应中,IgM 类抗体的作用比 IgG 类抗体要大数百倍,所以 IgG 类抗体常出现不完全反应,即不可见的抗原抗体反应。这种抗体有时又称不完全抗体。不完全的含义是:可与抗原牢固结合,但因其分子量较小,不能起到由桥联作用而形成的可见凝集现象。在试验过程中,为促使凝集现象的出现,可采取以下措施:增加蛋白质或电解质,降低溶液中离子强度以缩短颗粒间的距离;增加试液的粘滞度,如加入右旋糖酐或葡聚糖等;用胰酶或神经氨酸酶处理,改变细胞的表面化学结构;以离心方法克服颗粒间的排斥等。
凝集试验是一个定性的检测方法,即根据凝集现象的出现与否判定结果阳性或阴性;也可以进行半定量检测,即将标本作一系列对倍稀释后进行反应,以出现阳性反应的最高稀释度作为滴度。由于凝集反应方法简便,敏感度高,因而在临床检验中被广泛应用。
在免疫学技术中,凝集反应可分为直接凝集反应和间接凝集反应两大类。自身红细胞凝集试验和抗球蛋白参与的凝集试验是两种特殊的凝集反应。
第二节 直接凝集反应
细菌、螺旋体和红细胞等颗粒抗原,在适当电解质参与下可直接与相应抗体结合出现凝集,称为直接凝集反应(direct agglutination)。凝集反应中的抗原称为凝集原(agglutinogen),抗全称为凝集素(agglutinin)。常用的凝集试验有玻片法和试管法两种。
(一)玻片凝集试验
玻片凝集试验为定性试验方法,一般用已知抗体作为诊断血清、与受检颗粒抗原如菌液或红细胞悬液各加一滴在玻片上,混匀,数分钟后即可用肉眼观察凝集结果,出现颗粒凝集的为阳性反应。此法简便、快速,适用于从病人标本中分离得到的菌种的诊断或分型。玻片法还用于红细胞 ABO 血型的鉴定。
(二)试管凝集试验
试管凝集试验为半定量试验方法,在微生物学检验中常用已知细菌作为抗原液与一系列稀释的受检血清混合,保温后观察每管内抗原凝集程度,通常以产生明显凝集现象的最高稀释度作为血清中抗体的效价,亦称为滴度。在试验中,由于电解质浓度和 pH 不适当等原因,可引起抗原的非特异性凝集,出现假阳性反应,因此必须设不加抗体的稀释液作对照组。
临床上常用的直接试管凝集试验为肥达试验(Widal test)和外斐试验(Weil-Felix test)。在输血时也常用于受体和供体两者的红细胞和血清的交互配血试验。
第三节 间接凝集反应
将可溶性抗原(或抗体)先吸附于适当大小的颗粒性载体的表面,然后与相应抗体(或抗原)作用,在适宜的电解质存在的条件下,出现特异性凝集现象,称间接凝集反应(indirectagglutination)或被动凝集反应(passiveagglutination)。这种反应适用于各种抗体和可溶性抗原的检测,其敏感度高于沉淀反应,因此被广泛应用于临床检验。
一、间接凝集反应的类型
根据致敏载体用的是抗原或抗体以及凝集反应的方式,间接凝集反应可分为 4 类:
1.(正向)间接凝集反应用抗原致敏载体以检测标本中的相应抗体(图 13-1)。
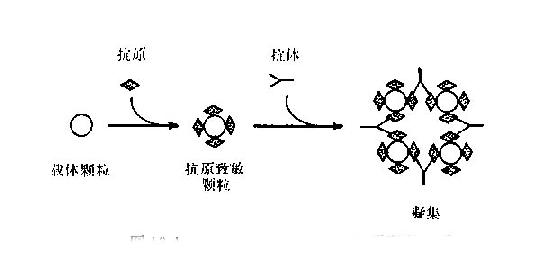
图 13-1(正向)间接凝集反应原理示意图
2.反向间接凝集反应用特异性抗体致敏载体以检测标本中的相应抗原(图 13-2)。
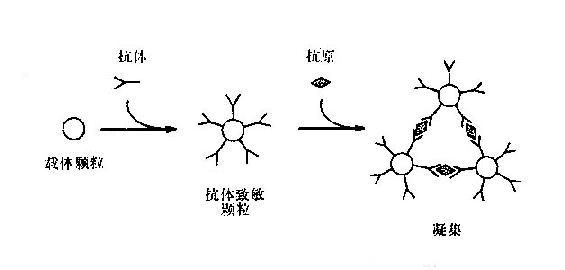
图 13- 2 反向间接凝集反应原理示意图
3.间接凝集抑制反应诊断试剂为抗原致敏的颗粒载体及相应的抗体,用于检测标本中是否存在与致敏抗原相同的抗原。检测方法为将标本先与抗体试剂作用,然后再加入致敏的载体,若出现凝集现象,说明标本中不存在相同抗原,抗体试剂未被结合,因此仍与载体上的抗原起作用。如标本中存在相同抗原,则凝集反应被抑制(图 13-3)。同理可用抗体致敏的载体及相应的抗原作为诊断试剂,以检测标本中的抗体,此时称反向间接凝集抑制反应。
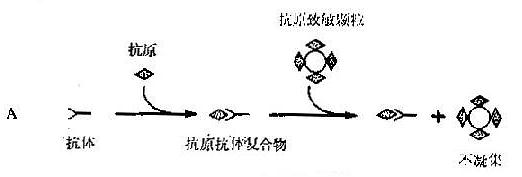
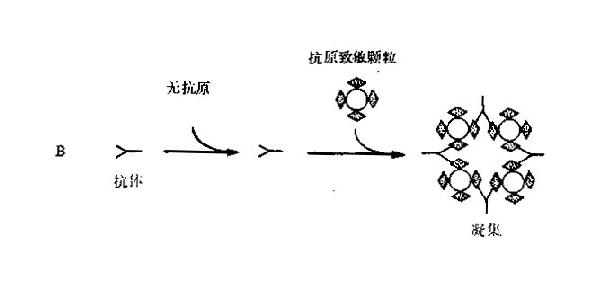
图 13- 3 间接凝集抑制反应原理示意图
A:标本中含抗原 B:标本中不含抗原
4.协同凝集反应协同凝集反应(coaggoltination)与间接凝集反应的原理相类似,但所用载体既非天然的红细胞,也非人工合成的聚合物颗粒,而是一种金黄色葡萄球菌。它的菌体细胞壁中含有 A 蛋白(staphylococcusprotienA,SPA)。SPA 具有与 IgG 的 Fc 段结合的特性,因此当这种葡萄球菌与 IgG 抗体连接时,就成为抗体致敏的颗粒载体。如与相应抗原接触,即出现反向间接凝集反应。协同凝集反应也适用于细菌的直接检测。
在间接凝集反应中,可用作载体的颗粒种类很多,常用的有动物或人红细胞、细菌和多种惰性颗粒如聚苯乙烯胶乳(polystyrenelatex)、皂土(bentonite)及明胶颗粒、活性炭、火棉胶等。在临床检验中最常用的为间接血凝试验和胶乳凝集试验。
二、间接血凝试验
血凝试验(hemagglutinationtest)是红细胞凝集试验的简称。间接血凝试验是以红细胞作为载体的间接凝集试验,在临床检验中应用广泛,以下简述其操作过程。
(一)载体
红细胞是大小均一的载体颗粒,最常用的为绵羊、家兔、鸡的红细胞及 O 型人红细胞。新鲜红细胞能吸附多糖类抗原,但吸附蛋白质抗原或抗体的能力较差。致敏的新鲜红细胞保存时间短,且易变脆、溶血和污染,只能使用 2~3 天。为此一般在致敏前先将红细胞醛化,可长期保存而不溶血。常用的醛类有甲醛、戊二醛、丙酮醛等。红细胞经醛化后体积略有增大,两面突起呈圆盘状。
醛化红细胞具有较强的吸附蛋白质抗原或抗体的能力,血凝反应的效果基本上与新鲜红细胞相似。如用两种不同醛类处理效果更佳。也可先用戊二醛,再用鞣酸处理。醛化红细胞能耐 60℃加热,并可反复冻融不破碎,在 4℃可保存 3~6 个月,在-20℃可保存一年以上。
(二)致敏
致敏用的抗原或抗体要求纯度高,并保持良好的免疫活性。用蛋白质致敏红细胞的方法有直接法和间接法。直接法只须在低 pH,低离子浓度下,用醛化红细胞直接吸附即可。间接法则需用偶联剂将蛋白质结合到红细胞上。常用偶联剂为双偶氮联苯胺(bidiazotizedbenzidine,BDB)和氯化铬。前者通过共价键,后者通过金属阳离子静电作用使蛋白质与红细胞表面结合而达到致敏的目的。
(三)血凝试验
可在微量滴定板或试管中进行,将标本倍比稀释,一般为 1:64,同时设不含标本的稀释液对照孔。在含稀释标本 1 滴的板孔(或试管)中,加入 0.5%致敏红细胞悬液 1 滴,充分混匀,置室温 1~2 小时,即可观察结果。凡红细胞沉积于孔底,集中呈一圆点的为不凝集(一)。如红细胞凝集,则分布于孔底周围。根据红细胞凝集的程度判断阳性反应的强弱(图 13-4),以++凝集的孔为滴度终点。
图 13- 4 血凝反应强度示意图
-:红细胞沉积于孔底;+:红细胞沉积于孔底,周围有散在少量凝集;
++:红细胞形成层凝集,面积较小,边缘较松散;+++:红细胞形
成片层凝集,面积略多于++;++++:红细胞形成片层凝集,均匀
布满孔底,或边缘皱缩如花边状
三、胶乳凝集试验
胶乳凝集试验也是一种间接凝集试验,所用的载体颗粒为聚苯乙烯胶乳,是一种直径约为 0.8μm 大小的圆形颗粒,带有负电荷,可物理性吸附蛋白分子,但这种结合牢固性差。也可制备成具有化学活性基团的颗粒,如带有羧基的羧化聚苯乙烯胶乳等,抗原或抗体以共价键交联在胶乳表面。化学交联一般通过缩合剂碳化二亚胺将胶乳上的羧基与被交联物上的氨基缩合在一起。这种用交联致敏的胶乳试剂性能稳定,保存期长。
胶乳凝集试验分试管法与玻片法。试管法先将受检标本在试管中以缓冲液作倍比稀释,然后加入致敏的胶乳试剂,反应后观察胶乳凝集结果。玻片法操作简便,一滴受检标本和一滴致敏的胶乳试剂在玻片上混匀后,连续摇动 2~3min 即可观察结果。出现凝集大颗粒的为阳性反应,保持均匀乳液状为阴性反应。胶乳为人工合成的载体,因此其性能比生物来源的红细胞稳定,均一性好。但胶乳与蛋白质的结合能力以及凝集性能不如红细胞,因此作为间接凝集试验,胶乳试验的敏感度不及血凝试验。
四、间接凝集反应的作用
间接凝集反应具有快速、敏感、操作简便、无需特殊的实验设备等特点,而且能用于抗原或抗体的测定,因此在临床检验中广为应用。
(一)抗原的检测
反向间接凝集试验可用于检测病原体的可溶性抗原,也可用于检测各种蛋白质成分。间接凝集反应的敏感度虽较沉淀反应高,但低于新发展的各种标记免疫测定。因此在微量抗原测定中其实用性取决于临床的要求。例如测定尿液 HGG 的胶乳凝集妊娠试验,直接凝集法的敏感度约为 300mIU/ml,凝集抑制法的敏感度约为 1000mIU/ml,停经 35~40 天以上的孕妇可测得阳性结果。检测乙型肝炎表面抗原(HBsAg)的间接血凝试验敏感度一般在 2~5ng/ml,对献血员的筛检已不符合要求。
(二)抗体的检测
可用于检测细菌、病毒、寄生虫等感染后产生的抗体,例如间接血凝试验或明胶颗粒凝集试验用于检测抗人免疫缺陷病毒(HIV)抗体以诊断艾滋病、胶乳凝集试验用于检测抗溶血素 O 等。也有用于检测自身免疫性疾病的抗体,例如类风湿因子胶乳凝集试验、抗 DNA 抗体和抗甲状腺球蛋白抗体的间接血凝试验等。
第四节 自身红细胞凝集试验
自身红细胞凝集试验(autologousred cell agglutination assay)与一般间接血凝试验不同之处为反应中的红细胞是未经致敏的受检者新鲜红细胞。主要试剂材料为抗人 O 型红细胞的单克隆抗体,这种抗体能与不论何种血型的红细胞结合,但不引起凝集反应。这种抗体与另一特异性抗体连接成的双功能抗体可用于检测标本中的抗原;如与特异性抗原连接,则可用于检测标本中的抗体。反应中的标本为受检者的全血。
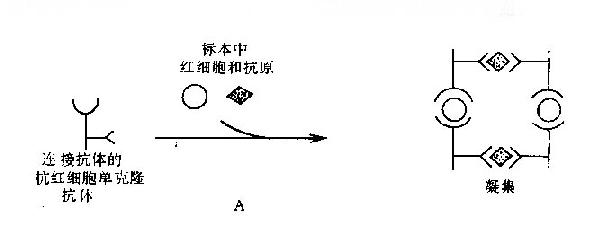
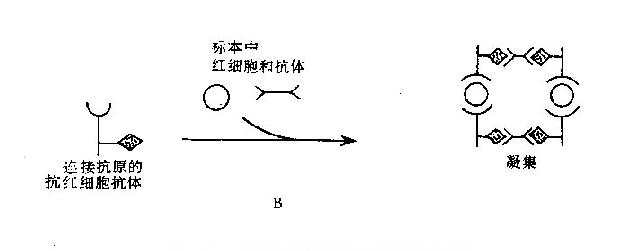
图 13-5 自身红细胞凝集试验原理示意图
A:检测抗原;B:检测抗体
试验的过程如下:在白色塑料片上加血液标本 1 滴和上述试剂 1 滴,混匀,2min 后观察结果,出现红细胞凝集为阳性。反应机制见图 13-5。血液标本中的红细胞和抗原(或抗体)分别与试剂中的抗红细胞单克隆抗体和特异性抗体(或抗原)反应,形成网络而导致红细胞的凝集。
自身红细胞凝集试验的特点是受检标本为全血,不需分离血清,采指血或耳垂血进行试验,受检者即刻可知检测结果。此试验已成功地用于抗 HIV 抗体的检测。也有检测 HbsAg 的试剂供应,其敏感度与间接血凝试验相仿。
第五节 抗球蛋白参与的血凝试验
抗球蛋白参与的血凝试验由 Coombs 于 1945 年建立,故又称为 Coombs 试验,是检测抗红细胞不完全抗体的一种很有用的方法。所谓不完全抗体,多半是 7S 的 IgG 类抗体,能与相应的抗原牢固结合,但在一般条件下不出现可见反应。Coombs 利用抗球蛋白抗体作为第二抗体,连接与红细胞表面抗原结合的特异抗体,使红细胞凝集。经常用作试验的有两类方法。
(一)直接 Coombs 试验
将含球蛋白的试剂直接加到红细胞表面结合抗体的细胞悬液中,即可见细胞凝集(图 13-6)。可用玻片法定性测定,也可用试管法作半定量分析。常用于新生儿溶血症、自身免疫性溶血症、特发性自身免疫性贫血和医源性溶血性疾病等的检测。
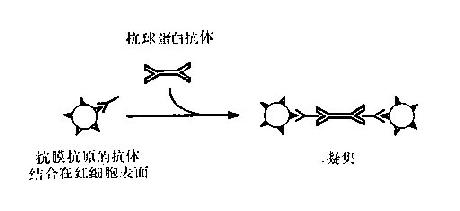
图 13- 6 直接 Coombs 试验
(二)间接 Coombs 试验
用以检测游离的血清中的不完全抗体。将受检血清和具有待测不完全抗体相应抗原性的红细胞相结合。再加入抗球蛋白抗体就可出现可见的红细胞凝集(图 13-7)。此试验多用于检测母体 Rh(D)抗体,以便及早发现和避免新生儿溶血症的发生。亦可对红细胞不相容的输血所产生的血型抗体进行检测。
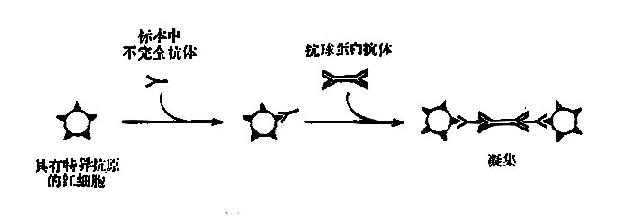
图 13- 7 间接 Coombs 试验
Coombs 试验除了广泛应用于血液病的检测外,还可采用专一特异性的抗球蛋白的血清如 IgG 血清、抗 IgA 或抗 IgM 以及抗补体血清等,分析结合于红细胞上的不完全抗体的免疫球亚类。
第十四章 溶血反应和补体结合试验
第一节 溶血反应
免疫溶血反应是补体参与的抗体致敏红细胞的溶解反应。参与反应的成分有 3 种:①红细胞,一般用绵羊红细胞(SRBC);②抗红细胞抗体,也称溶血素,多为家兔抗 SRBC 的抗血清;③补体。
溶血反应的直接用途是测定总补体活性或溶血素的效价;也可利用溶血系统作为指示剂,检测另一反应系统的抗原或抗体,即补体结合试验。
一、溶血反应的检测试剂
(一)补体
检测血清补体水平或补体活性时需要从受检者采血及分离血清。做补体结合试验时多采用豚鼠血清作为实验用补体的来源。因为补体在体外极易衰变,所以检测补体活性的血清标本和作为补体试剂的血清必须新鲜。
受检者一般做静脉采血,在动物可做心脏采血。血清分离后应及时使用,最好在当日用完。必须保存时采用小量分装的办法,置-70℃下可保存数月,避免反复冻融。冻干制品可长期保存,但其活性都不同程度地比新鲜血清降低。
以豚鼠血清作补体来源时,应考虑到个体差异。为了确保血清中补体的有效活性,必须取 3 只以上豚鼠的血清混合后使用。
(二)绵羊红细胞
从绵羊颈静脉无菌采血,抽出血液后立即小心地注入放有玻璃珠的无菌干燥三角烧瓶中,充分旋摇 15~20min,以除去纤维蛋白。也可将羊血与等量或 2 倍量的 Alsever 血液保存液混合,既有抗凝作用,又适于储存;分装后置 4℃,可使用 3 周。
实验前,取适量抗凝血,加入 8~10 倍的生理盐水,轻轻混匀后 2000r/min 离心 5min;弃上清,沉淀的红细胞用生理盐水再洗一次,这时上清为无色澄清,如显红色说明有溶血现象,应更换新鲜羊血;第三次用缓冲液洗涤,弃上清,取压积红细胞用缓冲液配制 SRBC 悬液,使用浓度一般为 2%~5%。为使红细胞浓度标准化,可吸取少量红细胞悬液,中入 20~30 倍的稀释液中,在 542nm 波长比浊,以吸光度为标准调整红细胞浓度。
(三)溶血素
溶血素即抗绵羊红细胞抗体,多是以绵羊红细胞免疫家兔而得到兔抗血清。一般没有必要进一步提纯抗体,但在试验前需先进行加热 56℃30min 或 60℃3min 以灭活补体。
由于补体溶血试验及补体结合试验均是比较精密的试验,其结果与溶血素的效价有关,所以试验需要滴定溶血素效价;在制备抗血清的过程中,于动物采血前和分离抗血清后也需要滴定溶血素效价。
1.溶血素稀释稀释溶血素时,要先对效价有个大概的估计,以便确定稀释度的范围。动物采血前滴定时稀释范围要稍大些,实验前的滴定便以原先的记录作为参考(溶血素的效价多在数千单位以上)。溶血素稀释一般不采用连续倍比稀释法,因为稀释到最后时跨度太大,不容易确定单位。为了便于操作,现举例按表 14- 1 配制不同稀释度的溶血素。
表 14- 1 不同浓度溶血素的配制
| 最终稀释度 | 缓冲液(ml) | 所加溶血素 | |
| 稀释度 | 体积(ml) | ||
| 1:1000 | 1.8 | 1:100 | 0.2 |
| 1:2000 | 0.2 | 1:1000 | 0.2 |
| 1:3000 | 0.4 | 1:1000 | 0.2 |
| 1:4000 | 0.2 | 1:2000 | 0.2 |
| 1:5000 | 0.8 | 1:1000 | 0.2 |
| 1:6000 | 0.2 | 1:3000 | 0.2 |
| 1:8000 | 0.2 | 1:4000 | 0.2 |
| 1:10000 | 0.2 | 1:5000 | 0.2 |
2.效价滴定将稀释好的溶血素及其他试剂按表 14- 2 所示逐步加入到各试管中,放置 37℃水浴,不要盖上水浴箱的盖子,以免盖子上冷凝的水蒸气滴入试管内引起非补体性溶血。30min 后取出观察结果。
表 14- 2 溶血素的滴定
| 管号 | 溶血素稀释度 | 试管内加的各种试剂材料 | 结果 | |||
| 溶血素(ml) | 1:60 稀释补体(ml) | 缓冲液(ml) | 20%羊红细胞(ml) | |||
| 1 | 1:1000 | 0.1 | 0.2 | 0.2 | 0.1 | 全溶 |
| 2 | 1:2000 | 0.1 | 0.2 | 0.2 | 0.1 | 全溶 |
| 3 | 1:3000 | 0.1 | 0.2 | 0.2 | 0.1 | 全溶 |
| 4 | 1:4000 | 0.1 | 0.2 | 0.2 | 0.1 | 全溶 |
| 5 | 1:5000 | 0.1 | 0.2 | 0.2 | 0.1 | 大部分 |
| 6 | 1:6000 | 0.1 | 0.2 | 0.2 | 0.1 | 微溶 |
| 7 | 1:8000 | 0.1 | 0.2 | 0.2 | 0.1 | 不溶 |
| 8 | 1:10000 | 0.1 | 0.2 | 0.2 | 0.1 | 不溶 |
| 9 | (对照) | - | - | 0.5 | 0.1 | 不溶 |
温育反应后,完全溶血的试管内液体红色透明,放置一段时间后管底无细胞沉淀,离心后可见少许细胞碎渣。不溶血的管内液体浑浊;放置后可见红细胞沉淀,上清无色透明。不同程度的不完全溶血介于两者的中间变化态。
按照以上标准,以产生完全溶血的最高稀释管为最大有效反应管,以该管的溶血素稀释倍数为溶血素产效价。例如表 14- 2 中的溶血素效价应为 1:4000;在 1:4000 稀释的情况下,反应液中所含溶血素的的量为 1U/ml。
做补体活性测定或补体结合试验时,一般使用 2U/ml 溶血素(在本例做 1:2000 稀释),与 SRBC 悬液等体积混合。
(四)稀释缓冲液
磷酸缓冲液或巴比妥缓冲液等均可用于溶血试验,pH 值应调至 7.2~7.4 之间。另加入适量氯化钠以保持等渗,并适当地加入一些钙离子和镁离子,这是补体活化所不可缺少的。有的配方还加入 0.1%的明胶以使蛋白溶液稳定;加入 0.01%NaN3可以防腐,利于较长时间保存。
二、溶血反应测定补体法
(一)CH50 试验原理
补体最主要的活性是溶细胞作用,这种活性很容易通过溶血反应进行检测。在一个适当的、稳定的反应系统中,溶血反应对补体的剂量依赖呈一个特殊的 S 形曲线(图 14-1)。
图 14- 1 溶血程度与补体含量的关系
从图 14- 1 可以看出,在轻微溶血和接近完全溶血时,补体量的变化不能使溶血程度有显着改变,速溶血对补体量的变化不敏感。但在半溶血(50%溶血)上下时曲线最陡,即使补体含量仅有较小变动时,溶血程度也会发生较大的改变,也就是说对补体量的变化非常敏感。故采用 50%溶血作为终点指标要比 100%溶血敏感得多,这一方法称为补体 50%溶血(complementhemolysis50%),简称为 CH50。
(二)CH50 试验方法
取新鲜血清标本进行试验。按表 14- 3 的要求在各管中加入试剂和反应物,一起放 37℃水浴箱中温育 30min。
做 CH50 试验时,应同时配制 50%溶血的标准管。取 2%SRBC 悬液 0.5ml,加 2.0 蒸馏水,使 SRBC 全部溶解;再加入 2.0ml1.8%NaC1 溶液校正为等渗溶液;最后加入 2%SRBC 悬液 0.5ml,即成为 50%溶血状态;混匀后取该悬液 2.5ml,随试管一起进行温育,便是 50%溶血标准管。
表 14- 3 总补体溶血活性测定
| 试管号码 | 1:20 稀释血清(ml) | 巴比妥缓冲液(ml) | 2U 溶血素(ml) | 2%羊红细胞(ml) |
| 1 | 0.10 | 1.40 | 0.5 | 0.5 |
| 2 | 0.15 | 1.35 | 0.5 | 0.5 |
| 3 | 0.20 | 1.30 | 0.5 | 0.5 |
| 4 | 0.25 | 1.25 | 0.5 | 0.5 |
| 5 | 0.30 | 1.20 | 0.5 | 0.5 |
| 6 | 0.35 | 1.15 | 0.5 | 0.5 |
| 7 | 0.40 | 1.10 | 0.5 | 0.5 |
| 8 | 0.45 | 1.05 | 0.5 | 0.5 |
| 9 | 0.50 | 1.00 | 0.5 | 0.5 |
| 10 | 0.00 | 1.50 | 0.5 | 0.5 |
温育后将所有试管 2500r/min 离心 5min,通过观察比较,选择溶血程度与标准管相近的两管在分光光度计上分别读取吸光度,以最接近标准管的那一管定为最高有效反应管,取其稀释倍数代入下列公式,求得 CH50 的测定值(单位 U)。
每毫升血清总补体活性(单位)=×稀释倍数
用 CH50 法测定总补体溶血活性时,所测得的值与反应体积成反比例关系,上例采用的液体总量为 2.5ml,测得的总补体活性的参考范围为 50~100U/ml。
(三)临床意义
CH50 法主要检测的是补体经典途径的溶血活性,所反映的主要是补体 9 种成分的综合水平。如果测定值过低或者完全无活性,首先考虑补体缺陷,可分别检测 C4、C2、C3 和 C5 等成分的血清含量;严重肝病时血浆蛋白合成能力受损,营养不良时蛋白合成原料不足,这些也都可以不同程度地引起血清补体水平下降。
在患系统性红斑狼疮、类风湿性关节炎和强直性脊柱炎等自身免疫病时,血清补体水平随病情发生变化。疾病活动期补体活化过度,血清补体水平下降;病情稳定后补体水平又反应性增高。另外,补体各成分在不同的自身免疫病时可有特征性的表现(详见第二十五章),因此补体检测常可作为自身免疫病诊断或是否有疾病活动的参考指标。
细菌感染、特别是革兰阴性细菌感染时,常因补体旁路途径的活化过度引起血清补体水平降低。心肌梗塞、甲状腺炎、大叶性肺炎、糖尿病、妊娠等情况下血清补体水平常升高。
第二节 补体结合试验
补体结合试验(complementfixationtest,CFT)是用免疫溶血机制做指示系统,来检测另一反应系统抗原或抗体的试验。早在 1906 年 Wasermann 就将其应用于梅毒的诊断,即著名的华氏反应。这一传统的试验经不断改进,除了用于传染病诊断和流行病学调查以外,在一些自身抗体、肿瘤相关以原以及 HLA 的检测和分析中也有应用。
一、类型及原理
该试验中有 5 种成分参与反应,分属于 3 个系统:①反应系统,即已知的抗原(或抗体)与待测的抗体(或抗原);②补体系统;③指示系统,即 SRBC 与相应溶血素,试验时常将其预先结合在一起,形成致敏红细胞。反应系统与指示系统争夺补体系统,先加入反应系统给其以优先结合补体的机会。
如果反应系统中存在待测的抗体(或抗原),则抗原抗体发生反应后可结合补体;再加入指示系统时,由于反应液中已没有游离的补体而不出现溶血,是为补体结合试验阳性。如果反应系统中不存在的待检的抗体(或抗原),则在液体中仍有游离的补体存在,当加入指示系统时会出现溶血,是为补体结合试验阴性(图 14-2)。因此补体结合试验可用已知抗原来检测相应抗体,或用已知抗体来检测相应抗原。
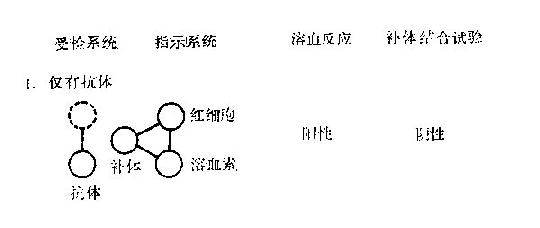
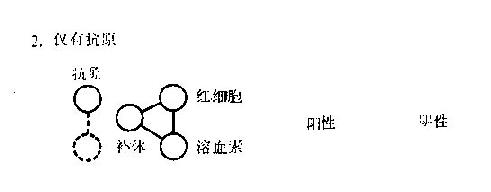
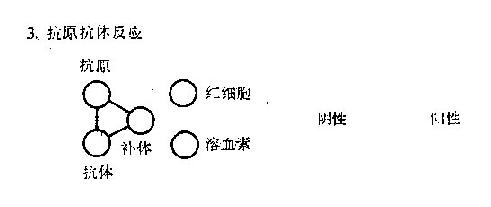
图 14- 2 补体结合试验示意图
二、试验方法
补体结合试验的改良方法较多,较常用的有全量法 (3ml)、半量法(1.5ml)、小量法(0.6ml) 和微量法(塑板法)等。目前以后两种方法应用较为广泛,因为可以节省抗原,血清标本用量较少,特异性也较好。以下叙述以小量法为例,即抗原、抗体、溶血素、羊红细胞各加 0.1ml,补体加 0.2ml,总量为 0.6ml。
(一)试剂
1.抗原试验中用于检测抗体的抗原应适当提纯,纯度愈高,特异性愈强。如使用粗制抗原时,须经同样处理的正常组织作抗原对照,以识别待检血清中可能存在的、对正常组织成分的非特异性反应。
2.抗原和抗本的滴定补体结合试验中,抗原与抗体按一定比例结合,因而应通过试验选择适宜的浓度比例。多采用方阵法进行滴定,选择抗原与抗体两者都呈强阳性反应(100%不溶血)的最高稀释度作为抗原和抗体的效价(单价)。滴定方法举例如表 14-4。在试管中加入不同稀释度的抗原,配加不同稀释度的抗血清,另作不加抗原的抗体对照管和不加抗血清的抗原对照管。按照试验方法加补体和指示系统,温育后观察结果。在表 14- 4 中可见 1:64 抗原和 1:32 抗体各作为 1 个单位。在正式试验中,抗原一般采用 2~4 个单位(1:64~1:32),抗体采用 4 个单位(1:8)。
表 14- 4 抗原和抗体的方阵滴定
| 抗原 | 抗血清稀释倍数 | 抗原对照 | |||||||
| 1:4 | 1:8 | 1:16 | 1:32 | 1:64 | 1:128 | 1:256 | 1:512 | ||
| 1:4 | 4 | 4 | 4 | 4 | 4 | 4 | 3 | 2 | |
| 1:8 | 4 | 4 | 4 | 4 | 4 | 3 | 2 | 1 | |
| 1:16 | 4 | 4 | 4 | 4 | 3 | 2 | 2 | ± | |
| 1:32 | 4 | 4 | 4 | 4 | 3 | 1 | ± | ||
| 1:64 | 4 | 4 | 4 | ④ | 2 | ± | |||
| 1:128 | 4 | 2 | 1 | ||||||
| 1:256 | 3 | 1 | |||||||
| 1:512 | |||||||||
| 抗体对照 | |||||||||
注:1、2、3、4 分别表示溶血反应强度+、++、+++、++++;0 为不溶血。
3.补体滴定按表 14- 5 逐步加入各试剂,温育后观察最少量补体能产生完全溶血者,确定为 1 个实用单位,正式试验中使用 2 个实用单位。如形 14- 5 中的结果为 1:60 的补体 0.12ml 可产生完全溶血,按比例公式 0.12×2:60=0.2:X 计算,X=50;即实际应用中的 2 个补体实用单位应为 1:50 稀释的补体 0.2ml。
表 14- 5 补体的滴定
| 管号 | 1:60 补体(ml) | 缓冲液(ml) | 稀释抗原(ml) | 致敏 SRBC (ml) | 结果 | ||
| 1 | 0.04 | 0.26 | 0.1 | 放 置 37℃水 浴 30min | 0.2 | 放 置 37℃水 浴 30min | 不溶血 |
| 2 | 0.06 | 0.24 | 0.1 | 0.2 | 不溶血 | ||
| 3 | 0.08 | 0.22 | 0.1 | 0.2 | 微溶血 | ||
| 4 | 0.10 | 0.20 | 0.1 | 0.2 | 微溶血 | ||
| 5 | 0.12 | 0.18 | 0.1 | 0.2 | 全溶血 | ||
| 6 | 0.14 | 0.16 | 0.1 | 0.2 | 全溶血 |
(二)血清标本
采集血液标本后及时分离血清,及时检验或将血清保存于-20℃。血清在试验前应先加热 56℃30min(或 60℃3min)以破坏补体和除去一些非特异因素。血清标本遇有抗补本现象时可做下列处理之一:①加热提高 12;②-20℃冻融后离心去沉淀;③以 3mmol/ L 盐酸处理;④加入少量补体后再加热灭活;⑤以白陶土处理;⑥通入 CO2;⑦以小白鼠肝粉处理;⑧用含 10%新鲜鸡蛋清的生理盐水稀释补体。
(三)正式试验
以小量法测定抗体的补体结合试验为例。按表 14- 6 逐步加入各种试剂,温育后先观察各类对照管,应与预期的结果吻合。阴性、阳性对照管中应分别为明确的溶血与不溶血;抗体或抗原对照管、待检血清对照管、阳性和阴性对照的对照管都应完全溶血。绵羊红细胞对照管不应出现自发性溶血。补体对照管应呈现 2U 为全溶,1U 为全溶略带有少许红细胞,0.5U 应不溶。如 0.5U 补体对照出现全溶表明补体用量过多;如 2U 对照管不出现溶血,说明补体用量不够,对结果都有影响,应重复进行试验。补体结合试验结果,受检血清不溶血为阳性,溶血为阴性。
表 14- 6 测定抗体的补体结合试验操作程序
| 反应物(ml) | 待检血清管 | 阳性对照管 | 阴性对照管 | 抗原对照管 | 补体对照管 | 红细胞对照管 | |||||
| 测定 | 对照 | 测定 | 对照 | 测定 | 对照 | 2U | 1U | 0.5U | |||
| 稀释血清 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | - | - | - | - | - |
| 抗原 | 0.1 | - | 0.1 | - | 0.1 | - | 0.1 | 0.1 | 0.1 | 0.1 | - |
| 缓冲液 | - | 0.1 | - | 0.1 | - | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.4 |
| 2U 补体 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | - | - | - |
| 1U 补体 | - | - | - | - | - | - | - | - | 0.2 | - | - |
| 0.5U 补体 | - | - | - | - | - | - | - | - | - | 0.2 | - |
| 混匀,置 37℃1h 或 4℃16~18h | |||||||||||
| 致敏红细胞 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 混匀,置 37℃30min 后观察结果 | |||||||||||
三、应用和评价
补体结合试验是一种传统的免疫学技术,能够沿用至今说明它本身有一定的优点:①灵敏度高。补体活化过程有放大作用,比沉淀反应和凝集反应的灵敏度高得多,能测定 0.05μg/ml 的抗体,可与间接凝集法的灵敏度相当。②特异性强。各种反应成分事先都经过滴定,选择了最佳比例,出现交叉反应的机率较小,尤其用小量法或微量法时。③应用面广,可用于检测多种类型的抗原或抗体。④易于普及,试验结果显而易见;试验条件要求低,不需要特殊仪器或只用光电比色计即可。
补体结合试验可应用在以下几方面:①传染病诊断。病原性抗原及相应抗体的检测。②其他抗原的检测。例如肿瘤相关抗原、血迹中的蛋白质鉴定、HLA 分型等。③自身抗体检测。
但是补体结合试验参与反应的成分多,影响因素复杂,操作步骤繁锁并且要求十分严格,稍有疏忽便会得出不正确的结果,所以在多种测定中已被其他更易被接受的方法所取代。但对于免疫学技术的基本训练仍是一个很好的试验。
第十五章 酶免疫技术
第一节 酶免疫技术的分类
酶免疫技术是以酶标记的抗体或抗原为主要试剂的方法,是标记免疫技术的一种。近年来标记免疫技术飞速发展,应用不同标记物,根据不同原理、不同技术建立起来的检测方法层出不穷,而方法的创建者往往给同类的方法以不同的名称。因此确知某一方法属于哪一类型,对该方法的正确理解有着重要意义。本节先叙述各种标记免疫技术的要点,然后介绍酶免疫技术的分类,这样可以对酶免疫技术和其他非酶的标记免疫技术的各种类型有一个总的概念。
一、标记的免疫技术
免疫技术是利用抗原抗体反应进行的检测方法,即应用制备好的特异性抗原或抗体作为试剂,以检测标本中的相应抗体或抗原。它的特点是具有高度的特异性和敏感性。如将试剂抗原或试剂抗体用可以微量检测的标记物(例如放射性核素、荧光素、酶等)进行标记,则在与标本中的相应抗体或抗原反应后,可以不必测定抗原抗体复合物本身,而测定复合物中的标记物,通过标记物的放大作用,进一步提高了免疫技术的敏感性。这种标记免疫技术一般分为两类,一类用于组织切片或其他标本中抗原或抗体的定位,另一类用于液体标本中抗原或抗体的测定。前者属于免疫组化技术(immunohistochemicaltechnique)范畴,后者则称为免疫测定(immunoassay)。
首先被用作标记免疫技术中标记物的是荧光素。1941 年 Coons 建立的荧光抗体技术(fluorescentantibodytechnique)使组织和细胞中抗原物质的定位成为可能。放射性核素作为标记物在免疫技术中的应用又开创了特异性的超微量测定。1956 年 Yalow 和 Berson 建立的放射免疫测定(radioimmunoassay,RIA)很快普遍应用于体液中的激素、微量蛋白及药物的测定。酶用作免疫技术标记物是从抗原定位开始的。1966 年 Nakene 和 Pierce 利用酶使底物显色的作用而得到与荧光抗体技术相似的结果。70 年代初,酶标抗体技术开始应用于免疫测定,其后得到迅速发展。
荧光抗体技术、放射免疫分析和酶免疫技术,即经典的三大标记技术,又可根据标记物是否为放射性物质分为放射性免疫测定和非放射性免疫测定两大类。后者消除了应用放射性物质在测定中带来的不便,受到使用者的欢迎,新的方法不断出现。化学发光免疫技术和金免疫技术等得到很大的发展。这些方法已普遍应用于临床检测验。
二、酶免疫技术的分类
酶免疫技术一般分成酶免疫组化技术和酶免疫测定两大类。酶免疫组化技术与荧光抗体技术相似,酶标记抗体与组织切片上的抗原起反应,然后与酶底物作用,形成有色沉淀物,可以在普通光学显微镜下观察。如酶作用的产物电子密度发生一定的改变,则可用电子显微镜观察,称为酶免疫电镜技术。
酶免疫测定根据抗原抗体反应后是否需要分离结合的与游离的酶标记物而分为均相(homogenous)和异相(heterogenous)两种类型,实际上所有的标记免疫测定均可分成这两类。如以标记抗体检测标本中的抗原为例,按照简单的形式是在试剂抗体过量的情况下进行,其反应式如下:
Ab*+Ag→Ab*Ag+Ab*
Ab*Ag 代表结合的标记物,Ab*为游离的标记物。如在抗原反应后,先把 Ab*Ag 与 Ab*分离,然后测定 Ab*Ag 或 Ab*中的标记物的量,从而推算出标本中的抗原量,这种方法称为异相法。如在抗原抗体反应后 Ab*Ag 中的标记物 * 失去其特性,例如酶失去其活力,荧光物质不显荧光,则不需要进行 Ab*Ag 与 Ab*的分离,可以直接测定游离的 Ab*量,从而推算出标本中的 Ag 含量,这种方法称为均相法。
在异相法中,抗原和抗体如在液体中反应,分离游离和结合的标记物的方法有好多种。与放射免疫测定相类似的液相异相酶免疫技测定,在某些激素等定量测定中也有应用。但常用的酶免疫测定法为固相酶免疫测定。其特点是将抗原或抗体制成固相制剂,这样在与标本中抗体或抗原反应后,只需经过固相的洗涤,就可以达到抗原抗体复合物与其他物质的分离,大大简化了操作步骤。这种被称为 ELISA 的检测技术成为目前临床检验中应用较广的免疫测定方法。
综上所述,酶免疫技术的分类可概括如图 15-1。
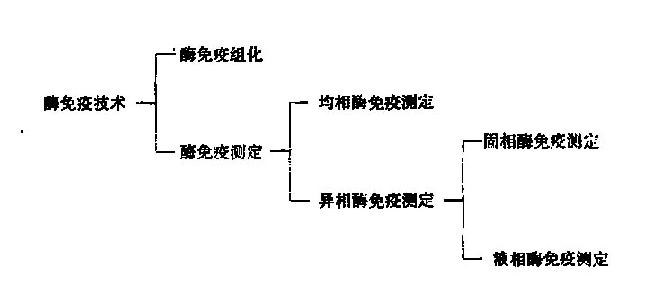
图 15- 1 酶免疫技术的分类
第二节 均相酶免疫测定
一、酶扩大免疫测定技术
酶扩大免疫测定技术是最早取得实际应用的均相酶免疫测定方法,是由美国 Syva 公司研究成功并定名的。此法主要检测小分子抗原或半抗原,在药物测定中取得较多应用。酶扩大免疫测定技术(enzyme-multipliedimmunoassaytechnique,EMIT)试剂盒的商标取名为 EMIT。
EMIT 的基本原理是半抗原与酶结合成酶标半抗原,保留半抗原和酶的活性(图 15-2B)。当酶标半抗原与抗体结合后,所标的酶与抗体密切接触,使酶的活性中心受影响而活性被抑制(图 15-2A)。EMIT 试剂盒中的主要试剂为:①抗体,②酶标半抗原,③酶的底物。检测对象为标本中的半抗原。当试剂①、②与标本混合后,标本中的半抗原与酶标的半抗原竞争性地与试剂中的抗体相结合。如标本中的半抗原量少,与抗体结合的酶标半抗原的比例增高,游离的具有酶活力的酶标半抗原的量就减少。因此在反应后酶活力大小一标本中的半抗原呈一定的比例,从酶活力的测定结果就可推算出标本中半抗原的量。
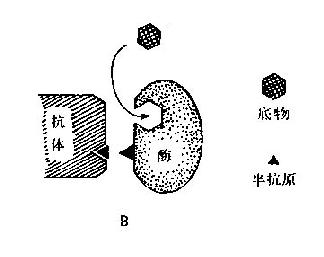
图 15-2EMIT 原理示意图
二、克隆酶供体免疫测定
利用重组 DNA 技术制备 β - 半糖苷酶的两个片段:大片段称为酶受体(enzymeacceptor,EA),小片段称为酶供体(enzymedonor,ED)。两个片段本身均不具酶活性,但在合适的条件下结合在一起就具有酶活性。利用这两相片段的特性建立的均相酶免疫测定称为克隆酶供体免疫测定(clonedenzymedonorimmunoassay,CEDIA)。CEDIA 的反应模式为竞争法,测定原理为:标本中的抗原和 ED 标记的抗原与特异性抗体竞争结合,形成两种抗原抗体复合物。ED 标记的抗原与抗体结合后由于空间位阻,不再能与 EA 结合。反应平衡后,剩余的 ED 标记抗原与 EA 结合,形成具有活性的酶(图 15-3)。加入底物测定酶活力,酶活力的大小与标本中抗原含量成正比。CEDIA 主要用于药物和小分子物质的测定。
图 15-3CEDIA 原理示意图
第三节 ELISA 的原理和类型
一、基本原理
1971 年 Engvall 和 Perlmann 发表了酶联免疫吸附剂测定(enzymelinkedimmunosorbentassay,ELISA)用于 IgG 定量测定的文章,使得 1966 年开始用于抗原定位的酶标抗体技术发展成液体标本中微量物质的测定方法。这一方法的基本原理是:①使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。②使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。加入酶反应的底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅刊物定性或定量分析。由于酶的催化频率很高,故可极大地地放大反应效果,从而使测定方法达到很高的敏感度。
二、方法类型和操作步骤
ELISA 可用于测定抗原,也可用于测定抗体。在这种测定方法中有 3 种必要的试剂:①固相的抗原或抗体,②酶标记的抗原或抗体,③酶作用的底物。根据试剂的来源和标本的性状以及检测的具备条件,可设计出各种不同类型的检测方法。
(一)双抗体夹心法
双抗体夹心法(图 15-4)是检测抗原最常用的方法,操作步骤如下:
图 15- 4 双抗体夹心法测抗原示意图
(1)将特异性抗体与固相载体连接,形成固相抗体:洗涤除去未结合的抗体及杂质。
(2)加受检标本:使之与固相抗体接触反应一段时间,让标本中的抗原与固相载体上的抗体结合,形成固相抗原复合物。洗涤除去其他未结合的物质。
(3)加酶标抗体:使固相免疫复合物上的抗原与酶标抗体结合。彻底洗涤未结合的酶标抗体。此时固相载体上带有的酶量与标本中受检物质的量正相关。
(4)加底物:夹心式复合物中的酶催化底物成为有色产物。根据颜色反应的程度进行该抗原的定性或定量。
根据同样原理,将大分子抗原分别制备固相抗原和酶标抗原结合物,即可用双抗原夹心法测定标本中的抗体。
(二)双位点一步法
在双抗体夹心法测定抗原时,如应用针对抗原分子上两个不同抗原决定簇的单克隆抗体分别作为固相抗体和酶标抗体,则在测定时可使标本的加入和酶标抗体的加入两步并作一步(图 15-5)。这种双位点一步不但简化了操作,缩短了反应时间,如应用高亲和力的单克隆抗体,测定的敏感性和特异性也显著提高。单克隆抗体的应用使测定抗原的 ELISA 提高到新水平。
图 15- 5 双位点一步法示意图
在一步法测定中,应注意钩状效应(hookeffect),类同于沉淀反应中抗原过剩的后带现象。当标本中待测抗原浓度相当高时,过量抗原分别和固相抗体及酶标抗体结合,而不再形成夹心复合物,所得结果将低于实际含量。钩状效应严重时甚至可出现假阴性结果。
(三)间接法测抗体
间接法(图 15-6)是检测抗体最常用的方法,其原理为利用酶标记的抗抗体以检测已与固相结合的受检抗体,故称为间接法。操作步骤如下:
(1)将特异性抗原与固相载体连接,形成固相抗原:洗涤除去未结合的抗原及杂质。
(2)加稀释的受检血清:其中的特异抗体与抗原结合,形成固相抗原抗体复合物。经洗涤后,固相载体上只留下特异性抗体。其他免疫球蛋白及血清中的杂质由于不能与固相抗原结合,在洗涤过程中被洗去。
(3)加酶标抗抗体:与固相复合物中的抗体结合,从而使该抗体间接地标记上酶。洗涤后,固相载体上的酶量就代表特异性抗体的量。例如欲测人对某种疾病的抗体,可用酶标羊抗人 IgG 抗体。
(4)加底物显色:颜色深度代表标本中受检抗体的量。
本法只要更换不同的固相抗原,可以用一种酶标抗抗体检测各种与抗原相应的抗体。
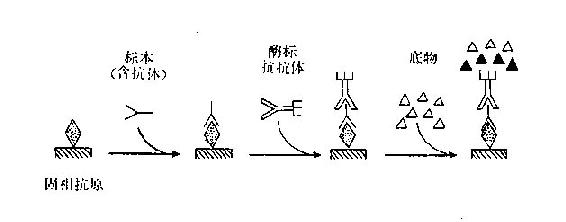
图 15- 6 间接法测抗体示意图
(四)竞争法
竞争法(图 15-7)可用于测定抗原,也可用于测定抗体。以测定抗原为例,受检抗原和酶标抗原竞争与固相抗体结合,因此结合于固相的酶标抗原量与受检抗原的量呈反比。操作步骤如下:
(1)将特异抗体与固相载体连接,形成固相抗体。洗涤。
(2)待测管中加受检标本和一定量酶标抗原的混合溶液,使之与固相抗体反应。如受检标本中无抗原,则酶标抗原能顺利地与固相抗体结合。如受检标本中含有抗原,则与酶标抗原以同样的机会与固相抗体结合,竞争性地占去了酶标抗原与固相载体结合的机会,使酶标抗原与固相载体的结合量减少。参考管中只加酶标抗原,保温后,酶标抗原与固相抗体的结合可达最充分的量。洗涤。
(3)加底物显色:参考管中由于结合的酶标抗原最多,故颜色最深。参考管颜色深度与待测管颜色深度之差,代表受检标本抗原的量。待测管颜色越淡,表示标本中抗原含量越多。
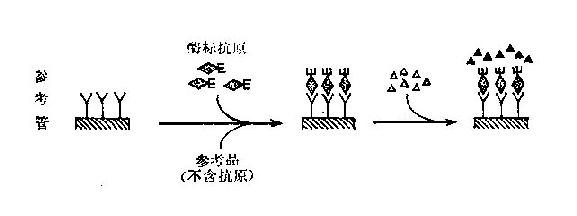
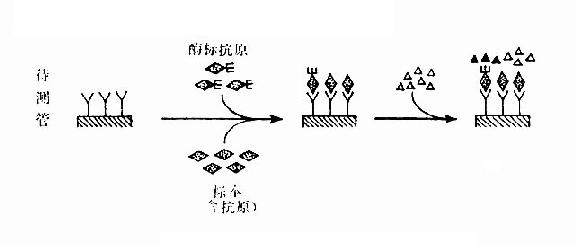
图 15- 7 竞争法测抗原示意图
(五)捕获法测 IgM 抗体
血清中针对某些抗原的特异性 IgM 常和特异性 IgG 同时存在,后者会干扰 IgM 抗体的测定。因此测定 IgM 抗本多用捕获法(图 15-8),先将所有血清 IgM(包括异性 IgM 和非特异性 IgM)固定在固相上,在去除 IgG 后再测定特异性 IgM。操作步骤如下:
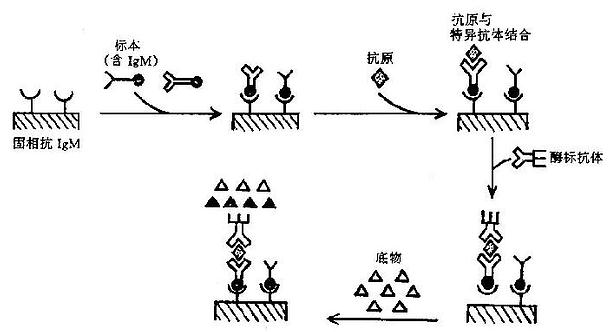
图 15- 8 捕获法测 IgM 抗体示意图
(1)将抗人 IgM 抗体连接在固相载体上,形成固相抗人 IgM。洗涤。
(2)加入稀释的血清标本:保温反应后血清中的 IgM 抗体被固相抗体捕获。洗涤除去其他免疫球蛋白和血清中的杂质成分。
(3)加入特异性抗原试剂:它只与固相上的特异性 IgM 结合。洗涤。
(4)加入针对特异性的酶标抗体:使之与结合在固相上的抗原反应结合。洗涤。
(5)加底物显色:如有颜色显示,则表示血清标本中的特异性 IgM 抗体存在,是为阳性反应。
(六)应用亲和素和生物素的 ELISA
亲和素是一种糖蛋白,可由蛋清中提取。分子量 60kD,每个分子由 4 个亚基组成,可以和 4 个生物素分子亲密结合。现在使用更多的是从链霉菌中提取的链霉和素(strepavidin)。生物素(biotin)又称维生素 H,分子量 244.31,存在于蛋黄中。用化学方法制成的衍生物,生物素-羟基琥珀亚胺酯(biotin-hydroxysuccinimide,BNHS)可与蛋白质、糖类和酶等多种类型的大小分子形成生物素化的产物。亲和素与生物素的结合,虽不属免疫反应,但特异性强,亲和力大,两者一经结合就极为稳定。由于 1 个亲和素分子有 4 个生物素分子的结合位置,可以连接更多的生物素化的分子,形成一种类似晶格的复合体。因此把亲和素和生物素与 ELIS 偶联起来,就可大提高 ELISA 的敏感度。
亲和素-生物素系统在 ELISA 中的应用有多种形式,可用于间接包被,亦可用于终反应放大。可以在固相上先预包被亲和素,原用吸附法包被固相的抗体或抗原与生物素结合,通过亲和素-生物素反应而使生物素化的抗体或抗在相化。这种包被法不仅可增加吸附的抗体或抗原量,而且使其结合点充分暴露。另外,在常规 ELISA 中的酶标抗体也可用生物素化的抗体替代,然后连接亲和素-酶结合物,以放大反应信号。桥联法 ABC-ELISA(avidinbiotincomplex-ELISA)夹心法测抗原的过程见图 15-9。
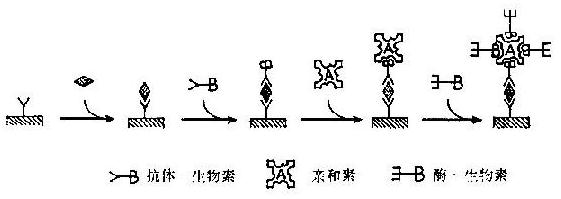
图 15- 9 桥连法 ABC-ELISA 夹心法测抗原示意图
第四节 ELISA 的技术要点
ELISA 的技术要点包括三个方面:试剂的制备、反应条件的选择和操作的标准化。
一、试剂的制备
ELISA 的主要试剂为固相的抗原或抗体、酶标记的抗原或抗体和与标记酶直接关联的酶反应底物。以下叙述这些试剂的原料和制备方法。
(一)固相载体
可作 ELISA 中载体的物质很多,最常用的是聚苯乙烯。聚苯乙烯具有较强的吸附蛋白质的性能,抗体或蛋白质抗原吸附其上后保留原来的免疫活性。聚苯乙烯为塑料,可制成各种形式。在 ELISA 测定过程中,它作为载体和容器,不参与化学反应。加之它的价格低廉,所以被普遍采用。
ELISA 载体的形状主要有三种:小试管、小珠和微量反应板。小试管的特点是还能兼作反应的容器,最后放入分光光度计中比色。小珠一般为直径 0.6cm 的圆球,表面经磨砂处理后吸附面积大增加。如用特殊的洗涤器,在洗涤过程中使圆珠滚动淋洗,效果更好。最常用的载体为微量反应板,专用于 ELISA 测定的产品也称为 ELISA 板,国际通用的标准板形是 8×12 的 96 孔式。为便于作少量标本的检测,有制成 8 联或 12 联孔条的,放入座架后,大小与标准 ELISA 板相同。ELISA 板的特点是可以同时进行大量标本的检测,并可在特定的比色计上迅速读出结果。现在已有多种自动化仪器用于微量反应板型的 ELISA 检测,包括加样、洗涤、保温、比色等步骤,对操作的标准化极为有利。
良好的 ELISA 板应该是吸附性能好,空白值低,孔底透明度高,各板之间和同一板各孔之间性能相近。聚苯乙烯 ELISA 板由于配料的不同和制作工艺的差别,各种产品的质量差异很大。因此每一批号的聚苯乙烯制品在使用前须检查其性能。常用的检查方法为:以一定浓度的人 IgG(一般为 10ng/ml)包被 ELISA 板各孔后,每孔内加入适当稀释的酶标抗人 IgG 抗人 IgG 抗体,保温后洗涤,加底物显色,终止酶反应后分别测每孔溶液的吸光度。控制反应条件,使各读数在 0.8 左右。计算所有读数的平均值。所有单个读数与平均读数之差应小于 10%。
与聚苯乙烯类似的塑料为聚氯乙烯。作为 ELISA 固相载体,聚氯乙烯板的特点为质软板薄,可切割,价廉、但光洁度不如聚苯乙烯板。聚氯乙烯对蛋白质的吸附性能比聚苯乙烯高,但空白值有时也略高。
为比较不同固相在某一 ELISA 测定中的优劣,可用以下方法加以检验:用其它免疫学测定方法选出一个典型的阳性标本和一个典型的阴性标本。将它们分别进行一系列稀释后,在不同的固相载体上按预定的 ELISA 操作步骤进行测定,然后比较测定结果。在哪一种载体上阳性结果与阴性结果判别最大,这种载体就是这一 ELISA 测定的最合适的固相载体。
除塑料制品外,固相酶免疫测定的载体还有两种材料:一是微孔滤膜,如硝酸纤维素膜、尼龙膜等,这类测定形式将在本章第五节“膜载体的酶免疫测定”中介绍。另一种载体是以含铁的磁性微粒制作的,反应时固相微粒悬浮在溶液中,具有液相反应的速率,反应结束后用磁铁吸引作为分离的手段,洗涤也十分方便,但需配备特殊的仪器。
(二)抗原和抗体
在 ELISA 实施过程中,抗原和抗体的质量是实验是否成功的关键因素。本法要求所用抗原纯度高,抗体效价高、亲和力强。
ELISA 所用抗原有三个来源:天然抗原、重组抗原和合成多肽抗原。天然抗原取材于动物组织或体液、微生物培养物等,一般含有多种抗原成分,需经纯化,提取出特定的抗原成分后才可应用,因此也称提纯抗原(purifiedantigen)。重组抗原(recombinantantigen)和多肽抗原(peptideantigen)均为人工合成品,使用安全,而且纯度高,干扰物质少。因此虽然制备合成抗原有较高的技术难度且要求较为昂贵的仪器设备和试剂,其应用仍十分普遍,特别是对那些天然抗原不易得到的试验,更显出其独到之处。
用于 ELISA 的抗体有多克隆的和单克隆的。抗血清成分复杂,应从中提取 IgG 才可用于包被固相或酶标记。含单克隆抗体的小鼠腹水中的特异性抗体含量较高,有时可适当稀释后直接进行包被。制备酶结合物用的抗体的质量往往要求有较高的纯度。经硫酸铵盐析纯化的 IgG 可进一步用各种分子筛层析提纯。也可用亲和层析法提纯特异性 IgG,如用酶消化 IgG 后提取的 Fab 片段,则效果更好。
(三)免疫吸附剂
固相的抗原或抗体称为免疫吸附剂。将抗原或抗体固相化的过程称为包被(coating)。由于载体的不同,包被的方法也不同。如以聚苯乙烯 ELISA 板为载体,通常将抗原或抗体溶于缓冲液(最常用的为 pH9.6 的碳酸缓冲液)中,加于 ELISA 板孔中在 4℃过夜,经清洗后即可应用。如果包被液中的蛋白质浓度过低,固相载体表面有能被此蛋白质完全覆盖,其后加入的血清标本和酶结合物中的蛋白质也会部分地吸附于固相载体表面,最后产生非特异性显色而导致本底偏高。在这种情况下,如在包被后再用 1%~5%牛血清白蛋白包被一次,可以消除这种干扰。这一过程称为封闭(blocking)。包被好的 ELISA 板在低温可放置一段时间而不失去其免疫活性。
(四)酶和底物
ELISA 中所用的酶要求纯度高、催化反应的转化率高、专一性强、性质稳定、来源丰富、价格不贵、制备成的酶标抗体或抗原性质稳定,继续保留着它的活性部分和催化能力。最好在受检标本中不存在与标记酶相同的酶。另外它的相应底物应易于制备和保存,价格低廉,有色产物易于测定,光吸收高。ELISA 中最常用的酶为辣根过氧化酶(HRP)和从牛肠粘膜或大肠杆菌提取的碱性磷酸酶(AP)。
HRP 在蔬菜作物辣根中含量很高,纯化方法也不复杂。它是一种糖蛋白,含糖量约 18%;分子量为 44kD;是一种复合酶,由主酶(酶蛋白)和辅基(亚铁血红素)结合而成的一种卟啉蛋白质。主酶为无色糖蛋白,在 275nm 波长处有最高吸收峰;辅基是深棕色的含铁卟啉环,在 403nm 波长处有最高吸收峰。HRP 催化下列反应:
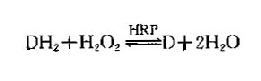
上式中 DH2为供氢体,H2O2 O 为受氢体。HRP 对受氢体的专一性很高,除 H 2O2外,仅作用于小分子醇的过氧化物和尿素的过氧化物。后者为固体,作为试剂较 H 2O2方便。许多化合物可作为 HRP 的供氧体,在 ELISA 中常用的供氢体底物为邻苯二胺(orthopenylenediamine,OPD)、四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)和 ABTS[2,2'-azino-bis(3-ethyl-benzthiazolinesulfonate-6)]。
OPD 为在 ELISA 中应用最多的底物,灵敏度高,比色方便。其缺点是配成应用液后稳定性差,而且具有致异变性。TMB 无此缺点。TMB 经酶作用后由无色变蓝色,目测对比鲜明;加酸停止酶反应后变黄色,可在比色计中定量;因此应用日见增多。ABTS,虽然灵敏度不如 OPD 和 TMB,但空白值很低。HRP 催化 OPD 的反应如下:
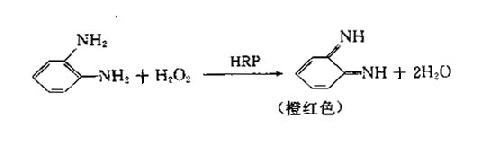
HRP 的纯度用 RZ(ReinheitZahl,意为纯度数)表示,是 403nm 的吸光度与 280nm 的吸光度之比,高纯度的 HRP 的 RZ≥3.0。应注意的是酶变性后,RZ 可不变而活力降低,故重用酶制剂时更重要的指标为活力。酶活力以单位表示:1min 将 1μmol 的底物转化为产物的酶量为 1 个单位。
在 ELISA 中另一常用的酶为碱性磷酸酶。从大肠杆菌提取的 AP 分子量为 80kD,酶作用的最适 pH 为 8.0;用小牛肠粘膜提取的 AP 分子量为 100kD,最适 pH 为 9.6。一般采用对硝基苯磷酸酯(p-nitrophenylphosphate,p-NPP)作为底物。它可制成片状试剂,使用方便。产物为黄色的对硝基酚,在 405nm 有吸收峰。用 NaOH 终止酶反应后,黄色可稳定一段时间。反应式如下:
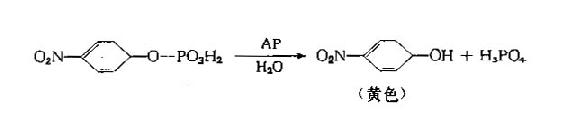
在 ELISA 中应用 AP 系统,其敏感性一般高于应用 HRP 系统,空白值也较低。但由于 AP 较难得到高纯度制剂,稳定性较 HRP 低,价格较 HRP 高,制备酶结合物时得率较 HRP 低等原因,国内在 ELISA 中一般均采用 HRP。
除 HRP 和 AP 以外,在商品 ELISA 试剂中应用的酶尚有葡萄糖氧化酶、β- 半乳糖苷酶和脲酶等。β- 半乳糖苷酸的底物常用 4 - 甲基伞基 -β- D 半乳糖苷(4-mehtyumbelliferyl-β-D-galactoside),经酶水解后产生荧光物质 4 - 甲基伞酮(4-mehtylumbelliferone),可用荧光计检测。荧光的放大作用大大提高了方法的敏感度。AP 也可应用可产生荧光的伞基磷酸酯作底物。其缺点是需要荧光计测定,而且如用固相载体直接作为测定容器,此载体不可发出荧光。脲酶的特点是酶作用后反应液发生 pH 改变,可使指示剂变色;另外,在人体内没有内源酶(酶的化学发光底物见第十八章)。
(五)结合物
酶标记的抗原或抗体称为结合物(conjugate)。抗原由于化学结构不同,可用不同的方法与酶结合。如为蛋白质抗原,基本上可参考抗体酶标记的方法。制备抗体酶结合物的方法通常有以下几种。
1.戊二醛交联法戊二醛是一种双功能团试剂,可以使酶与蛋白质或其他抗原的氨基通过它而偶联。戊二醛交联可用一步法(如连接 AP),也可用二步法(如连接 HRP)。举例如下:
2~5mg 纯抗体与 5mgAP 混合于 0.1mol/LpH6.8 的磷酸缓冲液 1ml 中,4℃下对同上缓冲液透析平衡。磁力搅拌下,缓慢加入 1%戊二醛 0.05ml,在室温下放置 2 小时。在 4℃下对 0.05mol/LpH8.0Tris 缓冲液透析平衡,即得酶标抗体。
辣根过氧化物酶可溶解于 50%饱和度硫酸铵中。用上法交联后可用 50%饱和度硫酸铵沉淀酶标抗体,弃去上清中游离酶。
戊二醛一步法操作简便、有效,而且重复性好。缺点是交联时分子间的比例不严格,大小也不一,影响效果。
制备 HRP 抗体结合物也可用二步法,即先将 HRP 与戊二醛作用,透析除去戊二醛,在 pH9.5 缓冲液中再与抗体作用而形成酶标抗体。此法的效率可高于一步法 10 倍左右。
2.过碘酸盐氧化法本法只用于 HRP 的交联。该酶含 18%碳水化合物,过碘酸盐将其分子表面的多糖氧化为醛基。用硼氢化钠(NaBH4)中和多余的过碘酸。酶上的醛根很活泼,可与蛋白质结合,形成按摩尔比例结合的酶标结合物。有人认为此法为辣根过氧化物酶交联最有效的方法。但也有只认为由于所用试剂较为剧烈,各批实验结果不易重复。
按以上方法制备的结合物一般混有未结合的酶和抗体。理论上结合物中混有游离酶不影响 ELISA 中最后的酶活性测定,因经过洗涤,非特异性吸附于固相上的游离酶已被洗去。但游离的抗体则会与酶标抗体竞争相应的固相抗原,因而减低结合到固相上的酶标抗体量。因此制备的结合物应予以纯化。纯化的方法较多,分离大分子混合物的方法均可应用。硫酸铵盐析法操作简便,但效果不如用 SephadexG-200 凝胶过滤的好。
二、最适工作浓度的选择
在建立某一 ELISA 测定中,应对包被抗原或抗体的浓度和酶标抗原或抗体的浓度予以选择,以达到最合适的测定条件和节省测定费用。下面以间接法测抗体和夹心法测抗原为例,介绍最适工作浓度的选择方法。
(一)间接法测抗体
1.酶标抗抗体工作浓度的选择
(1)用 100ng/ml 人 IgG 进行包被,洗涤。
(2)将酶标抗人 IgG 用稀释液作一系列稀释后分别加入已包被的孔中,保温、洗涤。
(3)加底物显色。加酸终止反应后,读取吸亮度(A),绘制曲线如图 15-10。读取 A 值在 1.0 时的酶标抗体稀释度,作为酶标抗体的工作浓度。该酶标抗人 IgG 的工作浓度应为 1 /1600。
2.棋盘滴定法选择包被抗原工作浓度
(1)用包被液将抗原作一系列稀释后进行包被,洗涤。
(2)将强阳性参考血清、弱阳性参考血清和阴性参考血清用稀释液作 1:100 稀释,加样,保温,洗涤。
(3)加按工作浓度稀释的酶标抗人 IgG 抗体,保温,洗涤。
(4)加底物显色。加酸终止反应后读取 A 值。
(5)选择强阳性参考血清的 A 值为 0.8 左右、阴性参考血清的 A 值小于 0.1 的包被抗的的稀释度作为工作浓度。表 15- 1 为本例的测定结果,表中数字为 A 值。从表中可见 1:200 为最舒适的工作浓度。
表 15-1 间接 ELISA 法包被抗原工作浓度的选择
| 各类血清 | 抗原稀释度 | ||||
| 1:50 | 1:100 | 1:200 | 1:400 | 1:800 | |
| 强阳性 | 1.20 | 1.04 | 0.84 | 0.68 | 0.42 |
| 弱阳性 | 0.64 | 0.41 | 0.30 | 0.22 | 0.19 |
| 阴性 | 0.23 | 0.13 | 0.08 | 0.66 | 0.05 |
| 稀释液 | 0.09 | 0.02 | 0.02 | 0.02 | 0.04 |
(二)夹心法测抗原
在夹心法 ELISA 法中可用棋盘滴定法同时选择包被抗体和酶标抗体的工作浓度,举例如下(表 15-2):
表 15-2 夹心 ELISA 包被抗体和酶标抗体工作浓度的选择
| 包被抗体的浓度及酶标抗体稀释度 | 参考抗原 | ||
| 强阳性(25ng/ml) | 弱阳性(1.5ng/ml) | 阴性 | |
| 10μg/ml | |||
| 1:1000 | 1.17 | 0.15 | 0.09 |
| 1:5000 | 0.46 | 0.03 | |
| 1:25000 | 0.12 | ||
| 1μg/ml | |||
| 1:1000 | >2 | 0.25 | 0.10 |
| 1:5000 | 0.91 | 0.12 | 0.01 |
| 1:25000 | 0.25 | 0.01 | |
| 0.1μg/ml | |||
| 1:1000 | 0.42 | 0.13 | 0.13 |
| 1:5000 | 0.11 | 0.03 | 0.02 |
| 1:25000 | 0.03 | ||
(1)抗体免疫球蛋白用包被缓冲液稀释至蛋白浓度为 10、1 和 0.1μg/ml,分别在 ELISA 板上进行包被,每一浓度包括三个纵行,洗涤。
(2)在一个横行各包被孔中加入强阳性抗原液,另一横行加入弱阳性抗原液,第三横行加入阴性对照液,保温,洗涤。
(3)将酶标抗体用稀释液稀释成三个浓度,例如 1:1000、1:5000 和 1:25000。分别加入每一包被浓度的一个纵行中,保温,洗涤。
(4)加底物显色。加酸终止反应后,读取 A 值。
(5)以强阳性抗原的 A 值在 0.8 左右、阴性参考的 A 值小于 0.1 的条件作最适条件,据此选择包被抗体和酶标抗体的工作浓度。从表 15- 2 可看出包被抗体浓度可选用 1μg/ml,酶标抗体的稀释度可选为 1:5000。为了进一步节省试剂,可以此浓度为基点,缩小间距再做进一步的棋盘滴定。
三、测定方法的标准化
要使 ELISA 测定得到准确的结果,不论是定性的还是定量的,必须严格按照规定的方法制备试剂和实施测定。主要试剂的制备要点已如前述,其他一般性试剂,如包被缓冲液、洗涤液、标本稀释液、结合物稀释液、底物工作液和酶反应终止液等,配制时不可掉以轻心。缓冲液可于冰箱中短期保存,使用前应观察是否变质。蒸馏水的质量在 ELISA 中也至关重要,最好使用新鲜重蒸馏的。不合格的蒸馏水可使空白值升高。
测定的实施中,应力求各个步骤操作的标准化,下面以板式 ELISA 为例,介绍有关注意事项。
(一)加样
在 ELISA 中除了包被外,一般需进行 45 加样。在定性测定中有时不强调加样量的准确性,例如规定为加样一滴。此时应该使用相同口径的滴管,保持准确的加样姿势,使每滴液体的体积基本相同。在定量测定中则加样量应力求准确。标本和结合物的稀释液应按规定配制。加样时应将液体加在孔底,避免加在孔壁上部,并注意不可出现气泡。
(二)保温
在 ELISA 中一般有二次抗原抗体反应,即加标本后和加结合物后,此时反应的温度和时间应按规定的要求,保温容器最好是水浴箱,可使温度迅速平衡。各 ELISA 板不应叠在一起。为避免蒸发,板上应加盖,或将板平放在底部垫有湿纱布的湿盒中。湿盒应该是金属的,传热容易。如用保温箱,空湿盒应预先放在其中,以平衡温度,这在室温较低时更为重要。加入底物后,反应的时间和温度通常不做严格要求。如室温高于 20℃,ELISA 板可避光放在实验台上,以便不时观察,待对照管显色适当时,即可终止酶反应。
(三)洗涤
洗涤在 ELISA 过程中不是反应聚,但却是决定实验成败的关键。洗涤的目的是洗去反应液中没有与固相抗原或抗体结合的物质以及在反应过程中非特异性吸附于固相载体的干扰物质。聚苯乙烯待塑料对蛋白质的吸附作用是普遍性的。因此在 ELISA 测定的反应过程中应尽量避免非特异性吸附,而在洗涤时又应把这种非特异性吸附的干扰物质洗涤下来。在标本和结合物的稀释液和洗涤液中加入聚山梨酯(吐温,Tween)一类物质即右达到此目的。聚山梨酯是聚氧乙烯去水山梨醇脂肪酸酯,为非离子型的表面张力物质,常作为助溶剂。根据脂肪酸的种类而对聚山梨酯编号,结合月桂酸的为聚山梨酯 20,在 ELISA 中最为常用。它的洗涤效果好,并具有减少非特异性吸附和增强抗原抗体结合的作用。
洗涤如不彻底,特别在最后一次,如有酶结合物的非特异性吸附,将使空白值升高。另外,在间接法中如血清标本内的非特异性 IgG 吸附在固相上而未被洗净,也将与酶标抗体作用而产生干扰。
ELISA 板的洗涤一般可采用以下方法:①吸干孔内反应液;②将洗涤液注满板孔;③放置 2min,略作摇动;④吸干孔内液,也可倾去液体后在吸水纸上拍干。洗涤的次数一般为 3~4 次,有时甚至需洗 5~6 次。
(四)比色
如阴性对照颜色极浅,在定性测定中一般可采用目视比色。如用比色计测定结果,准确性决定于 ELISA 板底的平整与透明度和比色计的质量。
第五节 膜载体的酶免疫测定
一、斑点 -ELISA
斑点 -ELISA(dot-ELISA)的特点时:①以吸附蛋白质能力很强的硝酸纤维素膜为固相载体;②底物经酶反应后形成有色沉淀,使固相膜染色。在实验室中斑点 -ELISA 可按下法进行。在硝酸纤维膜上用铅笔划成 4mm×4mm 的小格,在每格中央点加抗原 1~2μl,成为一个小点。干燥后将每格剪下分别放入 ELISA 板孔中,按 ELISA 方法操作,最后加入能形成不溶性有色沉淀的底物,如在膜上出现染色斑点,即为阳性反应(图 15-11)。因硝酸纤维素膜吸附性能强,一般在包被后须再进行封闭。如将硝酸纤维素膜裁剪成膜条,并在同一张膜条上点有多种抗原,将整个膜条与同一份血清反应,则可同时获得对多种疾病的诊断结果。斑点 -ELISA 的缺点是操作麻烦,特别是洗涤的操作很不方便。
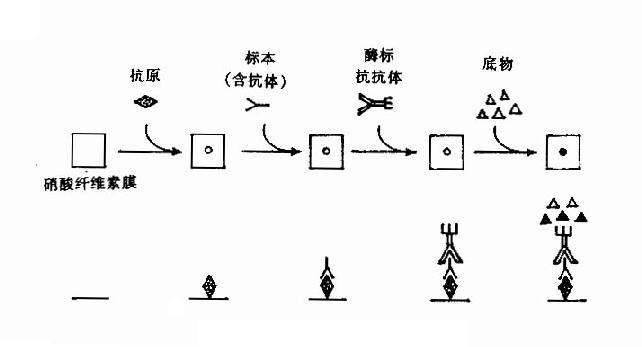
图 15-11 斑点 -ELISA 示意图
应用斑点 -ELISA 的原理,通过特殊工艺已制备出各种试剂,供临床检验用。一般分三种类型:①将试剂膜粘贴在塑料条片,便于洗涤和观察。②将试剂膜封在小盒内,膜下垫吸水剂,洗涤液通过膜吸入盒内。此即斑点免疫渗滤试验(见第十九章)。③将试剂膜固定在小杠框格中放入特殊的自动分析仪中检测。应用这一系统可做各种蛋白质、激素、药物和抗生素的定量测定。
二、免疫印迹法
免疫印迹法(immunoblottingtest,IBT)亦称酶联免疫电转移印斑法(enzymelinkedimmunoelectrotransferblot,EITB),因与 Southern 早先建立的检测核酸的印迹方法 Southernblot 相类似,亦被称为 Westernblot。免疫印迹法(图 15-12)分三个阶段进行。第一阶段为 SDS- 聚丙烯酰胺凝胶电泳(SDS-PAGE)。抗原等蛋白样品经 SDS 处理后带阴电荷,在聚丙烯胺凝胶中从阴极向阳泳动,分子量越小,泳动速度就越快。此阶段分离效果肉眼不可见(只有在染色后才显出电泳区带)。第二阶段为电转移。将在凝胶中已经分离的条带转移至硝酸纤维素膜上,选用低电压(100V)和大电流(1~2A),通电 45min 转移即可完成。此分阶段分离的蛋白质条带肉眼仍不可见。第三阶段为酶免疫定位。将印有蛋白质条带的硝酸纤维素膜(相当于包被了抗原的固相载体)依次与特异性抗体和酶标第二抗体作用后,加入能形成不溶性显色物的酶反应底物,使区带染色。常用的 HRP 底物为 3,3'- 二氨基联苯胺(呈棕色)和 4 - 氯 -1- 萘酚(呈蓝紫色)。阳性反应的条带清晰可辨,并可根据 SDA-PAGE 加入的分子量标准,确定各组分的分子量。本法综合了 SDS-PAGE 的高分辨力和 ELISA 法的高特异性和敏感性,是一个有效的分析手段,不仅广泛应用于分析抗原组分及其免疫活性,并可用于疾病的诊断。在艾滋病病毒感染中此法作为确诊试验。抗原经电泳转移在硝酸纤维素膜上后,将膜切成小条,配合酶标抗体及显色底物制成的试剂盒可方便地在实验室中供检测用。根据出现显色线条的位置可判断有无针对病毒的特异性抗体。
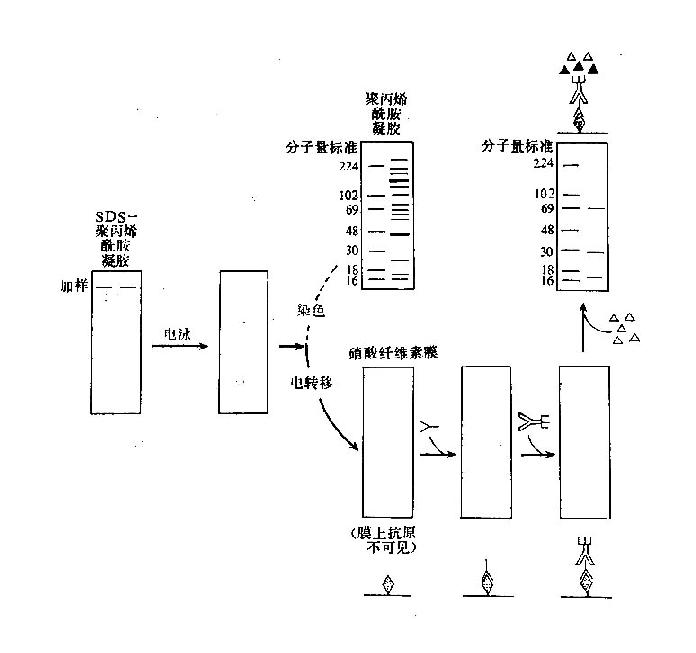
图 15-12 免疫印迹法原理示意图
三、重组免疫结合试验
重组免疫结合试验(recombinantimmunlbindingassay,RIBA)是与免疫印迹法的方法,不同之处在于特异性抗原不通过电泳分离转印,而是直接分条加在固相膜上。RIBA 已用于血清抗 HCV 抗体的测定和分析。HCV 抗原成分复杂,包括有特异性的非结构区抗原、结构区抗原、核心抗原和非特异性的 G 抗原。在 ELISA 中一般使用混合抗原包被,检测到的血清抗体是综合性的。RIBA 将各种抗原成分以横线条式分别吸附在硝酸纤维素膜的膜条上,放于特制的长条凹槽反应盘中与标本(一抗)和酶标二抗温育和洗涤,最终加底物显色后,显色条带提示血清中存在有针对这一吸附抗原的特异性抗体。根据条带的粗细和显色深浅,还可粗略估计抗体效价。
RIBA 十分适合于含复杂抗原成分的病原体抗体的分析,除抗 HCV 外,也成功地用于抗 HIV 抗本的测定。
第六节 酶免疫测定的应用
酶免疫测定具有高度的敏感性和特异性,几乎所有的可溶性抗原抗体系统均可用以检测。它的最小可测值达 ng 甚至 pg 水平。与放射免疫分析相比,酶免疫测定的优点是标记试剂比较稳定,且无放射性危害。因此,酶免疫测定的应用日新月异,酶免疫测定的新方法、新技术不断发展。但酶免疫测定在医学检验中的普及应归功于商品试剂盒和自动或半自动检测仪器的问世。酶免疫测定步骤复杂,试剂制备困难。只有用符合要求的试剂和标准化的操作,才能获得满意的结果。
商品 ELISA 试剂盒中应包含包被好的固相载体、酶结合物底物和洗涤液等。先进的试剂盒不仅提供全部试剂成分,而且所有试剂均已配制成应用液,并在各种试剂中加色素,使之呈现不同的颜色。ELISA 操作步骤多,所需试剂也多,这种有色试剂既方便操作又有利于减少操作错误。ELISA 所有仪器除定量测定中必需的出色仪(专用的称为 ELISA 测读仪)外,洗涤板也极有用。洗涤机的使用不仅省时省工,而且也利于操作标准化,对中小型实验室是实用且易于接受的。但应注意在采用洗板机前,应先对洗板机的性能加以检定,确认各孔的洗涤效果是否彻底,且重复性好。
半自动和自动化 ELISA 分析仪亦趋成熟,并在大中型临床检验实验室中取得应用。自动化 ELISA 分析仪有开放系统(opensystem)和封闭系统 (closesystem) 两类。前者适用于所有的 96 孔板的 ELISA 测定;后者只与特定试剂配套使用。
均相酶免疫测定主要用于药物和小分子物质的检测。ELISA 则应用更为广泛,可用以检测的项目包括以下几个方面:
1.病原体及其抗体广泛应用于传染病的诊断。病毒肝炎病毒、风疹病毒、疱疹病毒、轮状病毒等;细菌如链球菌、结核分枝杆菌、幽门螺杆菌和布氏杆菌等;寄生虫如弓形体、阿米巴、疟原虫等。
2.蛋白质各种免疫球蛋白、补体组分、肿瘤标志物(例如甲胎蛋白、癌胚抗原、前列腺特异性抗原等)、各种血浆蛋白质、同工酶(如肌酸激酸 MB)、激素(如 HGG、FSH、TSH)。
3.非肽类激素如 T3、T4、雌激素、皮质醇等。
4.药物和毒品如地高辛、苯巴比妥、庆大霉素、吗啡等。
第十六章 放射免疫分析
放射免疫分析(radioimmunoassay,RIA)是以放射性核素为标记物的标记免疫分析法,用于定量测定受检标本中的抗原。最初建立的方法模式是以核素标记的抗原与受检标本中抗原竞争的测定模式,为区别于前者,称为免疫放射分析(immunoradiometricassay,IRMA)。两种方法均在医学检验中得到了广泛应用。
第一节 放射免疫分析
放射免疫分析是由 Yalow 和 Berson 于 1960 年创建的标记免疫分析技术。由于标记物放射性核素的检测灵敏性,本法的灵敏度高达 ng 甚至 pg 水平。测定的准确性良好,ng 量的回收率接近 100%。本法特别适用于微量蛋白质、激素和多肽的定量测定。
一、基本原理
放射免疫分析的基本原理是标记抗原(Ag*)和非标记抗原(Ag)对特异性抗体(Ab)的竞争结合反应。它的反应式为:
在这一反应系统中,作为试剂的标记抗原和抗体的量是固定的。抗体的量一般取用能结合 40%~50%的标记抗原,而受检标本中的非标记抗原是变化的。根据标本中抗原量的不同,得到不同的反应结果。
假设受检标本中不含抗原时的反应条件为:
4(Ag*)+2(Ab)→2(Ag*Ab)+2(Ag*)(2)
在标本中存在抗原时,举例如下:
4(Ag*)+4(Ag)+(2Ab)→
1(Ag*Ab)+3(Ag*)+1(AgAb)+3(Ag)(3)
当标记抗原、非标记抗原和特异性抗体三者同时存在于一个反应系统时,由于标记抗原和非标记抗原对特异性抗体具有相同的结合力,因此两者相互竞争结合特异性抗体。由于标记抗原与特异性抗体的量是固定的,故标记抗原抗体复合物形成的量就随着非标记抗原的量而改变。非标记抗原量增加,相应地结合较多的抗体,从而抑制标记抗原对抗体的结合,使标记抗原抗体复合物相应减少,游离的标记抗原相应增加,亦即抗原抗体复合物中的放射性强度与受检标本中抗原的浓度呈反比(图 16-1)。若将抗原抗体复合物与游离标记抗原分开,分别测定其放射性强度,就可算性结合态的标记抗原(B)与游离态的标记抗原(F)的比值(B/F),或算出其结合率[B/(B+F)],这与标本中的抗量呈函数关系。用一系列不同剂量的标准抗原进行反应,计算相应的 B /F,可以绘制出一条剂量反应曲线(图 16-2)。受检标本在同样条件下进行测定,计算 B / F 值,即可在剂量反应曲线上查出标本中抗原的含量。
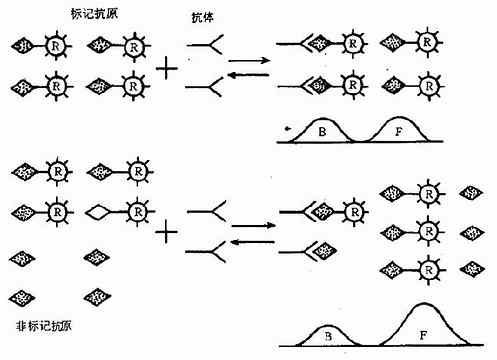
图 16-1 放射免疫分析原理示意图
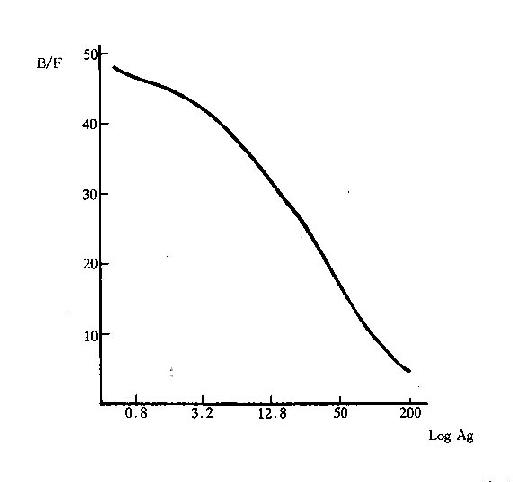
图 16-2 剂量反应曲线
(一)标记物
标记用的核素有放射 γ 射线和 β 射线两大类。前者主要为131I、125I、57Cr 和60Co;后者有14C、3 H 和32P。放射性核素的选择首先考虑比活性。例如125 I 比活性的理论值是 64.38×104GBq/g(1.74×104Ci/g),有较长半衰期的14 C 最大比活性是 166.5GBq/g(4.5Ci/g)。两者相比,1mol125 I 或14 C 结合到抗原上,125 I 的敏感度约比14 C 大 3900 倍。又因为125 I 有合适的半衰期,低能量的 γ 射线易于标记,因而125 I 是目前常用的 RIA 标记物。
(二)标记方法
标记125 I 的方法可分两大类,即直接标记法和间接标记法。
直接标记法是将125 I 直接结合于蛋白质侧链残基的酪氨酸上。此法优点是操作简便,为125 I 和蛋白质的单一步骤的结合反应,它能使较多的125 I 结合在蛋白质上,故标记物具有高度比放射性。但此法只能用于标记含酪氨酸的化合物。此外,含酪氨酸的残基如具有蛋白质的特异性和生物活性,则该活性易因标记而受损伤。
间接标记法(又称连接法)是以125 I 标记在载体上,纯化后再与蛋白质结合。由于操作较复杂,标记蛋白质的比放射性显著低于直接法。但此法可标记缺乏酪氨酸的肽类及某些蛋白质。如直接法标记引起蛋白质酪氨酸结构改变而损伤其免疫及生物活性时,也可采用间接法。它的标记反应较为温和,可以避免因蛋白质直接加入125 I 液引起的生物活性的丧失。下面介绍最常用的氯胺 T 直接标记法。
氯胺 T 是对甲苯磺基酰胺的 N - 氯衍生物的钠盐,在水溶液中逐渐分解形成次氯酸,是一种氧化剂。在偏碱溶液中(pH7.5),氯胺 T 将 125 I 的 I - 氧化为 I +,I+取代蛋白质酪氨酸苯环的氢,形成二碘酪氨酸。反应式如下:
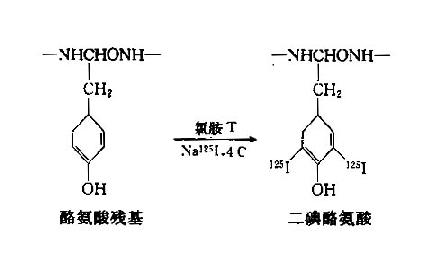
放射性碘标记率的高低与抗原(蛋白质或多肽)分子中酪氨酸的含量及分子中酪氨酸的暴露程度有关,当分子中含有较多的酪氨酸,又暴露在外时,则标记率就高。
标记方法:将纯化抗原和125 I 加入小试管底部,然后将新鲜配制的氯胺 T 快速冲入,混匀振荡数十秒~2min 后加入偏重亚硫酸钠终止反应。再加入 KI 溶液稀释。然后在葡聚糖 G 柱上分离,逐管收集。分别用井型闪烁计数器测定放射性强度(脉冲数 /min,cpm),前部为标记抗原峰,后部为游离125 I 峰。在标记抗原峰试管内加等量 1%白蛋白作稳定剂,此即为标记抗原液。
(三)标记物的鉴定
1.放射性游离碘的含量用三氯醋酸(预先在受鉴定样品中加入牛血清白蛋白)将所有蛋白质沉淀,分别测定沉淀物和上清液的 cpm 值。一般要求游离碘在总放射性碘的 5%以下。标记抗原在贮存过久后,会出现标记物的脱碘,如游离碘超过 5%则应重新纯化去除这部分游离碘。
2.免疫活性标记时总有部分抗原活性损失,但应尽量避免。检查方法是用小量的标记抗原加过量的抗体,反应后分离 B 和 F,分别测定放射性,算出 BT%。此值应在 80%以上,该值越大,表示抗原损伤越少。
3.放射性比度标记抗原必须有足够的放射性比度。比度或比放射性是指单位重量抗原的放射强度。标记抗原的比放射性用 mCi/mg(或 mCi/mmol)表示。比度越高,测定越敏感。标记抗原的比度计算是根据放射性碘的利用率(或标记率):

如:5μghGH 用 2mCiNa125 I 进行标记,标记率为 40%,则
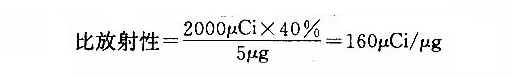
(四)抗血清的检定
含有特异性抗体的抗血清是放射免疫分析的主要试剂,常以抗原免疫小动物诱发产生多克隆抗体而得。抗血清的质量直接影响分析的灵敏度和特异性。抗血清质量的指标主要有亲和常数、交叉反应率和滴度。
1.亲和常数亲和常数(affinityconstant)常用 K 值表示。它反映抗体与相应抗原的结合能力。K 值的单位为 mol/L,即表示 1mol 抗体稀释至若干 L 溶液中时,与相应的抗原结合率达到 50%。抗血清 K 值越大,放射免疫分析的灵敏度、精密和准确度越佳。抗血清的 K 值达到 109~1012mol/ L 才适合用于放射免疫分析。
2.交叉反应率放射免疫分析测定的物质有些具有极为类似的结构,例如甲状腺素的 T3、T4,雌激素中的雌二醇、雌三醇等。针对一种抗原的抗血清往往对于其类似物会发生交叉反应。因此交叉反应率反映抗血清的特异性,交叉反应率过大将影响分析方法的准确性。交叉反应率的测定方法为用与抗血清相应抗原及其类似物用同法进行测定,观察置换零标准管 50%时的量。以 T3 抗血清为例,置换零标准 50%T3 为 1ng,其类似物 T4 则需 200ng,则其交叉反应率为:1/200=0.5%。
3.滴度滴度系指将血清稀释时能与抗原发生反应的最高稀释度。它反映抗血清中有效抗体的浓度。在放射免疫分析中滴度为在无受检抗原存在时,结合 50%标记抗原时抗血清的稀释度。
二、测定方法
用放射免疫分析进行测定时分三个步骤,即抗原抗体的竞争抑制反应、B 和 F 的分离及放射性的测量。
(一)抗原抗体反应
将抗原(标准品和受检标本)、标记抗原和抗血清按顺序定量加入小试管中,在一定的温度下进行反应一定时间,使竞争抑制反应达到平衡。不同质量的抗体和不同含量的抗原对温育的温度和时间有不同的要求。如受检标本抗原含量较高,抗血清的亲和常数较大,可选择较高的温度(15~37℃)进行较短时间的温育,反之应在低温(4℃)作较长时间的温育,形成的抗原抗体复合物较为牢固。
(二)B、F 分离技术
在 RIA 反应中,标记抗原和特异性抗体的含量极微,形成的标记抗原抗体复合物(B)不能自行沉淀,因此需用一种合适的沉淀剂使它彻底沉淀,以完成与游离标记抗原(F)的分离。另外对小分子量的抗原也可采取吸附法使 B 与 F 分离。
1.第二抗体沉淀法这是 RIA 中最常用的一种沉淀方法。将产生特异性抗体(第一抗体)的动物(例如兔)的 IgG 免疫另一种动物(例如羊),制得羊抗兔 IgG 血清(第二抗体)。由于在本反应系统中采用第一、第二两种抗体,故称为双抗体法。在抗原与特异性抗体反应后加入第二抗体,形成由抗原-第一抗体-第二抗体组成的双抗体复合物。但因第一抗体浓度甚低,其复合物亦极少,无法进行离心分离,为此在分离时加入一定量的与一抗同种动物的血清或 IgG,使之与第二抗体形成可见的沉淀物,与上述抗原的双抗体复合物形成共沉淀。经离心即可使含有结合态抗原(B)的沉淀物沉淀,与上清液中的游离标记抗原(F)分离。
将第二抗体结合在颗粒状的固相载体之上即成为固相第二抗体。利用固相第二抗体分离 B、F,操作简便、快速。
2.聚乙二醇(PEG)沉淀法最近各种 RIA 反应系统逐渐采用了 PEG 溶液代替第二抗体作沉淀剂。PEG 沉淀剂的主要优点是制备方便,沉淀完全。缺点是非常特异性结合率比用第二抗体为高,且温度高于 30℃时沉淀物容易复溶。
3.PR 试剂法是一种将双抗体与 PEG 二法相结合的方法。此法保持了两者的优点,节省了两者的用量,而且分离快速、简便。
4.活性炭吸附法小分子游离抗原或半抗原被活性炭吸附,大分子复合物留在溶液中。如在活性炭表面涂上一层葡聚糖,使它表面具有一定孔径的网眼,效果更好。在抗原与特异性抗体反应后,加入葡聚糖-活性炭。放置 5~10min,使游离抗原吸附在活性炭颗粒上,离心使颗粒沉淀,上清液中含有结合的标记抗原。此法适用于测定类固醇激素,强心糖苷和各种药物,因为它们是相对非极性的,又比抗原抗体复合物小,易被活性炭吸附。
(三)放射性强度的测定
B、F 分离后,即可进行放射性强度测定。测量仪器有两类,液体闪烁计数仪(β 射线,如3H、32P、14 C 等)和晶体闪烁计数仪(β 射线,如125、131I、57Cr 等)。
计数单位是探测器输出的电脉冲数,单位为 cpm(计数 / 分),也可用 cps(计数 / 秒)表示。如果知道这个测量系统的效率,还可算出放射源的强度,即 dpm(衰变 / 分)或 dps(衰变 / 秒)。
每次测定均需作标准曲线图,以标准抗原的不同浓度为横坐标,以在测定中得到的相应放射性强度为纵坐标作图(图 16-3)。放射性强度可任选 B 或 F,亦可用计算值 B /(B+F)、B/ F 和 B /B。标本应作双份测定,取其平均值,在制作的标准曲线图上查出相应的受检抗原浓度。
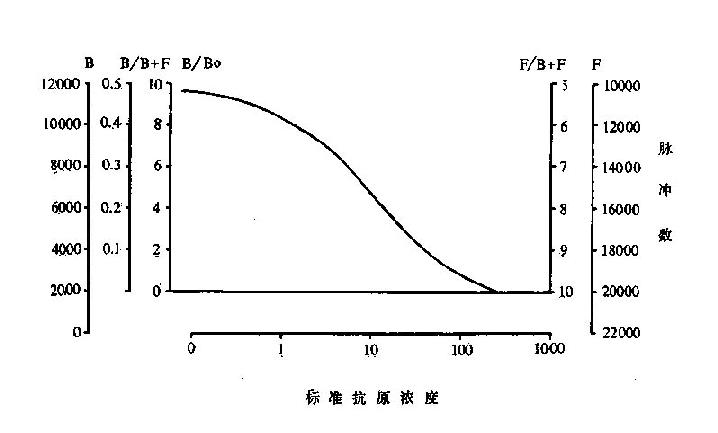
图 16-3 放射免疫分析标准曲线示例
第二节 免疫放射分析
免疫放射分析(IRMA)是从放射免疫分析(RIA)的基础上发展起来的核素标记免疫测定,其特点为用核素标记的抗体直接与受检抗原反应并用固相免疫吸附剂作为 B 或 F 的分离手段。IRMA 于 1968 年由 Miles 和 Heles 改进为双位免疫结合,在免疫检验中取得了广泛应用。
一、基本原理
IRMA 属固相免疫标记测定,其原理与 ELISA 极为相似,不同点主要为标记物为核素及最后检测的为放射性量。单位点 IRMA 的反应模式如图 16-4。
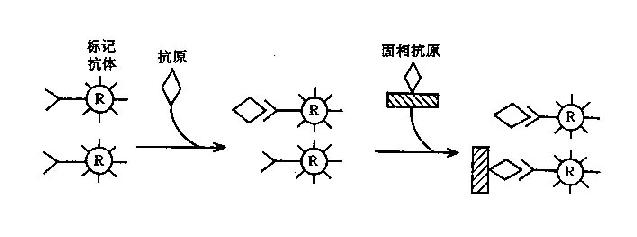
图 16-4 单位点 IRMA 原理示意图
抗原与过量的标记抗体在液相反应后加入免疫吸附剂,即结合在纤维素粉或其他颗粒载体上的抗原。游离的标记抗体与免疫吸附剂结合被离心除去,然后测定上清液的放射性量。
双位点 IRMA 的反应模式(图 16-5)与双抗体夹心 ELISA 的模式相同,可参见图 15-4。
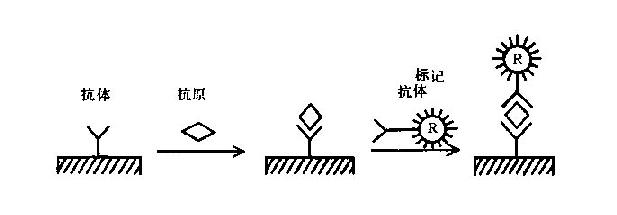
图 16-5 双位点 IRMA 原理示意图
受检抗原与固相抗体结合后,洗涤,加核素标记的抗体,反应后洗涤除去游离的标记抗体,测量固相上的放射性量。
不论是单位点还是双位点 IRMA,最后测得的放射性与受检抗原的量呈正比。
二、IRMA 与 RIA 的异同点
1.标记物在 RIA 中核素标记抗原,在 IRMA 中核素标记抗体。抗原有不同种类,根据其化学结构,标记时需用不同的核素和不同的方法。抗体为蛋白质,有利于碘化标记,不同抗体标记方法基本相同。标记抗体的比活度高,提高了分析的灵敏度。
2.反应速率反应速度与反应物的浓度呈正比,在 IRMA 中标记抗体是过量的,而且不存在竞争性结合复杂的反应,所以反应速度较 RIA 快。在 RIA 中抗体量是微量的,所以一定要用高亲和力的多克隆抗体,而在 IRMA 中应用亲和力较低的单克隆体也能得到满意的结果。
3.反应模式 RIA 为竞争抑制,测得放射性的量与受检抗原呈反比。IRMA 为非竞争结合,剂量反应曲线为正相关的直线关系。
4.特异性在比位点 IRMA 中,一般均应用针对不同位点的单克隆抗体,其交叉反应率低于应用多克隆抗体的 RIA。
5.标准曲线的工作浓度通常 RIA 的工作范围为 2~3 个数量级,而 RIMA 可达 3 个数量级以上。
6.分析误差 RIA 中加入的抗体和标记抗原都是定量的,加样误差可严重影响测定结果。IRMA 中标记和固相抗体在反应中都是过量的,只有受检标本的加样误差才会影响分析结果。因此,IRMA 的批内和批间变异均比较小。
7.其他 RIA 可以测定大分子量与小分子量的物质,双位点 IRMA 只能测定在分子上具有 2 个以上抗原表位的物质。
在 RIA 中应用的多为克隆抗体,亲和力和特异性要求较高,但用量很少。IRMA 中标记抗体和固相抗体用量较多,一般均用来源丰富、特异性较高的单克隆抗体。
第三节 医学检验中的应用
放射免疫分析由于敏感度高、特异性强、精密度高、并可测定小分子量和大分子量物质,所以在医学检验中应用极为广泛,常用于测定各种激素(如甲状腺激素、性激素、胰岛素等)、微量蛋白质、肿瘤标志物(如 AFP、CEA、CA-125、CA-199 等)和药物(如苯巴比妥、氯丙嗪、庆大霉素等)等。各种检测项目均有试剂盒供应,而且仪器设备并不昂贵,所以在国内被广泛采用。但由于核素的放射性对人体有一定的危害性,必须加以防护,核素实验室的建设须经防疫部门的监督,操作人员须经过特殊训练。另外由于核素有半衰期,试剂盒的货存期较短,因而放射免疫分析在应用中有诸多不便之处。特别是近年来其他标记免疫分析技术如酶免疫分析、发光免疫分析等在技术上有飞跃的进展,高级仪器的自动化程度已可与生化自动分析仪相媲美,因此从长远前景看,放射免疫分析有被取代的趋势。但在目前,从所需的设备和检测的费用上,放射免疫分析还有一定的优越性,还将在一定时期内被医学检验实验室所采用。
第十七章 荧光免疫技术
荧光免疫技术是标记免疫技术中发展最早的一种。很早以来就有一些学者试图将抗体分子与一些示踪物质结合,利用抗原抗体反应进行组织或细胞内抗原物质的定位。Coons 等于 1941 年首次采用荧光素进行标记而获得成功。这种以荧光物质标记抗体而进行抗原定位的技术称为荧光抗体技术(fluorescentantibodytechnique)。
由于一般荧光测定中的本底较高等问题,荧光免疫技术用于定量测定有一定困难。近年来发展了几种特殊的荧光免疫测定,与酶免疫测定和放射免疫分析一样,在临床检验中应用。
第一节 有关荧光的基本知识
一、荧光现象
(一)荧光的产生
一此化学物质能从外界吸收并储存能量(如光能、化学能等)而进入激发态,当其从激发态再回复到基态时,过剩的能量可以电磁辐射的形式放射(即发光)。
荧光发射的特点是:可产生荧光的分子或原子在接受能量后即刻引起发光;而一旦停止供能,发光(荧光)现象也随之在瞬间内消失。
可以引起发荧光的能量种类很多,由光激发所引起的荧光称为致荧光。由化学应所引起的称为化学荧光,由 X 线或阴极射线引起的分别称为 X 线荧光或阴极射线荧光。荧光免疫技术一般应用致荧光物质进行标记。
(二)荧光效率
荧光分子不会将全部吸收的光能都转变成荧光,总或多或少地以其他形式释放。荧光效率是指荧光分子将吸收的光能转变成荧光的百分率,与发射荧光光量子的数值成正比。
荧光效率=发射荧光的光量分子数(荧光强度)/吸收光的光量子数(激发光强度)
发射荧光的光量子数亦即荧光强度,除受激发光强度影响外,也与激发光的波长有关。各个荧光分子有其特定的吸收光谱和发射光谱(荧光光谱),即在某一特定波长处有最大吸收峰和最大发射峰。选择激发光波长量接近于荧光分子的最大吸收峰波长,且测定光波量接近于最大发射光波峰时,得到的荧光强度也最大。
(三)荧光的猝灭
荧光分子的辐射能力在受到激发光较长时间的照射后会减弱甚至猝灭,这是由于激发态分子的电子不能回复到基态,所吸收的能量无法以荧光的形式发射。一些化合物有天然的荧光猝灭作用而被用作猝灭剂,以消除不需用的荧光。因此荧光物质的保存应注意避免光(特别是紫外光)的直接照射和与其他化合物的接触。在荧光抗体技术中常用一些非荧的色素物质如亚甲蓝、碱性复红。伊文思蓝或低浓度的过锰酸钾、碘溶液等对标本进行得当复染,以减弱非特异性荧光本质,使特异荧光更突出显示。
二、荧光物质
(一)荧光色素
许多物质都可产生荧光现象,但并非都可用作荧光色素。只有那些能产生明显的荧光并能作为染料使用的有机化合物才能称为免疫荧光色素或荧光染料。常用的荧光色素有:
1.异硫氰酸荧光素(fluoresceinisothiocyanate,FITC)为黄色或橙黄色结晶粉末,易溶于水或酒精等溶剂。分子量为 389.4,最大吸收光波长为 490495nm,最大发射光波长 520530nm,呈现明亮的黄绿色荧光,结构式如下:
有两种同分异结构,其中异构体Ⅰ型在效率、稳定性、与蛋白质结合能力等方面都更好,在冷暗干燥处可保存多年,是应用最广泛的荧光素。其主要优点是:①人眼对黄绿色较为敏感,②通常切片标本中的绿色荧光少于红色。
2.四乙基罗丹明(rhodamine,RIB200)为橘红色粉末,不溶于水,易溶于酒精和丙酮。性质稳定,可长期保存。结构式如下:
最大吸收光波长为 570nm,最大发射光波长为 595~600nm,呈橘红色荧光。
3.四甲基异硫氰酸罗丹明(tetramethylrhodamineisothiocyanate,TRITC)结构式如下:
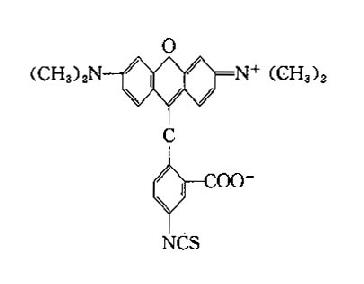
最大吸引光波长为 550nm,最大发射光波长为 620nm,呈橙红色荧光。与 FITC 的翠绿色荧光对比鲜明,可配合用于双重标记或对比染色。其异硫氰基可与蛋白质结合,但荧光效率较低。
(二)其他荧光物质
1.酶作用后产生荧光的物质某些化合物本身无荧光效应,一旦经酶作用便形成具有强荧光的物质。例如 4 - 甲基伞酮 -β- D 半乳糖苷受 β - 半乳糖苷酶的作用分解成 4 - 甲基伞酮,后者可发出荧光,激发光波长为 360nm,发射光波长为 450nm。其他如碱性酸酶的底物 4 - 甲基伞酮磷酸盐和辣根过氧化物酶的底物对羟基苯乙酸等。
2.镧系螯合物某些 3 价稀土镧系元素如铕(Eu3+)、铽(Tb3+)、铈(Ce3+)等的螯合物经激发后也可发射特征性的荧光,其中以 Eu3+应用最广。Eu3+螯合物的激发光波长范围宽,发射光波长范围窄,荧光衰变时间长,最适合用于分辨荧光免疫测定。
第二节 荧光抗体技术
一、荧光抗体的制备
(一)抗体的荧光素标记
用于标记的抗体,要求是高特异性和高亲和力的。所用抗血清中不应含有针对标本中正常组织的抗体。一般需经纯化提取 IgG 后再作标记。作为标记的荧光素应符合以下要求:①应具有能与蛋白质分子形成共价健的化学基团,与蛋白质结合后不易解离,而未结合的色素及其降解产物易于清除。②荧光效率高,与蛋白质结合后,仍能保持较高的荧光效率。③荧光色泽与背景组织的色泽对比鲜明。④与蛋白质结合后不影响蛋白质原有的生化与免疫性质。⑤标记方法简单、安全无毒。⑥与蛋白质的结合物稳定,易于保存。
常用的标记蛋白质的方法有搅拌法和透析法两种。以 FITC 标记为例,搅拌标记法为:先将待标记的蛋白质溶液用 0.5ml/LpH9.0 的碳酸盐缓冲液平衡,随后在磁力搅拌下逐滴加入 FITC 溶液,在室温持续搅拌 4~6h 后,离心,上清即为标记物。此法适用于标记体积较大,蛋白含量较高的抗体溶液。优点是标记时间短,荧光素用量少。但本法的影响因素多,若操作不当会引起较台强的非特异性荧光染色。
透析法适用于标记样品量少,蛋白含量低的抗体溶液。此法标记比较均匀,非特异染色也较低。方法为:先将待标记的蛋白质溶液装入透析袋中,置于含 FITC 的 0.01mol/LpH9.4 碳酸盐缓冲液中反应过夜,以后再对 PBS 透析法去除游离色素。低速离心,取上清。
标记完成后,还应对标记抗体进一步纯化以去除未结合的游离荧光素和过多结合荧光素的抗体。纯化方法可采用透析法或层析分离法。
(二)荧光抗体的鉴定
荧光抗体在使用前应加以鉴定。鉴定指标记包括效价及荧光素与蛋白质的结合比率。抗体效价可以用琼脂双扩散法进行滴定,效价大于 1:16 者较为理想。荧光素与蛋白质结合比率(F/P)的测定和计算的基本方法是:将制备的荧光抗体稀释至 A 2801≈1.0,分别测读 A 280(蛋白质特异吸收峰)和标记荧光素的特异吸收峰,按公式计算。
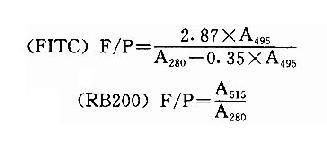
F/ P 值越高,说明抗体分子上结合的荧光素越多,反之则越少。一般用于固定标本的荧光抗体以 F /P=1.5 为宜,用于活细胞染色的以 F /P=2.4 为宜。
抗体工作浓度的确定方法类似 ELISA 间接法中酶标抗体的滴定。将荧光抗体自 1:4~1:256 倍比稀释,对切片标本作荧光抗体染色。以能清晰显示特异荧光、且非特异染色弱的最高稀释度为荧光抗体工作浓度。
荧光抗体的保存应注意防止抗体失活和防止荧光猝灭。最好小量分装,-20℃冻存,这样就可放置 3~4 年。在 4℃中一般也可存放 1~2 年。
二、免疫荧光显微技术
免疫荧显微技术的基本原理是:使荧光抗体与标本切片中组织或细胞表面的抗原进行反应,洗涤除去游离的荧光抗体后,于荧光显微镜下观察,在黑暗背景上可见明亮的特异荧光。
(一)标本的制作
荧光显微技术主要靠观察切片标本上荧光抗体的染色结果作为抗原的鉴定和定位。因此标本制作的好坏直接影响到检测的结果。在制作标本过程中应力求保持抗原的完整性,并在染色、洗涤和封埋过程中不发生溶解和变性,也不扩散至临近细胞或组织间隙中去。标本切片要求尽量薄些,以利抗原抗体接触和镜检。标本中干扰抗原抗体反应的物质要充分洗去,有传染性的标本要注意安全。
常见的临床标本主要有组织、细胞和细菌三大类。按不同标本可制作涂片、印片或切片。组织材料可制备成石蜡切片或冷冻切片。石蜡切片因操作烦琐,结果不稳定,非特异反应强等已少应用。组织标本也可制成印片,方法是用洗净的玻片轻压组织切面,使玻片粘上 1~2 层组织细胞。细胞或细菌可制成涂片,涂片应薄而均匀。涂片或印片制成后应迅速吹干、封装。置-10℃保存或立即使用。
(二)荧光抗体染色
于已固定的标本上滴加经适当稀释的荧光抗体。置湿盒内,在一定温度下温育一定时间,一般可用 25~37℃30min,不耐热抗原的检测则以 4℃过夜为宜。用 PBS 充分洗涤,干燥。
(三)荧光显微镜检查
经荧光抗体染色的标本,需要在荧光显微镜下观察。最好在染色当天即作镜检,以防荧光消退,影响结果。
荧光显微镜检查应在通风良好的暗室内进行。首先要选择好光源或滤光片。滤光片的正确选择是获得良好荧光观察效果的重要条件。在光源前面的一组激发滤光片,其作用是提供合适的激发光。激发滤光片有两种。MG 为紫外光滤片,只允许波长 275~400nm 的紫外光通过,最大透光度在 365nm;BG 为蓝紫外光滤片,只允许波长 325~500nm 的蓝外光通过,最大透光度为 410nm。靠近目镜的一组阻挡滤光片(又称吸收滤光片或抑制滤光片)的作用是滤除激发光,只允许荧光通过。透光范围为 410~650nm,代号有 OG(橙黄色)和 GG(淡绿黄色)两种。观察 FITC 标记物可选用激发滤光片 BG12,配以吸收滤光片 OG4 或 GG9。观察 RB200 标记物时,可选用 BG12 与 OG5 配合。
(四)实验的类型
1.直接法用特异荧光抗体直接滴加于标本上,使之与抗原发生特异性结合(图 17-1)。本法操作简便,特异性高,非特异荧光染色因素少;缺点是敏感度偏低,每检查一种抗原需制备相应的特异荧光抗体。
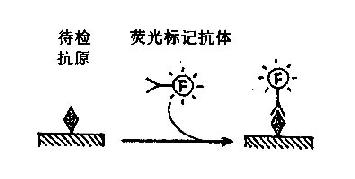
图 17-1 直接免疫荧光法原理示意图
2.间接法可用于检测抗原和抗体,原理见图 17-2。本法有两种抗体相继作用,第一抗体为针对抗原的特异抗体,第二抗体(荧光抗体)为针对第一抗体的抗抗体。本法灵敏度高,而且在不同抗原的检测中只需应用一种荧光抗体。
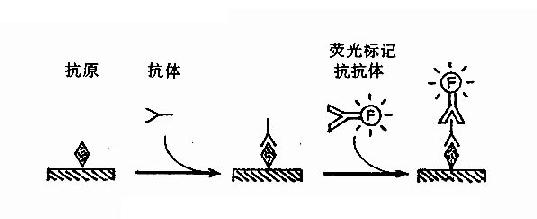
图 17-2 间接免疫荧光法原理示意图
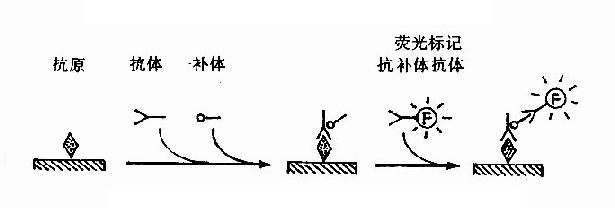
图 17-3 补体结合免疫荧光法原理示意图
3.补体结合法本法是间接法的第一步抗原抗体反应时加入补体(多用豚鼠补体),再用荧光标记的抗补体抗体进行示踪(图 17-3)。本法敏感度高,且只需一种抗体。但易出现非特异性染色,加之补体不稳定,每次需采新鲜豚鼠血清,操作复杂。因此较少应用。
4.标记法本法用 FITC 及罗丹明分别标记不同的抗体,而对同一标本作荧光染色。在有两种相应抗原存在时,可同时见到橙红和黄绿两种荧光色泽。
三、在医学检验中的应用
荧光抗体技术在临床检验上已用作细菌、病毒和寄生虫的检验及自身免疫病的诊断等。在细菌学检验中主要用于菌种的鉴定。标本材料可以是培养物、感染组织、病人分泌排泄物等。本法较其他鉴定细菌的血清学方法速度快、操作简单、敏感性高,但在细菌实验诊断中,一般只能作为一种补充手段使用,而不能代替常规诊断。荧光抗体染色法对脑膜炎奈氏菌、痢疾志贺菌、霍乱弧菌、布氏杆菌和炭疽杆菌等的实验诊断有较好效果。荧光间接染色法测定血清中的抗体,可用于流行病学调查和临床回顾诊断。免疫荧光用于梅毒螺旋体抗体的检测是梅毒特异性诊断常用方法之一。免疫荧光技术在病毒学检验中有重要意义,因为普通光学显微镜看不到病毒,用荧光抗体染色法可检出病毒及其繁殖情况。
在寄生虫感染诊断中,间接荧光抗体染色法有非常广泛的应用。间接免疫荧光试验(IFAT)是当前公认的最有效的检测疟疾抗体的方法。常用抗原为疟疾患者血液中红内期裂殖体抗原。IFAT 对肠外阿米巴、尤其是阿米巴肝脓肿也有很高的诊断价值,所用抗原是阿米巴培养物悬液或提取的可溶性抗原。
免疫荧光法还是检测自身抗体的好工具,在自身免疫病的实验诊断中应用广泛。其突出优点是能以简单方法同时检测抗体和与抗体起特异反应的组织成分,并能在同一组织中同时检查抗不同组织成分的抗体。主要有抗核抗体、抗平滑肌抗体和抗线粒体抗体等。抗核抗体的检测最常采用鼠肝作核抗原,可做成冰冻切片、印片或匀浆。用组织培养细胞如 Hep- 2 细胞或 Hela 细胞涂片还可检出抗着丝点抗体、抗中性粒细胞浆抗体等。应用免疫荧光技术可以检出的其他自身抗体有抗(胃)壁细胞抗体、抗双链 DNA 抗体、抗甲状腺球蛋白抗体、抗甲状腺微粒体抗体、抗骨髓肌抗体及抗肾上腺抗体等。
荧光抗体技术的一种特殊应用是流式细胞分析(flowcytometry)。在这种分析方法中检测仪器不是荧光显微镜,检测对象不是固定了的标本,而是将游离细胞作荧光抗体特异染色后,在特殊设计的仪器中通过喷嘴逐个流出,经单色激光照射发出的荧光信号由荧光检测计检测,并自动处理各处数据。这种方法可用于检测细胞大小、折散率、粘滞度等,更常用于 T 细胞亚群等的检测。
第三节 荧光免疫测定
一、时间分辨荧光免疫测定
以常用荧光素作为标记物的荧光免疫测定往往受血清成分、试管、仪器组件等的本底荧光干扰,以及激发光源的杂射光的影响,使灵敏度受到很大限制。时间分辨荧光免疫测定(timeresolvedfluorescenceimmunoassay,TR-FIA)是针对这缺点加以改进的一种新型检测技术。其基本原理是以镧系元素铕(Eu)螯合物作荧光标记物,利用这类荧光物质有长荧光寿命的特点,延长荧光测量时间,待短寿命的自然本底荧光完全衰退后再行测定,所得信号完全为长寿命镧系螯合物的荧光,从而有效地消除非特异性本底荧光的干扰。TR-FIA 的测定原理见图 17-4。以双抗体夹心法为例的测定反应程序见图 17-5。其中增强液的作用是使荧光信号增强。因为免疫反应完成后,生成的抗原-抗体-铕标记物复合物在弱碱性溶液中,经激发后所产生的荧光信号甚弱。在增强液中可至 pH2~3,铕离子很容易解离出来,并与增强液中的 β - 二酮体生成带有强烈荧光的新的铕螯合物,大大有利于荧光测量。
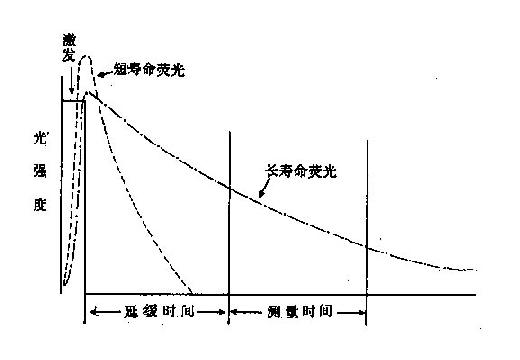
图 17-4 TR-FIA 测定原理示意图
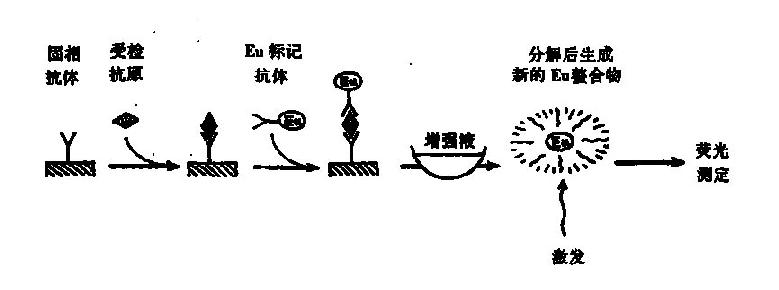
图 17-5 双抗体夹心法 TR-FIA 反应程序示意图
所用检测仪器为时间分辨荧光计,与一般的荧光分光光度计不同,采用脉冲光源(每秒闪烁 1000 次的氙灯),照射样品后即短暂熄灭,以电子设备控制延缓时间,待非特异本底荧光衰退后,再测定样品发出的长镧系荧光。检测灵敏度可达 0.2~1ng/ml。
二、荧光偏振免疫测定
荧光物质经单一平面的偏振光蓝光(波长 485nm)照射后,可吸收光能跃入激发态;在恢复至基态时,释放能量并发出单一平面的偏振荧光(波长 525nm)。偏振荧光的强度与荧光物质受激发时分子转动的速度成反比。大分子物质旋转慢,发出的偏振荧光强;小分子物质旋转快,其偏振荧光弱。利用这一现象建立了荧光偏振免疫测定(floutescencepolarizationimmunoassay,FPIA),用于小分子物质特别是药物的测定。
FPIA 的试剂为荧光素标记的药物和抗药物的抗体,模式为均相竞争法,标本中的药物与荧光标记的药物与一定量的抗体竞争结合。反应平衡后,与抗体结合的荧光标记药物的量与标本中药物浓度的量呈反比。由于抗体的分子量远大于药物的分子量,游离的荧光标记药物与结合抗体的荧光标记药物所产生的偏振荧光强度相差甚远。因此在 FPIA 中测定的偏振荧光强度与标本中药物的浓度呈反比。
第十八章 发光免疫技术
发光免疫技术是将发光系统与免疫反应相结合,以检测抗原或抗体的方法。其既具有免疫反应的特异性,更兼有发光反应的高敏感性,在免疫学检验中应用日趋广泛。
第一节 有关发光的基本知识
一种物质由电子激发态回复到基态时,释放出的能量表现为光的发射,称为发光(luminescence)。发光可分为三种类型:光照发光、生物发光和化学发光。
1.光照发光(photoluminescence)发光剂经短波长入射光照射后进入激发态,当回复至基态时发出较长波长的可见光(见第十七章)。
2.生物发光(bioluminescence)典型例子为萤火虫发光。反应底物为萤火虫光素(fireflyluciferin),在荧光素酶(luciferase)的催化下利用 ATP 产能,生成激发态的氧化荧光素(oxyluciferin),后者在回复到基态时多余的能量以光子形式放出。反应式如下:
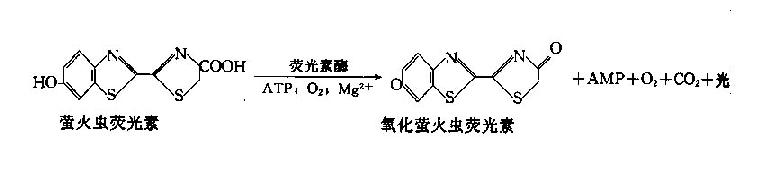
3.化学发光(chemiluminescence)在常温下由化学反应产生的光的发射。化学发光是一个多步骤的过程,其机制为某些化合物(发光剂或发光底物)可以利用一个化学反应产生的能量使其产物分子或反应中间态分子上升至电子激态。当此产物分子或中间态分子衰退至基态时,以发射光子的形式释放能量(即发光)。本章主要叙述化学发光免疫技术。
第二节 化学发光底物
在化学发光反应中参与能量转移并最终以发射光子的形式释放能量的化合物称为化学发光剂或发光底物。在发光免疫技术中常用的化学发光底物有以下几类。
1.氨基苯二酰肼类主要是鲁米诺及异鲁米诺衍生物,是最常用的一类化学发光剂。鲁米诺(luminol,5'- 氨基 -2,3- 二氢 -1,4- 酞嗪二酮)的分子结构及化学反应式如下:
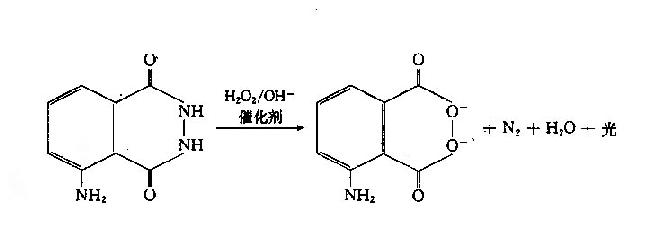
鲁米诺在免疫测定中既可用作标记物,也可用作过氧化物酶的底物。异鲁米诺衍生物 ASEI 和 ABMI 等也是常用的标记物。
2.吖啶酯(acridiniumester,AE)类这类发光剂不需催化剂的存在,在有过氧化氢的稀碱溶液中即能发光。反应式如下:
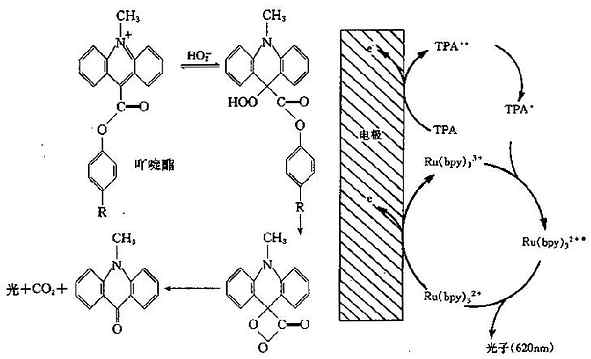
图 18-1 电化学发光原理
上式反应迅速,在 1~5s 内即可完成;具有背景低、信比高的优点,其检测极限可达 5×10-9mol,发光量与 AE 浓度呈良好的线性反应,是一类的标记物。
3.电化学发光(electrochemiluminescence,ECL)反应在电极表面进行。发光底物为三联吡啶钌 [Ru(bpy)32+],另一反应物为三丙胺(TPA)。在阳电极表面,以上两化学物质可同时失去电子发生氧化反应(图 18-1)。二价的 Ru(bpy)32+ 被氧化成三价 Ru(bpy)33+,TPA 被氧化成阳离子自由基 TPA+●,后者失去一个质子(H+),成为自由基 TPA●,这是一个强还原剂,可将一个电子递给三价的 Ru(bpy)32+*,而 TPA 自身被氧化成 TPA 氧化产物。激发态的 Ru(bpy)32+*在衰减时发射一个波长为 620nm 的光子,重新生成基态的 Ru(bpy)32+。这一过程在电极表面周而复始地进行,产生许多光子,使信号得以增强。
第三节 化学发光免疫测定
化学发光反应参与的免疫测定分为二种类型。第一种是以发光剂作为酶免疫测定的底物,通过发光反应增强测定的敏感性;第二种是以发光剂作为抗体或抗原的标记物,直接通过发光反应检测标本中抗原或抗体的含量。
一、化学发光酶免疫测定
从标记免疫测定来看,化学发光酶免疫测定(chemiluminescentenzymeimmunoasssay,CLEIA)应属酶免疫测定。测定中 2 次抗原抗体反应步骤均与酶免疫测定相同,仅最后一步酶反应所用底物为发光剂,通过化学发光反应发出的光在特定的仪器上进行测定。两种常用的标记酶,辣根过氧化物酶(HRP)和碱性磷酸酶(AP)均有其发光底物,由此建立的 CLEIA 均在临床检验中应用。
(一)HRP 标记的 CLEIA
常用的底物为鲁米诺或其衍生物。鲁米诺的氧化反应在碱性缓冲液中进行,通常以 0.1mol/LpH8.6Tris 缓冲液作底物液,鲁米诺和 H 2O2在无 HRP 催化时也能缓慢自发发光,而在最后光强度测定中造成空白干扰,因而宜分别配制成 2 瓶试剂溶液,只在用前即刻混合。
HRP 催化鲁米诺氧化的反应可被某些酚试剂(如邻-碘酚)或萤火虫荧光素酶等加强。加强剂的作用是增强发光和延长发光时间,由此可提高敏感度。
(二)AP 标记的 CLEIA
在以 AP 为标记酶的 CLEIA 中,应用的底物为 adamantyldioxetasephosphate,有不少衍生物的商品试剂如 PPD 可供应用。发光反应的反应式如下:

二、化学发光标记免疫测定
化学发光标记免疫测定亦称化学发光免疫测定(chemiluminescentimmunoassay,CLIA),是用化学发光剂直接标记抗原或抗体的一类免疫测定方法。用作标记的化学发光剂应符合以下几个条件:①能参与化学发光反应;②与抗原或抗体偶联后能形成稳定的结合物试剂;③偶联后仍保留高的量子效应和反应动力;④应不改变或极少改变被标记物的理化特性,特别是免疫活性。鲁米诺类和吖啶酯类发光剂等均是常用的标记发光剂。
鲁米诺类的发光反应须有催化剂(例如过氧化物酶)催化,且与蛋白质或肽结合后其发光作用减弱,因此鲁米诺类在 CLEIA 中是很好的底物,但已较少用于 CLIA 的标记。吖啶酯类对 CLIA 更为适用,其显著的优点是:①氧化反应不需催化剂,只要碱性环境中就可以进行。反应物在加入 H 2O2后再加氢化钠溶液,发光反应迅速,本底低。②在氧化反应过程中,结合物被分解,因此游离的吖啶酯的发光不受抑制。试剂稳定性好。
三、电化学发光免疫测定
在电化学发光免疫测定(electrochemluminescenceimmunoassay,ECLI)中应用的标记物为电化学发光反应的底物三联吡啶钌,其衍生物 N - 羟基琥珀酰胺(NHS)酯可通过化学反应与抗体或不同化学结构的抗原分子结合,制成标记的抗体或抗原。ECLI 的测定模式与 ELISA 相似,分二个步骤进行。以双抗体夹心法测定抗原为例,第一步在试管中进行,反应物为 Ru(bpy)32+标记的抗体、吸附在磁性微球上的固相抗体以及受检的标本,反应式如图 18-2。
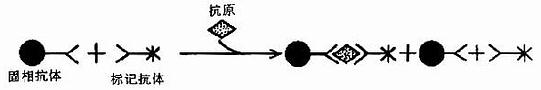
图 18-2 ECLI 中的抗原抗体反应
反应后除由标记抗体、固相抗体与标本中的抗原形成的夹心复合物外,尚有多余的标记抗体和固相抗体。第二步是将反应液输入特殊的检测仪器的反应室中(图 18-3),随即用含三丙胺(TPA)的缓冲液冲洗。反应室电极下有磁铁。含磁性微球的夹心复合物及游离的固相抗体被吸附在电极表面,游离的标记抗体随冲洗液流出。此时在反应室中即发生如图 18- 1 的电化学发光反应。发出的光由光电倍增管转为信号,通过电信号的测定反映标本中抗原的含量。
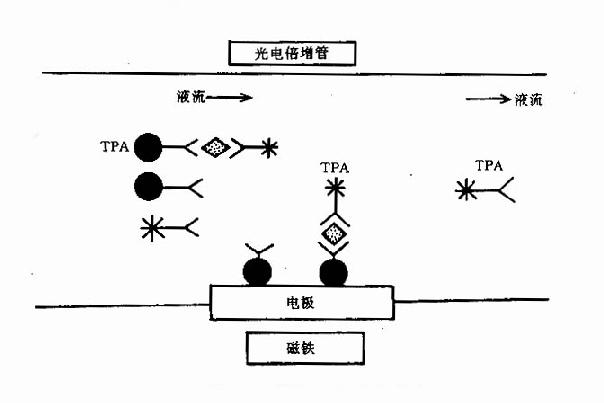
图 18-3 ECLI 中的 ECL 反应
ECLI 具有以下优点:①标记物在再循环利用,使发光时间更长、强度更高、易于测定;②敏感度高,可达 pg/ml 或 pmol 水平;③线性范围宽,>104;④反应时间短,20min 以内可完成测定;⑤试剂稳定性好,2~5℃可保持一年以上。
四、在医学检验中的应用
放射免疫分析因标记物的放射性在应用中存在不少问题。为替代这一广被采用的测定方法,近年来创立了多种新的标记免疫技术。化学发光免疫测定具有明显的优越性:①敏感度高,甚至超过 RIA;②精密度和准确性均可与 RIA 相比;③试剂稳定,无毒害;④测定耗时短;⑤测定项目多;⑥已发展成自动化测定系统。因此化学发光免疫测定在医学检验中不仅能取代 RIA,而且可得到更为广泛的应用。
第十九章 金免疫技术
金免疫技术的特点是以胶体金作为标记物。这一技术在 70 年代初期由 Faulk 和 Taylor 始创,最初用于免疫电镜技术。迄今为止,金标记仍主要用于免疫组织化学中。在免疫测定中,金标记常与膜载体配合,形成特定的测定模式,典型的如斑点免疫渗滤试验和斑点免疫层析试验等,已是目前应用广泛的简便、快速检验方法。
第一节 免疫胶体金的制备
一、胶体金的特性和制备
(一)胶体金的结构
胶体金(colloidalgold)也称金溶胶(goldsol),是由金盐被还原成原金后形成的金颗粒悬液。胶体金颗粒由一个基础金核(原子金 Au)及包围在外的双离子层构成,紧连在金核表面的是内层负离子(AuC12-),外层离子层 H +则分散在胶体间溶液中,以维持胶体金游离于溶胶间的悬液状态。
胶体金颗粒的基础金核并非是理想的圆球核,较小的胶体金颗粒基本是圆球形的,较大的胶体金颗粒(一般指大于 30nm 以上的)多呈椭圆形。在电子显微镜下可观察胶体金的颗粒形态。
(二)胶体金的特性
1.胶体性质胶体金颗粒大小多在 1~100nm,微小金颗粒稳定地、均匀地、呈单一分散状态悬浮在液体中,成为胶体金溶液。胶体金因而具有胶体的多种特性,特别是对电解质的敏感性。电解质能破坏胶体金颗粒的外周永水化层,从而打破胶体的稳定状态,使分散的单一金颗粒凝聚成大颗粒,而从液体中沉淀下来。某些蛋白质等大分子物质有保护胶体金、加强其稳定性的作用。
2.呈色性微小颗粒胶体呈红色,但不同大小的胶体呈色有一定的差别。最小的胶体金(2~5nm)是橙黄色的,中等大小的胶体金(10~20nm)是酒红色的,较大颗粒的胶体金(30~80nm)则是紫红色的。根据这一特点,用肉眼观察胶体金的颜色可粗略估计金颗粒的大小。
3.光吸收性胶体金在可见光范围内有一单一光吸收峰,这个光吸收峰的波长(λmax)在 510~550nm 范围内,随胶体金颗粒大小而变化,大颗粒胶体金的 λmax 偏向长波长,反之,小颗粒胶体金的 λmax 则偏于短波长,表 19- 1 所列为部分胶体金的 λmax。
(三)胶体金的制备
1.制备方法胶体金的制备多采用还原法。氯金酸(HauC14)是主要还原材料,常用还原剂有柠檬酸钠、鞣酸、抗坏血酸、白磷、硼氢化钠等。根据还原剂类型以及还原作用的强弱,可以制备 0.8nm~150nm 不等的胶体金。最常用的制备方法为柠檬酸盐还原法。具体操作方法如下:
(1)将 HauC14先配制成 0.01%水溶液,取 100ml 加热至沸。
(2)搅动下准确加入一定量的 1%柠檬酸三钠(Na3C6H5O7·2H2O)水溶液。
(3)继续加热煮沸 15min。此时可观察到淡黄色的氯金酸水溶液在柠檬酸钠加入后很快变灰色,续而转成黑色,随后逐渐稳定成红色。全过程约 2~3min。
(4)冷却至室温后用蒸馏水恢复至原体积。
用此法可制备 16~147nm 粒径的胶体金。金颗粒的大小取决于制备时加入的柠檬酸三钠的量。表 19- 1 列举制备 4 种不同粒径胶体金时柠檬酸三钠的用量。
表 19-1 四种粒径胶体金的制备及特性
| 胶体金粒径(nm) | 1%柠檬酸三钠加入量(ml)* | 胶体金特性 | |
| 呈色 | λmax | ||
| 16 | 2.00 | 橙色 | 518nm |
| 24.5 | 1.50 | 橙红 | 522nm |
| 41 | 1.00 | 红色 | 525nm |
| 71.5 | 0.70 | 紫色 | 535nm |
* 还原 100ml0.01%HauC14所需量
2.注意事项
(1)氯金酸易潮解,应干燥、避光保存。
(2)氯金酸对金属有强烈的腐蚀性,因此在配制氯金酸水溶液时,不应使用金属药匙称量氯金酸。
(3)用于制备胶体金的蒸馏水应是双蒸馏水或三蒸馏水,或者是高质量的去离子水。
(4)是以制备胶体金的玻璃容器必须是绝对清洁的,用前应先经酸洗并用蒸馏水冲净。最好是经硅化处理的,硅化方法可用 5%二氯甲硅烷的氯仿溶液浸泡数分钟,用蒸馏水冲净后干燥备用。
(5)胶体金的鉴定和保存:胶体金的制备并不难,但要制好高质量的胶体金却也并非易事。因此对每次制好的胶体金应加以检定,主要检查指标有颗粒大小,粒径的均一程度及有无凝集颗粒等。
肉眼观察是最基本也是最简单和方便的检定方法,但需要一定的经验。良好的胶体金应该是清亮透明的,若制备的胶体金混浊或液体表面有漂浮物,提示此次制备的胶体金有较多的凝集颗粒。在日光下仔细观察比较胶体金的颜色,可以粗略估计制得的金颗粒的大小。当然也可用分光光度计扫描 λmax 来估计金颗粒的粒径。结制备的胶体金最好作电镜观察,并选一些代表性的作显微摄影,可以比较精确地测定胶体金的平均粒径。
胶体金在洁净的玻璃器皿中可较长时间保存,加入少许防腐剂(如 0.02%NaN3)可有利于保存。保存不当时会有细菌生长或有凝集颗粒形成。少量凝集颗粒并不影响以后胶体金的标记,使用时为提高标记效率可先低速离心去除凝集颗粒。
二、免疫金的特性和制备
(一)免疫金的特性
胶体金可以和蛋白质等各种大分子物质结合,在免疫组织化学技术中,习惯上将胶体金结合蛋白质的复合物称为金探针。用于免疫测定时胶体金多与免疫活性物质(抗原或抗体)结合,这类胶体金结合物常称为免疫金复合物,或简称免疫金(immunogold)。
胶体金与蛋白质结合的机制尚有十分清楚,一般认为是物理吸附性的。胶体金颗粒带有一层表面阴性电荷,与蛋白质表面的阳性电荷通过静电感应相附。因此环境 pH 和离子强度是影响吸附的主要因素,其他如胶体金颗粒的大小、蛋白质的分子量及蛋白质浓度等也会影响蛋白质的吸附。
(二)免疫金的制备
1.用 0.2mol/LK2CO3或 0.1mol/LHC1 调节胶体金溶液的 pH 至选定值。原则上可选择待标记蛋白质等电点,也可略为偏碱。但通常最适反应 pH 往往需经多次试验才能确定。
在调节胶体金的 pH 值时应注意,胶体金会阻塞 pH 计的电极,不可直接将电极插入胶体金溶液中,宜先用终浓度为 0.15 的聚乙二醇(PEG,20000)稳定胶体金后,再胶体金的 pH 值。
2.将 1 /10 体积的合适浓度的蛋白质溶液加于胶体金溶液中,放置室温反应 2~5min。
由于盐类成分能影响胶体金对蛋白质的吸附,并可使胶体金聚沉,因此待标记蛋白质溶液若含有较高的离子浓度,应在标记前先对低离子强度的蒸馏水透析去盐。
3.加入浓度为 0.2%的 PEG 或 BSA 以饱和游离的胶体金。
4.离心分离,去除上清液中未结合的蛋白质。离心条件视胶体金颗粒的粒径而异:对 5nm 金颗粒可选用 40000r/min 离心 1h;8nm 金颗粒用 25000r/min 离心 45min;14nm 金颗粒用 25000r/min 离心 30min,40nm 金颗粒用 15000r/min 离心 30min。
5.轻吸上清液。沉淀用含 PEG 或 BSA 的缓冲液悬浮,恢复原体积后再离心。如此洗涤 2~4 次。以彻底除去未结合的蛋白质。
6.免疫金复合物最终用稀释液配制成工作浓度保存。稀释液通常是加入稳定剂的缓冲液。缓冲溶液常用中性的 PBS 或 Tris 缓冲液。
多种蛋白质、葡聚糖、PEG2000、明胶等均为良好的高分子稳定剂,PEG 和 BSA 是最常用的稳定剂。稳定剂有两大作用:一为保护胶体金的稳定性,使之便于长期保存;二为防止或减少免疫金复合物的非特异性吸附反应。稳定剂的合理选择是十分重要的,不适当的稳定剂有时也会导致非特异性反应。
第二节 金免疫测定
在第十五章酶免疫测定中已叙述了斑点 -ELISA 和 RIBA 两种斑点免疫结合试验,本节介绍的两种方法(斑点金免疫渗滤试验和斑点免疫层析试验)是在以上两种方法的基础上发展形成的,均以硝酸纤维素膜为固相载体,以免疫金为结合物。因其最大特点是简便快速,故统称为快速斑点免疫结合试验。
一、斑点金免疫渗滤试验
斑点免疫渗滤试验的基本原理是:以硝酸纤维素膜为载体,利用微孔滤膜的可滤过性,使抗原抗体反应和洗涤在一特殊的渗滤装置上以液体渗滤过膜的方式迅速完成。斑点免疫渗滤试验最初是从斑点 ELISA 基础上发展起来建立的,应用的结合物是酶标记的,称为斑点酶免疫渗滤试验。90 年代初发展了以胶体金为标记物的斑点免疫渗滤试验(dotymmunogoldfiltrationassay,DIGFA),又名滴金免疫测定法(简称滴金法)。在滴金法中不需酶对底物的反应,更加简便、快速,在临床检验中应用日渐广泛。
(一)原理
以双抗体夹心法为例。在硝酸纤维素膜的膜片中央滴加纯化的抗体,为膜所吸附。当滴加在膜上的标本液体渗滤过膜时,标本中含抗原被膜上抗体捕获,其余无关蛋白等没滤出膜片。其后加入的胶体金标记也在渗滤中与已结合在膜上的抗原相结合。因胶体金本身呈红色,阳性反应即在膜中央显示红色斑点。
(二)试剂和操作
1.渗滤装置渗滤装置是滴金法测定中的主要试剂成分之一,由塑料小盒、吸水垫料和点加了抗原或抗体的硝酸纤维素膜片三部分组成。塑料小盒可以是多种形状的,盒盖的中央有一直径约 0.4~0.8cm 的小圆孔,盒内垫放吸水垫料,硝酸纤维素膜片安放在正对盒盖的中央有一直径约 0.40.8cm 的小圆孔,盒的垫放吸水塑料,硝酸纤维素膜片安放在正对盒的圆孔下,紧密关闭盒盖,使硝酸纤维素膜片贴紧吸水垫料。如此即制备成一渗滤装置(图 19-1)。塑料小盒的形状最多见的是扁平的长方形小板,加之滴金法的整个反应过程都是在渗滤装置上进行的,因此又常称渗滤装置为滴金法反应板。
2.试剂盒组成滴金法试剂盒的三个基本试剂成分是滴金法反应板、免疫金复合和洗涤液。为了提供质控保证,用于抗原测定的试剂盒还应包括抗原参照品,相应的检测抗体的试剂盒应有阳性对照品。
3.测定操作以双抗体夹心法为例,具体步骤如下:
(1)将反应板平放于实验台上,于小孔内滴加血清标本 1~2 滴,待完全渗入。
(2)于小孔内滴加免疫金复合物试剂 1~2 滴,待完全渗入。
(3)于小孔内滴加洗涤液 2~3 滴,待完全渗入。
(4)判读结果:在膜中央有清晰的淡红色斑点显示者判为阳性反应;反之,则为阴性反应。斑点呈色的深浅相应地提示阳性强度。
(三)质量控制
滴金法的质量控制常采用在硝酸纤维素膜上点加质控点的方法。质控小圆点多位于反应斑点的正下方。双抗体夹心法的质控点最好是相应抗原,若该抗原试剂不易制备或价格昂贵时,也可用 SPA 或针对金标抗体的抗抗体来充当。间接法的质控点采用盐析法粗提的人 IgG 最为经济、方便。
图 19-1 DIGFA 渗滤装置及操作示意图
A:操作示意图 B: 装置分解图
有将包被斑点由圆点改成短线条式的:质控斑点横向包被成横线条,如“-”;反应斑点纵向包被成竖线条,如“∣”;两者相交成“+”。这样,阳性反应结果在膜上显示红色的正号(+),阴性反应结果则为负号(-),目视判断直观、明了。
二、斑点免疫层析试验
(一)原理
斑点免疫层析试验(dotimmunochromatographicassay,DICA)简称免疫层析试验(ICA),也以硝酸纤维素膜为载体,但利用了微孔膜的毛细血管作用,滴加在膜条一端的液体慢慢向另一端渗移,犹如层析一般。
(二)试剂和操作
免疫层析试验以单克隆双抗体夹心法为例。试验所用试剂全部为干试剂,多个试剂被组合在一个约 6mm×70mm 的塑料板条上,成为一单一试剂条(图 19-2),试剂条上端(A)和下端(B)分别粘贴吸水材料,免疫金复合物干片粘贴在近下端(C)处,紧贴其上为硝酸纤维素膜条。硝酸纤维素膜条上有两个反应区域,测试区(T)包被有特异抗体,参照区(R)包被有抗小鼠 IgG。
图 19-2 免疫层析试验原理示意图
测定时将试纸条下端浸入液体标本中,下端吸水材料即吸取液体向上端移动,流经 C 处时使干片上的免疫金复合物复溶,并带动其向膜条渗移。若标本中有待测特异抗原,其时可与免疫金复合物之抗体结合,此抗原抗体复合物流至测试区即被固相抗体所获,在膜上显出红色反应线条(T)。过剩的免疫金复合物继续前行,至参照区与固相小鼠 IgG 结合(免疫金复合物中的单克隆抗体为小鼠 IgG),而显出红色质控线条(R)。反之,阴性标本则无反应线条,而仅显示质控线条。
斑点免疫层析试验在试剂形式和操作步骤上较前述的几种免疫测定法都更为简化,只用一个试剂,只有一步操作。
三、应用
上述两种试验的共同特点是:简便、快速、单份测定、可立等结果,除试剂外无需任何仪器设备,且试剂稳定。因此特别适用于急诊检验。但这类试验不能准确定量,所以主要限于检测正常体液中不存在的物质(例如诊断传染病中的抗原或抗体)以及正常含量极低而在特殊情况下异常升高的物质(如 HCG 等)。目前临床检验中已开展的项目有 HCG、抗 HCV 和抗 HIV 等。新项目正在不断发展中。
第三节 免疫金银染色
免疫金银染色(immunogoldsilverstaining,IGSS)是在金免疫技术基础上发展起来的更为敏感的技术,由 Holgate 在 1983 年首先建立成功。
一、原理
金免疫技术测定的产物上的金颗粒可将银离子还原成银颗粒,在金颗粒表面形成一色泽更深的黑色层,因而增强了金免疫技术的敏感性(图 19-3)。
图 19-3 免疫金银染色原理示意图
二、方法
IGSS 的主要试剂为银染液。以往一般用硝酸银染液,但其对光的稳定性较差;改用乙酸银溶液后稳定性加强,配方如下:
A 液:0.22%乙酸银溶液(乙酸银 110mg 溶于去离子水 50ml 中)。
B 液:50%阿拉伯树胶溶液(阿拉伯树胶 50g 溶于去离子水 100ml 中,每天振摇 3 次,5 天后过滤使用)。
C 液:1%对苯二酚溶液(对苯二酚 500mg 溶于 0.55mol/LpH3.8 的柠檬酸盐缓冲液 50ml 中)。
D 液:在 C 液中加入 B 液 10~40ml。
使用前将 A 液和 D 液等量混合,即为银染液。
IGSS 多用于组织化学检测。对于以膜为载体的免疫学试验,金染色后的银加强可按下法进行:将膜用 0.05mol/LpH8.2TBS 浸洗 3 次,每次 3min,用去离子水冲洗一次,浸入 0.05mol/LpH3.8 柠檬酸缓冲液平衡 5min,浸入银染液中,37℃25min。将膜取出,用去离子水冲洗,放入定影液 1min,去离子水冲洗,空气干燥。
三、应用
金免疫技术的敏感度低于其它标记免疫技术,经银加强染色后敏感度可与荧光免疫技术和酶免疫技术相当。因此近年来发展了不少 IGSS 方法以替代荧光免疫技术,可以在普通显微镜下进行检测。
在以膜为载体的免疫技术(如免疫印迹法)中,也有应用 IGSS 以替代酶免疫法。也有用金标记抗体代替酶标记抗体进行类似 ELISA 的测定,最后进行银加强,其敏感度与 ELISA 相仿。
第二十章 免疫细胞的分离和保存技术
用体外方法对机体各种具有免疫反应的细胞分别作鉴定、计数和功能测定,是观察机体免疫状态的一种重要手段。为此,须将各种参与免疫反应的细胞从血液或脏器中分离出来。参与免疫反应的细胞主要包括淋巴细胞、巨噬细胞、中性粒细胞等。由于检测的目的和方法有同,分离细胞的需求和技术也异。有的仅需分离白细胞,有的则需分离单个核细胞(mononuclearcell),其中含淋巴细胞和单核细胞(monocyte),有的则需分离 T 细胞和 B 细胞以及其亚群。分离细胞选用的方法应力求简便可行,并能获得高纯度、高获得率、高活力的细胞。现用分离细胞群的原则,一是根据各类细胞的大小、沉降率、粘附和吞噬能力加以组分,另一则按照各类细胞的表面标志,包括细胞表面的抗原和受体加以选择性分离。
第一节 白细胞的分离
(一)血液中红细胞与白细胞比例约 600~1000:1,两者的比重不同其沉降速度亦异,通常用两种方法加以分离。
本法是利用血细胞自然沉降率的分离法,采集血液后应及时抗凝,通常选用肝素抗凝法。肝素能阻止凝血酶原转化为凝血酶,从而抑制纤维蛋白原形成纤维蛋白而防止血液凝固。操作原则是将含抗凝血的试管直立静置室温 30~60min 后,血液分成明显三层,上层为淡黄色血浆,底层为红细胞,紧贴红细胞层上面的灰白层为白细胞,轻轻吸取即得富含白细胞的细胞群,离心洗涤后加入少量蒸馏水或含氯化铵的 Gey 溶液,经短时间的低渗处理,使红细胞裂解,经过反复洗涤可得纯度较高的白细胞悬液。
(二)聚合物加速沉淀法
本法是利用高分子量的聚合物如明胶、右旋糖酐、聚乙烯吡喀烷酮(polyvinylpyrolidone,PVP)等使红细胞凝集成串,加速红细胞沉降,使之与白细胞分离。本法的细胞获得率比自然沉降法高。
第二节 外周血单个核细胞的分离
外周血中单个核细胞包括淋巴细胞和单核细胞,其体积、形态和密度与其他细胞不同,红细胞和多核白细胞密度较大,为 1.090 左右,而淋巴细胞和单核细胞密度为 1.075~1.090,血小板为 1.030~1.035。为此利用一种密度介于 1.075~1.092 之间而近于等渗的溶液(分层液)做密度梯度离心,使一定密度的细胞按相应密度梯度分布,从而将各种血细胞加以分离。常用的分层液有 Ficoll 和 Percoll 两种。
(一)Ficoll 分层液法
主要用于分离外周血中的单个核细胞,是一种单次密度梯度离心分离法。聚蔗糖-泛影葡胺是一种较理想的细胞分层液,其主要成分是一种合成的蔗糖聚合物称聚蔗糖(商品名为 Ficoll),分子量为 40kD,具有高密度、低渗透压、无毒性的特点。高浓度的 Ficoll 溶液粘性高,易使细胞聚集,故通常使用 60g/ L 的低浓度溶液,密度为 1.020,添加比重为 1.200 的泛影葡胺(urografin)以增加密度。国外常用商品 Isopaque 或 Hypaque,故又称 Ficoll-Hypaque 分层液,将适量 340g/ L 泛影葡胺加入 Ficoll 溶液中即可配制成密度合适分层液。分离人外周淋巴细胞以密度为 1.077±0.001 的分层液最佳,因为人的红细胞密度为 1.093,粒细胞密度为 1.092,单个核细胞在 1.076~1.090 之间。而不同动物血中的单个核细胞对分离液的密度要求各不相同,如小鼠为 1.088,马为 1.090。分离时先将分层液置试管底层,然后将肝素化全血以 Hanks 液或 PBS 液作适当稀释后,轻轻叠加在分层液上面,使两者形成一个清晰的界面。水平式离心后,离心管中会出现几个不同层次的液体和细胞带(图 20-1)。红细胞和粒细胞密度大于分层液,同时因红细胞遇到 Ficoll 而凝集成串钱状而沉积于管底。血小板则因密度小而悬浮于血浆中,唯有与分层液密度相当的单个核细胞密集在血浆层和分层液的界面中,呈白膜状,吸取该层细胞递经洗涤高心重悬。本法分离单个核细胞纯度可达 95%,淋巴细胞约占 90%~95%,细胞获得率可达 80%以上,其高低与室温有关,超过 25℃时会影响细胞获得率。
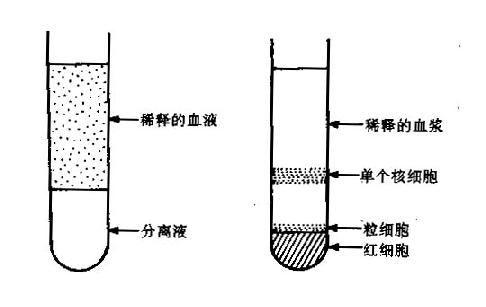
图 20-1 Ficoll 分层液离心后外周血细胞示意图
(二)Percoll 分层液法
这是一种连续密度梯度离心分离法。Percoll 是一种经聚乙烯吡喀烷酮 (PVP) 处理的硅胶颗粒,对细胞无毒性。利用 Percoll 液经高速离心后形成一个连续密度梯度的原理,将密度不等的细胞分离纯化。用 Percoll 原液 (密度 1.135) 与约等量双离子强度的磷酸缓冲液均匀混合,高速离心后,使分层液形成一个从管底到液面密度逐渐递减的连续密度梯度,再将已制备的单个核细胞悬液轻轻叠加在液面上,低速离心后,便得四个细胞层。表层为死细胞残片和血小板,底层为粒细胞和红细胞,中间有两层,上层富含单个核细胞(75%),下层富含淋巴细胞(98%)(图 20-2)。该法是纯化单核细胞和淋巴细胞的一各较好的方法,但操作流程较长,手续较多。
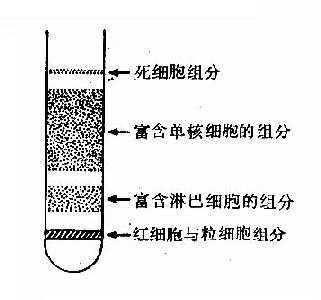
图 20-2 连续密度梯度离心法分离单个核细胞中各细胞成分的分布示意图
第三节 淋巴细胞及其亚群的分离
为研究免疫细胞的功能,常需高纯度的淋巴细胞或其亚群,分离方法介绍如下。
一、纯淋巴细胞群的采集
通常利用单核细胞在 37℃和 Ca2+存在条件下,能主动粘附在玻璃、塑料、尼龙毛、棉花纤维或葡聚糖凝胶的特性,据此建立许多从单个核细胞悬液中去除单核细胞的方法,藉以获得高纯度的淋巴细胞群。
(一)粘附贴壁法
将已制备的单个核细胞悬液倾于玻璃或塑料平皿或扁平小瓶中,移至 37℃温箱静置 1h 左右,单核细胞和粒细胞均贴于平皿壁上,而未贴壁的非粘附细胞几乎为纯淋巴细胞,继用橡皮刮下贴壁的细胞即为纯单核细胞群。因 B 细胞也有贴壁现象,用本法分离的淋巴细胞群中 B 细胞有所损失。
(二)吸附柱过滤法
将单个核细胞悬液注入装有玻璃纤维或葡聚糖凝胶 SephadexG10 的柱层中,凡有粘附能力的细胞绝大部分被吸附而粘滞在柱层中,从柱上洗脱下来的细胞主要是淋巴细胞。此法简单易行,对细胞极少损害。
(三)磁铁吸引法
利用单核细胞具有吞噬的特性,在单个核细胞悬液中加直径为 3μm 的羰基铁颗粒,置 37℃温箱内短时旋转摇动,待单核细胞充分吞噬羰基铁颗粒后,用磁铁将细胞吸至管底,上层液中含较纯的淋巴细胞。
二、淋巴细胞亚群的分离
分离相当纯化的淋巴细胞亚群是细胞免疫检验的基本技术。其原则是根据相应细胞的特性和不同的标志加以选择性纯化。凡根据细胞的特性和标志选择纯化所需细胞的方法是阳性选择法;而选择性去除不要的细胞,仅留下所需的细胞是为阴性选择。常用以下几种方法:
(一)E 花环沉降法
本法是将淋巴细胞与一定比例的绵羊红细胞混合,待淋巴细胞形成 E 花环后,继用淋巴细胞分层液分离细胞。浮悬在分层界面而不形成 E 花环的群则富含 B 细胞,而沉降在管底的形成 E 花环的细胞用低渗法处理,使围绕细胞周围的绵羊红细胞快速裂解,则获得纯的 T 细胞。
(二)尼龙毛分离法
本法利用 B 细胞和单核细胞具有易粘附于尼龙纤维表面的特性,可将 T 和 B 细胞分开。操作原则是取松散而经过处理的尼龙毛(聚酰胺纤维),均匀充填在内径 5~6nm 的聚乙烯塑料管(饮料管即可)内,经 Hanks 液浸透保温,将单个核细胞悬液加入柱内,放 37 温箱静置 1~2h。用预温的含 10%~20%小牛血清培养液灌洗,洗脱液内含有非粘附的 T 细胞,重复灌洗几次以除去管内残留的 T 细胞。再用冷或温培养液边冲边洗边挤压塑料管,此时洗脱液内富含 B 细胞。如此得到的 T 细胞纯度在 90%以上,B 细胞纯度可达 80%。
(三)亲和板结合分离法
利用亲和层析法分离淋巴细胞亚群,其原理是各种淋巴细胞亚群具有不同的抗原性,将相应抗体结合于塑料平板上,继加细胞悬液,凡抗原阳性的细胞则与相应抗体结合,抗原阴性的细胞可从未吸附的细胞悬液中获取(图 20-3)。同样若用特异性抗原交联在塑料板上,则可分离得具有特异抗原受体的淋巴细胞。淋巴细胞受体与特异抗原或抗体接触,可引起细胞激活,因此,凡欲去除细胞悬液内某一细胞亚群时,本法更适用。如要分离 CD4+或 CD8+细胞,则可用抗 CD4 或 CD8 单克隆抗体吸附。用抗 Ig 抗体则可分离 B 细胞。同样,用活化的 C3 包被,可分离出有 C3 受体的细胞。
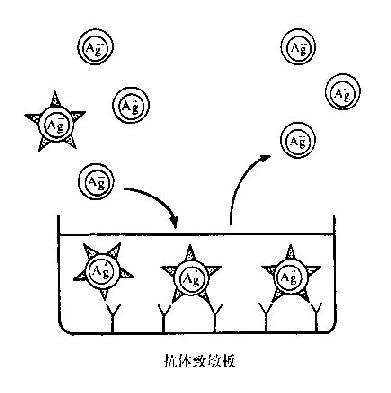
图 20-3 亲和分离法图解
(四)荧光激活细胞分离仪分离法
荧光激活细胞分离仪(fluorescenceactivatedcellsorter,FACS)主要由 4 部分组成:①细胞流动系统及气压流速控制系统,②激光系统,③检测与讯号处理系统,④细胞分选系统。其主要原理是细胞经荧光染色后,通过高速流动系统,细胞排成单行,逐个流经检测区进行测定。当细胞从流动室喷嘴处流出时,超声振荡搅动液流,使液流断裂成一连串的均匀小滴(40000 个 /s),每小滴内最多含一个细胞(其中只有百分之几的液滴中含细胞),细胞经激光束照射产生荧光和散射光,由光电倍增管接收,转换成脉冲信号,数据经电脑处理,分辨细胞的类型。如识别的是预计所需的细胞时(如 T 细胞、B 细胞要其亚群),在细胞样品流断裂成小滴时,使液滴瞬即感应阳电荷、阴电荷或不带电荷,使所需的细胞在电场偏转下进入不同的收集管(图 20-4)。用 FACS 分离细胞准确快速,能保持细胞活力,并可在无菌条件下进行,但仪器昂贵,极少用于常规,而多数仅作为研究的手段。
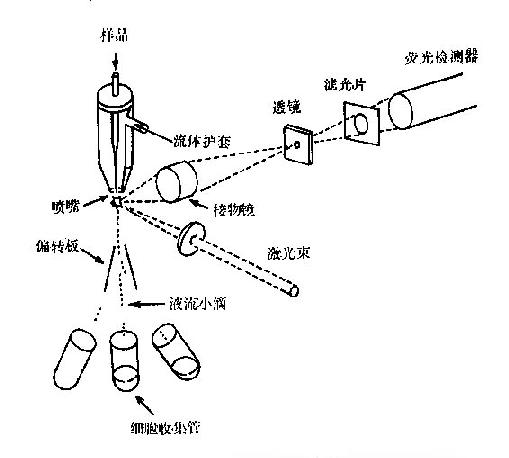
图 20-4 荧光激活细胞分离仪简图
第四节 吞噬细胞的分离和收集
人外周血中单核-巨噬细胞可通过 Pecoll 密度梯度分离法获取,但数量较少,用血量多。用斑蝥敷贴法可从人体组织液中获取较纯的巨噬细胞,不需作进一步体外分离,细胞量损失较少。该法是用滤纸蘸取 10%中药斑蝥酒精浸出液,贴敷在臂内侧皮肤表面,4~5h 后皮肤局部充血,48h 后局部形成水疱,吸取疱中的组织液,内含巨噬细胞。但此法对病人皮肤有一定损伤,有时可引起局部感染,应慎用。
欲获取小鼠、大鼠、豚鼠等小动物的巨噬细胞,可经腹腔内注入少许石蜡油,3~4 天后冲洗出腹腔渗出液,所得细胞悬液中 70%~80%为巨噬细胞。
第五节 淋巴细胞的保存和活力测定
一、分离细胞的保存
在某些情况下,分离所得细胞需要加以保存,否则活力迅速下降,甚至死亡。
(一)短期保存技术
将分离到的细胞用适量含 10%~20%灭活小牛血清的 Hanks、Tc-199、RPMI1640 或其他培养液稀释重悬。所用培养液要求等渗,具缓冲作用,并对细胞无毒性。通常置 4℃保存较好,可减低细胞代谢活动。要注意不要迅速改变细胞所处的温度,以免造成细胞“温度”休克。
(二)长期冷冻保存技术
利用液氮深低温(-196℃)环境保存细胞,是当前世界上通用的细胞长期保存技术。其原理在于深低温环境可中断细胞的代谢,但在降温过程由于冰晶的形成和渗透压的改变均可导致细胞的损伤和部分死亡,所以在冷冻过程中一定要加用冷冻保护剂,常用的保护剂为二甲亚砜(dimethylsulfoxide,DMSO)。冷冻时的降温速度和细胞解冻时的升温速度对细胞活力的保存有很大影响。条件合适时,冻存细胞一旦复苏,恢复 37℃培养,其形态和代谢活动均可恢复正常。操作的原则是先对需冻存的细胞作活细胞计数,低速离心后,取沉积细胞用含 10%二甲亚砜的小牛血清配制成适当浓度的细胞悬液,分装于冻存管内,速即放入降温过渡站中,避免二甲亚砜对细胞的损伤。继而进行降温冷冻,目前常用两步降温法,即迅速降温至一选择好的临界温作为过渡站,如-80℃低温冰箱过夜,或在液氮罐液面以上的一层空间放置片刻,然后再放入液氮中。如需复苏细胞,则需迅速解冻以恢复细胞的活力,要求在 20s 以内完全融化。将冻存管自液氮中取出,立即放入 40℃温水中,融化后即从水中取出,吸出细胞悬液,加入 10 倍的培养液中混匀,继而低速离心,尽快洗去保护剂,再悬于新培养液中,计数并检查细胞活力,然后置 37℃培养箱内培养。
二、细胞活力测定
细胞活力常用百分比表示,活力的大小对试验结果有很大影响。细胞活力的测定有许多方法,最简便常用的方法是台盼蓝(trypanblue)染色法。台盼蓝又称锥蓝,是一种阴离子型染料,这种染料不能透过活细胞正常完整的细胞膜,故活细胞不着色,但死亡细胞的细胞膜通透性增加,可使染料通过细胞膜进入细胞内,使死细胞着色呈蓝色。
第二十一章 淋巴细胞标志和功能的检测 >
人体内的淋巴细胞分为 T 细胞、B 细胞和包括 NK 细胞为代表的第三群细胞,下分若干亚群,各有其特异的表面标志和功能,据此建立许多相应的检测方法。临床上各种类型的免疫缺陷症、自身免疫病以及肿瘤等均可出现不同群淋巴细胞数量和功能的变化。因此计数外周血和组织内淋巴细胞及其亚群的数目或比例,以及它们所显示的功能强弱,可藉此判断机体的细胞免疫水平,对临床认识疾病,探讨其发病机制、观察病情、判断预后、考核疗效以及防治疾病等方面可提供极为有用的信息。
第一节 T 细胞表面标志的检测
一、特异性抗原的检测
检测人 T 细胞的特异性抗原,曾采用抗人脑、抗人胸腺细胞和抗人 T 细胞等抗血清,通过细胞毒试验或免疫荧光染色加以鉴定。自抗白细胞分化抗原的单克隆抗体问世以来,上述诸多方法均被新方法取而代之。常用以鉴定和检测计数 T 细胞的表面分化抗原如表 21- 1 所示。
表 21-1 T 胞表面主要 CD 抗原及其特异性
| CD 抗原 | 特 异 性 |
| CD2 | E 受体、全部 T 细胞和部分 NK 细胞 |
| CD3 | 成熟 T 细胞 |
| CD4 | T(辅助 / 诱导)细胞、Mφ、HIV 受体 |
| CD8 | T(杀伤 / 抑制)细胞、NK 细胞的亚型 |
| CD25 | 活化 T 细胞、IL- 2 受体 |
用单克隆抗体检测 T 细胞表面抗原的方法有两大类,一类是用标记抗体着染,如免疫荧光法、酶免疫法、生物素-亲和素(或链霉亲和素)系统的 ABC 法以及免疫金银染色法;另一类是用抗体致敏的红细胞作花环试验。两类方法各有优缺点。以下叙述有代表性的方法。
(一)间接免疫荧光法
本法是将分离获得的外周血单个核细胞分别与抗相应 CD 的单克隆抗体(如 CD2、CD4、CD8)结合后,洗去游离的抗体,继加荧光素标记的抗小鼠 IgG 抗血清,经温育结合后,洗去多余的标记抗体,取样制片,用荧光显微镜观察并计数约 200 个单个核细胞,以荧光阳性细胞与计数细胞总数之比,求得相应 CD 抗原阳性的 T 百分率。如有条件,细胞经荧光标记抗体着染后,用流式细胞仪计数,快速而准确,但需要较多的投资,难以普及应用。
(二)免疫细胞化学法
通常用酶免疫检测法,如 APAAP 酶免疫桥联法。为减少非特异性着染,可选用生物素-链霉亲和素系统试剂作 ABC 法染色。该类方法可用普通显微镜观察,凡呈棕黄色的细胞为相应 CD 抗原阳性细胞,计其占总淋巴细胞的百分率。本法简便易行,不需特殊仪器,一般试验室均可采用。
(三)抗体致敏细胞花环法
用相应的 CD 单克隆抗体致敏醛化的红细胞作为指示物,它与受检的细胞混匀后,置室温片刻,继经低速离心,移放室温作短期温育或 4℃过夜后,重悬取样涂片染色镜检。凡受检细胞周围粘附有 3 个或更多红细胞的判为花环形成细胞,共计数 100~200 个细胞,以花环形成数与计数细胞总数之比为相应 CD 抗原阳性细胞的百分率。本法需有相应的致敏红细胞试剂,受影响的因素较前两法多。
二、特异性受体的检测
T 细胞表面有特异性绵羊红细胞(E)受体和 T 细胞抗原识别受体(TCR),其中 E 受体曾广泛被用作鉴定和计数 T 细胞的标志。当人 T 细胞与绵羊红细胞悬液按一定比例混匀后,置 4℃至少 2h 或过夜,T 细胞表面的 E 受体能与绵羊红细胞结合而形成玫瑰花样的花环(图 21-1),取样涂片染色、镜检计数可得总花环形成北,亦即 T 细胞的百分率。如减少淋巴细胞与绵羊红细胞的比例,两者混合后,经短时间的温育即行取样涂片镜检计数,仍可见部分淋巴细胞形成花环,称为活性 E(Ea)花环,它可能代表 T 细胞的一个亚群,正常值仅为总 E 花环的 1 /3~1/2,约 20%~40%。检测 Ea 花环形成细胞比总 E 花环形成细胞更能反映受检者的细胞免疫水平。这类花环试验多种多样,因操作简便易行,曾被广泛使用,但影响因素较多,操作稍有不同,所得结果差异较大,因此渐被检测 CD 抗原方法所取代。

图 21-1 显微镜下的 E 花环
有些哺乳动物与人类相似,其外周血中 T 细胞能与某种或某几种动物的红细胞结合形成花环,其匹配如牛、猪淋巴细胞与绵羊红细胞,狗-人、猫-豚鼠、豚鼠-兔,因此这些相应的花环试验可以作为实验研究细胞免疫有用的技术之一。T 细胞抗在识别受体分 α /βTCR 和 γ /δTCR,可用相应单克隆抗体作免疫荧光检测,现仅作为研究的工具。
第二节 T 细胞功能的检测
T 细胞具有多种生物学功能,如直接杀伤靶细胞,辅助或抑制 B 细胞产生抗体,对特异性抗原和促有丝分裂原的应答反应以及产生细胞因子等,据此建立了一系列的检测方法,其中有些已用作临床检测细胞免疫功能的指标。
一、T 细胞增殖试验
本试验又称 T 细胞转化试验。T 细胞在体外经某种物质刺激,细胞代谢和形态相继发生变化,主要表现为短时间内细胞表面电荷即起变化,数小时后细胞内酶活化,在 24~48h 细胞内蛋白质和核酸合成增加,从而产生一系列增殖的变化,如细胞变大、细胞浆扩大、出现空泡、核仁明显、染色质疏松、淋巴细胞转变成母细胞(图 21-2)。因此,这种淋巴细胞增殖又称淋巴母细胞转化(lymphoblasttransformation)。淋巴细胞增殖反应既可通过形态学观察计数,也可用3H-TdR 掺入法检测细胞内 DNA 合成量的增加,据此判断出淋巴细胞对有关刺激的反应性与功能状态。

图 21-2 淋巴细胞转化的形态特征
体外引起淋巴细胞转化的刺激物种类很多,可分为非抗原性刺激物和抗原性刺激物两类。
1.非抗原性刺激物如植物血凝系(phytoagglutinin,PHA)、刀豆素 A(concanavalinA,ConA)、美洲商陆(pokeweedmitogen,PWM)和脂多糖(LPS)等,通称促有丝分裂原(mitogen)。其中 LPS 刺激 B 细胞,PWM 可刺激 T 和 B 两类细胞,PHA 和 ConA 刺激 T 细胞增殖。
2.抗原性刺激物如破伤风类毒素、链球菌激酶、纯化蛋白衍生物(purifiedproteinderivative,PPD)和白色念珠菌等。同种异型组织抗原也可作为刺激物,例如 HLA,用混合淋巴细胞培养法观察器官移植中受体细胞对供体细胞的反应性实质上也是一种淋巴细胞转化试验。
非抗原性刺激物可使正常人外周血中的淋巴细胞引起转化,与机体是否对某种抗原致敏无关,因此属非特异的淋巴细胞转化。抗原刺激物的作用只能使相应致敏的淋巴细胞发生转化,因此转化率大大低于非特异性转化。通常应用最多的刺激物是 PHA,特异性抗原仅使已经相应抗原致敏的 T 细胞发生转化,转化率一般约 5%~30%,而且需要培养 4~5 天。虽然 T 细胞对特异和非特异性抗原的识别过程不同,但被激活后,诱发的分裂和增殖过程却是相同。因此根据非特异性促有丝分裂原激活 T 细胞增殖反应的程度,同样可推测 T 细胞识别特异性抗原增殖反应。目前淋巴细胞转化试验是判断 T 细胞功能的一项常用的非特异性体外免疫学检测指标。
该试验有形态计数法和同位素计数法两种。
(一)形态法
其原则是将外周血液或分离的单个核细胞与适量的 PHA 混合,置 37℃培养 72h,取培养细胞作涂片染色镜检。根据细胞的大小,核与胞浆的比例,胞浆的染色性和核结构以及有无核仁等特征,分别计数淋巴细胞、过渡型母细胞和核有丝分裂相细胞以及成熟的小淋巴细胞,以前三者为转化细胞,每份标本计数 200 个细胞,按下列计算转化率:
转化率=转化的淋巴细胞数/(转化的淋巴细胞数+未转化的淋巴细胞数)×100%
在正常情况下,健康人外周血经 PHA 刺激的淋巴细胞转化率为 60%~80%,小于 50%可视为降低。形态学方法简便易行,便于基层实验室推广采用,但判读结果受主观因素影响较大,有些细胞形态难以确认,因此重复性和可靠性较差。
(二)同位素法
绝大多数外周血中 T 细胞通常处于细胞周期的 G 期,受特异性抗原或促有丝分裂原激活后,从 G 期进入 G 1期,并合成蛋白质、RNA 和 DNA 前体物质等,为 DNA 复制准备物质基础,然后进入 S 期,细胞合成 DNA 量倍增,此时若在培养液中加 3 H 标记的 DNA 前体(3 H 胸腺嘧啶苷,3H-TdR),后者即掺入新合成的 DNA 中,根据掺入的多少推测细胞增殖程度。检测原则是将全血或分离的单个核细胞悬液加入含培养液的试管中,每份样品分实验管和对照管,实验管加最适量和亚适量 PHA 后,移置 5%CO2 温箱 37℃培养 56h,加适量 3H-TdR,继续培养 16h,结束后将细胞收集在玻璃纤维膜上,递经处理,最后用液体闪烁器测量,记录每分钟脉冲数(cpm),算出 3 个复管的均数±S。通常以刺激指数(SI) 表示转化能力。
SI=PHA 刺激管 cpm 均值 / 对照管 cpm 均值
由于对照管组和刺激组实验条件一致,故用 SI 表示淋巴细胞增殖能力可以减少可变因素的干扰,但对照组同位素掺入量的增加或减少,能使 SI 发生明显变动,以致有时不能反映真实的增殖情况,因此最好同时参照对照组和实验组的 cpm 加以判断。值得强调的是目前配制的 PHA 多为最适浓度,在该条件下,功能略逊的细胞仍有应答能力。如同时采用最适和亚适浓度,一些细胞免疫功能较低的 T 细胞对亚适浓度的 PHA 则缺乏或仅呈极弱的应答,故在一定程度上可识别出应答功能较差的 T 细胞群。
二、T 细胞介导的细胞毒试验
T 细胞介导的细胞毒性(lymphocytemediatedcytotoxicity,LMC)是细胞毒性 T 细胞(CTL)的特性,凡致敏的 T 细胞再次遇相应靶细胞抗原,可表现出对靶细胞的破坏和溶解作用,它是评价机体细胞免疫水平的一种常用指标,特别是测定肿瘤患者 CTL 杀伤肿瘤细胞的能力,常作为判断预后和观察疗效的指标之一。该试验的原则是选用适当的靶细胞,常用可传代的已建株的人肿瘤细胞如人肝癌、食管癌、胃癌等细胞株,经培养后制成单个细胞悬液,按一定比例与受检的淋巴细胞混合,共温一定时间,观察肿瘤细胞被杀伤情况,常用方法如下:
(一)形态学检查法
淋巴细胞与肿瘤细胞混合共育后,以瑞氏染液着色,用显微镜计数残留的肿瘤细胞数,计数淋巴细胞抑制肿瘤细胞生长的抑制率:
抑制率%=(对照组平均残留级肿瘤细胞数-实验组平均残留细胞数/对照组平均残留肿瘤细胞数×100%
(二)同位素法
一般采用125I-UdR 掺入法或51Cr 释放法,以细胞毒指数或51Cr 释放率表示 T 细胞的细胞毒活性。
第三节 B 细胞表面标志的检测
B 细胞具有多种特异性抗原和受体,据此建立了相应的检测方法,一般用以研究 B 细胞各分化发育阶段的特性,也可藉以鉴定和计数各阶段 B 细胞在人外周血和淋巴样组织的分布以及疾病时的变化动态,为临床提供诊治相关疾病的有用信息。
一、B 细胞表面抗原的检测
B 细胞表面有 CD19、CD20、CD21、CD22 和 CD29 等分化抗原,其中有些系全部 B 细胞所共有,而有些仅活化 B 细胞所特有,据此可用相应的 CD 系列单克隆抗体,通过间接荧光免疫法、酶免疫组化或 ABC 法加以检测。健康成年人外周血 CD20 阳性细胞约占淋巴细胞总数的 8%~12%。
二、B 细胞受体的检测
B 细胞表面有膜免疫球蛋白(SmIg)、Fc 受体、补体受体、EB 病毒受体和小鼠红细胞受体,其中以 SmIg 为 B 细胞所特有,是鉴定 B 细胞可靠的指标。
(一)SmIg 的检测
大多采用间接荧光免疫法或包括 ABC 法在内的酶免疫组化法,关键是选用高效价、高特异性和高和力的荧光或酶标记的多价抗人 Ig 抗体,也可分别用各种类型的 Ig,即 IgM、IgG、IgA、IgE 等抗血清,检测带有各种类型 Ig 的 B 细胞,在人外周血中以带有 SmIgM 的细胞数为最多。
B 细胞经荧光标记的抗 Ig 抗体染色,细胞膜表面呈现的荧光着色可有不同的形式,开始均匀分布呈环状,其后集中在某些部位呈斑点状,然后又可集在一个部位呈帽状,最后可被吞饮入胞浆直至荧光消失。这一现象是由于淋巴细胞膜由双层类脂组成,上嵌有蛋白分子,在体温条件下,膜呈半液体状,而镶嵌物能在其中移动。当 SmIg 抗体发生结合时,由于抗血清为双价,使 SmIg 出现交联现象,这种抗原与抗体结合物可连成斑点和帽状,时间过长,帽状结合物可脱落或被吞饮而消失,因此染色后,观察时间不能超过 30min,或在染色时加叠氮钠防止帽状物形成或被吞饮。
(二)Fc 受体和补体受体的检测
B 细胞表面具有与 IgGFc 段结合的受体,极易与抗原抗体复合物中抗体 Fc 段牢固结合,故用相应抗体致敏的红细胞 (EA) 作批示物,在一定条件下,它能与带 Fc 受体的 B 细胞形成 EA 花环,故称 EA 花环试验。而细胞表面的补体受体,则能与红细胞 (E)- 抗红细胞抗体(A)- 补体(C) 复合物 (EAC) 中的补体相结合,从而建立 EAC 花环试验。但由于单核细胞、巨噬细胞、NK 以及部分 T 细胞也带有 Fc 或补体受体。因此形成 EA 和 EAC 花环并非 B 细胞所特有,加上该类试验需制备新鲜指示物,操作麻烦,目前基本上已被其他试验所取代,甚少应用。
(三)小鼠红细胞受体的检测
部分 B 细胞能与小鼠红细胞形成花环,慢性 B 细胞白血病患者外周血淋巴形成小鼠红细胞花环率高达 60%~85%,但健康人该花环率仅占总淋巴细胞的 5%~10%,据此推知形成该花环的性能是某些 B 细胞亚群的标志,由于方法简便,临床可用作鉴定不同型淋巴细胞白血病。
第四节 B 细胞功能的检测
一、体内试验
B 细胞受抗原或促有丝分裂原刺激后,可行分裂增殖并分化成熟为抗体生成细胞,且分泌相应的 Ig。B 细胞功能减低或缺陷,可表现为体内 Ig 和血型抗体量下降或缺如,患者对外源性抗原的应答能力减弱或缺如,仅产生极低或不能产生特异性抗体,故临床定量测定受检者血清中各种 Ig 量和相应血型抗体,可判断 B 细胞功能,也是诊断体液免疫缺陷的指标。反之,如血清中一种或多种 Ig 或轻、重链片段异常增高,表明 B 细胞产生 Ig 的功能异常增高。此外给患者注射适量常用的抗原,如白喉类毒素、破伤风类毒素等蛋白质抗原,或肺炎链球菌和流感嗜血杆菌等多糖抗原,经一定诱导期后,用适当的方法测定受检者血清中相应抗体的效价,根据抗体的水平也可判断受检者体内 B 细胞的功能。实验室常用如下的体外试验检测 B 细胞功能。
二、B 细胞早期活性指标的测定
B 细胞经不同抗原激发即开始分化增殖,初期表现为体积增大,可用仪器加以检测。激活的 B 细胞表面 MHCⅡ类抗原的表达增多,可用相应的单克隆抗体通过荧光免疫或 ABC 法检测。
三、溶血空斑形成试验
经典的溶血斑试验用于检测实验动物抗体形成细胞的功能,其原理是将绵羊红细胞(SRBC)免疫小鼠,4 天后取出脾细胞,加入 SRBC 及补体,混合在温热的琼脂溶液中,浇在平皿内或玻片上,使成一蒲层,置 37 温育。由于脾细胞内的抗体生成细胞可释放抗 SRBC 抗体,使其周围的 SRBC 致敏,在补体参与下导致 SRBC 溶血,形成一个肉眼可见的圆形透明溶血区而成为溶血空斑(plaque)。每一个空斑表示一个抗体形成细胞,空斑大小表示抗体生成细胞产生抗体的多少。这种直接法所测至的细胞为 IgM 生成细胞,其它类型 Ig 由于溶血效应较低,不能直接检测,可用间接检测法,即在小鼠脾细胞和 SRBC 混合时,再加抗鼠 Ig 抗体(如兔抗鼠 Ig),使抗体生成细胞所产生的 IgG 或 IgA 与抗 Ig 抗体结合成复合物,此时能活化补体导致溶血,称间接空斑试验。
但是上述直接和间接空斑形成试验都只能检测抗红细胞抗体的产生细胞,而且需要事先免疫,难以检测人类的抗体产生情况。如果用一定方法将 SRBC 用其它抗原包被,则可检查与该抗原相应的抗体产生细胞,这种非红细胞抗体溶血空斑试验称为空斑形成试验,它的应用范围较大。
现在常用的为 SPA-SRBC 溶血空斑试验。SPA 能与人及多数哺乳动物 IgG 的 Fc 段呈非特异性结合,利用这一特征,首先将 SPA 包被 SRBC,然后进行溶血空斑测定,可提高敏感度和应用范围。在该测试系统中,加入抗人 Ig 抗体,可与受检细胞产生的免疫球蛋白结合形成复合物,复合物上的 Fc 段可与连接在 SRBC 上的 SPA 结合,同时激活补体,使 SRBC 溶解形成空斑。此法可用于检测人类外周血中的 IgG 产生细胞,与抗体的特异性无关。用抗 IgA、IgG 或 IgM 抗体包被 SRBC,可测定相应免疫球蛋白的产生细胞,这种试验称为反相空斑形成试验。
溶血空斑形成试验可用于测定药物和手术等因素对体液免疫功能的影响,或评价免疫治疗或免疫重建后机体产生抗体的功能。
四、B 细胞增殖能力的试验
(一)不同刺激物诱发增殖试验
抗 IgM 抗体和细菌脂多糖均能刺激 B 细胞增殖,培养 1~3 天以后,加3H-TdR,与淋巴细胞增殖试验一样,检测细胞内 cpm,计算促有丝分裂原对淋巴细胞的刺激指数。也可用台盼蓝法计细胞增殖或用 DNA 特异性染色观察胞内 DNA 或 RNA 的分化程度。
(二)葡萄球菌诱导试验
葡萄球菌 CowenⅠ株(SAC)表面富含 SPA。该试验不依赖 T 细胞的参与,操作原则是将 SAC 与淋巴细胞按一定比例混合,按增殖试验法同样操作和计数 cmp 值。葡萄球菌表面 SPA 含量与激发 B 细胞转化能力成正比。
第五节 自然杀伤细胞的检测
NK 细胞表面至少存在 CD2、CD11b、CD11c、CD16、CD56 和 CD69 等多种抗原,但均非 NK 细胞所特有,因此现今极少以 CD 系列抗原为指标鉴定和计数 NK 细胞,而多检测 NK 细胞活性。NK 细胞株作为靶细胞,而测小鼠 NK 细胞活性则用 YAC 细胞株,检测方法多种多样,各有其优缺点。
(一)形态法
检测原则是将效应细胞与靶按一定比例混合共育,继而台盼蓝或伊红 Y 等活细胞拒染的染料处理,然后分别计数着染的死细胞和不着染的活细胞,由此推算 NK 的细胞的杀伤活性。本法简便,易于掌握,但判断死细胞与活细胞不免带有检测者的主观因素,也无法计数轻微损伤的细胞。
(二)酶释法
检测原则是将一定比例的效应细胞和靶细胞共温一段时间后,离心沉淀,取上清液检测靶细胞遭破坏后释放的乳酸脱氢酶或碱性磷酸酶含量。本法经济、快速简便,但可定量。缺点是靶细胞内碱性磷酸酶含量低或因某些未死亡细胞能自行释放,从而影响法灵敏度和特异性。此外乳酸脱氢酶分子较大,仅当靶细胞膜完全被破坏时才释放,故不能较早地反映效应的功能。
(三)荧光法
检测原则是用荧光素标记靶细胞,经与效应细胞共温后,离心法上清,用荧光计检测剩余的活靶细胞的荧光,缺点是活细胞释放的荧光常被效应细胞和培养液等所粹灭。另外,荧光分析法常遇细胞自然释放率高,荧光本底强,影响灵敏度。为克服上述障碍,用时间分辨荧光免疫分析,将靶细胞用镧系元素铕(Eu3+)的螯合物标记,按同法与效应细胞共温后,用时间分辨荧光计检测荧光,可除去非特异性荧光本底。本法实验时间短,效靶细胞仅需共温 2h,检测速度快,特异性强。
检测原则是将效应细胞和靶细胞按一定比例混合温育后,直接检测靶细胞。分有靶细胞浆释放法和胞核释放法。
1.胞浆释放法常用51Cr 释放法。51Cr 透过细胞膜与胞浆中小分子蛋白质结合,一旦细胞膜遭破坏,同位素随蛋白质外溢,并且不会被完整的细胞再度摄入。本法操作简便快速能定量,缺点是自然释放率高,所需靶细胞数量多,51Cr 半衰期短。近年有用111In(铟)检测 NK 细胞活性,优点是标记率高,用量微,以 γ 射线放射,可释放 90%的自身能量,比51Cr 高 10 倍,自然释放率低,仅为51Cr 的一半。
2.胞核释放法常用3H-TdR 或125IudR 作为 DNA 合成的前体物,可被摄入靶细胞核内。当效应细胞和靶细胞共温后,用胰酸和 DNA 酶处理可使遭破坏的胞核内容物释放。本法自然释放率比51Cr 低,半衰期较长,方法的敏感性高,故被大多数实验室所采用。
(五)化学发光法
检测原则是当效应细胞与靶细胞接触时,效应细胞呼吸爆发,生成极不稳定的 O 2-和 OH-等,放出光子,在发光剂存在的条件下,可被电倍增管接受和计数,发光量与 NK 细胞杀伤能力相关。
总之,检测 NK 细胞活性的方法多种多样,方法的简繁有很大差异,但敏感性和特异性亦异,从简单的活细胞计数直至最先进的流式细胞仪分析,一般可根据实验要求和具体条件选用。
第二十二章 吞噬细胞的检测
体内具有吞噬功能的细胞群按其形态的大小分两类:一类为大吞噬细胞;另一类为小吞噬细胞,亦即中性粒细胞。两类在形态上各有其特征。外周血或实验动物腹腔液等标本中白细胞分类和计数为重要的常规指标,人外周血中性粒细胞的数量对诊断大多数感染性疾病具有重要的参考价值。
吞噬细胞的吞噬活动大致分趋化、吞噬和胞内杀灭作用三阶段,在免疫学实验研究和临床检验中已建立相应的检测方法。
第一节 中性粒细胞功能的检测
(一)细胞运动功能的检测
小吞噬细胞的运动可以分成随机运动和定向运动,前者类似于布朗运动。检测方法是将采集的白细胞悬液滴于玻片上,用光学显微镜直接观察其运动。也可用毛细血管法将细胞悬液装入硅化毛细血管中,稍加离心,使细胞沉积在一端,切去无细胞的毛细血管段,继而移放在含细胞培养液的培养小瓶中,37℃温育 18~20h,游动的细胞将从毛细血管内外移,在管口形成一细胞团,根据细胞面积可判断受检中性粒细胞活动的强弱。某些患者中性粒细胞的任意运动明显减弱,甚至消失。中性粒细胞的定向运动表现为趋化运动,测定方法有多种,其原理相同,而方法大同小异,常用以下两法:
1.Boyden 小室法又称滤膜小室法,采用特殊的小盒装置,盒中以一片 3~5μm 孔径的微孔滤膜将盒分为上下两小室。上室加受检的白细胞悬液;下室加细菌菌体或其产物、酵母菌活化的血清等趋化因子。置 37℃温育数小时。上室中的中性粒细胞因受下室内趋化因子的招引,使细胞由滤膜微孔进入滤膜内,最后取滤膜,经固定、干燥、着染、脱色等步骤,将透明后的滤膜置油镜下检测细胞在膜内通过的距离,求其趋化单位。
2.琼脂糖凝胶平板法将含小牛血清的 1%琼脂糖倾到在玻片或平皿中制成凝胶平板,继而按图 22- 1 打孔,每三孔为一组,中央孔加细胞悬液,两侧孔分别加趋化因子或对照培养液,经 37℃温育 2~3h 后,用 2%戊二醛固定,移去琼脂糖层,经染色后,测量细胞运动的距离,按下式计算移动指数。
移动指数=趋化移动距离/任意移动距离
图 22-1 琼脂糖平皿法打孔谱型
(二)吞噬和杀菌功能的检测
检测原则是将受检细胞悬液按一定比例混和,继加活的白色念珠菌悬液,保温生,加美蓝溶液作活体染色,取样涂片镜检。如胞内白色念珠菌呈蓝色,表示该菌已被杀死,共计 100200 个细胞,分别求其吞噬率和杀菌率。

溶细胞法更能直接反映细胞杀菌的情况,将受检的细胞悬液与一定量已经新鲜人血清调理过的大肠杆菌或金黄色葡萄球菌悬液混合后,置 37℃,每隔一定时间取定量培养物,稀释后接种固体平板培养基,37℃培养 18h 后,计算菌落数,据以计算中性粒细胞的杀菌能力:
正常情况下,对大肠杆菌的杀菌率约为 90%,对金黄色葡萄球菌的杀菌率约为 85%。
在临床常用的硝基四氮唑蓝(NBT)还原试验,本法用以检测中性粒细胞的胞内杀菌能力,由于中性粒细胞在杀菌过程中能量消耗剧增,耗氧量亦随之相应增加,磷酸己糖旁路代谢活力增强,葡萄糖 6 - 磷酸氧化脱氢,此时加入 NBT 可接受所脱的氢,使原先呈淡黄包的 NBT 还原成点状或块状甲朊颗粒并沉积在胞浆内。NBT 还原反应式如下:
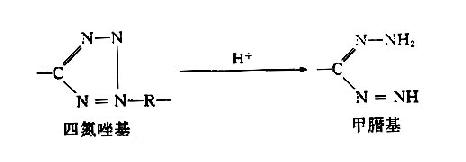
近此年来还采用了新颖的化学发光法,中性粒细胞在吞噬经调理的金黄色葡萄球菌过程中,伴有化学发光的产生,故可用化学发光仪测定中性粒细胞的吞噬功能及其代谢活性。实验证明全血化学发光试验可同时获得两种信息,即中性粒细胞的吞噬功能、代谢活性及受检血清的调理功能。由于中性粒细胞的氧代谢活性与对细胞的吞噬率密切相关,杀菌能力与发光强度相平行,因此化学发光法可检测细胞杀菌功能。因此吞噬细胞化学发光测定法可用以研究中性粒细胞的吞噬功能,代谢活性和血清调理功能,它可在生理温度和中性环境下测定,能较好地反映生理条件下吞噬细胞的功能,具有准确灵敏、样品用量少,简便快速等优点。其敏感性高于 NBT 还原试验。
第二节 巨噬细胞功能的检测
人巨噬细胞可从外周血或经斑蝥激发的皮疱液中获取,也可从肺灌洗液或患者腹膜透析液中分离,但操作繁锁,得量不多。许多实验室在进行基础或配合临床研究巨噬细胞功能及其与疾病的关系、或筛检免疫增强药物和探讨其作用机制时,常选用小鼠腹腔巨噬细胞为研究对象,常用的检测方法如下。
(一)炭粒廓清试验
正常小鼠肝中枯否细胞可吞噬清除 90%炭粒,脾巨噬细胞约吞噬清除 10%炭粒,据此给小鼠定量静脉注射印度墨汁(炭粒悬液),间隔一定时间反复取静脉血,测定血中炭粒的浓度,根据血流中炭粒被廓清的速度,判断巨噬细胞的功能。
(二)吞噬功能的检测
巨噬细胞具有较强的吞噬功能,实验室常用比细菌大的细胞性抗原作为被吞噬颗粒,如鸡红细胞。其检测原理是将受检细胞与适量的颗粒抗原混合后,置 37℃保温 0.5~1h,其间时加振摇,最后离心取测定细胞制成涂片,染色镜检,分别计数出吞噬百分比和吞噬指数。各实验室应根据自己的条件建立正常参考值。
(三)巨噬细胞溶酶体酶的测定
巨噬细胞富含溶酶体酶,如酸性磷酸酶、非特异性酯酶、溶菌酶等,测定这些酶的活性也是衡量巨噬细胞功能的实用指标之一。
1.酸磷酸酶的测定
(1)硝酸铅法:本法优点是用普通试剂,价格便宜,一般实验室均有条件做,封片后可较长时间保存,并可用电子显微镜研究观察细胞的超微结构。缺点是细胞必需固定,而且固定条件要求严格,如处理不当酶活性易消失,反应步骤也较多。
该法基本原理是在适当的酶性条件下,巨噬细胞内的酸性磷酸酶能使 β 甘油磷酸钠水解成磷酸盐后,后者与硝酸铅反应产生磷酸铅,而磷酸铅再与硫酸铵反应则形成黑色硫化铅,沉积在胞浆内酸所在处,显示棕黑色颗粒。酶活性强弱可根据颗粒的数量和粗细不同而分级判断,颗粒数量少则细的为+,颗粒多而粗的为++,颗粒很多且很粗的为+++。
(2)偶氮法:本法操作简便,反应液中的底物 α - 萘磷酸钠被酸性磷酸酶分解后,形成萘酚和磷酸盐,而萘酚结构中的羟基(-OH)邻近的活泼碳原子,立即与偶氮染料起反应,而产生鲜艳的棕色沉积在酶所在处,缺点是封片后保存时间短。
2.非特异性酶的测定该酶比较稳定,酶活性丧失较慢,细胞经涂片干燥,置室温至少可保存半天至一天,因此特别有利于临床检验室采用。
常用 α - 萘醋酸法,该酶可将 - 萘醋酸分解成萘酚和醋酸,萘酚迅速与偶染料结合,形成有色反应物而沉积。
(四)巨噬细胞促凝血活性测定
激活巨噬细胞可产生一种与膜结合的凝血活性因子,加速正常血浆的凝固,为此取已经 37℃预温的正常兔血浆和 CaC12混合液,加入经粘附单层巨噬细胞的试管中,移置 37℃,即时记录血浆凝固时间。实验证明当巨噬细胞与 LPS、肿瘤相关抗原或 HbsAg 等温育后,可见血浆凝固时间明显缩短。本法稳定方便,也是检测不同疾病患者巨噬细胞功能的指标之一。
(五)巨噬细胞表面受体的检测
成熟的巨噬细胞表面具有 Fc 受体和 C3b 受体,这些受体能识别经 IgG 和 C3b 调理的颗粒,并迅速与之结合,促使细胞对相应颗粒的吞噬,为此检测这些受体可间接判断巨噬细胞的功能。常用抗羊红细胞致敏的羊红细胞悬液作指示物进行 EA 花环试验,也可用抗原(E)抗体(A)补体(C)复合物作 EAC 花环试验。由于操作繁锁,现仅供研究用。
第二十三章 细胞因子和细胞粘附分子的检测
细胞因子和细胞粘附分子均在机体的免疫调节、炎症应答、肿瘤转移等生理和病理过程中起重要作用。检测这类因子不仅是基础免疫研究的有较手段,亦是临床上探索疾病发病机制、判断预后和考核疗效的指标。
第一节 细胞因子检测概述
检测细胞因子的方法主要有生物学检测法、免疫学检测法和分子生物学检测法。
一、生物学检测法
生物学检测又称生物活性检测,是根据细胞因子特定的生物活性而设计的检测法。由于各种细胞因子具有不同的活性,例如 IL- 2 促进淋巴细胞增殖,TNF 杀伤肿瘤细胞,CSF 刺激造血细胞集落形成,IFN 保护细胞免受病毒攻击,因此选择某一细胞因子独特的生物活性,即可对其进行检测。生物活性检测法又可分为以下几类:
1.细胞增殖法许多细胞因子具有细胞生长因子活性,特别是白细胞介素,如 IL- 2 刺激 T 细胞生长、IL- 3 刺激肥大细胞生长、IL- 6 刺激浆细胞生长等。利用这一特性,现已筛选出一些对特定细胞因子起反应的细胞,并建立了只依赖于某种因子的细胞系,即依赖细胞株(简称依赖株)。这些依赖株在通常情况下不能存活,只有在加入特定因子后才能增殖。例如 IL- 2 依赖株 CTLL- 2 在不含 IL- 2 的培养基中很快死亡,而加入 IL- 2 后则可右体外长期培养。在一定浓度范围内,细胞增殖与 IL- 2 量呈正比,因此通过测定细胞增殖情况(如使用3H-TdR 掺入法、MTT 法等)鉴定 IL- 2 的含量。除依赖株外,还有一些短期培养的细胞,如胸腺细胞、骨髓细胞、促有丝分裂原刺激后的淋巴母细胞等,均可作为靶细胞来测定某种细胞因子活性。
2.靶细胞杀伤法是根据某些细胞因子(如 TNF)能在体外杀伤靶细胞而设计的检测方法。通常靶细胞多选择体外长期传代的肿瘤细胞株,利用同位素释放法或染料染色等方法判定细胞的杀伤率。
3.细胞因子诱导的产物分析法某些细胞因子可刺激特定细胞产生生物活性物质,如 IL-2、IL- 3 诱导骨髓细胞合成胺、IL- 6 诱导肝细胞合成 α1- 抗糜蛋白酶等。通过测定所诱生的相应产物,可反映细胞因子的活性。
4.细胞病变抑制法病毒可造成靶细胞的损伤,干扰素等则可抑制病毒所导致的细胞病变,因此可利用细胞病变抑制法检测这类因子。
二、免疫学检测法
细胞因子均为蛋白或多肽,具有较强的抗原性。随着重组细胞因子的出现,可较方便地获得细胞因子的特异性抗血清或单克隆抗体,因此可利用抗原抗体特异性反应的特性,用免疫学技术定量检测细胞因子。尽管细胞因子种类繁多,只要获得了针对某一因子的特异性抗体(包括多克隆抗体或单克隆抗体)均可采用相似的技术开展工作。常用的方法包括 ELISA、RIA 及免疫印迹法。目前,几乎所有常见细胞因子的检测试剂盒均有商品供应。此外还可利用酶标或荧光标记的抗细胞因子单克隆抗体,原位检测因子在细胞内的合成及分布情况。免疫学检测法可直接测定样品中特定细胞因子的含量(用 ng/ml 表示),为大规模检测临床病人血清中细胞因子的含量提供了方便。本法仅测定细胞因子的抗原性,与该因子活性不一定相平行,因此要了解细胞因子的生物学效应,必须结合生物学检测法。
三、分子生物学方法
这是一类利用细胞因子的基因探针检测特定细胞因子基因表达的技术。目前所有公认的细胞因子的基因均已克隆化,故能较容易地得到某一细胞因子的 cDNA 探针或根据已知的核苷酸序列人工合成寡聚核苷酸探针。利用基因探针检测细胞因子 mRNA 表达的方法多种多样,常使用斑点杂交、Northernblot、逆转录 PCR,细胞或组织原位杂交等。实验的关键在于制备高质量的核酸探针和获得合格的待测物(提取的 mRNA 样品或细胞 / 组织标本)。核酸探针是指一段用放射性同位素或其他标记物(如生物素、地高辛等)标记并与目的基因互补的 DNA 片段或单链 DNA、RNA。根据其来源可分为 cDNA 探针、寡核核苷酸探针、基因组基因探针及 DNA 探针等。其中 cDNA 探针和人工合成寡核苷酸探针常用于斑点杂交及 Northernblot,而 RNA 探针因穿透性好更适用于原位杂交。核酸探针技术的应用已经程序化,以 cDNA 探针为例主要包括:①质粒 DNA 的提取;②靶 DNA 片段的分离;③靶 DNA 片段标记;④待测样品 mRNA 的提取;⑤标记 cDNA 探针对待检样品的杂交;⑥放射自显影或显色分析。近年来出现的 RT-PCR 检测特异性 mRNA 的方法也广泛用于细胞因子研究领域。该法具有灵敏、快速等优点,甚至从 1~10 个细胞中就可检出其中的特异 mRNA。
上述三种方法,各有优缺点,可互相弥补,在实际应用中,呆根据各自的实验目的和实验室条件进行选择。生物学检测法比较敏感,又可直接测定生物学功能,是最可靠的方法,适用于各种实验目的,是科研部门最常用的技术,但需要长期培养依赖性细胞株,检测耗时长,步骤繁杂,影响因素多,不容易熟练掌握。免疫学检测法比较简单,迅速,重复性好,但所测定的只代表相应细胞因子的量而不代表活性,同时敏感度也低生物活性检测法(约低 10~100 倍)。分子生物学法只能检测基因表达情况,不能直接提供有关因子的浓度及活性等资料,主要用于机制探讨。
第二节 白细胞介素的检测
现已发现的白细胞介素(IL)多达 10 余种,兹举有代表性的几种 IL 检测法藉以举一反三。
一、IL- 1 的检测
IL- 1 有两种分子形式,即 IL-1α 和 IL-2β,它们的生物学活性基本相同,均可采用生物学检测方法进行检测,若要区分 IL-1α 和 IL-2β 需用免疫学检测法。
(一)细胞增殖法
1.淋巴细胞增殖法 IL- 1 具有淋巴细胞活化因子的活性,可以协同促有丝分裂原刺激 T 细胞或胸腺细胞发生有丝分裂,同时 IL- 1 可以刺激 T 细胞产生 IL- 2 或其它 T 细胞生长因子,并使之表达相应的受体。因此用细胞增殖法检测 IL- 1 可有直接增殖法和间接增殖法两种。
(1)直接增殖法:IL- 1 在促有丝分裂原存在的情况下,能够促使胸腺淋巴细胞和某些体外建株的 T 细胞克隆生长,因此测定这些细胞的增殖情况即可反映 IL- 1 的活性。小鼠胸腺细胞测定法操作简单,比较常用,缺点是缺少特异性,因为 IL- 2 亦可协同促有丝分裂原刺激胸腺细胞增殖。D10G4.1(一种小鼠 T H细胞克隆)测定法较胸腺细胞测定法的敏感性高,且 D10G4.1 对 IL- 2 不敏感,因此特异性增强,缺点是需要长期饲养细胞株,该实验以3H-TdR 掺入法或 MTT 法检测细胞增殖情况。通常 IL- 1 浓度越高,细胞转化能力越强,IL- 1 浓度低于 0.05ng/ml 时,细胞转化能力接近促有丝分裂原单独刺激的程度。
(2)间接增殖法:某些品系小鼠的 T 细胞系只有在 IL- 1 存在的条件下才能产生 IL-2,并且 IL- 2 的产生量与 IL- 1 的浓度成直线关系。因此可以利用 IL- 2 依赖细胞株(如 CTLL2)测定 IL-2,藉以间接测定 IL- 1 的含量。
2.成纤维细胞增殖法 IL- 1 能刺激成纤维细胞的增殖,故可利用来源于新生儿包皮或传代的人皮肤成纤维细胞(如 CRL1445)测定 IL-1。国内常用小鼠成纤维细胞瘤 L929 细胞株。
检测原则是将生长成单层的 L929 细胞用胰酶消化后,配成适当浓度的细胞悬液,继将不同稀释度的待测样本与 L929 细胞悬液分加入 96 孔培养液中。一式三份,并设置阴性对照,放入 37℃、5%CO2的温箱中温育 72h,在第 16h 时加入适量3H-TdR,继续温育,结束后离心弃去培养上清,加入适量胰酶消化数分钟后,收集细胞测定 cpm 值或吸光度值。
(二)其他方法
1.骨和较骨组织测定法利用 IL- 1 可诱导胶原酶释放,破坏软骨组织的特性,用分光光度计测定软骨硫酸盐释放量,即可间接椎知 IL- 1 量。又如 IL- 1 能影响骨质吸收,应用放射性45Ca 通过小鼠头顶骨系统吸收可测定 IL- 1 活性,为骨质吸收释放法。
2.PGE2测定法 IL- 1 作用于下丘脑,诱导脑细胞合成前列腺素 E 2(PGE2),发挥致热原作用;还能诱导原代培养或建株传代的成纤维细胞产生 PGE2,故可用放免疫技术测定 PGE2藉以间接测定 IL-1。
3.放射免疫测定法本法利用受检 IL- 1 样品与碘标记 IL- 1 竞争性结合 Sepharose4B 中抗 IL- 1 抗体结合位点的原理而设计。该法敏感性较高,且可排除样品中其它干扰因素的影响,其特点是可以区分 IL-1α 和 IL-1β。
4.体内测定法 IL- 1 在体内可诱导发热、引起急性期蛋白合成及影响血中铁和锌水平。实验室多利用 IL- 1 的致热原作用加以检测。在给动物静脉注射 IL- 1 前后,以体温的升高幅度表示 IL- 1 的活性,或定期测定血清中某些急性期蛋白的含量,如血清淀粉样蛋白 A,血清淀粉样蛋白 P 等。
总之,由于 IL- 1 的生物学活性比较广泛,其检测方法亦多种多样,但每种方法均有其缺点,往往需要结合使用。T 细胞增殖法简便、易行且敏感,但样品中若混有 IL-2,则可协同促有丝分裂原刺激 T 细胞增殖,从而干扰 IL- 1 的测定。血清中的 TNF 同样可以刺激成纤维细胞的增殖,也可用成纤维细胞测定法,但特异性较差。放免法可排除其它因子的干扰,但此法仅测得 IL- 1 的抗原性,不能完全代表其生物学活性。
二、IL- 2 的检测
IL- 2 的检测方法主要有两大类,一类是细胞增殖法,另一类是免疫学检测法。
(一)细胞增殖法
IL- 2 可刺激某些淋巴细胞增殖,根据细胞增殖情况可反映 IL- 2 的活性,结果以 U /ml 表示。目前所用的 IL- 2 反应细胞主要有 CTLL、CTB6、F12、CTLL- 2 等小鼠 IL- 2 依赖细胞株以及 ConA 活化的小鼠淋巴母细胞和小鼠胸腺细胞。这类细胞的增殖情况均可通过显微镜下直接计数、3H-TdR 掺入法以及 MTT 法加以测定。
1.依赖性细胞株增殖法 IL- 2 依赖细胞株在 IL- 2 存在时才能生长,而对 PHA、ConA 等促有丝分裂原及 IL- 2 以外的其它细胞因子均无反应。CTLL- 2 对 IL- 2 的依赖性最强,表现为在单独培养时3H-TdR 的掺入量低,而在 IL- 2 存在时掺入值高,故为首选的靶细胞株。
2.T 淋巴母细胞增殖法 T 细胞经植物血凝素激发转化为 T 淋巴母细胞,并表达丰富的 IL- 2 受体,在体外 IL- 2 存在时持续增殖,并与 IL- 2 含量呈剂量依赖关系。
3.胸腺细胞增殖法 IL- 2 可以增另 ConA 的促有丝分裂原作用而引起 T 血细胞大量增殖。将一定数量的小鼠胸腺细胞与亚刺激量的 ConA 和不同稀释的待检标本共育,在一定时间后检测 IL- 2 增殖情况即能代表 IL- 2 的活性。胸腺细胞增殖试验是目前检测 IL- 2 活性最简便的方法。此法缺点是敏感性较差,如待测标本中存留有 ConA 会出现较强的非特异性反应等。
(二)免疫学检测法
根据抗原-抗体反应的原理,可利用抗 IL- 2 的单克隆或多克隆抗体直接测定样品中的 IL- 2 含量,结果用 ng/ml 表示。本法在 rIL- 2 生产制备过程中可用以跟踪检测,在 rIL- 2 基因克隆时亦可对阳性质粒进行初步筛选。
三、IL- 3 的检测
IL- 3 又名多能集落刺激因子(multi-CSF),在刺激多能造血干细胞及造血前体细胞的分化及增殖方面具有重要作用。目前检测 IL- 3 的方法多根据其对某些 IL- 3 反应性细胞促增殖及分化作用而设计。
IL- 3 能刺激多种细胞增殖,因此测定 IL- 3 反应细胞的增殖情况即可反映 IL- 3 的活性。目前常用于细胞增殖法的 IL- 3 反应细胞有骨髓干细胞、骨髓来源的 IL- 3 依赖株及肥大细胞等。此外,也可取小鼠胫骨和股骨骨髓细胞加受检样品,制成琼脂平板,置 5%CO237℃温育 1 周后,计数集落形成数,凡细胞数等于或大于 40~50 个的细胞团块计为一个集落,根据形成集落数的多少判断 IL- 3 的活性。
IL- 3 除刺激骨髓细胞增殖外,也能活化骨髓细胞使其释放组胺等生物活性物质。将小鼠骨髓细胞与不同稀释度的待检样品共温 48h 后,用荧光法检测培养上清中组织胺含量也能反映 IL- 3 的活性。
第三节 肿瘤坏死因子的检测
一、生物学检测法
TNF 的主要生物学活性之一就是对某些肿瘤细胞的细胞毒作用。根据这一特点,可利用 TNF 敏感的靶细胞测定 TNF 活性,根据细胞死亡得出 TNF 的相对活性。该法的关键是选择敏感特异的靶细胞。靶细胞可以是长期传代培养的细胞系,也可以是新鲜分离的原代细胞(如瘤细胞)。现以贴壁生长的 L929 细胞为例,简述 TNF 活性的检测原则。
两种 TNF 均可伤体外培养的 L929 细胞,细胞死亡率与 TNF 活性成正比。某些染料如中性红、结晶紫等能使活细胞染上相应颜色,再用脱色液将染料脱出,通过测定其吸亮度值间接监没细胞存活状态。
试验原则是收集对数生长期的 L929 细胞,用培养液调细胞至适当浓度,加入培养板小孔中,置 37℃,5%CO2温箱中培养 16~24h,换液后,在各孔中加入不同稀释度的待检样品,再加适当浓度的放线菌素 D 和适量培养液,继续温育 16~24h,弃培养液,经 Hanks 液洗涤后,每孔加入适当浓度的结晶紫染色液,37℃培养 1h,使活细胞充分着色。然后各孔加 1%SDS 短时温育使染色细胞溶解,再以酶标测定仪测各孔 A 570nm值。每次检测均设培养液(阴性)对照和不同浓度的 rTNF(阴性)对照。以使阴性对照 50%细胞溶解的标本最大稀释倍数为 TNF 活性单位,以 u /ml 表示。
由于放线菌素 D 能抑制 DNA 的合成、降低靶细胞对损伤的修复机制,因而在检测中加入放线素 D 可使靶细胞对 TNF 的敏感性增高 10~200 倍。
二、免疫学检测法
通常采用 ELISA,该法特异性高、敏感性强且快速使捷,而且能够区别 TNFα 和 TNFβ,为临床检测病人血清中 TNF 水平的有效方法,但不能反映 TNF 活性。
三、其它检测法
检测 TNF 还可用生物发光法及 NAG 微量酶反应比色法。这类方法是应用生化技术检测细胞内代谢的变化,从而推知靶细胞功能变化及死亡情况。其优点是不仅反映细胞的死亡情况,而且能反映细胞的功能变化。此外,还具有快速、方便、微量的特点。
第四节 造血生长因子的检测
在造血生长因子的检测方法中,生物活性检测法最为基础,具体方法有以下几种:
1.集落刺激法 CSF 在体外可以刺激骨髓细胞增殖,形成造血细胞集落,集落的多少与 CSF 的生物学活性成正比。
2.细胞增殖法 CSF 的依赖株很多,如 GN-CSF 的依赖细胞株是 DA3.15,M-CSF 依赖细胞株是 M14,G-CSF 依赖株是 NES60.4。待测样品与相应细胞株共同培养后,用3H-TdR 掺入法或 MTT 法测定,根据依赖株细胞的增殖情况,检测不同 CSF 的生物活性。
此外,也可用免疫学检测法和分子生物学检测法,其检测原理与检测其它细胞因子基本相同。
第五节 细胞粘附分子的检测
白细胞和血管内皮细胞、巨噬细胞和上皮细胞等以及血液中均存在细胞粘附分子。按其结构特 1 瀀,分有钙离子依赖性家族、整合素家族、免疫球蛋白超家族和选择素家族四大类。在各种细胞因子、内毒素、凝血酶等作用下,细胞粘附分子由细胞内贮存池转移至细胞膜或合成增加,导致细胞表面的粘附分子数量增多。因此在某些疾病中细胞粘附分子的数量有改变。此外,细胞粘附分子经磷酸化、糖基化等修饰作用可发生构象改变,导致其亲和力和扩散速率改变而影响其功能,因此定量检测细胞粘附分子的数量、亲和力及扩散速率对探索某些疾病的发病机制、监视疾病的发生、发展过程和指导临床治疗有重要意义。目前的检测方法,大多限于用免疫学技术检测其数量,而有关分子的亲和力及扩散速率的检测正在建立中。
一、细胞表面粘附分子的检测
1.放射免疫测定法通常用抗细胞粘附分子抗体包被载体,加受检样品后,继加相应单克隆抗体和同位素标记的二抗作非竞争性固相放射免疫测定法。2.免疫荧光测定法除常规的间接免疫荧光法外,有条件的实验室,用不同激发波长的荧光素着染色受检细胞,在 FACS 仪上可同时检测有两种不同的细胞粘附分子。3.酶免疫测定法主要为双抗体夹心 ELISA,本法应用最广,但仅能检出一群细胞的表面粘附分子数量,而不能反映单个细胞粘附分子数量的变化。
二、可溶性粘附分子的检测
多采用双抗体夹心 ELISA,研究最多的选择素家和免疫球蛋白超家族。前者有 E、L、P 三型,均可见血液中。溶血性尿毒症和血小板减少性紫癜患者血液中,P 选择素比正常人高 2~3 倍,而败血症、HIV 感染和艾滋病患者血液中 L 选择素明显增高。血液中存在可溶性 E 选择素是内皮细胞激活的证据,败血症、糖尿病等患者血液中 E 选择素水平增高,一般与疾病的活动性无关,而与器官受损程度相关。如败血症患者,可溶性 E 选择素可增高 20 倍以上,据称与疾病的严重性或预后有关。肝炎、肝硬化等患者血液中超免疫球蛋白家族中 ICAM- 1 水平增高,与肝功能损害指标相关。总之,现已发现许多疾病可见细胞粘附分子数量的异常,但这类工作尚处于探索阶段,有待深入研究和资料的积累才能判断其确切的临床意义。
免疫学检验
第二十四章 变态反应的检验
第一节 变态反应的类型及检验原则
变态反应(allergy)是由免疫炎症或其他免疫应答机制所致的组织损伤或功能障碍,也称为超敏反应(hypersensitivity)。诱发变态反应的抗原称为变应原,可以是完全抗原,也可以是半抗原;可以是外来抗原,也可以是自身抗原。自身抗原引起的病理状态又称自身免疫病(见第二十五章)。
按照发生机制(见第八章)的不同,变态反应可分为若干类型;多数学者习惯上接受 4 型分类法(表 24-1)。
表 24-1 变态反应的分类比较
| 型别 | 别名 | 发生机制 | 主要相关疾病 |
| Ⅰ型 | 即刻型、反应素型、过敏反应 | IgE/ 肥大细胞和嗜碱性粒细胞介导的血管和平滑骨反应 | 支气管哮喘、药物过敏荨麻诊、过敏性鼻炎、过敏性休克等 |
| Ⅱ型 | 细胞毒型,细胞结合抗原型 | IgG,IgM/ 补体或粒细胞介导的靶细胞溶解和吞噬等 | 新生儿溶血症、自身免疫性溶血性贫血、特发性血小板减少性紫癜等 |
| Ⅲ型 | 免疫复合物型 | 免疫复合物 / 补体介导的组织炎症 | 血清病、皮肤血管炎、系统性红斑狼疮、类风湿性关节炎等 |
| Ⅳ型 | 迟发型(细胞介导型)超敏反应 | TH细胞介导的浸润性炎症 | 接触性皮炎、移植排斥反应、结核病等 |
(一)Ⅰ型变态反应
诱导Ⅰ型变态反应的抗原多是外源性的,例如花粉、尘螨、青霉素、食品等,可经呼吸道、消化道或皮肤等途径进入机体,刺激机体产生 IgE 或 IgG4,结合到肥大细胞和嗜碱性粒细胞上,使宿主进入致敏状态。变应原再次进入机体时,可与细胞表面的 IgE 或 IgG4 结合,诱导细胞脱颗粒,释放炎症介质,引起一定部位的血管和平滑肌反应。相关疾病有:支气管哮喘、过敏性鼻炎、过敏性胃炎、荨麻疹、过敏性休克等。Ⅰ型变态反应发生迅速,临床常见的严重病例是青霉素引起的过敏性休克,如不及时抢救患者会很快死亡。但型变态反应一般不引起组织损伤,所以刺激因素解除后康复也快。
Ⅰ型变态反应的检验有多种方法:①皮肤试验,例如青霉素皮试;②激发试验,例如支气管激发试验;③血清 IgE 测定。Ⅰ型变态反应的临床诊断并不困难,实验室检查的主要目是明确过敏原,以采取适当的回避措施,或者必要时进行特异性脱敏治疗。
(二)Ⅱ型变态反应
Ⅱ型变态反应涉及的抗原比较复杂,药物、病毒或自身抗原都可成为变应原,刺激机体产生 IgG 或 IgM 类抗体,抗体可特异性地结合到位于细胞表面的抗原上,活化补体、溶解靶细胞、诱导粒细胞浸润及吞噬作用。涉及的疾病有新生儿溶血症、自身免疫性血性贫血、特发性血小板减少性紫癜、重症肌无力、部分肾小球肾炎、肺出血-肾炎综合征等。
少数情况下,某些抗体与靶细胞结合可刺激靶细胞兴奋,导致非常特殊的效果。例如抗体促甲状腺素受体的抗体可使甲状腺细胞过度分泌甲状腺素而引起甲状腺功能亢进;有些抗体诱导 ADCC 作用引起慢性淋巴细胞性甲状腺素等。这两型特殊的Ⅱ型变态反应曾被命名为Ⅴ型和Ⅵ型变态反应。
Ⅱ型变态反应的检验主要是针对引起反应的特异性抗体;但Ⅱ型变态反应主要涉及血液系统疾病和自身免疫病,有关内容参见血液学检验教材和本书第二十五章。
(三)Ⅲ型变态反应
Ⅲ型变态反应的抗原多是蛋白质分子,刺激机体产生大量 IgG 和 IgM 类循环抗体,抗原与抗体结合形成的免疫复合物(immunecomplex,IC)在一定条件下可沉淀于局部组织,激活补体引起炎症反应。涉及的疾病有血清病、结缔细胞病及局部 Arthus 反应等。
Ⅲ型变态反应的检验主要是检测循环免疫复合物或组织固定的免疫复合物;还可进一步检测免疫复合物中的抗体特异性;有时候也可用皮肤试验进行测定。
(四)Ⅳ型变态反应
Ⅳ型变态反应是细胞免疫介导的炎症,没有抗体和补体参与,发生较为缓慢,所以又称为迟发型超敏反应(DTH)。涉及的疾病有接触性皮炎、结核病、移植排斥性反应等。
Ⅳ型变态反应的检验可从多方面进行。要以用促有丝分裂原或结核菌素检测 T 细胞的敏感状态;也可用抗原检测机体的特异性致敏状态;还可通过检测细胞因子或者皮肤试验的办法进行检验。
第二节 皮肤试验
皮肤试验(skintest)简称皮试,是在皮肤的体内免疫学试验。当试验抗原进入致敏者皮肤时,皮肤中结合有 IgE 的肥大细胞或致敏 T 细胞就会与试验抗原结合,引发即刻型或迟发型的皮肤超敏反应。试验抗原也可从注射部位进入微血管,与循环中的相应抗体结合,形成的免疫复合物可在局部沉积,激活补体引起炎症。所以皮肤试验主要用于检测型和型变态反应,有时也用于检测Ⅲ型变态反应。
一、试验准备
首先应当制备试验用抗原,如有合格商品可直接购买。可以作为变应原的物质种类繁多,例如动物皮毛、家禽羽毛、鸽粪、昆虫、螨类、真菌、花粉、杂草、物理粉尘和各种食品等都可能成为变应原。
不同抗原的制备方法不同,但一般包括以下几个步骤:①收集原料;②粉碎与匀浆;③脱脂与提取;④过滤与分离;⑤分装保存。分装保存之前应对提取产物进行鉴定。首先必须经过无菌试验、急性毒性试验和热原检查,保证提取产物无明显的毒副作用;还要测定产物的蛋白含量,用凯氏定氮法或磷钨酸沉淀法标定出总氮单位或蛋白氮单位。
变应原的范围很广,难以做得完全,所以查找变应原需依靠患者的病史和医师的经验以将可疑范围缩小, 学样成功的机会就大得多。一般医院和卫生所都能做药物过敏试验,多在注射室完成;防疫部位在一些免疫接种之前有时也要做皮肤试敏;其余的均在变态反应科或检验科的专门实验室。实验室应有专人负责,除具备各种专用试验器材之外,还应备有意外抢救的药品及设施。
试验部位应清洗干净,严格消毒,以免皮肤的不洁物引起非特异性反应或感染。当皮肤患湿疹、感染、皮炎或外伤时不宜进行皮肤试验。正在或近日服用免疫抑制剂或抗组胺药物者也不宜进行皮肤试验。
二、试验类型及方法
皮肤试验的最常用部位是前臂曲侧,因此处皮肤较为光滑细腻,而且便于试验操作和结果观察。按正规作法,左右两臂一侧作试验,另一侧作对照。需要时也可选用上臂或背部皮肤。具体试验方法可分为皮内试验(intracutaneoustest)、挑刺试验(pricktest)和斑贴试验(patchtest)。
1.皮内试验将试验抗原与对照液各 0.0~20.03ml 用皮试针头分别注入皮内(不是皮下),使局部产生一个圆形小丘。当同时试验多种抗原时,相互间至少间隔 4cm,以免强烈反应时互相混淆结果。
皮内试验的敏感性比其他皮肤试验高,所用抗原应适当稀释,以免出现严重反应;当高可疑性抗原出现阴性结果时,应逐渐加大抗原浓度进行重复试验。
皮内试验是最常用的皮肤试验,应用范围也很广,几乎各类抗原及各型反应都可用皮内试验进行测定,只是不同类型的反应观察结果的时间和判定结果的标准不所不同。
2.挑刺试验也称点刺试验或刺痕试验。将试验抗原与对照液分别滴于试验部位皮肤上,用针尖透过液滴或在皮肤上轻轻地挑刺一下,以刺破皮肤但以不出血为度;1min 后拭(吸)去抗原溶液。同时试验多肿抗原时,千万注意不要将不同的抗原液交叉混合,以免出现假阳性。
挑刺试验主要用于型变态反应,该法虽比皮内试验法敏感性稍低,但假阳性较少,与临床及其他试验的相关性较强。
划痕试验(scratchtest)是挑刺试验的一个变型,用三棱针或注射器针头在皮肤划一条或多条约 1cm 长的创痕。因为划痕的轻重与长短难于掌握一致,故不常用。
3.斑贴试验将试验抗原直接贴敷于皮肤表面的方法。试验抗原为软膏时可直接涂沫在皮肤上;如为固体物时可用蒸馏水混合或浸湿后涂敷于皮肤上;如为水溶液则浸湿纱布后敷贴于皮肤上。所用抗原浓度以不刺激皮肤为原则,涂敷范围以 0.5~1cm 为宜。涂敷后盖以油纸或玻璃纸,用纱布或绷带固定;如有明显不适感可随时打开查看,并进行适当处理。
斑贴试验主要是检测Ⅳ型变态反应,敏感程度虽然不太高,但假阳性较少,结果的可信度大。
三、结果判定及分析
1.Ⅰ型变态反应在抗原刺激后 20~30min 内观察结果。挑刺试验的阳性反应以红晕为主,皮内试验的阳性反应则以风团为主,判定标准见表 24-2。
表 24-2 速发型皮肤试验的结果判定标准
| 反应程度 | 皮内试验 | 挑刺试验 |
| - | 无反应或小于对照 | 无反应或小于对照 |
| + | 风团 3~5min,红晕<20mm | 红晕>对照,≤20nm |
| ++ | 风团 6~9mm,伴红晕 | 红晕>20mm,无风团 |
| +++ | 风团 10~15mm,伴红晕 | 红晕伴有风团 |
| ++++ | 风团>15mm,红晕伴伪足 | 红晕伴伪足和风团 |
2.Ⅳ型变态反应在接触抗原后 48~72h 内观察结果。皮内试验的阳性结果以红肿和硬结为主,斑贴试验的阳性结果以红肿和水疱为主。判定标准见表 24-3。
表 24-3 迟发型皮肤反应试验的结果判定标准
| 反应程度 | 皮内试验 | 斑贴试验 |
| - | 无反应或小于对照 | 无反应或小于对照 |
| + | 仅有红肿 | 轻度经肿,搔痒 |
| ++ | 红肿伴硬结 | 明显红肿,时有红斑 |
| +++ | 红肿,硬结,水疱 | 红肿伴豆疹,水疱 |
| ++++ | 大疱或(和)溃疡 | 红肿,水疱伴溃疡 |
有时候,机体对某变应原可能同时存在多种类型的反应。例如在做青霉素皮内试验时,30min 内观察呈阴性反应,但在 5~8h 可能会出现Ⅲ型变态反应,反应的外观现象介于Ⅰ型与Ⅳ型变态反应之间;甚至还可能出现型变态反应。
3.假性结果在一定条件下,皮肤反应的结果可能与机体的实际情况不符,即出现假阳性或假阴性等不真实的结果。
出现假阴性的常见原因有:①试验抗原的浓度过低,或者因各种原因失效;②试验时正服用免疫抑制剂或抗组胺药物(后者可通过设立组胺阳性对照而判断出来;③操作误差,例如皮内试验时注射过深进入皮下,注入抗原量过少等;④皮试季节选择不当,例如花粉季节过后,抗花粉抗体水平可下降。
出现假阳性的常见原因有:①试验抗原不纯,在提取、配制,甚至在试验过程中被其他抗原污染,引起交叉反应;②试验溶液配制不当,过酸或过碱都会对皮肤产生非特异性刺激;③皮肤反应性过强,例如被试者患有皮肤划痕症,或者有既往过敏的痕迹等;④操作不当,例如注入少量空气也可出现假阳性。
四、应用与评价
皮肤试验属于活体试验,虽然影响因素众多,却能反应机体各种因素综合作用的实际免疫状态;并且简单易行,结果的可信度大;这些优点是其他方法难以替代的,所以在临床和防疫工作中都经常应用。
1.寻找变应原变态反应防治的重要原则之一是回避变应原,而回避的前提是明确变应原,确定变应原的常用方法便是各种类型的皮肤试验。例如支气管哮喘和荨麻疹等均可用皮肤试验来。但食物过敏与皮肤试验的相关性较差,这可能是因为食物的抗原提取液与肠吸收的物质有所不同,或食物过敏并非 IgE 所介导;而且,食物过敏的变应原容易发现,一般不必作皮肤试验。
2.预防药物或疫苗过敏对患者首次注射某批号的青霉素、链霉素或其它易过敏药物之前,必须做过敏试验;如果患者呈阳性反应(即使是可疑阳性),就应更换其他抗生素。注射导种抗血清(例如抗破伤风血清和抗狂犬病血清)前也必须做过敏试验,如果呈阳性反应就需要换用精制抗体;或进行脱敏治疗(少量多次注射,使抗原逐渐中和血液中的抗体)。
3.评价宿主细胞免疫状态在可疑免疫缺陷病、肿瘤或器官移植进,了解患者的细胞免疫状态对疾病诊断和预后判断都有重要意义。这种情况下可以使用共用抗原结核菌素(OT 或 PPD)或双链酶(SD-SK)进行皮肤试验;或使用人工合成的二硝基氯苯(DNCB)或二硝基氟苯(DNFB)等先进行致敏再作皮肤试验,这样可消除抗原接触史不同所致的误差。
4.传染病的诊断对某些可疑的传染病,用某种病原体的特异性抗原进行皮肤试验可以起到诊断或鉴别诊断的作用。例如对布氏菌病和软下疳等细菌感染、对某些病毒感染和真菌感染、以及某些寄生虫感染均有一定的意义。
另外,还有一些反应机制不同于变态反应的中和性皮肤试验,例如诊断白喉的锡克(Schick)试验和诊断猩红热的狄克(Dick)试验等。
第三节 激发试验
激发试验(provocationtest)是模拟自然发病条件、以少量致敏原引起一次较轻的变态反应发作、用以确定变应原的试验。主要用于Ⅰ型变态反应,有时也用于Ⅳ型变态反应的检查,尤其在皮肤试验或其他试验不能获得肯定结果时,此法可排除皮肤试验中的假阳性反应和假阴性反应。
激发试验或分为特异性激试验和非特异性激发试验。非特异性激发是用组胺或甲基胆碱做雾吸入,以观察患者对Ⅰ型变态反应的敏感性,从而进行病因分析或疗效判定;特异性激发是用抗原做试验,对明确变应原有一定价值。根据患者发病部位的不同,可以进行不同器官的激发试验,常做的是支气管激发试验(BPT)、鼻粘膜激发试验和结膜激发试验。
一、支气管激发试验
1.试验方法 先用肺量计测定 BPT 前的肺通气功能,常用指标为第一秒用力呼气量(FEV-1)和肺活量;然后用喷雾器将对照液和抗原液或者非特异性刺激剂输出,患者直接经口或用面罩吸入;吸入抗原后 15~20min 复查 FEV-1。无反应者可加大抗原量继续试验。
2.结果判定 阳性结果的判定标准如下:①明显自觉症状,如胸部紧迫感和喘息等;②肺部闻及哮鸣音;③FEV- 1 下降 20%以上。
反应类型包括以下几种:①速发型,在十几分钟出现症状,为Ⅰ型变态反应;②缓发型,在 6~12 小时出现症状,为Ⅲ型变态反应;③迟发型,在 24 小时以后出现,为Ⅳ型变态反应;④多相反应,速发反应后又出现缓发及迟发反应。
3.应用及评价 BPT 较皮肤试验的特异性高,与患者的病史、症状和过敏原吸附试验的相关性较强。常用于确定支气管哮喘的过敏原、检验新制剂的抗原性、评价平喘药疗效以及观察脱敏治疗的结果等方面。本法的缺点是每次只能测试一种抗原,要求有一定专门设备和技术,并需取得病人合作。
4.注意事项 BPT 偶可引起严重的反应,所用抗原浓度不宜过高,应该由小到大递增;试验前必须做好系列抢救准备,对反应较重者,需及时吸入舒喘灵等气管解痉剂或皮下注射肾上腺素。
二、其他激试验
1.结膜激发试验 球结膜背景明亮、毛细血管组织排列整齐,反应结果容易观察,是一个较为理想的变态反应试验场所。将适当浓度的变应原浸液滴入患者一侧眼结膜,另一侧滴入生理盐水作对照;15~20min 观察结果。试验侧结膜充血、水肿、分泌增加、痒感,甚至出现眼睑红肿等现象者为阳性反应。
该试验主要用于眼部变态反应病的过敏原检查。注意抗原液中任何刺激性物质均可导致假阳性;出现较重反应者应立即用生理盐水冲洗。
2.鼻粘膜激发试验 可经抗原吸入法(粉剂)或滴入法(液体)进行,接触抗原 15~20min 后出现粘膜水肿和苍白,病人出现鼻痒、流涕、喷嚏等症状可即判为阳性反应。主要用于诊断花粉病和变应性鼻炎。如果出现较严重反应时可用稀释的去甲肾上腺液进行鼻腔冲洗,必要时按变态反应性鼻炎急性发病给药。
3.口腔激发试验 将变应原直接与口腔粘膜接触,阳性反应为口腔粘膜肿胀和充血。主要用于食物、药物或其他变应原的检查。
4.泌尿生殖系统试验 将抗原用适宜大小的子宫帽固定于子宫颈,放入阴道内;或通过导尿管导入尿道内。阳性反应表现为粘膜卡他性炎症,分泌物中可查见嗜酸性粒细胞。本试验多用于测试对避孕药、泌尿生殖道外用药和造影剂的敏感性。
5.冰水试验 将装满冰水的试管倒扣于背部皮肤,1min 后局部出现风团为阳性反应。本试验对寒冷性荨麻疹具有诊断意义。
第四节 血清 IgE 的检测
IgE 和 IgG4(以下只用 IgE 代表)是介导Ⅰ型变态反应的抗体,因此检测血清总 IgE 和特异性 IgE 对Ⅰ型变态反应的诊断和过敏原的确定很有价值。
一、总 IgE 的测定
(一)测定方法
正常情况下血清 IgE 仅在 ng/ml 水平,用常规测定 IgG 或 IgM 的凝胶扩散法检测不出 IgE,必须用高度敏感的放射免疫测定法及酶联免疫测定法进行检测。
1.放射免疫吸附剂试验(radioimmunosorbenttest,IRST)是将抗 IgE 吸附到固相载体上用以检测血清 IgE 的方法,故又称固相放射免疫测定(SPRIA);临床常用双抗体夹心法,多以滤纸为载体。将抗 IgE 抗体偶联到经溴化氟活化的滤纸上,使其与待检血清及 IgE 参考标准进行反应;洗涤后加入125 I 标记的抗人 IgE,再经洗涤后测定滤纸片的放射活性,其测定值与标本中的 IgE 含量呈正相关。
2.酶联免疫测定法测定血清 IgE 时也常用双抗体夹心 ELISA 法(详见第十五章),操作方便,敏感性也很高,在临床上经常应用。
3.间接血凝试验用抗 IgE 至敏红细胞,将标本血清做系列稀释后与致敏红细胞反应。此法更加简便易行,便于普及,但敏感性比上两法稍低。
(二)临床意义
血清总 IgE 水平一般用国际单位(IU)或 ng 表示,1IU=2.4ng,相当于 WHO 标准冻干血清制剂 0.00928mg 内所含的 IgE 量。正常人群 IgE 水平受环境、种族、遗传、年龄、检测方法及取样标准等因素的影响,以致各家报道的正常值相差甚远。婴儿脐带血 IgE 水平小于 0.5IU/ml,出生后随年龄增长而逐渐升高,12 岁时达成人水平。成人血清 IgE 水平约在 20~200IU/ml 之间,一般认为大于 333IU/ml(800ng/ml)时为异常升高。
IgE 升高相关的常见疾病有:过敏性哮喘、季节性过敏性鼻炎、特应性皮炎、药物性间质性肺炎、支气管肺曲菌病、麻风、类天疱疮及某些寄生虫感染等。上述疾病时 IgE 升高的程度并不一致,在过敏性支气管肺曲菌病时最为显著,其值可达 5000~20000ng/ml,除了此病和特应性皮炎以及在花粉季节之外,任何血清总 IgE 水平大于 5000ng/ml 的患者均应考虑寄生虫感染的可能性。
二、特异性 IgE 的测定
(一)测定方法
特异性 IgE 是指能与某种过敏原特异性结合的 IgE,因此需要用纯化的变应原代替抗 IgE 进行检测;常用的方法仍然是放射免疫技术和酶标免疫技术。
1.放射变应原吸附剂试验(radioallergosorbenttest,RAST)将纯化的变应原与固相载体结合,加入待检血清及参考对照,再与同位素标记的抗 IgE 抗体反应,然后测定固相的放射活性,通过标准曲线求出待检血清中特异性 IgE 的含量,或在标本放射活性高于正常人均数加 3S 时判为阳性。
2.酶联免疫测定法试验原理及步骤基本同 RAST,仅是最后加入酶标记的抗 IgE,利用酶底物进行显色。测定结果的表示也与 RAST 相同。
(二)临床意义及评价
RAST 是目前公认的检测型变态反应的有效方法之一,具有特异性强、敏感性高、影响因素少、对患者绝对安全等优点;不但有助于过敏性哮喘的诊断,对寻找变应原也有重要价值。RAST 与皮肤试验和支气管激发试验的符合率在 80%左右,但不能完全代替后两种试验,因为活体试验还能反映嗜碱性粒细胞和靶细胞的反应性。
但是 RAST 也有许多缺点:费用昂贵、花费时间长、放射性同位素易过期而且污染环境、不同来源试剂盒的参比血清不同而不易相互比较、待检血清含有相同特异性 IgG 时可干扰正常结果。因此一般只在下列情况下才做 RAST:①皮试结果难以肯定、但需提供进一步的诊断证据者;②不适宜做皮试或激发试验者,例如老年、幼儿、妊娠妇女、患有皮肤病、对变应原有严重过敏史或正服用抗过敏药物以及重病者;③观察脱敏治疗效果或研究变态反应机制。
ELISA 法与 RAST 有相似的优点,而且还有独特的长处,如没有同位素污染、酶标抗体可长期保存,因此在国内应用较多。用 ELISA 测试屋尘和一些花粉的结果与 RAST 符合率较高,且与临床也较符合,但与皮肤试验的符合率可能不够理想。
第五节 免疫复合物的检测
免疫复合物在体内存在有两种方式,一是存在于血液中的循环免疫复合物(CIC),一是组织中固定的免疫复合物。免疫复合物的检测技术可分为抗原特异性方法和非抗原特异性方法。在大多数情况下,免疫复合物中的抗原性质不太清楚或非常复杂,所以抗原特异性方法并不常用。
一、循环免疫复合物的检测
根据免疫复合物的物理学、免疫学和生物学特性,已经设计出很多检测 CIC 的方法(表 24-4),本章只述及常用的代表性方法。
表 24-4 循环免疫复合物的常用检测方法
| 类别 | 原理 | 方法 | 敏感性 | 备注 |
| 物理法 | 分子大小 | 1. 超速离心 | - | 适于研究 |
| 2. 分子超滤 | - | 适于研究 | ||
| 3. 凝胶过滤 | 30μg | 适于研究 | ||
| 溶解度 | 1.PEG 沉淀 | 20μg | 粗定量, 易推广 | |
| 2. 冷沉淀 | - | 定性, 临床应用 | ||
| 补体法 | 固定补体, 结合 C1q | 抗补体试验 | 0.1μg | 常用, 特异性差 |
| 1.C1q 凝胶沉淀试验 | 100μg | 定性, 不易普及 | ||
| 2.C1q 偏离试验 | 4μg | 不易普及 | ||
| 3. 液相法 | 10μg | 不易普及 | ||
| 4. 固相法 | 1μg | 不易普及 | ||
| 胶固素 | 胶固素结合试验 | 3μg | 敏感, 稳定 | |
| 抗 Ig 法 | 结合 RF | 1.RF 凝胶沉淀试验 | 100G | 定性, 不敏感 |
| 2.mRF 固相抑制试验 | 1~20μg | 不易普及 | ||
| 3.PRF 凝集抑制试验 | 1~10μg | 不易普及 | ||
| 结合 Ig | 抗抗体法 | 2~3μg | 不易普及 | |
| 细胞法 | Fc 受体 | 1. 血小板凝集试验 | 1~4μg | 需新鲜制备 |
| 2.ADCC 抑制试验 | 5~10μg | 细胞活性质控难 | ||
| 3.Mφ 吞噬抑制试验 | 0.03μg | 细胞活性质控难 | ||
| 补体受体 | 1.Raji 细胞法 | 6μg | 需维持细胞株 | |
| 2. 花环抑制试验 | 10μg | 影响因素多 |
(一)物理测定法
1.聚乙二醇法聚乙二醇(PEG)是乙二醇聚合而成的无电荷形多糖分子,分子量变化范围较大,常用的分子量是 6000。用 3%~4%浓度的 PEG 可以选择性地将大分子免疫复合物沉淀下来,其作用机制尚不甚清楚。将 PEG 溶液与待检血清混合,置 4℃冰箱过夜后离心,将沉淀物用 PEG 溶液充分洗涤,重新溶解于 0.01mol/ L 的 NaOH 中,在波长 280nm 下测量溶液的吸光度;也可利用散射比浊法直接测定 PEG 沉淀的免疫复合物;以不同浓度的热聚合 IgG 作为参考标准来计算 CIC 的含量。
聚乙二醇法简单易行,可在临床工作中推广。但此法易受多种大分子蛋白和温度的干扰,特异性稍差。PEG 法还特别适用于沉淀获得 CIC,再进行解离分析其中的抗原与抗体。
2.冷球蛋白测定在某些病理情况下,血清中的免疫复合物具有可逆性冷沉淀的特性,于 4℃冰箱中放置 1~3 天可自发地沉淀下来(参见第二十六章);此种情况多见于冷球蛋白血症,所涉及的抗原包括自身的 IgG、IgM、核苷酸、肿瘤相关抗原、肾小管上皮、甲状腺球蛋白、红细胞基质等,还有外源性抗原如乙肝病毒、EB 病毒、巨细胞病毒、牛白蛋白和马蛋白等。
(二)补体相关测定法
IgG 和 IgM 类抗体与抗原结合后,重链 CH2 区的补体结合点暴露,可以固定 C1q 并激活补体的系列反应,这是利用补体有关技术检测免疫复合物的基础。
1.C1q 结合试验将待检血清先行加热 56℃30min,以灭活其中的补体和破坏已与 CIC 结合的 C1q,空出补体结合点。CIC 与 C1q 的结合可用多种方法进行检测,常用的有以下 3 种。
(1)液相法:先将同位素标记的 C1q 与灭活过的血清标本混合作用,再加入 0.5%(终浓度)的 PEG 将结合了 C1q 的 CIC 沉淀下来,通过检测沉淀物中的放射活性来计算 CIC 的含量。
(2)固相法:先将 C1q 吸附于固相载体表面,加入待检血清使 CIC 与 C1q 结合,再加入同位标记的或酶标记的抗人 IgG 或 SPA,最后检测其放射活性或酶活性。
(3)C1q 偏离试验:先将同位素标记的 C1q 与灭活的血清标本混合,再加抗体致敏的绵羊红细胞,温育后离心,检测红细胞上的放射活性。红细胞的放射活性与免疫复合物的量呈负相关。
2.补体试验本法的原理类似补体结合试验。将一定量的补体(多为混合豚鼠血清)与灭活的待检血清混合温育,反应后加入致敏绵羊红细胞。如出现溶血表示血清中没有 CIC 存在;不溶血说明标本中有 CIC 存在。将血清标本做不同稀释,并与已知的热聚合 IgG 作对照,可以计算出 CIC 的含量。本方法的灵敏度较高,且易于在一般实验室开展,不足之处是特异性较差。
3.胶固素结合试验胶固素(conglutinin)是牛血清中的一种正常蛋白,能与 C3d 特异性结合;体内与补体结合的 CIC 都带有 C3d,因此胶固素可与 CIC 结合。用一定量的胶固素包被塑料管,往管中加入稀释的血清标本,温育后再加入同位素标记或酶标记的抗人 IgG 抗体,最后检测各管的放射活性或酶活性,计算 CIC 的含量。
胶固素性质稳定、容易保存、来源方便、价格便宜,检测方法也不复杂,便于推广。本法的不足是只能检出已结合补体的 CIC,但不论何种激活途径都一样检出,并可用作 CIC 分离。
(三)抗球蛋白测定法
类风湿因子(RF)为抗 IgG 的自身抗体,与变性 IgG、热聚合 IgG 和 IC 都有较强的亲和力。单克隆 RF(mRF)可从待发性冷球蛋白血症的血清中提取,多克隆 RF(pRF)可从类风湿性关节炎的血清中提取。用 mRF 比 pRF 的敏感性更高一些。
1.mRF 固相抑制试验将 mRF 吸附于固相载体上,随后加入血清标本,再加入同位素标记的可溶性热聚合 IgG。如果标本中含有 IC,固相 mRF 已与 IC 结合,热聚合 IgG 与 mRF 的结合使被抑制,所以固相中的放射活性与 CIC 的含量呈负相关。
也可用同位素标记的 mRF 先与血清标本反应,再加入热聚合 IgG 附着的琼脂糖珠,温育并离心洗涤后测量沉淀物的放射强度,测定值与 CIC 的含量呈负相关。此法的敏感性比前法更高一些。
2.pRF 胶乳凝集抑制试验将 pRF 与血清标本混合,再加入 IgG 致敏的胶乳悬液。如果标本中有 CIC 存在,则 pRF 先与之结合,凝集反应呈阴性。
3.抗抗体法抗抗体可存在于极个别的健康人血清中,是一种抗 IgGF(ab')2的 IgM 类抗体,能与已结合抗原的 IgG 反应,但不与游离的 IgG 或热聚合 IgG 反应,因而特异性较高。先将抗抗体与待检血清混合,再加入 IgG 致敏的人 O 型 Rh+红细胞;如标本中有 CIC 存在,抗抗体被中和,致敏红细胞不出现凝集。
以上各种抗球蛋白试验以 mRF 法敏感性最高,但是 mRF 较难寻找。这类方法易受内源性 RF 的干扰,最好先行检查并除去标本中的内源性 RF 后再行试验。若遇标本中有聚合 Ig,RF 法也易出现假阴性;改用抗抗体法可避免这种现象,但是抗抗体的来源困难。
(四)细胞技术测定
有些细胞表面具有 Fc 受体和(或)补体受体,可与免疫复合物相应成分特异性结合,因而可用来对免疫复合物进行检测。
1.Raji 细胞试验 Raji 细胞是从 Burkin 淋巴瘤患者分离的一种 B 细胞株,表面有大量 C1q、C3b 和 C3d 受体,但无表面免疫球蛋白;因此 Raji 细胞能与带有补体的免疫复合物结合。先在塑料管中加处一定量的 Raji,再加入待检血清,充分作用后离心洗涤;最后加入荧光素标记的抗人 IgG,洗涤后细胞表面显现荧光为试验阳性;但荧光法只能做定性检测。或加入同位素标记的抗人 IgG,离心洗涤后检测沉淀细胞的放射活性;以热聚合 IgG 作参考标准,可绘制出 CIC 含量与放射活性的标准曲线,从而求得待测标本中 CIC 的含量。
Raji 细胞法敏感性高、特异性强、方法简单、不受 DNA 与内毒素的影响;但 Raji 细胞表面还有 Fc 受体,因此被检血清中的游离 IgG 通过 Fc 段与 Raji 细胞结合,造成假阳性。在待检标本中有抗淋巴细胞抗体时也可导致假阳性。再则,维持 Raji 细胞的培养较困难,培养条件的变化可改变 Raji 细胞表面受体的数目及亲和性,影响检测敏感性。
2.人红细胞法人红细胞表面具有 C3b 受体,可与带有补体成分的 CIC 相结合。将待检血清与 4%的人 O 型红细胞悬液等量混合,37℃温育后离心洗涤;加入同位素标记的抗人 IgG 抗体,再温育洗涤后测定红细胞的放射活性;以热聚合 IgG 作参考标准计算出标本中 CIC 含量。但该法只能检测已结合补体的 CIC。
其他细胞法如血小板凝集试验、玫瑰花环形成抑制试验、ADCC 抑制试验、巨噬细胞吞噬抑制试验和中性粒细胞游走抑制试验等,也都可用来检测 CIC,方法的敏感性也都很高,但这些方法的影响因素多,可重复性差,所以实际中工作并不多用。
(五)免疫复合物的成分检测
免疫复合物中抗原和抗体的性质及各类的检测对临床诊治疾病及深入研究疾病的免疫病理机制有一定价值。但是由于所涉及的抗原种类很多,例如病原微生物、自身物质、各类同种抗原等,检测方法可分别参见各种抗原的检测技术。免疫复合物中的抗体主要涉及 IgG 及其亚类、IgM 和 IgA;方法是将血清中免疫复合物分离出来,再用双抗体 ELISA 夹心法等方法分析抗体的类别。
循环免疫复合物的理想检测方法应具备以下特点:①敏感性高,②特异性强,可重复性好,④操作简便,⑤适用面广。目前检测免疫复合物的方法虽发展到几十种,但还没有一种方法具备上述所有的特点,综合相比之下,C1q 结合试验、胶固素结合试验、Raji 细胞试验和 RF 抑制试验等方法比较好些。如果方法得当、试剂合格、标本新鲜、操作小心、分析谨慎、CIC 测定就会有较大的参考价值。
二、组织固定免疫复合物的检测
确定免疫复合物病的直接证据不是检出 CIC,而是在病变部位查到固定的 IC 沉积。在一些自身免疫病和免疫复合物病,例如系统性红斑狼疮、部分肾小球肾炎、类风湿性关节炎、结节性多动脉炎和寻常型天疱疮等,组织沉积免疫复合物的检出对疾病的诊断和发病机制的研究都比 CIC 的检出更有意义。
检测组织沉淀免疫复合物常用免疫组织化学技术,首先从适当的病理部位采取组织标本做冰冻切片,用荧光标记物的抗人 IgG 或抗人 C3 染色,在荧光显微镜下见到相应部位显示荧光为阳性反应(详见第十七章);也可用酶标抗人 IgG 或抗人 C3 与标本切片反应,再用酶的底物溶液显色,用普通生物显微镜即可观察到相应部位被染色(详见第十五章)。
三、免疫复合物检测的意义及应用
判定免疫复合物为发病机制的证据有三:①病变局部有 IC 沉积;②CIC 水平显着升高;③明确 IC 中的抗原性质。第三条证据有时很难查到,但至少要具备前两条,单独 CIC 的测定不足为凭。人体在健康状态下也存在少量的 CIC(大约 10~20μg/ml),其生理与病理的界限不易区分。另外,CIC 检测的方法太多,其原理各不相同,用一种方法测定为阳性,另一种方法检测可能为阴性;但与免疫组化法一起检测,其意义就大得多。
目前已经明确系统性红斑狼疮、类风湿性关节炎、部分肾小球肾炎和血管炎等疾病为免疫复合物病,CIC 检测对这些疾病仍是一种辅助诊断指标,对判断疾病活动和治疗效果也有一定意义。在发现紫癜、关节痛、蛋白尿、血管炎和浆膜炎等情况时,可考虑免疫复合物病的可能性,进行 CIC 和组织沉积 IC 的检测。另外,患有恶性肿瘤时 CIC 检出率也增高,但不出现Ⅲ型变态反应的损伤症状,称之为临床隐匿的 IC 病,然而这种状态常与肿瘤的病情和预后相关。
第六节 相关白细胞及其它因素测定
(一)嗜酸性粒细胞计数
嗜酸性粒细胞参与Ⅰ型变态反应,因此嗜酸性粒细胞增多可作为Ⅰ型变态反应的辅助诊断指标,而且可作为疗效判定的指标之一。
嗜酸性粒细胞计数可用白细胞分类计数法,也可以用直接计数法,目前多采用后者。该类细胞的胞浆颗粒中富含碱性氨基酸和碱性蛋白,其等电点为 pH11,因此呈嗜酸性,易与阴离子结合而被染色。常用的染色液含伊红、石炭酸和福尔马林,该溶液可溶解红细胞和其他白细胞,增加背景的清晰度,使嗜酸性粒细胞易于识别。
(二)嗜碱性粒细胞计数
嗜碱性粒细胞亦参与型变态反应,其计数方法主要是直接计数法。嗜碱性粒细胞胞浆颗粒中肝素的硫酸根容易与阳离子染料结合而着色,现在常用的酸性染色液包括 0.1%EDTA、阿利新蓝、氯代十六烷基吡啶和氯化镧等。该染液能使红细胞和其他白细胞溶解,使嗜酸性粒细胞易于区别。
外周血嗜碱性粒细胞数大于 33/mm3判为增高,大于 50/mm3为显著增高。本试验可作为Ⅰ型变态反应的筛选试验,阳性率可达 60%~70%;而且可作为疗效考查的辅助指标。
(三)嗜碱性粒细胞脱颗粒试验
正常嗜碱性粒细胞内含有大量嗜碱性颗粒,很容易被阳离子碱性染料甲苯胺蓝或阿利新蓝分别染成紫红色或蓝色,极易辨认和计数。当加入过敏原或抗 IgE 抗体后,与细胞表面的 IgE 结合而使细胞将颗粒脱出,细胞不再着色;从染色细胞数的减少可以判断脱颗粒的情况。本法可分为玻片法和试管法。玻片法操作稍繁锁,而且孔间误差较大;试管法用血细胞计数板观察结果,既方便又省时,重复性也较好,适于普及。
本法一 RAST 和皮肤试验的符合率都很高,可用于寻找过敏原、研究脱敏治疗的机制及判定脱敏治疗的疗效。
(四)其他检测方法
1.致敏 T 细胞检测检查 T 细胞总体反应状态和对某种抗原的致敏状态对判断Ⅳ型变态反应有重要价值,具体检测方法见第二十一章。
2.淋巴因子的检测淋巴因子在Ⅳ型变态反应的发生机制中起重要作用,所以检测淋巴因子对变态反应的研究和临床方面都有一定意义。
3.抗血细胞抗体的检测血细胞抗体是Ⅱ型变态反应的主要介质,检测抗血细胞抗体对Ⅱ型变态反应的诊断有重要的意义,具体方法和临床分析参见血液学检验教材。
还有许多检测方法与变态反应相关,例如冷抗体试验、抗基底膜抗体检测和血小板有关检测等,这些可参见本书自身免疫等有关章节,本章不予赘述。
第二十五章 自身免疫病的检验
第一节 自身免疫病概述
一、自身耐受与自身免疫
机体对某种抗原的刺激不表现出免疫应答的现象称为免疫无应答性(unresponsiveness)。这种状态主要由两种原因引起:一为机体的免疫系统异常,例如免疫缺陷病(见第二十七章);二是特异性免疫不反应,即免疫耐受性(immunetolerance)。免疫耐受产生的机制尚未完全明了,可能与抗原的性质和剂量、免疫刺激的途径和时相、以及机体的免疫状态等多方面的因素有关(参见第七章);所有不利于产生免疫应答的条件均可能诱导免疫耐受。免疫耐受是一种重要的生理现象,不论是在基础理论研究还是临床医学实践方面都具有重要的意义。例如可以用诱导免疫耐受的措施缓解变态反应、抑制器官排斥反应、治疗自身免疫病等。
正常情况下,免疫系统对宿主自身的组织和细胞不产生免疫应答,这种现象称为自身免疫耐受(autoimmunetolerance)。自身耐受是维持机体免疫和谐的重要因素,其机制与胚胎期的免疫接触有关。根据 Burnet 的克隆选择学说,在胚胎期或新生期免疫系统尚未发育成熟时,抗原刺激不会引起免疫应答,而只会引起相应淋巴细胞克隆的永久性抑制,被抑制的细胞群称为禁忌克隆。一般情况下,在胚胎期免疫系统能够接触到的抗原都是自身物质;另一方面,也几乎所有的可暴露性自身抗原都在胚胎期接触过免疫系统,所以出生后免疫系统对自身抗原表现为天然耐受状态。
当某种原因使自身免疫耐受性削弱或破坏时,免疫系统就会对自身成分产生免疫应答,这种现象称为自身免疫(autoimmunity)。微弱的自身免疫并不引起机体的病理性损伤,在许多正常人血清中可发现多处微量的自身抗体或致敏淋巴细胞。这种自身免疫现象随着年龄递增而愈加明显,在 70%以上的正常老年人血清中可查出自身抗体。这些低度的自身抗体能促进体内衰老残疾细胞的清除,帮助吞噬细胞完成免疫自稳效应,以保持机体生命环境的稳定。
二、自身免疫病的概念及特征
健康个体的正常免疫调节功能会将自身耐受和自身免疫协调在一个相辅相成的合理水平上。当某种原因使自身免疫应答过分强烈时,也会导致相应的自身组织器官损伤或功能障碍,这种病理状态就称为自身免疫病(autoimmunedisease,AID)。
自身免疫病有以下特点:
1.患者血液中可以检出高滴度的自身抗体和(或)与自身免疫组织成分起反应的致敏淋巴细胞。
2.患者组织器官的病理特征为免疫炎症,并且损伤的范围与自身抗体或致敏淋巴细胞所针对的抗原分布相对应。
3.用相同抗原在某些实验动物中可复制出相似的疾病模型,并能通过自身抗体或相应致敏淋巴细胞使疾病在同系动物间转移。
上述三个特点是自身免疫的三个基本特征,也是确定自身免疫病的三个基本条件。除此之外,目前所认识的自身免疫病往往还具有以下特点:
4.多数病因不明,常呈自发性或特发性,有些与病毒感染或服用某类药物有关。
5.病程一般较长,多呈反复发作和慢性行迁延的过程,病情的严重程度与自身免疫应答呈平行有关系。
6.有遗传倾向,但多非单一基因作用的结果;HLA 基因在某些自身免疫病中有肯定的作用。
7.发病的性别和年龄倾向为女性多于男性,老年多于青少年。
8.多数患者血清中可查到抗核抗体。
9.易伴发于免疫缺陷病或恶性肿瘤。
三、自身免疫病的发病机制
许多自身免疫病的起始原因和发病机制尚不清楚。但不论何种原因使机体产生了针对自身抗原和抗体或致敏淋巴细胞时,就可以通过各种途径导致免疫炎症,使机体发生组织损伤或功能异常,表现相应的临床症状。
1.隐蔽抗原释放机体有些组织成分由于解剖位置的特殊性,正常情况下终生不与免疫系统接触,称为隐蔽抗原。例如眼晶状体、葡萄膜和精子等都是隐蔽抗原。机体不能建立对这些组织的免疫耐受性。出生后由于感染或外伤等原因,隐蔽抗原释放出来,与免疫系统接触便能诱导相应的自身免疫应答,导致自身免疫病发生。例如交感性眼炎等。
2.自身组织改变一些理化因素(例如 X 线照射或服用某些药物)或生物学因素(例如受病毒感染)可直接引起组织抗原变性或改变细胞代谢过程的基因表达,从而改变自身抗原的性质,诱导自身应答,导致自身免疫病。例如自身免疫性溶血性贫血和特发性血小板减少性过敏性紫癜等。
3.共同抗原诱导某些外源性抗原(例如微生物)与人体某些组织有类似的抗原结构,这些抗原进入人体后诱发的免疫应答可以针对相应的组织发生反应。例如 A 群 β 溶血性链球菌与人的心肌间质或肾小球基底膜有共同抗原,所以在链球菌感染后容易发生风湿性心脏病或肾小球肾炎。
但既然是共同抗原,为什么自身组织不引起免疫应答,而外源性抗原会引起免疫应答? 这可用旁路激活途径来解释。在形成免疫耐受(例如自身耐受)时,T 细胞形成耐受状态的速度快,持续时间久;但 B 细胞产生免疫耐受慢,持续时间短;所以免疫耐受实际上经常处于 T 细胞耐受而 B 细胞敏感的不同步状态。但对 TD-Ag,单独 B 细胞敏感不足以引起免疫应答。由于 T 细胞识别抗原的载体,而 B 细胞识别半抗原决定簇;所以当共同的半抗原决定簇与另一载体(如病毒或药物)结合时,即可诱发 B 细胞活化,导致自身免疫耐受的破坏。
4.先天易感性遗传因素对自身免疫病的发生也起一定的作用。例如某些带有特殊 HLA 抗原的人群容易发生自身免疫病。
5.多克隆 B 细胞活化有许多外源性或内源性的 B 细胞活化剂(例如细菌脂多糖、淋巴因子、抗 Ig 抗体等)可以直接作用于 B 细胞,使多克隆 B 细胞活化,包括针对自身抗原的 B 细胞也活化,绕过了 T 细胞的控制而产生自身免疫应答。
6.免疫调节失常正常情况下,免疫功能处在一个调节网络的控制之下,当调节作用失控或抑制细胞缺陷时,可以使禁忌克隆的细胞复活,重新获得了对自身抗原的应答能力,就有可能发生自身免疫性疾病。所以在免疫缺陷病或恶性肿瘤时易伴发自身免疫病。这种理论很容易解释,但是很难得到证实。
人类自身免疫病的研究得益于一些实验动物,最常用的是新西兰黑小鼠 (NZB) 及其与新西兰白小鼠 (NZW) 杂交的子代。NZB 小鼠会自发地出现免疫调节失常和自身免疫病,疾病的表现与人类的系统性红斑狼疮非常相似。另外,还可在其他小鼠、大鼠、豚鼠及家兔等实验动物中人为地诱导制造出一些自身免疫病模型,例如实验性变态反应性脑脊膜炎和实验性自身免疫性甲状腺炎等。
四、自身免疫病的分类
目前自身免疫病尚无统一的分类标准,可以按照不同方法来进行分类。常用的方法有两种:①按发病部位的解剖系统进行分类,例如可分为结缔组织病、消化系统病和内分泌疾病等;②按病变组织的涉及范围进行分类,可分为器官特异性和非器官特异性两大类(表 25-1)。
表 25-1 常见自身免疫病分类
| 类别 | 病名 | 自身抗原 |
| 非器官特异性 | ||
| 系统性红斑狼疮 | 胞核成分(DNA,DNP,RNP,Sm) | |
| 类风湿性关节炎 | 变性 IgG, 类风湿相关的核抗原 | |
| 干燥综合征 | 细胞核(SS-A,SS-B), 唾液腺管 | |
| 胞浆线粒体, 微粒体, 红细胞, 血小板 | ||
| 混合性结缔组织病 | 细胞核(RNP) | |
| 器官特异性 | ||
| 乔本甲状腺炎 | 甲状腺球蛋白、微粒体 | |
| Graves 病 | 甲状腺细胞表面 THS 受体 | |
| Addison 病 | 肾上腺皮质细胞 | |
| 幼年型糖尿病 | 胰岛细胞 | |
| 萎缩性胃炎 | 胃壁细胞 | |
| 溃疡性结肠炎 | 结肠上皮细胞 | |
| 原发性胆汁性肝硬化 | 胆小管细胞、线粒体 | |
| 重症肌无力 | 乙酰胆碱受体 | |
| 自身免疫性溶血性贫血 | 红细胞 | |
| 特发性血小板减少性紫癜 | 血小板 |
一般,器官特异性自身免疫病预后较好,而非器官特异性自身免疫病病变广泛,预后不良。这处区分并不十分严格,因为在血清检查中常可出现两者之间有交叉重叠现象,如自身免疫性状腺炎是属于器官特异性自身免疫病,但患者血清中除可检出抗甲状腺球蛋白抗体外,还可检出抗胃粘膜抗体、抗核抗体和类风湿因子等。
1.系统性红斑狼疮(systemiclupserythematosus,SLE)是一种累及多器官、多系统的炎症性结缔组织病,多发于青年女性。其临床症状比较复杂,可出现发热、皮疹、关节痛、肾损害、心血管病变(包括心包炎、心肌炎和脉管炎)、胸膜炎、精神症状、胃肠症状、贫血等;疾病常呈渐进性,较难缓解。免疫学检查可见 IgG、IgA 和 IgM 增高,尤以 IgG 显著;血清中出现多种自身抗体(主要是抗核抗体系列)和免疫复合物,活动期补体水平下降。
2.类风湿性关节炎(rhumatoidarthritis,RA)一种以关节病变为主的全身性结缔组织炎症,多发于青壮年,女性多于男性。本病的特征是关节及周围组织呈对称性、多发性损害,部分病例可有心、肺及血管受累。免疫学检查可见血清及滑膜液中出现类风湿因子(rhiumatoidfactor,RF),血清 IgG、IgA 和 IgM 水平升高。
第二节 自身抗体的检测及临床意义
多数自身免疫病患者血清中都会出现自身抗体。虽然有些自身抗体在疾病中的确切意义尚未得到严格的证实,但其与疾病的相关性已得到认可,所以这些自身抗体在自身免疫病的诊断和疗效评价方面都具有重要的意义。
一、抗核抗体
抗核抗体(antinuclearantibodies,ANA)泛指抗各种核成分的抗体,是一种广泛存在的自身抗体。ANA 的性质主要是 IgG,也有 IgM 和 IgA,甚至 IgD 和 IgE。ANA 可以与不同来源的细胞核起反应,无器官特异性和种属特异性。ANA 主要存在于血清中,也可存在于其他体液如滑膜液、胸水和尿液中。
ANA 在 SIE 患者的滴度较高,但也出现在其他许多自身免疫病中,在许多研究报告中,都将检出 ANA 作为自身免疫甚至自身免疫病存在的依据。这种现象的机制尚未明了,有待于进一步研究。
(一)ANA 的类型及意义
由于细胞核成分的复杂性,不同成分的抗原性也不同;因此就会有多种不同的 ANA。
1.抗核蛋白抗体核蛋白抗原(DNP)由 DNA 和组蛋白组成。由于 DNP 抗原存在不溶性和可溶性两个部分,可分别产生相应的抗体。不溶性 DNP 抗体通常不完全被 DNA 和组蛋白所吸收,它是形成狼疮细胞的因子;可溶性抗原存在于各种关节炎病人的滑膜液中,其相应抗体也出现于 RA 病人的滑膜液中。
2.抗 DNA 抗体可以分为两大类:①抗天然 DNA(nDNA)抗体,或称抗双链 DNA(dsDNA)抗体;②抗变性 DNA 抗体,或称抗单链 DNA(ssDNA)抗体。抗 dsDNA 抗体对 SLE 有较高的特异性,70%~90%的活动期 SLE 病人该抗体阳性,效价较高,并与病情有关。抗 ssDNA 抗体可见于多种疾病中,特异性较差。
3.抗 ENA 抗体可提取性核抗原(ENA)多从动物的胸腺中提取。先将胸腺匀浆并破碎细胞,分离出细胞核;再经盐水或磷酸盐缓冲液处理后,很容易从胞核中提取出来。ENA 不含 DNA,对核糖核酸酶敏感。近年来的研究表明,ENA 可分为十几种,现仅介绍几种主要的 ENA 及其相应抗体。
(1)抗 PNP 抗体:PNA 即核糖核蛋白,对核糖核酸酶和胰蛋白酶敏感,加热 561h 变性。抗 PNP 抗体多见于混合性结缔组织病。高效价的抗 PNP 抗体对混合性结缔组织病有诊断意义,而低效价的抗 PNP 抗体可在 SIE 患者中发现。
(2)抗 Sm 抗体:该抗体在一名 Smith 姓的患者血中首次发现,便以其名字的前两个字母命名。Sm 抗原系非核酸性糖蛋白,对 DNase 及 RNase 均不敏感,但经碘酸盐及胰蛋白酶处理后可被水解。抗 Sm 抗体是 SLE 的特异性标志之一,但阳性率偏低,约为 30%~4%;可能是 SIE 的一种回忆性抗体,故在非活动期亦可检出。若将抗 dsDNA 和抗 Sm 抗体同时检测,可提高 SLE 的诊断率。
(3)抗 SS- A 抗体:SS- A 为干燥综合征(SS)的 A 抗原,可从动物胸腺的胞浆中提取。抗 SS- A 抗体主要见于 SS,但也可见于其他自身免疫病如 SLE 中。
(4)抗 SS- B 抗体:SS- B 为 SS 的 B 抗原,亦可从动物胸腺或小鼠肝细胞浆中提取,可被胰蛋白酶、轻度加热或改变溶液 pH 而破坏。13%的 SLE 及 30%的 SS 患者有抗 SS- B 抗体。
(5)抗组蛋白抗体(AHA):组蛋白是一种碱性蛋白质,含有大量的赖氨酸及精氨酸。目前已经发现组蛋白抗原可分为 5 个亚单位:H-1、H2A、H-2B、H-3、H-4。抗组蛋白抗体及其抗亚单位抗体见于 SLE 及药物诱发的 LE。SLE 病人血清中的抗组蛋白亚单位抗体检出率顺序为:抗 H -2B、抗 H -1、抗 H -3、抗 H -2A 及抗 H -4,以抗 H -2B 和抗 H - 1 为主,并与 SLE 的活动性有关。
(二)ANA 的检测方法
由于 ANA 的复杂性及多样性,故测定方法繁多。目前 ANA 常用的方法有免疫荧光法、放射免疫法、ELISA、免疫双扩散、对流免疫电泳及免疫印迹技术等。
1.免疫荧光法检测血清总 ANA 最常用的方法是荧光免疫组化法。多用小鼠肝切片或印片作为细胞核基质,结果比较稳定可靠,在荧光显微镜下见到的细胞核有荧光着色为阳性反应。如将患者血清先进行不同比例的稀释,可以做大致的定量试验,在 1:80 稀释仍然虽阳性时,对 SLE 的诊断有较大的参考价值。在油镜下观察结果,可以将 ANA 阳性的荧光现象分成 4 种主要的荧光核型,核型的确定对临床诊断有进一步的参考价值。①周边型表示抗 DNA 抗体存在;②均质型表示有抗 DNP 抗体;③斑点(颗粒)型多为抗 ENA 抗体;④核仁型多为抗核小体抗体。SLE 患者常出现周边型、匀质型或混合型,斑点型多见于混合结缔组织病,而硬皮病多为核仁型;周边型对 SLE 有较高的特异性。
近年有人用锥虫或血鞭毛虫(例如绿蝇短膜虫试验)作基质测定抗 dsDNA 抗体,因为这些血寄生虫的动基体内含大量的纯 dsNDA,无其他抗原干扰;在阳性结果时,可见鞭毛一端的动基体显示清晰的荧光。因此该试验用于测定抗 dsDNA 抗体具有特异性强和敏感性高的优点。另外,短膜虫对人畜无害,可以人工养殖,来源方便,值得推广。
2.放射免疫法常用检测抗 DNA 抗体,有 Farr 法及过滤法。①Farr 法的原理为用同位素标记 DNA,被标记的 DNA 和被检血清的抗 DNA 抗体结合,经 50%硫酸铵饱和液沉淀,然后比较沉淀物和上清液中的放射活性,从而得出 DNA 结合活性,一般结合率大于 20%为阳性。②过滤法是在分离结合物时用纤维素酯薄膜滤器(孔径为 0.45μm)进行过滤,游离的 DNA 被滤去而与抗体结合的复合物被阻留在滤膜上。
3.ELISA 临床上主要是应用间接 ELISA 检测抗 dsDNA 抗体,其重复性及敏感性均较对流免疫电泳及双扩散为高。目前已有试剂盒供应。
4.免疫印迹(immunoblotting)先将混合抗原作凝胶电泳,分离开不同的区带,然后将这些带转印到硝酸纤维素膜上,最后用酸标抗体或放射性同位素标记抗体进行检测和分析(方法见第十五章)。由于该试验不需纯化的单个抗原,可在同一固相上作多项分析检测,灵敏度高,特异性强。故目前已广泛用于自身免疫病患者血清中多种自身抗体的检测,如检测抗 Sm 抗体、抗 RNP 抗体、抗 SS- A 抗体及 SS- B 抗体等。
另外,还可用传统的琼脂双向扩散法、对流免疫电泳法、间接血凝法和补体结合试验等。这些试验要求的实验条件比较低,但敏感性也比较低。
二、类风湿因子
类风湿因子(RF)是抗变性 IgG 的自身抗体,主要为 19S 的 IgM,也可见 7S 的 IgG 及 IgA。它能与人或动物的变性 IgG 结合,而不与正常 IgG 发生凝集反应。RF 主要出现在类风湿性关节炎患者,约 70%~90%的血清中和约 60%的滑漠液中可检出 IgG 类 RF,这很可能是自身 IgG 变性所引起的一种自身免疫应答的表现。
IgG 是感染等原因诱导的免疫应答中的主干抗体,这些抗体与相应抗原结合时会发生变性;此外,在炎症等病理条件下滑漠或其他部位可能产生不正常的 IgG;这些变性 IgG 就构成自身抗原,刺激免疫系统产生各种抗 IgG 抗体。滑膜液中的 IgG 类 RF 与变性 IgG 结合而形成中等大小的免疫复合物,比血清中的 IgM 类 RF 更具有致病意义,因为这一类免疫复合物易于沉积在关节滑膜等部位,可激活补体,形成慢性渐进性免疫炎症性损伤。
RF 的检测最初是用致敏绵羊红细胞凝集试验(Rose-Waaler 法)进行检测,目前最常采用 IgG 吸附的胶乳颗粒凝集试验;但此法的灵敏度和特异性均不高,而且只能检出血清中的 IgM 类 RF。IgG 类和 IgA 类 RF 则需要用 RIA 或 ELISA 等方法检测。
RF 在类风湿性关节炎患者中的检出率很高,RF 阳性支持早期 RA 的倾向性诊断,如对年轻女性应进行 RA 和风湿热间的鉴别;而对非活动期 RA 的诊断,需参考病史。但 RF 也象 ANA 一样,并不是 RA 独有的特异性抗体。在 SLE 病人均有 50%RF 阳性,在其他结缔组织病如 SS、硬皮病、慢性活动性肝炎及老年人中均可有不同程度的阳性率。
三、其他自身抗体
(一)抗甲状腺球蛋白及微粒体抗体
这类抗体可以针对甲状腺的多种成分,以甲状腺球蛋白和微粒体为代表。抗体主要是 IgG,可以介导 ADCC 活性,引起慢性淋巴细胞性甲状腺炎,又称乔本(Hashimoto)甲状腺炎。
检测方法多用免疫荧光技术,以甲状腺组织的冰冻切片作基质。也可用 RIA、ESISA 等方法进行检查。强阳性反应或高滴度抗体对乔本甲状腺炎和原发性甲状腺功能减退症有诊断意义,抗体变化对于疾病治疗转归的评价甚为重要,对乔本甲状腺炎与甲状腺功能亢进的鉴别诊断也有较大价值。正常人血清中很少检出甲状腺抗体,或仅有 5%~10%无疾病症状人群有低度反应;女性和年龄较大的人群检出率较高。检出该抗体可提示既往患过自身病,也可能是自身免疫病的早期指标。
在甲状腺功能亢进 (Graves 病) 患者的血清中存在甲状腺刺激抗体 (TSAb),包括长效甲状腺刺激素(LATS) 和 LATS 者(LATS-P)。这些抗体作用于甲状腺细胞表面的 TSH 受体,使受体活化并促进甲状腺素的释放;过多的甲状腺素引起机体的代谢亢进。
(二)抗乙酰胆碱受体抗体
抗乙酰胆碱受体(AchR)抗体可结合到横纹肌细胞的乙酰胆碱受体上,引起运动终板的破坏,使神经-肌肉之间的信号传导发生障碍,导致骨髓肌运动无力,称为重症肌无力(myastherniagravis,MG)。疾病可发于任何年龄,最先出现的症状常是眼肌无力,进而累及其他部位,常呈进行性加重。
抗 AchR 抗体多用较敏感的方法进行检测。①ELISA 法:以 α - 银环蛇毒素包被酶标板,并与骨骼肌匀浆(含 AchR)作用,再加入待测血清和对照血清,最后加酶标抗体。试验的正常结果为阴性或≤0.03mmol/L。②放免法:将放射性同位素标记的 α - 银环蛇毒素与骨骼匀浆结合,再加入患者血清和抗人 IgG 使之沉淀,检测沉淀物的放射性。
抗 AchR 抗体的检测对 MG 具有诊断意义,且特异性和敏感性较高,大约 90%的 MG 患者阳性;伴有眼肌症状的病人,抗体效价低于普通症状的病人;同时还用来监测对该疾病免疫抑制治疗的效果。肌萎缩侧索硬化症患者用蛇毒治疗后可出现假阳性。
(三)抗平滑肌抗体
抗平滑肌抗体(ASMA)产生机制不明,但与肝和胆管的自身免疫疾病有关,尤其是慢性活动性肝炎(狼疮性肝炎)和原发性胆汁性肝硬化(PBC)。该类疾病的发生与自身免疫性密切相关,试验结果有助于诊断以及与其他肝病的鉴别诊断。
ASMA 的检测用间接免疫荧光法,用大鼠胃大弯或小弯的冰冻切片作基质;正常结果为阴性或≤1:20。检出阳性率较高的疾病有慢性活动性肝炎和 PBC;而在肝外性胆汁阻塞、药物诱发性肝病、急性病毒性肝炎及肝细胞癌等时 ASMA 的检出率极低。
(四)抗心肌抗体
在心肌受损(例如手术、感染或梗塞等)时,心肌细胞内的物质释出,作为隐蔽抗原刺激机体产生抗体。这些抗体与心脏结合可导致新的免疫性损伤,例如心包切开综合征、风湿性心脏病等。
抗心肌抗体的检测用胎儿或大鼠心肌的冰冻切片作抗原基质,进行免疫荧光检测,正常值为阴性。阳性结果相关的疾病有:心脏术后综合征、心肌梗塞后综合征和风湿性心脏病等。
(五)抗线粒体抗体(AMA)检测
抗线粒体抗体(AMA)所针对的抗原是内层线粒体膜,无器官特异性和种属特异性。该抗体主要是 IgG,与 PBC 相关,但对肝细胞或胆管没有直接的损伤效应,在疾病中的作用尚不明确。
AMA 用免疫荧光法进行检测,用大鼠肾的冰冻切片作基质;也可用补体结合试验来检测。正常结果为阴性或效价在 1:5 以下。PBC 患者可有 79%~94%为阳性反应或效价≥1:160;长期持续性肝阻塞、慢性活动性肝炎;、原因不明性肝硬化等也可呈阳性反应。但是肝外性黄疸为阴性。
(六)抗胃壁细胞抗体
抗胃壁细胞抗体(APA)可以破坏胃粘膜的壁细胞,使内因子产生障碍,有时也可发现抗内因子抗体而使其功能受阻,从而导致恶性贫血的发生。患者可无前驱症状或患有胃炎。
APA 常以间接免疫荧光法检测,用人或家兔的胃冰冻切片作抗原基质,正常成人为阴性反应,正常儿童可有 2%~20%的检出率。恶性贫血患者能检出抗胃壁细胞或抗内因子抗体。而其他各种贫血患者不能检出其中任何一种抗体。胃溃疡或胃癌等极少该抗体阳性。
(七)抗胰岛素抗体
抗胰岛素抗体在体内可与胰岛素结合形成抗原抗体复合物,使胰岛素的活性明显降低甚至无效;从而导致胰岛素依赖性糖尿病,必需注入大量胰岛素才能有疗效。该抗体主要为 IgG,其他 4 类 Ig 也存在;其中 IgE 类抗体可引起病人的变应性反应,IgM 类可能引起胰岛素耐受。
检测抗胰岛素抗体及其免疫球蛋白类别可用各种琼脂扩散试验、间接血凝和 ELISA 等方法,试验结果会有助于糖尿病的分型诊断及适当治疗。此外,还可用于监测病人的胰岛素耐量。
(八)抗肾小球基底膜抗体
抗肾小球基底膜(GBM)抗体多产生在链球菌感染后,为共同抗原交叉诱导产生。抗 GBM 抗体可引起 GBM 损伤,导致肾小球肾炎的发生。
抗 GBM 抗体的检测也是用荧光或酶免疫组化法,用动物或人的肾组织冰冻切片作抗原基质。阳性反应可见与肾小球血管走行相一致的荧光染色或酶底物染色;这与免疫复合物时斑块状分布的染色现象完全不同。试验正常值为阴性。该试验主要用于肾小球肾炎的分型诊断与鉴别诊断。约 5%的肾小球肾炎由抗 GBM 抗体引发,为自身免疫性。
(九)抗精子抗体
正常情况下精细胞是隐蔽抗原,但当外伤、手术或感染时,精子可与免疫系统接触,诱导机体产生抗精子抗体。高滴度的抗精子抗体可使精细胞的活力下降甚至数量减少,是导致男子不育症的原因之一。在部分女性也可检出抗精子抗体,可能与不孕症相关。
抗精子抗体的检测方法很多,例如精子制动试验、精子凝集试验、免疫荧光法、ELISA 法和免疫珠结合法等。抗精子抗体阳性相关的疾病有实验性输精管阻塞和输精管切断等,一部分妇女和孕妇也可检出抗精子抗体。
(十)抗血细胞抗体
抗红细胞抗体主要涉及 ABO 的 Rh 血型抗体及自身免疫性抗体,与输血、新生儿溶血症和自身免疫性溶血性贫血等相关。抗血小板和抗白细胞抗体等均与自身免疫性血液病相关(详见血液学检验教材)。
第三节 其它免疫学检测
(一)淋巴细胞检测
虽然自身免疫病多与自身抗体有关,但仍有部分疾病不存在相关的自身抗体,而与致敏淋巴细胞有关,还可能与免疫调节异常或其他因素有关。这些相关因素的检测对疾病的诊断有一定的参考意义。
1.特异性致敏淋巴细胞在溃疡性结肠炎、外周神经炎及实验性变态反应性脑脊髓炎等疾病,可能与自身反应性致敏淋巴细胞有关。虽然这些淋巴细胞在疾病中的确切作用要比自身抗体的作用更难证实,但相关性本身也具有一定参考价值。
检测致敏淋巴细胞可用器官特异性抗原作诱导剂,进行淋巴细胞转化试验或吞噬细胞移动抑制试验等;皮肤试验也能反映机体致敏情况,但有诱导致敏性或诱发变态反应的危险。实验结果需结合临床或其他检查进行综合分析。
2.淋巴细胞数量及比例前已述及,在免疫缺陷病或免疫失调时容易发生自身免疫病,所以进行淋巴细胞数量及亚群比例的检查也有一定意义。检测内容包括淋巴细胞总数、T 和 B 细胞分类计数及 CD4/CD8 亚群比例测定等。
(二)狼疮细胞试验
狼疮(LE)细胞是胞浆内含有大块状聚合 DNA 的中性粒细胞。狼疮病人血清中的抗核抗体可诱导 LE 细胞的形成,因此称为 LE 因子。用病人血清与正常人中性粒细胞一起培养,可使后者变成 LE 细胞。该试验称为狼疮细胞试验,试验过程更要 3 天连续重复进行。
系统性红斑狼疮病人有 75%~80%呈阳性。在 RA、硬皮病、部分肝炎、结节性动脉炎、多发性硬化症、皮肌炎和变态反应病等偶尔可呈阳性反应。现已证明至少有十几种药物可诱发 LE 细胞试验阳性。
(三)免疫复合物和补体检测
某些自身免疫病的活动期可出现循环免疫复合物增加及血清补体水平下降等情况,因此这两项检查对诊断部分疾病和判断疾病活动有一定意义。检测的方法多种多样,详见相关章节。
第二十六章 免疫增殖病的检验
第一节 免疫增殖病的分类
免疫增殖病(immunoproliferativedisease)是指免疫器官、免疫组织或免疫细胞(包括淋巴细胞和单核-巨噬细胞)异常增生(包括良性或恶性)所致的一组疾病。这类疾病的表现有免疫功能异常及免疫球蛋白质和量的变化。
关于免疫增殖病的分类,过去多依据增殖细胞的形成和疾病的的临床表现,现在则按增殖细胞的表面标志进行分类(表 26-1)。
表 26-1 免疫增殖病的分类
| 增殖细胞 | 疾病 |
| T 细胞 | |
| 急性淋巴细胞白血病(20%) | |
| 淋巴母细胞瘤 | |
| 部分非霍奇金淋巴瘤 | |
| Sezary 综合征 | |
| 蕈样霉菌病 | |
| B 细胞 | |
| 慢性淋巴细胞白血病 | |
| 原发性巨球蛋白血症 | |
| 多发性骨髓瘤 | |
| 重链病和轻链病 | |
| Burkitt 淋巴瘤 | |
| 其他多数淋巴细胞瘤 | |
| 传染性单核细胞增多症 | |
| 裸细胞 | |
| 急性淋巴细胞白血病(80%) | |
| 部分非霍奇金淋巴瘤 | |
| 组织-单核细胞 | |
| 急性单核细胞白血病 | |
| 急性组织细胞增多症 | |
| 其他(分类不统一) | |
| 毛细胞白血病 | |
| 其他霍奇金病 |
表 26- 1 所列血细胞异常增殖的疾病主要属于血液病学的研究领域,与免疫学检验关系最为密切的是 B 细胞异常增殖所引起的免疫球蛋白异常及水平增高,称为丙种球蛋白病(gammopathy)或者免疫球蛋白病(immunoglobulinopathy)。严格地讲,这并不是一种疾病,而是一组复杂的病理现象,主要表现为高免疫球蛋白血症(hyperimmunoglobulinemia),使血清蛋白总量超过 100mg/ml 以上。这些超常增多的免疫球蛋多数没有正常的生物活性,只会增加血液的粘滞度,发生高血粘度综合征,而正常的免疫球蛋白水平降低。按照异常增加的免疫球蛋白的性质,可将丙种球蛋白病分为多克隆丙种球蛋白病和单克隆丙种球蛋白病,本章偏重于后者。
第二节 单克隆丙种球蛋白病的临床免疫学特征
单克隆丙种球蛋白病突出的特点是患者血清在存在异常增多的单克隆蛋白(monoclonalprotein,MP,M 蛋白),其理化性质十分均一,是研究 Ig 结构、制备各亚类特异性杭血清的天然原料;但是多无免疫活性,所以又称副蛋白(paraprotein)。M 蛋白可以是 IgG、IgM、IgA、IgE 或 IgD,也可以是 κ 或 λ 轻链中的任何一型。若 κ 或 λ 轻链的合成超过重链时,则轻链游离于血清中,分子量为 45kD,容易从尿中排出,这种现象早在 1847 年就由 Bence-Jones 测知,故以他们的名字命名为本周蛋白。
血清中的 M 蛋白多来源于骨髓浆细胞的恶性增生。与其他肿瘤细胞的发生相似,关于浆细胞异常增殖的真正原因尚未明了,可能与病毒感染或基因突变有关,通过这些因素触发浆细胞增殖。单克隆丙种球蛋白病可分为良性和恶性;除原发者外,也可继发于一些良性或恶性疾病。现将常见的单克隆丙种球蛋白病与原有疾病归纳在表 26-2
表 26-2 单克隆丙种球蛋白病的分类
| 分类 | 疾病 |
| 原发性恶性单克隆丙种球蛋白病 | |
| 多发性骨髓瘤 | |
| 原发性巨球蛋白血症 | |
| 孤立性浆细胞瘤 | |
| 淀粉样变性 | |
| 重链病 | |
| 轻链病 | |
| 半分子病 | |
| 恶性淋巴瘤 | |
| 慢性淋巴细胞白血病 | |
| 继发性单克隆丙种蛋白病 | |
| 非淋巴系统肿瘤 | |
| 单核细胞白血病 | |
| 类风湿病 | |
| 慢性炎症 | |
| 冷球蛋白血症 | |
| 原发性巨球蛋白血症性紫癜 | |
| 丘疹性粘蛋白沉积症 | |
| 家族性脾性贫血 | |
| 原发性良性单克隆丙种球蛋白病 | |
| 一过性单克隆丙种球蛋白病 | |
| 持续性单克隆丙种球蛋白病 |
一、多发性骨髓瘤
多发性骨髓瘤(multiplemyeloma)为浆细胞增生的恶性肿瘤,是最为常见的免疫增殖病之一。免疫学特征为血中和尿中出现 M 蛋白、血清中正常 Ig 水平明显降低、骨髓中不成熟浆细胞比例显着升高。
患者早期可无特殊症状,仅表现为血沉增快或 M 蛋白、浆细胞增多、蛋白尿。典型病人的临床表现和病理变化为:①骨髓瘤细胞增生,浸润和破坏骨组织,造成骨质疏松和溶骨性病变,导致骨痛和不同部位的骨折;②恶性增殖的骨髓瘤细胞代替了骨髓中的正常成分,引起贫血、粒细胞和血小板减少,同时产性大量的 M 蛋白,引起血液粘度增加,或沉积于肾小管中,造成肾小管上皮细胞淀粉样变性,发生肾病综合征,严重时导致肾功能衰竭。血液粘度的增加,还将影响中枢神经系统的功能,出现昏迷以及神经功能障碍;③骨髓瘤细胞浸润其他组织,当累及脊髓和神经根受压时引起运动功能障碍甚至截瘫等。
根据血清 M 蛋白的类别不同,可将浆细胞骨髓瘤分成不同类型,其中 IgG 型居多(约 50%),其次为 IgA 型(约 25%),IgD 型较少(约 1%),IgE 型罕见。有少数骨髓瘤患者由两个克隆的浆细胞同时恶变,可出现双 M 蛋白。例如偶可见到两个 IgM 类蛋白并存或 IgG 或 IgM 类 M 蛋白并存,这种双 M 蛋白血症患者在临床上多表现为巨球蛋白血症或淋巴瘤。还有一部分患者由于恶变的浆细胞合成功能不全,只合成与分泌某类免疫球蛋白分子的部分片段,如轻链或者重链,从而表现为轻链病或重链病。
轻链病是多发性骨髓瘤的一个重是亚型,约占总数的 20%。有约 1%的骨髓瘤由于恶变的浆细胞分泌功能缺陷而呈非分泌型本周蛋白尿症,约有 50%的浆细胞骨髓瘤患者尿中出现单一的免疫球蛋白轻链,即本周蛋白;可以是 λ 型,也可以是 κ 型。约 20%的患者血中和尿中单独出现本周蛋白(轻链病),其余多数则常伴发于其他类型的骨髓瘤患者,也可出现在其他免疫增殖病(例如原发性巨球蛋白血症)中。
浆细胞白血病是多发性骨髓瘤的一外变异型,患者的恶性浆不仅在骨髓中可见,而且在血液中出现,这可与一般的骨髓瘤相鉴别,但易与其他白血病相混淆。
二、原发性巨球蛋白血症
原发性巨球蛋白血症(primarymacroglobulinemia)又称 Waldenstrem 巨球蛋白病,是一种伴有血清 IgM 增加的 B 细胞增殖病。疾病原因不明,其临床和病理学表现与多发性骨髓瘤有所不同,骨损害不常见,疾病发展类似淋巴瘤。患者除有体重减轻、乏力、贫血和肝、脾、淋巴结肿大、反复感染等一般症状外,主要表现为 IgM 过多所致的血液高粘性综合征,可出现粘膜出血和视力减退,以及一些神经症状,例如头痛、眩晕、嗜睡、甚至昏迷和全身抽搐等。由于高血容量可导致心力衰竭,所以在血清相对粘度大于 3 时即可出现临床症状,但也有粘度达 7~10 仍未有严重症状者。
增多的 IgM 主要为 19S 五聚体,也有更大的聚合物达 27S 以至 31SS,这更加重了血液粘度;少数患者也有为 7S 单体的。血清 IgM 水平一般均超过 300mg/dl,占血清总蛋白的 30%以上。骨髓中 B 细胞增生呈多态性,有含 IgM 的浆细胞和浆细胞样淋巴细胞,还有多量带 SmIgM 的淋巴细胞。另外,有些 IgM 分子具有冷球蛋白的特征,患者可伴有雷诺形象;还有约 40%的病人可出现本周蛋白尿。
三、重链病
由于浆细胞发生突变并异常增殖,合成功能障碍,只产生免疫球蛋白的重链或有缺陷的重链,不能与轻链组成完整的免疫球蛋白分子,致使血清中和尿中出现大量游离的无免疫功能的重链,称为重链病(heavychaindisease)。重链病可根据重链的类别分类,目前已报道了 γ、α、μ、δ 四种重链病,但 δ 型极为罕见,常见的有 γ、α、和 μ 三型。
1.γ 重链病多发生于 40 岁以上男性,临床表现与恶性淋巴瘤相似,可见发热、贫血、淋巴结肿大、肝脾肿大和反复感染等。主要免疫学特征为血清和尿中出现类游离重链,多为 γ1 和 γ2,但无本周蛋白;外周血中可见异常淋巴细胞或浆细胞;正常免疫球蛋白水平降低。
2.α 重链病可分为肠型和肺型,以前者较多见。肠型表现为腹痛、慢性腹泻、吸收不良、低血钙、体重明显减轻,一般不累及肝、脾和浅表淋巴结,而肠系膜淋巴结常肿大。小肠活检有浆细胞、淋巴细胞等细胞浸润。肺型较少见,表现为肺部病变与呼吸困难,并可见纵隔淋巴结肿大。α 重链病的主要免疫学特征是血清和尿中出现代浓度的类游离重链,以 α1 亚类重链多见,但无本周蛋白。空肠液标本中亦可检出链。血清蛋白电泳分析可见 β 和 α 区之间出现明显增宽的蛋白带。
3.μ 重链病多见于慢性淋巴细胞白血病的病人,发病年龄在 40 岁以上。主要症状为肝脾肿大,但周围淋巴结肿大不常见,有的可见骨损害和淀粉样变性。主要免疫学特征是骨髓中出现空泡浆细胞或者淋巴细胞,血清中出现类游离重链但含量较低,尿中可有本周蛋白。血清蛋白电泳显示异常的丙球蛋白血症,可见 α1~α2 区域的升高。免疫电泳证明,有一种能与抗 μ 链抗体起反应但不能与抗轻链抗体起反应的快速移动成分。
四、良性单克隆丙种球蛋白病
良性单克隆丙种球蛋白病(benignmonoclonalgammopathy)系指正常人血清中出现 M 蛋白,而不伴有浆细胞恶性增殖的疾病。本病一般无症状,可发生于 50 岁以上(5%)或 70 岁以上(8%)的正常人群中,这些病人只有很少数最终(有长达 24 年者)出现多发性骨髓瘤。与上述恶性病不同,本病的血清 M 蛋白水平一般不太高,不超过 20mg/dl,不呈进行性增加;血中抗体水平及活性正常;血中及尿中没有游离的轻链及重链。临床上不伴发淋巴细胞恶性增生的症状,不出现骨损害和贫血等。骨髓中浆细胞数不超过骨髓细胞总数的 10%,且形态正常。仅少数患者有可能转变为恶性病,如血中或尿中出现本周蛋白,则很可能是一个危险信号。良性和恶性单克隆丙种球蛋白病鉴别见表 26-3。
表 26-3 恶性与良性单克隆丙种球蛋白病 * 的鉴别诊断
| 症状 | 恶性单隆丙种球蛋白病 | 良性单克隆丙种球蛋白病 |
| 贫血 | 几乎都出现 | 一般无,但可因其他疾病而伴发 |
| 骨损害 | 溶骨性损害很普遍 | 不常见 |
| 骨髓像 | 浆细胞>10%,形态正常或异常 | 浆细胞在<10%,形态一般正常 |
| M 蛋白 | 常高于 2g/dl,随病情而增高 | 低于 2g/dl,保持稳定 |
| 正常 Ig | 降低 | 增高或正常 |
| 游离轻链 | 常出现在血清和尿中 | 一般呈阴性 |
* 包括原发和继发性在内
五、其他有关病症
(一)冷球蛋白血症
冷球蛋白(cryoglobulin)是指温度低于 30 时易自发形成沉淀,加温后又可溶解的免疫球蛋白。不包括冷纤维蛋白原、C 反应蛋白与白蛋白的复合物和肝素沉淀蛋白等一类具有类似特性的血清蛋白质。当血中含有冷球蛋白时便称为冷球蛋白症。这种病理状态多继发于某些原发性疾病,例如感染、自身免疫病和某些免疫增殖病。
冷球蛋白血症可分为 3 型:①Ⅰ型为单克隆型,约占总数的 25%,主要是 IgM 类,偶有 IgG,罕有 IgA 或本周蛋白。多伴发于多发性骨髓瘤、原发性巨球蛋白血症或慢性淋巴性白血病,实质上是一种特殊类型的 M 蛋白血症。②Ⅱ型为混合单克隆型,约占总数的 25%,其冷球蛋白是具有抗自身 IgG 活性的单克隆免疫球蛋白,主要是 IgM(类风湿因子),偶有 IgG 或 IgA。这些冷球蛋白常与自身 IgGFc 段上的抗原决定簇相结合,呈 IgG-IgM 等复合物状态。多伴发于类风湿性关节炎、干燥综合症、淋巴增殖疾病和慢性感染等,也有少数的自发性混合冷球蛋白血症。③Ⅲ型为混合多克隆型,约占总数的 50%,其冷球蛋白为多克隆、多类型的免疫球蛋白混合物,例如 IgM-IgG 或者 IgM-IgG-IgA 等。常伴发于以下疾病:系统性红斑狼疮、类风湿性关节炎、干燥综合征、传染性单核细胞增多症、巨细胞病毒感染、病毒性肝炎、链球菌感染后与心内膜炎、麻风、黑热病等。
本症临床表现多变,主要涉及冷球蛋白类型,除原发疾病的临床表现外,部分病例(50%的型和 15%的Ⅱ型和Ⅲ型患者)可无症状,其他患者常有因为冷球蛋白遇冷沉淀所引起的高血粘度、红细胞凝集、血栓形成等病理现象。常见症状包括雷诺现象(即寒冷性肢端紫绀)、皮肤紫癜、坏死、溃疡、寒冷性荨麻疹、关节痛、感觉麻木等,以及深部血管受累时所涉及的肾、脑、肝和脾等器官损害。
(二)淀粉样变性
淀粉样变性(amyloidosis)是组织器官中有淀粉样物质沉积的一种病理现象。该病比较少见,常可累及各种不同的组织和器官,但以小动脉、肾小球、肝、脾和肾上腺最为常见。本病多伴发其他免疫增殖病、慢性感染或自身免疫病等,而且血液中都出现 M 蛋白;但这些难以作为疾病的诊断依据,临床上怀疑为淀粉样变性患者,其确诊需要依赖组织活检。
淀粉样变性的发病机制尚未明了,一般认为主要是由于各种原因导致的轻链合成增多或免疫球蛋白降解所形成的轻链片段,以及其他类型的淀粉样纤维弥散出血管,与其他物质一起沉积于组织中,导致淀粉样变性。将淀粉样纤维分离纯化作氨基酸序列分析发现淀粉样纤维有三种类型:①淀粉样纤维来自免疫球蛋白轻链(特别是可变区),λ 型轻链比 κ 型更易形成淀粉样纤维。此型最常见于原发性淀粉样变性和骨髓瘤病人。②淀粉样纤维似与轻链无关,主要的淀粉样纤维由一种不同于 Ig 的 A 蛋白组成,这可能是由于浆细胞产生的免疫球蛋白经过吞噬细胞溶酶体酶的蛋白水解作用而转变成的。此型见于继发性淀粉样变性病人。③家族性淀粉样变性的淀粉纤维主要为正常或异常的前白蛋白复合物(分子量 14kD),其次为 β2 微球蛋白。对于淀粉样变性局限于某些组织器官的原因,可能因这些组织器官的抗原性改变而成为自身抗原,本周蛋白作为自身抗体的碎片而与这些组织器官发生特异性免疫反应而沉积所致。
第三节 单克隆丙种球蛋白病的检测方法
单克隆丙种球蛋白病的实验室诊断主要依靠血液学和免疫学手段。其中免疫学检测尤为重要。一般,免疫球蛋白的多数分析测定技术都可用于丙种球蛋白病的检测。当临床上考虑为多发性骨髓瘤、巨球蛋白血症或其它浆细胞恶变疾病时,首先应该做血清蛋白区带电泳,如果发现有异常球蛋白区带,继而进行免疫球蛋白测定与免疫电泳,作进一步定量分析和免疫球蛋白分类鉴定。注意作追踪观察,以助病情、疗效的了解和预后的推断。良性或继发患者往往是在体检或其他检查中,进行血清蛋白区带电泳而发现的。当疑为冷球蛋白血症或轻链病时,均应进行冷球蛋白测定或本周蛋白测定加以证实。
一、血清蛋白区带电泳
蛋白质区带电泳是血清蛋白的经典分析方法,血清(或尿液)标本中不同性质的蛋白质可明显分开形成不同的区带,通过正常的电流图谱进行比较分析,很容易发现患者电泳图谱不一狭窄而浓缩的集中带,即 M 区带(图 26-1),这是由于 M 蛋白的化学结构高度均一,因而其电泳迁移率十分一致。如果将这些区带电泳图谱扫描,还可计算出异常蛋白的含量和百分比。这种 M 区带较多见于 γ 或 β 区,偶亦可见于 α 区。M 区带的电泳位置可大致反应出免疫球蛋白的类型,IgG 型多位于 α 区至 γ 慢区,IgA 型多位于 γ1 与 β 区,IgM 型多位于 β2 或 γ 区,IgD 型多位于 β 或 γ 区。但是区带电泳不能完全确定免疫球蛋白的类型,最终确定还需用特异性抗体进行鉴定。
在某些情况下还可以出现假的狭区带,易与 M 蛋白混淆,应注意区别。例如溶血标本中血红蛋白形成的 β 位区带,陈旧血清中聚合 IgG 形成的近原位窄区带,以及由类风湿因子形成的位于 γ 区中间的细区带都易于 M 区带相混淆,遇到这些可疑情况时,应进一步做免疫电泳等分析加以区别。
非分泌型骨髓瘤患者血清蛋白区带电泳中不能检出单克隆丙种球蛋白的 M 区带,往往呈现低丙种球蛋白血症的特征,临床上却存在浆细胞骨髓瘤的表现。为明确诊断需对患者骨髓中恶性浆细胞进行表面免疫荧光染色分析,或提取其恶性浆细胞,经溶解后再行免疫球蛋白分析。轻链病有时血清中也检测不出 M 蛋白,这就需要进行尿中本周蛋白的检测。多克隆丙种球蛋白病是临床上更为常见的一类疾病,其病因与单克隆丙种球蛋白病明显不同,是受一些抗原刺激引起多株细胞过度免疫应答的结果。因此,血清蛋白电泳图谱是在 γ 区域呈现着色深浓、宽阔而不匀的区带,易与 M 蛋白相区别。多克隆丙种球蛋白病中免疫球蛋白的升高谱型大多无特异性,一般以 IgG 升高为多,可伴 IgA 或 IgM 升高,也可 IgA 或 IgM 单独升高。低丙种球蛋白血症则表现为 γ 区的缺失。结缔组织中多克隆丙种球蛋白增高有随疾病严重程度而升高的趋势,而肝病中的增高程度也可用来估计肝损伤的程度。
二、免疫球蛋白定量测定
免疫球蛋白定量测定较常用的方法有单向扩散法与免疫浊度法,前者较为简便,后者更为准确迅速。恶性单克隆丙种球蛋白病常呈现某一类丙种球蛋白的显着增高,大多在 30mg/ml 以上;而正常的免疫球蛋白,包括与 M 蛋白同类的丙种球蛋白的含量则显着降低。在良性丙种球蛋白病的血清标本中,M 蛋白的升高幅度一般不象恶性丙种球蛋白病那么高,多在 20mg/ml 以下;M 蛋白以外的免疫球蛋白含量一般仍在正常范围之内。如在单向扩散试验中出现双圈状沉淀环,则标本中可能存在某种免疫球蛋白片段的 M 蛋白。多克隆丙种球蛋白病患者的血清中常有多种类型的免疫球蛋白水平同时升高,每类上升的幅度不太大,但总的丙种球蛋白水平增主比较明显。
免疫球蛋白的定量检测,有时会由于不同实验室所用抗血清特异性的差异,而造成 M 蛋白定量结果的不同,特别在使用某一株 M 蛋白制备的抗血清检测其他患者的 M 蛋白时。如能配合作用区带电泳光密度扫描,常可纠正这种误差。
进行免疫球蛋白的定量检测,不仅有助于丙种球蛋白病的诊断,并对丙种球蛋白病的良、恶性鉴别具有一定的帮助。如做动态观察,对丙种球蛋白病的病情和疗效的判断有一定的价值。M 蛋白含量的多少常可反映病情的轻重,尤其对同一患者,M 蛋白含量明显增高常提示病情恶化;经有效治疗后,M 蛋白含量逐渐下降,而正常免疫球蛋白的含量则由降低趋向正常。
三、免疫球蛋白的分类鉴定
疑为丙种球蛋白病的患者,经血清蛋白区带电泳和免疫球蛋白测定,已基本证实是否有免疫球蛋白的异常增高和其含量的多少,但是增高的 M 蛋白究竟是哪一类免疫球蛋白,仍需进一步分类鉴定,常应用各种类型的特异性抗血清,做不同形式的电泳或免疫扩散。
(一)免疫电泳
免疫电泳是将区带电泳和免疫扩散结合起来的一种免疫学分析法。血清标本先经区带电泳将各种蛋白成分分离开,继而用各种特异性抗血清进行免疫扩散,根据 M 蛋白在免疫电泳中所形成的特殊沉淀弧,观察其电泳迁移位置与抗原特异性,可将 M 蛋白的免疫球蛋白类型和其轻链型加以鉴定。一般多用抗 IgG、IgM、IgA、κ 和 λ 轻链等 5 种抗血清进行实验,用抗正常人血清作为对照。M 蛋白与相应抗体发生反应所出现的沉淀弧较为特殊,较普通沉淀弧宽,凸出呈弓形,不难辨认。如有下列情况,可作出判断或提示。
1.如果待测血清标本与某型免疫球蛋白重链及轻链抗血清产生相同迁移度的特殊沉淀弧,提示存在单克隆丙种球蛋白(M 蛋白),此现象多见于 IgG、IgA 或 IgM 型多发性骨髓瘤或原发性巨蛋白血症等(图 26-2)。
图 26-2 IgAλ 型骨髓瘤的免疫电泳图谱
孔中为血清标本,槽中为抗血清,箭头所指为骨髓瘤蛋白
a:抗正常人血清;b:抗 IgG 血清;c:抗 IgA 血清;
d:抗 IgM 血清;e:抗 κ 血清;f:抗 λ 血清
2.在同一抗轻链血清的反应中,同时出现二条毗邻的特殊沉淀弧(图 26-3),则可能是除 M 蛋白以外还存在游离轻链,偶尔也可见两种 M 蛋白,此时应进一步测定尿中的本周蛋白。
3.患者血清中仅与其中一种抗轻链抗血清产生一种特殊的沉淀弧,而其他 5 种抗重链抗血清均不产生此种特殊的沉淀弧,这种情况可能是①伴有肾功能不全的轻链病,游离轻链较少从尿中排出而滞留于血液中;②存在轻链的四分子多聚体,分子量大(90kD),不易从尿中排出,而留存于血液中;③尚未发现的新重链的免疫球蛋白。
图 26-3I gGκ 型骨髓瘤伴 κ 型本周蛋白尿的免疫电泳图谱
上孔为尿液,下孔中为血清标本,槽中为抗血清,箭头所指为骨髓瘤蛋白 b:
抗 IgG 血清;c:抗 IgA 血清;d:抗 IgM 血清;e:抗 κ 血清;f:抗 λ 血清
图 26-4 IgG 重链病的免疫电泳图谱
上孔中为尿液,下孔中为血清,槽中为抗血清,
箭头所指为骨髓瘤蛋白 a:抗正常人血清;b:抗 IgG 血清;c:抗
IgA 血清;d:抗 IgM 血清;e:抗 κ 血清;f:抗 λ 血清
4.若患者血清只与 IgG、IgA 或 IgM 中的一种抗重链血清产生一特殊沉淀弧,但在两型抗轻链血清中无相应位置的沉淀弧出现,血清标本经 2 - 巯基乙醇还原处理后,仍无改变,提示可能是重链病(图 26-4),需进一步测定其分子量。
5.非分泌型丙种球蛋白病血清中某一类型的免疫球蛋白含量一般不会太高,沉淀弧带偏近抗体槽,以致影响分析。必要时需对血清标本进行不同稀释后再作试验,以资比较。有时某些 M 蛋白(如 IgA 或 IgM)的四级结构会阻碍轻链抗原决定簇与其相应抗血清结合,因而误诊为重链病。这时需在血清标本中加入 2 - 巯基乙醇(10μl/ml 血清)作还原处理后再作试验,才能获得正确结果。作游离轻链分析时,由于轻链分子量小,扩散很快,要每隔 10min 观察一次结果,并注意标本浓度不宜过高,否则难以获得满意结果。
如果免疫电泳仍不能完全进行 M 蛋白的分类鉴定,可应用免疫选择电泳与免疫固定电泳作为补充,以便进一步鉴定。
(二)免疫选择电泳
将含抗 κ 或 λ 血清的琼脂制成薄层琼脂板,打孔后加入待测血清或其他标本进行火箭电泳,与标本相应的免疫球蛋白形成火箭样沉淀峰。然后于孔的两侧各挖一槽,加入某型免疫球蛋白的抗血清或另一型轻链抗血清,温育扩散后,按沉淀弧形成的情况,进行分析鉴定。图 26- 5 为 α 重链病和 IgA 骨髓瘤的结果。
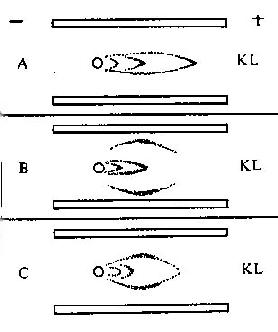
图 26-5 免疫选择电泳图谱示例孔中为血清标本,槽中为抗 IgA 重链抗血清 KL 表示琼脂中含抗 κ 及抗 λ 抗血清
A:正常人;B:α 重链病;C:IgA 骨髓瘤
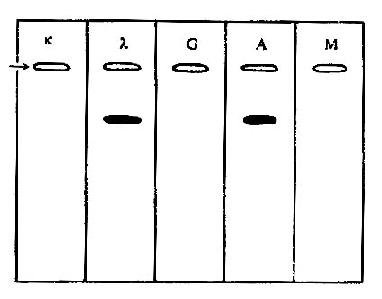
图 26-6 免疫固定电泳图谱示例(IgA- λ 型 M 蛋白)
κ、λ、G、A、M 分别代表覆盖含抗 κ,抗 λ,抗 IgG,
抗 IgA 和抗 IgM 的抗血清;箭头所指为加样处
(三)免疫固定电泳
该方法类似免疫电泳,将待测血清或其他标本在琼脂平板上作区带电泳,分离后于其上覆盖含抗 κ 或 λ 轻链或各类重链的抗血清滤纸,当抗体与某区带中的单克隆免疫球蛋白结合后,便形成复合物而沉淀下来,再通过漂洗与染色,呈现浓而狭窄的着色区带,即可判断单克隆丙种球蛋白的轻链和重链型别(图 26-6)。
四、其他检测方法
(一)本周蛋白的检测
本周蛋白即尿中游离的免疫球蛋白轻链,其检测对轻链病的诊断是必不可少的项目,并对多发性骨髓瘤、原发性巨球蛋白病、重链病等疾病的诊断、鉴别和预后判断均有一定帮助。
本周蛋白在 pH5.0 的条件下,加热至 50℃~60℃时出现沉淀,继续加热至 90℃后又重新溶解。根据这种理化性质,又将其称为凝溶蛋白,故可根据这一特点,用化学方法进行检测。这种加热沉淀法简便易行,但敏感度较低,也不能确定轻链的型别。
也可用抗 κ 和 λ 型轻链抗血清进行免疫电泳分析。为提高检出率,尿标本宜先用聚乙二醇通过透膜浓缩。游离轻链往往与其中一型的抗血清起反应,在 β - γ 区附近形成一条致密的弓形沉淀弧。有时轻链还含有其他蛋白,要注意识别。如多克隆免疫球蛋白常同时与 κ 和 λ 两型抗轻链血清形成沉淀弧,而单克隆免疫球蛋白(M 蛋白)虽只与其中一型抗轻链血清反应,但也与某一型重链抗血清产生一位置相同的沉淀弧,通过观察分析可作出正确判断。
轻链病患者尿中可测得本周蛋白,但由于其分子量较小,易迅速自肾排出,故血中反而呈阴性,检测时应该注意。
(二)冷球蛋白的检测
冷球蛋白是血清中的一种特殊蛋白质,在 4℃时自发沉淀,加温至 37℃时又可溶解,故常利用这种可逆性冷沉淀的特性对其进行测定。取患者外周血,分离出血清置 4℃冰箱中,一般在 24~72h 出现沉淀,若 1 周仍不出现沉淀者方可判断为阴性。如形成沉淀,再置 37℃温育使其复溶,也可将冷沉淀物离心洗涤后做定性与定量分析。
进行冷球蛋白研究和检测时,必须注意以下事项:①部分单克隆冷球蛋白可在低于 10℃时发生沉淀,故标本采集时必须将注射器和容器预温,离心及整个操作过程中也都要注意保温;②部分冷球蛋白在冷的条件下可迅速沉淀,但有一些则需数天,因此,这些血清需在 4℃下放置 1 周;③大部分正常人血清也含有多克隆冷球蛋白,但通常在是 80μg/ml 以下;④冷纤维蛋白原、C 反应蛋白 - 蛋白复合物和肝素沉淀蛋白等也具有冷沉淀特性,实验时应加以区别。
第二十七章 免疫缺陷病的检验
由于遗传或其他原因造成的免疫系统先天发育不全或获得性损伤称为免疫缺陷(immunodeficiency);由此所致的各种临床征称为免疫缺陷病(immunodeficiencydiseases)。免疫缺陷病的主要临床特征是病人有反复延性或机会性感染,易发生恶性肿瘤,常伴发过敏性疾病和自身免疫病。
第一节 免疫缺陷病的发病机制
一、免疫系统的个体发育
人体的免疫系统是在遗传控制下发育成熟的。胸腺发生于咽囊,胚胎时期干细胞发生于卵囊,以后逐渐分化为各系的祖细胞并分别沿各自的途径分化成熟。例如在胸腺内分化成熟的为 T 细胞,B 细胞则在骨髓中直接成熟。
人类的免疫球蛋白最早出现在胚胎第 10~20 周,最先出现的是 IgM,IgG 和 IgA 次之。至出生时 IgM 可达成人水平的 10%;IgA,1.2%;IgG,82%;后者包括从母体传输过来的一大部分。测定儿童免疫球蛋白水平是评价其免疫功能的一种重要方法。0~15 岁儿童血清免疫球蛋白平均水平见表 27-1。表中数字为占成人 Ig 水平的百分比。
表 27-1 各年龄组儿童的血清 Ig 相对水平
| 年龄组 | IgG | IgM | IgA |
| 新生儿(脐带血) | 82 | 10 | 1.2 |
| 2~7 天 | 81 | 11 | 0.9 |
| 8~13 天 | 79 | 46 | 2.4 |
| 31~60 天 | 52 | 35 | 5.2 |
| 3~4 月 | 38 | 54 | 6.9 |
| 5~6 月 | 38 | 60 | 8.8 |
| 7~12 月 | 56 | 82 | 16 |
| 1~2 岁(13~24 月) | 61 | 86 | 25 |
| 3~4 岁(25~36 月) | 60 | 91 | 29 |
| 4~5 岁 | 69 | 82 | 40 |
| 6~8 岁 | 87 | 106 | 79 |
| 9~11 岁 | 90 | 96 | 78 |
| 12~15 岁 | 92 | 113 | 95 |
| 成年人 | 100 | 100 | 100 |
细胞反应最早出现在胚胎第 12~15 周,但至出生时也远不成熟,迟发型反应较弱。新生儿的吞噬功能也不完备,吞噬细胞在数量和功能上均未过成人水平。补体发育比较早一些,至出生时补体的血清水平可达成人的 50%,旁路途径也已成熟。
二、免疫缺陷病的发病机制
(一)免疫缺陷的发生阶段及环节
免疫系统在发生和发育过程中,由于某种原因导致某个环节受阻,就会发生免疫缺陷(图 27-1)。
1.干细胞发育障碍(图 27-1A)使淋巴细胞系、粒细胞系及巨核细胞系皆可发生缺陷。
2.淋巴细胞系发育障碍(图 27-1B)形成联合免疫缺陷病。
3.粒细胞发育障碍(图 27-1C)可发生慢性肉芽肿。
4.第三、四咽囊形成障碍(图 27-1D)使胸腺和甲状旁腺发育不良,常见的疾病有 DiGeorge 综合征等。
5.胸腺形成不良(图 27-1E)可导致 Nezelof 综合征。
6.间叶细胞系发育障碍(图 27-1F)骨髓血管系异常,可出现共济失调性毛细血管扩张症等。
7.胸腺功能障碍(图 27-1G)T 细胞异常,可导致共济失调性毛细血管扩张症等。
8.类囊组织的障碍(图 27-1H)影响 B 细胞形成,可出现性连无丙种球蛋白血症。
以上皆为中枢性干细胞发育障碍所致的免疫缺陷。
图 27-1 免疫系统各阶段发育障碍示意图
(A~K 为发育障碍的部位)
9.致敏 T 细胞功能不全(图 27-1I)可发生慢性皮肤粘膜真菌感染症等。
10.B 细胞至浆细胞阶段发生障碍(图 27-1J)可发生选择性免疫缺陷病,例如 IgA 选择性缺陷病等。
11.T 细胞和 B 细胞协同作用障碍(图 27-1K)也是一种联合免疫缺陷,但属于外周性的,例如 Wiskott-Aldrich 综合征等。
以上各种免疫缺陷的发生率相差很大,其中 B 细胞缺陷最多见(约 50%),其次为联合免疫缺陷(20%)(图 27-2)。
(二)免疫缺陷的发生原因
1.遗传基因异常一是 X 连锁隐性遗传,病态基因位于 X 染色体上,在女性可以不表现疾病,但在男性则别无选择;所以男性患病率比女性高得多;例如 Bruton 型丙种球蛋白缺乏症、X 连锁高 IgM 型 Ig 缺陷症和 X 连锁联合免疫缺陷病(Gitlin 型)等。另一类为常染色体隐性遗传,发病无性别差异,例如 Swiss 型联合免疫缺陷病等。
图 27-2 各型免疫缺陷的发生率
2.中枢免疫器官发育障碍可由遗传缺陷所致,也可由宫内感染某些病毒(例如巨细胞病毒、麻疹病毒等)导致胚胎发育受损,免疫系统发育异常。
3.免疫细胞内在缺陷多由先天性酶缺陷引起,例如腺苷脱氨酶(ADA)缺乏、核苷磷酸化酶(PNP)缺乏以及葡萄糖 -6- 磷酸脱氢酶(G6P-D)缺乏皆可引起 T 细胞、B 细胞或吞噬细胞缺陷。
4.免疫细胞间调控机制异常机体的免疫调控是一个极为复杂的网络机制,在这个调节网中,无论是辅助不足或抑制过盛,皆可导致免疫缺陷。许多继发性免疫缺陷则常因感染、药物和放射线等因素而发生。
第二节 免疫缺陷病的分类和临床表现
免疫缺陷病的分类方法很多,根据其发生原因和时间可分为原发性和继发性两类。
一、原发性免疫缺陷病
原发性免疫缺陷病的种类很多,包括 B 细胞缺陷、T 细胞缺陷、联合免疫缺陷、吞噬细胞缺陷和补体缺陷等 5 个方面。
(一)原发性 B 细胞缺陷病
本组疾病的临床类型有 3 种:①全部 Ig 缺失或极度降低,如 Bruton 型丙种球蛋白缺乏症;②部分缺失,例如选择性 IgA 缺乏症;③Ig 正常,但在抗原刺激后无抗体应答。各种原发性 B 细胞缺陷病的一些主要特征见表 27-2。
表 27-2 常见原发性 B 细胞缺陷病及其主要特征
| 疾病 | 发病年龄 | 性别 | 遗传方式 | 临床和免疫学特征 |
| 1. 性联丙种球蛋白缺乏症(Bruton 型) | 6~10 月 | 男 | 性联隐性 | 反复细菌感染, 血清 Ig 极低, 淋巴组织发育不良 |
| 2. 婴儿暂时性丙种球蛋白缺乏症 | 婴儿期 | 男, 女 | ? | 同上, 但较轻,预后较好,18~30 个月可恢复, 偶可猝死 |
| 3. 性联低丙球血症伴 IgM 正常或过高 | 婴幼儿期 | 男 | 性联隐性 | 化脓菌易感, 肝脾及淋巴结肿大;IgG,IgA 低;IgM 正常或高 |
| 4. 选择性 IgA 缺乏症 | 任何时期 | 男, 女 | 常染色体 隐性遗传 | 发病率高, 症状轻, 呼吸道, 肠道感染, 血清和分泌型 IgA 低 |
| 5. 选择性 IgM 缺乏症 | 婴儿期 | 男, 女 | 家族性 | 全身感染,IgM 低;IgG 和 IgA 正常, 脾大, 淋巴系肿瘤, 预后差 |
| 6. 选择性 IgG 亚类缺乏症 | 任何时期 | 男, 女 | 家族性 | IgG 总量正常,IgG1,2,3 缺乏, 反复细菌感染, 抗体应答性差 |
| 7. 获得性丙种球蛋白缺乏症 | 5 岁~成人 | 男, 女 | 可有家族性 | 化浓菌感染, 常 3 种 Ig 降低 |
| 8. 遗传性转钴蛋白Ⅱ缺乏伴低丙球血症 | 幼期儿 | 男, 女 | 常染色体 隐性遗传 | 巨细胞性贫血, 细胞易感染, 各类 Ig 均低,VB2 治疗有效 |
| 9.Ig 含量正常性抗体缺陷症 | 婴幼儿期 | 男, 女 | 可有家族性 | 细菌感染,Ig 正常, 但对抗原刺激缺乏抗体应答 |
(二)原发性 T 细胞缺陷病
由于 T 细胞对抗体产生有调节作用,因此 T 细胞缺陷也可影响体液免疫效应。T 细胞缺陷共同的临床表现是对病毒和真菌易感,易发生 GVHR;淋巴组织发育不良,淋巴细胞缺乏,易合并自身免疫病和恶性肿瘤。几种常见的原发性 T 细胞免疫缺乏病的特征见表 27-3。
表 27-3 几种原发性 T 细胞免疫缺陷病及其主要特征
| 疾病 | 发病年龄 | 性别 | 遗传方式 | 临床和免疫学特征 |
| 1. 先天性胸腺发育不全(DiGeorge 型) | 新生儿 | 男, 女 | - | 特殊面容, 手足抽搐, 血钙↓, 易感染病毒和真菌,T 细胞成熟缺陷, 外周血中极少 T 细胞 |
| 2. 先天性核苷磷酸化酶缺乏症 | 婴儿期 | 男, 女 | 常染色体 隐性遗传 | 对细菌, 病毒和真菌均易感, 迟发型反应(-),T 细胞少, 血和尿中尿酸含量低 |
| 3. 慢性皮肤粘膜念珠菌病 | 任时期何 | 男, 女 | - | 轻型不全性缺陷, 慢性皮肤和粘膜念珠菌感染, 易伴发内分泌障碍 |
(三)原发性联合免疫缺陷病
原发性 T 细胞和 B 细胞联合免疫缺陷病所占的比例较大,约为 10%~25%,以重症联合免疫缺陷病 (SCID) 的预后最差。本组疾病的上些主要特征见表 27-4。
表 27-4 常见原发性联合免疫缺陷病及其主要特征
| 疾病 | 发病年龄 | 性别 | 遗传方式 | 临床和免疫学特征 |
| 1. 重症联合免疫缺陷病 | ||||
| ①Swiss 型 | 0~6 月 | 男, 女 | 常染色体 隐性遗传 | 对病原微生物易感, 淋巴细胞发育不良,Ig 降低 |
| ②Gitlin 型 | <6 月 | 男 > 女 | 性联隐性 | 与上相似, 但稍轻 |
| ③腺苷脱氨酶缺乏 | 婴幼儿 | 男, 女 | 常染色体 隐性遗传 | 易感染, 骨改变, 血细胞内酶下降, 淋巴细胞受损 |
| ④网状组织发育不全 | 新生儿 | 男, 女 | 个别家族性 | 易感染, 胸腺和骨髓发育不良, 淋巴细胞和中性粒细胞下降 |
| 2. 其他联合免疫缺陷病 | ||||
| ①Nezelof 综合征 | 婴幼儿 | 常染色体 隐性遗传 | 反复感染, 胸腺和淋巴组织发育不良, 淋巴细胞少 | |
| ②共济失调性毛细血管扩张症 | <1 岁 | 男, 女 | 常染色体 隐性遗传 | 胸腺发育不良, 小脑共济失调, 毛细血管扩张, 选择性 IgA 缺乏, 性发育异常 |
| ③Wiskott-Aldrich 综合征 | <1 岁 | 男 | 性联隐性 | 胸腺发育不良, 感染, 湿疹, 血小板减少性紫癜,IgM 降低 |
| ④软骨毛发发育不全综合征 | 婴儿期 | 男, 女 | 常染色体 隐性遗传 | 四肢短小, 毛发缺少, 颈短粗,T 细胞功能降低, 血 Ig 均降低 |
(四)原发性吞噬细胞缺陷病
这组疾病主要指单核细胞和中性粒细胞的缺陷,包括其趋化作用、吞噬作用和杀伤作用各个方面。常见疾病及其特征见表 27-5。
表 27-5 常见原发性吞噬细胞缺陷病及其主要特征
| 病名 | 受损细胞 | 功能缺陷 | 发生机制 | 遗传方式 | 其他特征 |
| 1. 慢性肉芽肿 | 中性粒细胞单核细胞 | 杀菌力↓ | 过 (超) 氧化酶产生障碍 | X 性联隐性 | 患儿母亲有 SLE 样红斑 |
| 2. 髓过氧化酶缺乏症 | 中性粒细胞 | 杀菌力↓ | 同上 | 常染色体 隐性遗传 | |
| 3.G-6-PD 缺乏症 | 中性粒细胞 | 杀菌力↓ | 同上 | 性联隐性(?) | |
| 4.Swachman 综合征 | 中性粒细胞 | 移动性↓ | 粒细胞减少 | 常染色体 隐性遗传 | 胰腺功能↓骨髓发育↓ |
| 5. 懒白细胞病 | 中性粒细胞 | 移动性↓ | ? | ? |
(五)原发性补体缺陷病
在五类原发性免疫缺陷病中,补体缺陷的发病率最低。补体系统的各种成分均可发生缺陷,其中以 C1q 缺陷、C2 缺陷(常染色体隐性遗传)和 C1 抑制剂缺陷(常染色体隐性遗传)较为常见。大多数补体缺陷患者可出现反复感染,或伴发系统性红斑狼疮和慢性肾炎等,有的也可表现正常。C1 抑制剂缺陷患者表现为特有的遗传性血管神经性水肿。
上述五大类原发性免疫缺陷病的各种症状中,以感染最为多见,但各种免疫缺陷病出现的类型互有不同(表 27-6),对免疫缺陷病的临床诊断有参考意义。
表 27-6 各种免疫缺陷病的感染及特点
| 免疫缺陷病 | 感染类型 | 病原体类别 |
| 体液免疫缺陷病(B 细胞系) | 败血症、化脓性脑膜炎、肺炎、气管炎、中耳炎等 | 以化脓性球菌感染为主, 例如葡萄球菌、链球菌和肺炎链球菌等 |
| 细胞免疫缺陷(T 细胞系) | 重症病毒感染、真菌感染布氏菌病, 结核, 麻风病等 | 细胞内寄生虫病原体感染为主, 如病毒, 真菌, 放线菌和布氏菌等 |
| 联合免疫缺陷(T,B 细胞系) | 全身重症细菌及病毒感染, 顽固性腹泻或脓皮病等 | 以化脓菌为主, 有时合并胞内寄性病原体感染 |
| 吞噬细胞和补体缺陷 | 肺炎、化脓性淋巴结炎、脓皮病、全身性内肉芽肿 | 化脓菌为主, 补体缺陷时也常见脑膜炎球菌和淋球菌感染 |
二、继发性免疫缺陷病
继发性免疫缺陷病是出生后由物理(如射线)、化学(如药物)和生物(如病毒)等因素造成,亦可因营养、疾病(如肿瘤)和大型外科手术造成,发病不仅局限于儿童。疾病可涉及免疫系统的各个方面,其临床表现和免疫学特征与相应的原发性免疫缺陷病相似,多可找到明显的致病因素。
近年来发现了一种对人类生命和健康威胁很大的免疫缺陷病枣获得性免疫缺陷综合征(acquiredimmunodefiencysyndrome,AIDS,艾滋病),由人类免疫缺陷病毒(HIV)引起。HIV 是一类逆转录病毒,T 细胞表面的 CD4 分子是其天然受体,因此主要侵犯辅助性 T 细胞;其他如 B 细胞和单核-巨噬细胞等也间接或直接地在一定程度上受累。因此受感染者免疫应答启动不力,表现为获得性免疫缺陷。
HIV 主要通过性接触、输注污染血制品、共用注射器或母-婴途径传播。感染几周后有些可出现类似传染性单核细胞增多病或流感的症状,持续 3~14 天,并伴有抗 HIV 抗体出现,之后进入潜伏期。艾滋病的潜伏期可长达 2~10 年甚至更长。患病初期为流感样症状,有发热、咽喉痛、肌肉痛和皮疹,血中可查出 HIV。艾滋病相关综合征主要表现为持续性体重减轻、间歇发热、慢性腹泻、全身淋巴结肿大和进行性脑病;多有呼吸道、消化道和神经系统感染或恶性肿瘤,最常见的是卡氏肺孢子菌肺炎(50%以上)和 Kaposi 肉瘤(30%以上)。
第二十八章 移植免疫的检验
第一节 概述
移植(transplantation)是将健康细胞、组织或器官从其原部位移植到自体或异体的一定部位、用以替代或补偿所丧失的结构和(或)功能的治疗方法。被移植的部分称为移植物(graft),提供移植物的个体称为供者(donor),接受移植物的个体称为受者(recipient)。现代科学的技术几乎可以对全身任何组织或器官进行移植,但是移植的成功与否不完全取决于外科技术,在相当大程度上还与免疫学有关。
研究移植与免疫的相关性以延长移植物有效存活的学科称为移植免疫学(transplantionimmunology);目前移植所取得的巨大成就、仍然存在的限制以及未来的发展多与免疫学有着密不可分的联系。
一、移植的类别
移植的类型多种多样,可以从不同角度进行分类。例如根据移植物性质可分成生命器官移植和支架组织移植;根据植入部位可分成原位移植和异位移植。但免疫学分类主要是根据移植物供者与受者间的关系,一般可分为以下几种类型。
1.自身移值(autograft)是将自身组织从一人部位移植到另一部位,如烧伤后值皮。因为自身组织存在免疫耐受,所以可终生存活。
2.同系移植(isograft 或 syngenicgtaft)指遗传基因完全相同的异体间移植,例如同卵双生间移植和同种纯系动物间的移植,移植效果与自身移植相同。但是临床上极其罕见。
3.同种移植(allograft 或 homograft)或称同种异体移植,是指同种不同基因型个体之间的移植,是临床最常见的移植类型,也是移植免疫学研究的重点所在。
4.异种移植(xenograft)指不同种属间的移植。因为供者与受者的基因完全不同,移植后出现强烈排斥,到目前为止尚不能成功。异种移植可解决临床移植物的来源,但对移植免疫学是一个严峻的挑战,也是移植免疫研究的方向之一。
5.胚胎组织移植利用胚胎的组织或细胞作为移植物进行的移植。20 周以内的人胚组织抗原发育尚不成熟,在同种间移植的成功率较高。在有资源可利用的地方,值得进一步研究和应用。
二、移植抗原
在同种移植中,即使外科手术十分成功,没有任何失误,移植物也会因排斥反应(rejection)而不能长期存活,这是长久困扰人们的一个大问题。1944 年 Medawar 等人以周密的实验证明了移植排斥反应是宿主和移植物之间产生的免疫应答;以后相继发现了多种与排斥反应相关的抗原,称为组织相容性抗原或移植抗原。在同种异体移植时,决定组织相容性的同种抗原种类很多,其中起主要作用的称为主要组织相容性抗原;在小鼠为 H -2,在人类为 HLA。
HLA 分子分 3 类,其中 MHCⅠ类和Ⅱ类分子与移植免疫的关系较为密切;目前认为 HLA-DR 位点的抗原对移植最为重要,其次为 HLA-A、HLA-B、HLA-DQ 和 HLA-DP,HLA- C 在移植免疫过程中没有明显作用。HLA 复杂的排列组合是一个非常庞大的数字,使得正常人群中除同卵双胞胎以外很难找到 HLA 基因完全相同者;只要供者与受者之间的 HLA 抗原有所不同,就会出现程度不等的排斥反应,为临床移植工作带来困难,本章所涉及的组织配型、排斥反应和免疫抑制等多是针对 HLA 及其诱导的免疫排斥。
ABO 血型系统也是主要组织相容性抗原。ABO 系统的抗原不仅存在于红细胞,亦存在于血管内皮及其它组织细胞表面,当供者与受者的 ABO 血型不符时,移植物的血循环重建后会即刻导致严重的排斥反应而使移植失败。但是 ABO 血型只有 4 种主要类型,容易检测也容易配型。
三、移植的结局及对策
移植成功的关键标准是移植物能基本代替原有器官或组织的功能,从而恢复人体的正常处理状态;移植成功与否有 4 个决定因素:器官保存、外科技术、移植物选择和免疫抑制。前两个因素不属于免疫学的范围,早在 18 世纪就有人开始进行外科的尝试,到本世纪初法国医师 Carrel 等人采用现代外科技术进行肾和心脏等器官移植获得了诺贝尔奖;但是这些移植物多因排斥反应而不能长期存活。随着免疫学的不断进步,认识了排斥反应发生的免疫学机制及其抑制方法,在一定程度上实现了移植物的长期有效存活。
1.免疫抑制排斥反应是免疫应答引起,所以免疫抑制就应该是一项有效的预防措施。在国内外同种异体移植的临床实践中,都采用不同方式的免疫抑制,取得明显的成效。最常见的方法是使用免疫抑制剂,例如硫唑嘌呤、环磷酰胺、皮质醇等,目前首选的是环孢霉素 A;但近年又发现一种链丝菌产生的高效免疫抑制剂棗 FK-506,效果更佳。
另外也可应用淋巴细胞抗体、抗 CD3 抗体、胸导管引流等方法使受者体内淋巴细胞数量降低,免疫应答能力减弱。还可采用手术前对受者输血(尤其是输供者血)的办法,作用机制尚不清楚。
2.移植物选择选择理想的供者,使移植物尽量与受者相配,降低排斥反应的发生率和反庆程度(详见第二节)。
3.诱导免疫耐受性诱导受者对移植物产生特异性免疫耐受是最为理想的办法,使受者既不发生排斥反应,又不降低对其他抗原的免疫应答能力。现在已提出一些理论与措施,有些已在实验动物身上取得了一定的效果。
通过以上方法可使移植物的存活率大大提高,存活时间大大延长;例如肾移植患者的 2 年存活率可达 90%~95%;肝移植的 1 年存活率为 70%~90%,5 年存活率为 60%;心脏移植的 1 年、5 的和 10 年存活率分别可达 78%、67%和 53%。
第二节 供者与受者的配合选择
一、移植物选择标准
移植物选择是移植能否成功的关键因素之一,选择的标准可归纳为以下几类:
1.一般情况①移植物本身必须是健康细胞、组织或器官,在形态和功能上都没有异常发现;②供者无传染病(尤其是艾滋病和肝炎等)或相关感染、无代谢病和恶性肿瘤(原发性脑肿瘤除外),全身重要器官的功能正常;③供者与受者的年龄应相仿,尤其供者应小于受者;但在生命器官移植时,供者年龄最好在 10~50 岁之间;④供者器官与受区的大小应相接近,尤在心、肝、肺等原位移植中,供者与受者体重相差不能过于悬殊,否则就植入困难或者不适应。
2.ABO 血型相容一般临床输血的 ABO 选配原则也适用于移植,O 型受者只接受 O 型移植物;A 型受者接受 A 型或 O 型;B 型受者接受 B 型或 O 型;AB 型受者接受范围较广。一般情况下,不管是活体移植物还是尸体移植物,血型不相容就不应该进行移植。
3.HLA 相容性供者与受者之间 HLA 相同的位点越多,相容性就越好,长期存活的可能性就越大。但是临床移植的绝大多数是同种移植,在非直系血缘关系的人群中,几乎不可能发现 HLA 完全相同者;只要能发现 1~2 个 HLA 位点相同,就比 HLA 完全不相同者之间的移植成功率大得多。如果有可能,移植物的供者最好是近亲(例如父母、子女或同胞兄弟姊妹等)的健康志愿者,这样可以在移植前对双方较全面的检测和交叉配合试验,还可能有选择的余地。如果等待尸体器官,检测 HLA 的困难性增加,选择的机会也少。移植中心的建立可以解决好多难题。
二、HLA 血清学定型试验
HLA-A、B、C、DR 或 DQ 位点的抗原可用血清方法进行检测,所以称为 SD 抗原(serologicallydefinedantigen),其检测方法目前普遍采用补体依赖的细胞毒(complementdependentcytotoxicyty,CDC)试验。
1.试验方法美国国家卫生研究院(NIH)的标准方法如下:将一系列已知特异性的标准分型血清(1μl/ 孔)按设计好的方案加到 72 孔或 60 孔专用反应板中(如暂时不用可以冰冻保存);加入待检淋巴细胞 2000 个 /1μl/ 孔,置室温 30min 让抗体与抗原结合;加入补体(多为家兔混合血清)5μl,置室温 60min;每孔加入 5%伊红 2~3μl,使死细胞着色;3~5min 后每孔加 12%福尔马林 8μl 固定细胞;待细胞全部沉淀后用相差显微镜或倒置显微镜观察结果。某孔的着色细胞超过 50 个即为阳性反应,说明被检细胞的 HLA 型与该孔所加抗体的相一致;否则为不一致。
2.细胞分离检测活体可取外周血直接分离;检测尸体时取淋巴结,制成单个细胞并洗涤后再分离。检测 HLAⅠ类抗原时取单个核细胞层的细胞即可应用,因为该层细胞都表达Ⅰ类抗原;但检测 HLA-DR 和 DQ 等Ⅱ类抗原时,就需要进一步分离较纯的 B 细胞(纯度达 80%以上),因为Ⅱ类抗原不分布在 T 细胞上。
3.分型血清试验用的标准抗血清必须从经产妇(尤其多产妇)的血清中筛选,胎盘液或其他体液也可应用;也可通过人工免疫献血员的方法得到。筛选的方法也用 CDC 试验,只是将已知与待检互换。Ⅱ类抗血清筛选后还必须用混合血小板将其中可能含有的Ⅰ类抗体吸收去,因试验用的 B 细胞上也有Ⅰ类抗原。许多人尝试过抗 HLA 的单克隆抗体,但是多不成功,因鼠源性抗体主要是针对人类的公共抗原而非某个体的 HLA 私有抗原;还有一个原因是鼠源性抗体多不能固定补体,不能用细胞毒方法进行检测。
4.HLA 定型板某些专门实验室将 HLA 定型血清预先加到专用的反应板上冰冻保存,可供自己或出售给他人使用,试验时只须加入待检细胞及其它试剂即可。定型板中抗血清的种类要覆盖本民族或本地区 80%以上的抗原,其中高频抗原每种抗血清 3 份以上,低频抗原每种抗血清 2 份以上。定型血清板须经几个实验室认可或有关部门核准后才能销售和使用;现在国内所做的定型板多限于 HLAⅠ类抗原的检测。
三、HLA 细胞法分型试验
HLA- D 和 DP 位点的抗原须用细胞法分型进行鉴定,所以又称 LD 抗原(lymphocytedefinedantigen),其鉴定方法普遍采用混合淋巴细胞培养(mixedlymphocyteculture,MLC),也称混合淋巴细胞反应(mixedlymphocytereaction,MLR)。
1.试验方法将分离的反应细胞(通常是患者的淋巴细胞)与刺激细胞(通常是供者或已知的标准淋巴细胞)配制成 1×106/ml 浓度的悬液,各加 0.2ml 到反应管中;放置 37℃和 5%CO2环境下培养 5~6 天。培养结束后进行涂片染色,观察并计数转化的淋巴细胞;也可在培养结束前 5~12 小时加入3H-TdR,收获后用液体闪烁仪计数细胞的放射性。试验结果的常用表示方式是刺激指数(SI)。
MLC 分为双向法和单向法。双向 MLC 是反应管中两种细胞都有应答能力,可以互为刺激细胞和反应细胞,试验结果是两种细胞反应之和。
SI=2×试验管 cpm/(A 对照 cpm+B 对照 cpm)
双向 MLC 只能反映两种细胞间 LD 的差别,结果比较模糊,也不能做 LD 抗原的分型。单向 MLC 是将刺激细胞用丝裂霉素 C(mitomycinC)或 X 线照射先行灭活,但细胞的抗原性保持不变,因此可作为刺激细胞而不能作为反应细胞,试验结果是待检测细胞的反应,使于结果分析。
SI=试验管 cpm/ 自身对照 cpm
单向 MLC 可以用来进行 HLD- D 和 DP 位点的分型试验,常用的方法有两类:纯合子分型细胞(homozygoustypingcell,HTC)试验和预敏淋巴细胞分型(primedlymphocytetyping,PLT)试验。
2.HTC 试验 HTC 是指细胞内一对同源染色体上两个 HLA 单倍型完全相同,所以该位点在细胞表面只表达一种抗原;HTC 可从近亲婚配的子代表中寻找。将一组 HTC 经处理来活后作为刺激细胞,与待检细胞做单向 MLC。如果待检细胞与刺激细胞的 LD 不同,就会发生反应;如果相同便不反应;所以试验又称为阴性分型法。当 SI≤2 时可认为待检细胞与该管 HTC 的 LD 抗原相同。本法的缺点是 HTC 难以得到,而且培养时间长(5~6 天),在尸体器官移植时不能应用。
3.PLT 试验本方法需事先准备分型细胞:选择只有一个单倍型相同的两个体 a / b 和 a /c(这在双亲与子女之间不难做到),取前者的淋巴细胞处理后作刺激细胞,取后者的淋巴细胞作反应细胞;将两者进行单向混合培养,至第 10 天使可得到针对 b 单倍型有特异性免疫应答能力的预致敏分型细胞(PTL)。依此类推,可以制备出一系列能识别各种已知 LD 抗原的一套 PTL;这些处于休止状态的致敏记忆细胞可在液氮中长期保存备用。
进行 PLT 试验时,需将待检淋巴细胞处理成刺激细胞,而 PTL 为反应细胞;如果待检细胞的 LD 抗原与 PTL 预先识别的特异性相同,则 PTL 会迅速出现反应(二次应答),如不同则不出现快速反应,所以本法又称为阳性分型法。PLT 法克服了 HTC 法试验周期长的缺点,在 24 小时内即可报出结果;PTL 比 HTC 容易得到,但真正做起来也复杂。
不管是 CDC 试验还是 MIC 方法,都必须以受检者的淋巴细胞作为检测标本,这就大大地限制了检测方法的应用范围;而且还存在抗体来源困难、细胞培养周期过长等缺点;所以近年来将分子生物学技术引入了 HLA 检测的领域,产生了 DNA 分型法。DNA 分型法是利用 PCR 技术将标本中的少量目的 DNA 大量扩增,然后再进行产物鉴定的方法(原理和步骤在此不予讨论),特点是灵敏度高,试剂来源容易,应用范围广,陈旧的或微量的标本都可进行检测,在移植医学、法医学和其他方面都有广阔的前途。
四、交叉配合试验
传统的交叉配合(crossmatching)试验是检测受者体内是否存在抗供者的特异性抗体,现在可同时检测受者对供者 LD 抗原的相容程度。不管是否已经进行过各种 HLA 分型试验,交叉配合试验对选择移植物都有一定的参考价值。
1.微量细胞毒试验用供者的淋巴细胞作靶细胞,与受者的血清进行 CDC;出现阳性反应说明受者体内含有抗供者的特异性抗体,移植后很有可能发生超急排斥反应。若要明确受者的抗体是抗Ⅰ类抗原还是抗Ⅱ类抗原,可以将供者的淋巴细胞进一步分离出较纯的 T 细胞和 B 细胞分别进行检测;若要排除患者自身抗体的影响,可以用患者自己的细胞与自已的血清进行试验作为对照。
交叉配合是移值前必须做的一个检验项目;对一些曾经接触过移植抗原的受者,例如多次接受输血者、经产妇、有不成功移植史或接受过血清透析治疗者,尤其要进行审慎的检验。
2.流式细胞仪检测将供者淋巴细胞与受者血清共育后,用荧光标记的抗人 Ig 对结合有抗体的细胞染色,在流式细胞仪上进行荧光标记测定。该法比微量细胞毒法的灵敏度高 100 倍,有条件的单位可以优先考虑使用。
3.混合淋巴细胞培养将供者与受者的淋巴细胞做双向混合培养,或者灭活供者的淋巴细胞做向混合培养,细胞反应的程度与供-受者相容的程度呈负相关。
4.细胞介导的淋巴细胞毒试验检测受者对移植物可能发生的细胞介导的淋巴细胞毒作用(cell-mediatedlymphocytotoxicity,CML)。将受者淋巴细胞与灭活的供者淋巴细胞做常规单向 MLC,收获致敏的受者淋巴细胞后,再与51Cr 标记的、PHA 刺激的供者淋巴细胞做 CML 试验;51Cr 释放的程度与供-受者相容程度呈负相关。
第三节 排斥反应及其监测
移植排斥反应(tranlplantationrefection)是由移植抗原诱导的免疫应答所导致的移植物功能丧失或受者机体损害,是临床移植失败的主要原因和移植免疫学所致力克服的关键难题。目前已基本清楚排斥反应的发生机制和临床类型,对其检测和抑制的研究也取得了一定的成就。
一、排斥反应的类型
在同种异体移植中,排斥反应有两种基本类型:宿主抗移植物反应(hostversusgraftreaction,HVGR)和移植物抗宿主反应(graftversushostreaction,GVHR), 临床最多见的是前者;根据发生的机制、时间、速度和临床表现,HVGR 又可分为 3 种类型。
1.超急排斥反应发生在移植物与受者血管接通的数分钟到数小时内,出现坏死性血管炎表现,移植物功能丧失,患者有全身症状。发生的基本原因是受者循环内存在抗供者的抗体,常见于下列情况:①ABO 血型不符;②由于多次妊娠或反复输血等使受者体内存在抗 HLA 抗体;③移植物保存或处理不当等其他原因。超急排斥发生迅速,反应强烈,不可逆转;需立即切除移植物,否则会导致受者死亡。如果事先认真进行 ABO 基至 Rh 血型检查和交叉配合试验,多可避免这种现象的发生。
2.急性排斥反应是排斥反应最常见的一种类型,多发生在移植后数周到 1 年内,发生迅速,临床表现多有发热、移植部位胀痛和移植器官功能减退等;病理特点是移植物实质和小血管壁上有以单个核细胞为主的细胞浸润、间质水肿与血管损害,后期在大动脉壁上有急性纤维素样炎症。急性排斥出现得早晚和反应的轻重与供-受者 HLA 相容和程度有直接的关系,相容性高则反应发生晚、症状轻、有些可迟至移植后 2 年才出现。急性排斥反应经过及时恰当的免疫抑制治疗多可缓解。
3.慢性排斥反应属于迟发型变态反应,发生于移植后数月甚至数年之后,表现为进行性移植器官的功能减退直至丧失;病理特点是血管壁细胞浸润、间质纤维化和瘢痕形成,有时伴有血管硬化性改变。本型反应虽然进展缓慢,但用免疫抑制治疗无明显的临床效果。
4.移植物抗宿主反应多发生于同种骨髓移植者,也可见于脾、胸腺和小肠移植中;此时患者的免疫状态极度低下,而移植物中丰富的免疫活性细胞则将受者细胞视为非己抗原,对其发生免疫应答;移植物的 T 细胞在受者淋巴组织中增殖并产生一系列损伤性效应。GVHR 分为急性与慢性两型。急性型多见,多发生于移植后 3 个月以内,患者出现肝脾肿大、高热、皮疹和腹泻等症状;虽是可逆性变化,但死亡率较高;慢性型由急性型转来,患者呈现严重的免疫失调,表现为全身消瘦,多个器官损害,以皮肤和粘膜变化最突出,病人往往因严重感染或恶液质而死亡。
二、排斥反应的机制
移植排斥反应的机制和过程与一般免疫应答相似,只是参与细胞是一种特殊类型的 Tc 细胞,称为同种反应型 Tc 细胞(alloreactiveCTL)。这种 Tc 细胞能识别并杀伤遗传学上无关供体表达外来抗原分子的移植物中的靶细胞,从而导致组织不相容移植物的排斥反应。造成排斥反应损伤效应的机制除 Tc 细胞介导的细胞毒作用外,尚有 NK 细胞介导的直接细胞毒作用和 ADCC、抗体介导的补体依赖性细胞毒作用和炎症效应以及细胞因子介导的系列炎症效应等。在不同情况下,各种机制分别参与的程度有所侧重,所以不同类型排斥反应的表现也不尽相同。
三、排斥反应的免疫学监测
排斥反应的临床判断主要依靠症状和体征、移植物功能状态及实验室检测等综合指标。超急排斥很容易诊断,急性排斥和 GVHR 的临床表现较明显,慢性排斥多无典型临床表现。移植器官的功能测定根据移植物不同而异,多需做大量的生化测定和血液学指标,某些辅助检查例如 B 型超声和彩色多普勒等对了解移植器官的形态、血管通畅性和血流量等也有一定的帮助。免疫学监测是在排斥反应发生之前检查受者体内参与反应的免疫细胞及某些免疫分子的变化,对判断患者是否会出现排斥反应有重要的参考意义。
1.外周血 T 细胞计数用单克隆抗体免疫荧光法或流式细胞仪测定 T 细胞及其亚群,在急性排斥的临床症状出现前 1~5 天,T 细胞总数和 CD4/CD8 比值升高,巨细胞病毒感染时比值降低;各家报道的比值不同,一般认为当比值大于 1.2 时,预示急性排斥即将发生;比值小于 1.08 则感染的可能性很大。如果能进行动态监测,对急性排斥和感染的鉴别诊断会有重要价值。另外,淋巴细胞转化试验对测定 T 细胞总数和功能状态也有一定意义。
2.杀伤细胞活性测定移植后因免疫抑制剂的应用,杀伤细胞的活性受抑制,但在急性排斥前会明显增高。取供者淋巴灭活后作为刺激细胞,分离患者淋巴细胞作反应细胞,将两种细胞混合直接做 CML,测得的结果是 Tc 细胞和 NK 细胞共同作用的结果;进行动态监测的意义更大一些。
3.血清 IL-2R 测定 T 细胞激活后可释出 IL-2R,在急性排斥和病毒感染时 IL-2R 的血清含量升高,以巨细胞病毒感染时增高最明显。环孢霉素 A 肾毒性的肾功能减退时血清肌酐值增高,而 IL-2R 明显降低。血清肌酐值和 IL-2R 同时增高对急性排斥的诊断有意义。但个体间血清 IL-2R 的含量差别显著,无公认的诊断标准,限制了它的临床的应用,动态测定可克服这一缺点。
4.抗供者 HLA 抗体的检测利用交叉配合试验检测患者血清中是否存在抗供者 HLA 的抗体,抗体的存在预示着排斥反应的可能性。
其他方法如血清补体测定等也有报道,但其意义不确切。